修回日期: 2008-01-10
接受日期: 2008-01-15
在线出版日期: 2008-02-18
目的: 探讨BxPC-3条件培养液影响分化的PC12细胞神经递质代谢的机制.
方法: 用去除IL-6的BxPC-3条件培养液处理分化的PC12细胞, 采用流式细胞仪检测各组细胞凋亡率、HPLC检测上清和细胞裂解液中DA、5-HT和NE的含量. 在不含血清的条件培养液中加入IL-6(0.01 mg/L, 0.1 mg/L, 0.25 mg/L, 0.5 mg/L, 1 mg/L, 1.5 mg/L, 2 mg/L), 分别收集上清和细胞裂解液, 采用HPLC检测DA和NE的含量.
结果: 各组细胞凋亡率之间差别无统计学意义, 条件培养液中加入IL-6抗体后, 上清中DA和NE的含量明显增加, 而细胞内DA和NE代谢差异无统计学意义, 在加入不同剂量IL-6后, 随着浓度的增加, DA和NE的代谢近似呈现剂量依赖性降低, 当IL-6浓度为1 mg/L时DA和NE的变化有统计学意义.
结论: BxPC-3条件培养液主要通过IL-6影响分化的PC12神经递质代谢.
引文著录: 李荣, 王杰军, 吴欣, 郭静, 王妙苗, 王喜, 解静, 何晓静. BxPC-3条件培养液对PC12细胞株DA和NE代谢的影响. 世界华人消化杂志 2008; 16(5): 484-487
Revised: January 10, 2008
Accepted: January 15, 2008
Published online: February 18, 2008
AIM: To study the effect of BxPC-3-conditioned medium on the metabolism of DA and NE in PC12 cells and its mechanism of action.
METHODS: PC12 cells were treated with BxPC-3-conditioned medium without IL-6. The rate of apoptosis of PC12 cells was detected by flow cytometry. DA, 5-HT and NE in the medium were measured by HPLC. IL-6 (0.01 mg/L, 0.1 mg/L, 0.25 mg/L, 0.5 mg/L, 1 mg/L, 1.5 mg/L, 2 mg/L) was added into the medium deprived of serum, then the DA, 5-HT and NE in the medium were measured.
RESULTS: There was no significant difference in the rate of apoptosis of PC12 cells in each group. After anti-IL-6 was added into the conditioned medium, the quantity of DA and NE in the medium was increased. The concentration of IL-6 was increased. DA and NE were metabolized in a dose-dependent manner. Addition of 1mg/L IL-6 significantly decreased DA and NE.
CONCLUSION: BxPC-3-conditioned medium has certain effects on the metabolism of DA and NE of PC12 cells by adding IL-6.
- Citation: Li R, Wang JJ, Wu X, Guo J, Wang MM, Wang X, Xie J, He XJ. Effect of BxPC-3-conditioned medium on the metabolism of DA and NE in PC12 cell line and its mechanism of action. Shijie Huaren Xiaohua Zazhi 2008; 16(5): 484-487
- URL: https://www.wjgnet.com/1009-3079/full/v16/i5/484.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i5.484
肿瘤患者普遍伴有抑郁障碍, 其严重影响患者的治疗与康复, 降低患者的生活质量[1]. 研究显示, 胰腺癌患者的抑郁发病率高于其他肿瘤患者[2], 且抑郁与胰腺癌之间存在特殊的密切联系[3], 但相关机制不详. 我们在前期实验中发现胰腺癌细胞微环境可以影响类中枢神经元神经递质的代谢, 并发现其中含有大量的IL-6. 本研究继续探讨细胞因子在胰腺癌条件培养液影响神经递质代谢中的作用.
PC12细胞由第二军医大学神经生物教研室惠赠(购自ATCC), BxPC-3细胞由第二军医大学长海医院消化内科实验室惠赠(购自ATCC), NGF购自Sigma公司, 胎牛血清、马血清和多聚赖氨酸均购自Gibco公司, IL-6抗体, IL-6及IL-6的同型对照兔IgG均购自PEPROTECH公司, 应用于细胞HPLC检测的溶剂和物质中, 除乙腈外均购自于Merck公司, 乙腈购于上海中科院药物研究所.
1.2.1 PC12细胞的培养及分组: 按照参考文献[4]的方法选用第13-15代的PC12细胞, 以6×105个/孔接种在铺被有多聚赖氨酸的六孔板中, 培养液选用含100 mL/L马血清, 50 mL/L胎牛血清的DMEM, 在含有50 mL/L CO2, 37 ℃的孵箱中培育. 接种后第1天, 用50 ng/L的NGF诱导分化, 然后在含有NGF的DMEM中培养7-10 d, 隔天换液, 然后用于实验研究. 根据检测项目的不同, 细胞分组不同, 总体将细胞分为对照组, 去除IL-6的条件培养液处理组, IL-6抗体同型对照处理组, IL-6处理组(0.01 mg/L, 0.1 mg/L, 0.25 mg/L, 0.5 mg/L, 1 mg/L, 1.5 mg/L, 2 mg/L).
1.2.2 条件培养液的制备: 参照参考文献[5]在BxPC-3处于对数生长期时, 换用不含血清的DMEM培养24 h, 收集上清, 500 r/min离心5 min, 存于-80 ℃低温冰箱备用. 按照参考文献[6]的方法制备除IL-6的条件培养液, 略有改进, 用终浓度为0.1 mg/L的IL-6多抗来阻断1mL BxPC-3条件培养液中IL-6的活性, 加入后共培养15 min, 收集, 500 r/min离心5 min, 将去除IL-6的条件培养液用于处理分化的PC12细胞, 对照为1 μg非特异性兔IGg.
1.2.3 高效液相检测神经递质的合成和分泌: 按照参考文献[7]的方法, 分别收集培养液和细胞, 培养液4 ℃ 17500 g离心10 min, 去掉蛋白及可能存在的细胞碎屑, 立即取5 μL用做HPLC检测. 收集的细胞用0.2N高氯酸处理后4 ℃ 17500 g离心10 min, 然后参照参考文献[8]将细胞裂解液和上清应用高效液相电化学检测器检测.
统计学处理 实验数据采用t检验进行分析, 定量资料以mean±SD表示, P<0.05为统计学有显著差异.
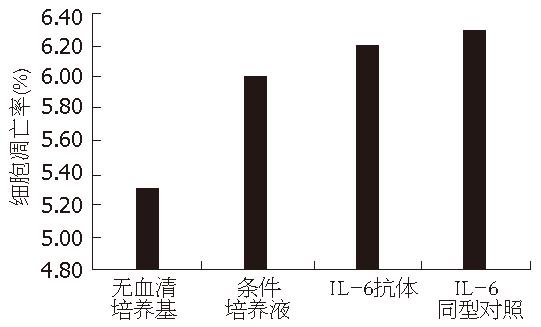
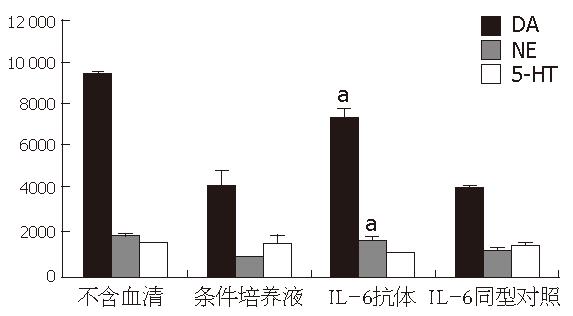
在各处理组间, 细胞凋亡率无显著差异. 应用IL-6抗体处理过的条件培养液处理分化的PC12细胞, 结果显示DA、NE代谢障碍被纠正, 与条件培养液相比较结果有统计学意义(图1, 图2).
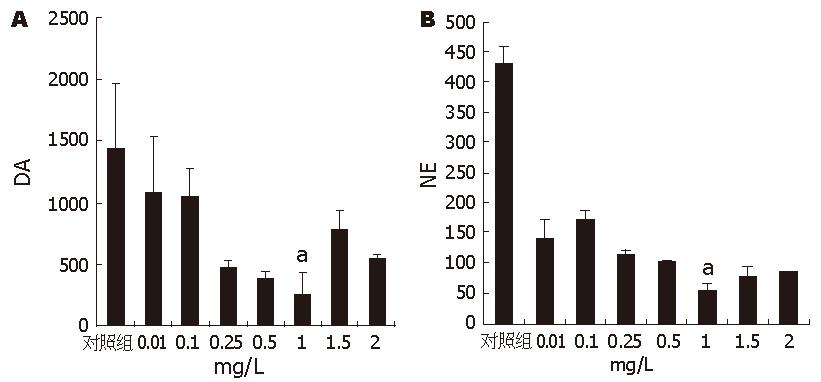
将不同剂量IL-6加入培养液中, 随IL-6剂量的增加, 细胞外液中DA和NE的含量逐渐下降, IL-6浓度为1 mg/L时处理组与对照组的差别具有显著统计学意义(图3).
胰腺癌合并抑郁的研究属于肿瘤精神学的交叉领域, 当前, 这一研究领域主要集中在流行病学调查研究. 在以往的实验中, 我们采用胰腺癌细胞株BxPC-3条件培养液处理类中枢神经元-分化的PC12细胞, 发现其合成分泌的DA和NE明显下降. DA和NE是与情绪和行为密切相关的神经递质. 以兴趣丧失、失眠、体质量减轻等情绪和行为改变为主要临床表现的抑郁症, 常伴有中枢神经系统内DA和NE的减少.
我们在前面的实验中还发现BxPC-3条件培养液中含有较多量的IL-6. Yang et al[9]和Kim et al[10]都发现抑郁患者外周血中IL-6水平明显高于非抑郁患者, Capuron et al发现给动物注射IL-6会使动物产生症状类似抑郁症的病态综合征[11], 这些研究显示IL-6水平与抑郁密切相关. Ebrahimi et al研究发现胰腺癌患者外周血IL-6水平明显高于其他消化系统肿瘤患者和健康人[12], 基础研究也显示胰腺癌细胞株可以合成和分泌相对较高量的IL-6[13], 提示IL-6水平与胰腺癌也关系密切. 基于IL-6水平与肿瘤及抑郁都存在密切关系, 我们在本实验中进一步了解IL-6与BxPC-3条件培养液影响PC12细胞神经递质代谢的关系.
首先应用IL-6抗体处理过的条件培养液处理分化的PC12细胞, 结果显示, DA、NE代谢障碍被纠正, 与条件培养液相比较结果有统计学意义, 但神经递质的量并未完全恢复到对照组的水平. Kunioku et al[14]发现IL-6可使分化的PC12细胞免于无血清导致的凋亡, 为排除细胞数量可能对神经递质检测的影响, 我们检测各处理组中细胞凋亡率的影响. 结果在处理时间段内, 各组细胞凋亡率没有明显区别. 进一步将不同剂量IL-6加入培养液中提示, 随IL-6剂量的增加, 细胞外液中DA和NE的含量逐渐下降, 当IL-6浓度为1 mg/L时处理组与对照组的差别具有显著统计学意义. 这些实验结果提示, 胰腺癌细胞合成和分泌的IL-6影响PC12细胞神经递质代谢.
关于胰腺癌与抑郁之间的关系, 临床流行病学和基础研究的结果都提示两者之间存在甚为密切的联系. Carney et al通过前瞻性研究认为胰腺癌与抑郁之间存在因果联系[15], 并认为抑郁可以导致胰腺癌的产生和发展, 而Brown et al认为胰腺癌导致抑郁, 并认为可能是胰腺癌细胞合成和分泌的单胺类神经递质受体抗体所导致[16]. 我们以体外研究的模式发现, 胰腺癌合成和分泌的IL-6可以降低PC12细胞内DA和NE的合成代谢, 也就是说, 抑郁患者胰腺癌细胞株合成和分泌的细胞因子导致抑郁的产生, 这一结论支持Brown et al的观点, 但是与Brown et al的研究结果还有差异, 究其原因, 除与研究方法不同外, 也与不同时期实验研究的背景有关. 在抑郁症的研究方面, 经历不同的过程, 在19世纪90年代以前, 多数学者的实验结果提示抑郁症患者处于免疫抑制状态, 而近代, 许多学者发现抑郁症患者呈现以炎症细胞因子、急性期反应蛋白增多为主要表现的免疫激活状态, 甚至有学者认为抑郁症的发病机制与免疫细胞活化后分泌的细胞因子有关, 进而提出"抑郁症的细胞因子学说"[17]. 另外, 在肿瘤合并抑郁免疫状态的结果也显示, 免疫功能处于激活状态[18].
IL-6是一种炎症细胞因子, 不仅在胰腺癌患者、抑郁症患者血清内明显升高, 而且在肿瘤合并抑郁患者外周血清内也明显升高[18]. 现代神经生理研究证实, 外周血内的IL-6可以通过缺乏血脑屏障的区域、特殊的转运机制等方式而最终通过血脑屏障影响神经系统内的功能[19]. 虽然在正常情况下, 中枢神经系统内有少量的IL-6, 在神经细胞的生长发育中发挥重要作用[20-21], 但在病理情况下, 中枢神经系统内IL-6的浓度升高, 发挥破坏学习能力以及记忆能力的作用[22], 动物实验也证实过高浓度的IL-6会影响神经递质的代谢[23]. 由此我们认为, 胰腺癌细胞合成和分泌过多的IL-6, 通过不同的途径进入中枢神经系统, 影响神经递质的代谢, 可能是胰腺癌合并高抑郁发病率的原因.
胰腺癌合并抑郁的研究属于肿瘤精神学的交叉领域. 当前, 这一研究领域主要集中在流行病学调查研究上. DA和NE是与情绪和行为密切相关的神经递质. 以兴趣丧失、失眠、体质量减轻等情绪和行为改变为主要临床表现的抑郁症, 常伴有中枢神经系统内DA和NE的减少.
吴泰璜, 教授, 山东省立医院肝胆外科
Carney et al通过前瞻性研究认为胰腺癌与抑郁之间存在因果联系, 并认为抑郁可以导致胰腺癌的产生和发展, 而Brown et al认为胰腺癌导致抑郁, 并认为可能是胰腺癌细胞合成和分泌的单胺类神经递质受体抗体所导致.
本文中首次以体外研究的模式, 采用胰腺癌细胞条件培养液和类神经元细胞-分化的PC12细胞, 探讨了胰腺癌合并抑郁的可能的机制.
本文研究设计合理, 技术路线可行, 论述较全面, 具有较强的学术价值.
编辑: 李军亮 电编: 郭海丽
| 1. | Rodin G, Lloyd N, Katz M, Green E, Mackay JA, Wong RK. The treatment of depression in cancer patients: a systematic review. Support Care Cancer. 2007;15:123-136. [PubMed] [DOI] |
| 2. | Massie MJ. Prevalence of depression in patients with cancer. J Natl Cancer Inst Monogr. 2004;57-71. [PubMed] [DOI] |
| 3. | Boyd AD, Riba M. Depression and pancreatic cancer. J Natl Compr Canc Netw. 2007;5:113-116. [PubMed] |
| 4. | Ireland LM, Yan CH, Nelson LM, Atchison WD. Differential effects of 2,4-dithiobiuret on the synthesis and release of acetylcholine and dopamine from rat pheochromocytoma (PC12) cells. J Pharmacol Exp Ther. 1995;275:1453-1462. [PubMed] |
| 5. | Jandu N, Ceponis PJ, Kato S, Riff JD, McKay DM, Sherman PM. Conditioned medium from enterohemorrhagic Escherichia coli-infected T84 cells inhibits signal transducer and activator of transcription 1 activation by gamma interferon. Infect Immun. 2006;74:1809-1818. [PubMed] [DOI] |
| 6. | Suwa T, Hogg JC, Vincent R, Mukae H, Fujii T, van Eeden SF. Ambient air particulates stimulate alveolar macrophages of smokers to promote differentiation of myeloid precursor cells. Exp Lung Res. 2002;28:1-18. [PubMed] [DOI] |
| 7. | Liu HQ, Zhu XZ, Weng EQ. Intracellular dopamine oxidation mediates rotenone-induced apoptosis in PC12 cells. Acta Pharmacol Sin. 2005;26:17-26. [PubMed] [DOI] |
| 8. | Liang YQ, Tang XC. Comparative studies of huperzine A, donepezil, and rivastigmine on brain acetylcholine, dopamine, norepinephrine, and 5-hydroxytryptamine levels in freely-moving rats. Acta Pharmacol Sin. 2006;27:1127-1136. [PubMed] [DOI] |
| 9. | Yang K, Xie G, Zhang Z, Wang C, Li W, Zhou W, Tang Y. Levels of serum interleukin (IL)-6, IL-1beta, tumour necrosis factor-alpha and leptin and their correlation in depression. Aust N Z J Psychiatry. 2007;41:266-273. [PubMed] [DOI] |
| 10. | Kim YK, Na KS, Shin KH, Jung HY, Choi SH, Kim JB. Cytokine imbalance in the pathophysiology of major depressive disorder. Prog Neuropsychopharmacol Biol Psychiatry. 2007;31:1044-1053. [PubMed] [DOI] |
| 11. | Capuron L, Miller AH. Cytokines and psychopathology: lessons from interferon-alpha. Biol Psychiatry. 2004;56:819-824. [PubMed] [DOI] |
| 12. | Bartsch R, Woehrer S, Raderer M, Hejna M. Serum interleukin-6 levels in patients with gastric MALT lymphoma compared to gastric and pancreatic cancer. Anticancer Res. 2006;26:3187-3190. [PubMed] |
| 13. | Bellone G, Smirne C, Mauri FA, Tonel E, Carbone A, Buffolino A, Dughera L, Robecchi A, Pirisi M, Emanuelli G. Cytokine expression profile in human pancreatic carcinoma cells and in surgical specimens: implications for survival. Cancer Immunol Immunother. 2006;55:684-698. [PubMed] [DOI] |
| 14. | Kunioku H, Inoue K, Tomida M. Interleukin-6 protects rat PC12 cells from serum deprivation or chemotherapeutic agents through the phosphatidylinositol 3-kinase and STAT3 pathways. Neurosci Lett. 2001;309:13-16. [PubMed] [DOI] |
| 15. | Carney CP, Jones L, Woolson RF, Noyes R, Doebbeling BN. Relationship between depression and pancreatic cancer in the general population. Psychosom Med. 2003;65:884-888. [PubMed] [DOI] |
| 16. | Brown JH, Paraskevas F. Cancer and depression: cancer presenting with depressive illness: an autoimmune disease? Br J Psychiatry. 1982;141:227-232. [PubMed] [DOI] |
| 17. | Smith RS. The macrophage theory of depression. Med Hypotheses. 1991;35:298-306. [PubMed] [DOI] |
| 18. | Musselman DL, Miller AH, Porter MR, Manatunga A, Gao F, Penna S, Pearce BD, Landry J, Glover S, McDaniel JS. Higher than normal plasma interleukin-6 concentrations in cancer patients with depression: preliminary findings. Am J Psychiatry. 2001;158:1252-1257. [PubMed] [DOI] |
| 19. | Simmons DA, Broderick PA. Cytokines, stressors, and clinical depression: augmented adaptation responses underlie depression pathogenesis. Prog Neuropsychopharmacol Biol Psychiatry. 2005;29:793-807. [PubMed] [DOI] |
| 20. | Fernandes A, Falcão AS, Silva RF, Brito MA, Brites D. MAPKs are key players in mediating cytokine release and cell death induced by unconjugated bilirubin in cultured rat cortical astrocytes. Eur J Neurosci. 2007;25:1058-1068. [PubMed] [DOI] |
| 21. | Ghorbel MT, Sharman G, Leroux M, Barrett T, Donovan DM, Becker KG, Murphy D. Microarray analysis reveals interleukin-6 as a novel secretory product of the hypothalamo-neurohypophyseal system. J Biol Chem. 2003;278:19280-19285. [PubMed] [DOI] |
| 22. | Elwan O, Madkour O, Elwan F, Mostafa M, Abbas Helmy A, Abdel-Naseer M, Abdel Shafy S, El Faiuomy N. Brain aging in normal Egyptians: cognition, education, personality, genetic and immunological study. J Neurol Sci. 2003;211:15-22. [PubMed] [DOI] |