修回日期: 2008-01-16
接受日期: 2008-01-22
在线出版日期: 2008-02-08
目的: 研究大鼠急性坏死性胰腺炎(ANP)末端回肠组织中Toll样受体2(TLR2)的表达及意义.
方法: 60只大鼠随机分为2组: 假手术组20只, ANP组40只. 采用逆行胰胆管注射5%牛磺胆酸钠制作大鼠ANP模型, 并又分为8 h和16 h组. 应用实时定量PCR检测不同组、不同时点末端回肠组织TLR2 mRNA的表达, 应用Western blot和免疫组化分析各组TLR2蛋白表达变化及组织学定位.
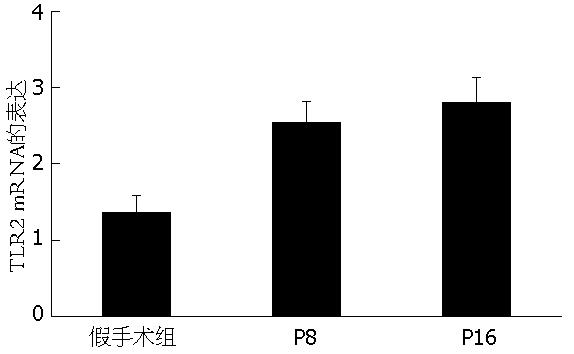
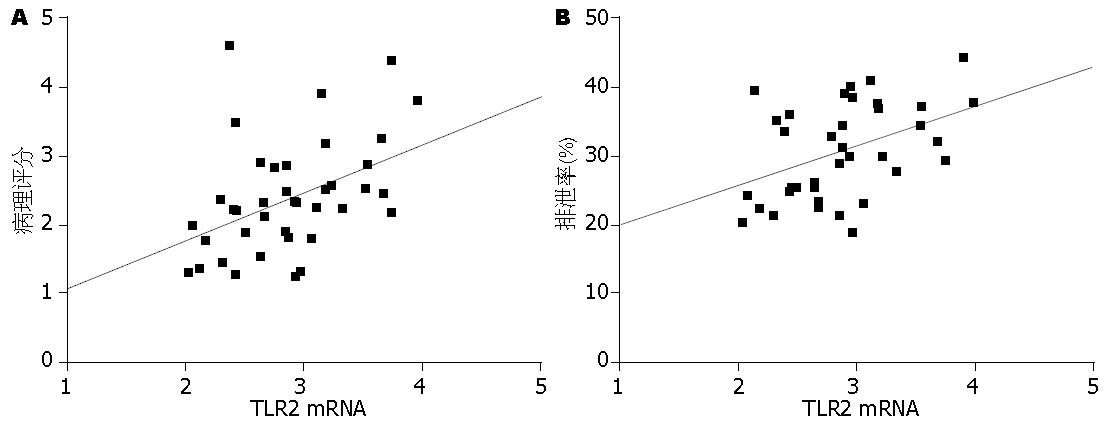
结果: 与假手术组相比, ANP时末端回肠组织TLR2 mRNA及蛋白表达显著升高, TLR2的表达水平分别与肠黏膜的病理学评分(r = 0.42, P<0.01)和肠黏膜通透性(r = 0.41, P<0.01)呈正相关. 免疫组化发现, ANP组的回肠黏膜表面、黏膜固有层的T、B淋巴细胞、单核细胞、中性粒细胞、嗜酸性细胞、黏膜下层的动静脉、纵形和环形肌层等处都有比较强的TLR2的表达.
结论: ANP时末端回肠组织内TLR2 mRNA和蛋白表达上调, 可能与ANP肠黏膜的病理改变和肠源性感染的发生与发展有关.
引文著录: 马继民, 崔杰, 杨志军. TLR2在大鼠急性坏死性胰腺炎中末端回肠的表达及意义. 世界华人消化杂志 2008; 16(4): 361-365
Revised: January 16, 2008
Accepted: January 22, 2008
Published online: February 8, 2008
AIM: To investigate the expression of Toll-like receptor 2 (TLR2) in distal ileum of rats with acute necrotizing pancreatitis(ANP) and its significance.
METHODS: Sixty SD rats were randomly divided into ANP group (n = 40) and sham-operation group (n = 20). TLR2 mRNA expression in distal ileum of rats was detected by real-time PCR, and its protein expression was determined by immunohistochemistry and Western blot.
RESULTS: The expression levels of TLR2 mRNA and its protein were significantly higher in the ANP group than in the sham-operation group. Western blot showed that the TLR2 mRNA expression level was correlated with the pathological scores (r = 0.42, P < 0.01) and permeability (r = 0.41, P < 0.011) of intestinal mucosa. Immunohistochemistry displayed that the TLR2 protein expression was rather high on ileum mucosa surface, in T and B lymphocytes, histoleucocytes and eosinocytes of lamina propria, arteries and veins of submucosa, longitudinal and circular muscular layers of the ANP group.
CONCLUSION: Expression of TLR2 is increased in the distal ileum of rats with ANP. Its overexpression may correlate with intestinal mucosa injury and development of enterogenic infection.
- Citation: Ma JM, Cui J, Yang ZJ. Expression of Toll-like receptor 2 in distal ileum of rats with acute necrotizing pancreatitis and its significance. Shijie Huaren Xiaohua Zazhi 2008; 16(4): 361-365
- URL: https://www.wjgnet.com/1009-3079/full/v16/i4/361.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i4.361
急性坏死性胰腺炎(ANP)是一类起病急、病死率高、涉及多个脏器的危重症疾病, 胰腺坏死组织继发感染是ANP患者死亡的主要原因[1]. 在急性胰腺炎早期, 肠道是全身炎症反应的一个靶器官, 而肠道屏障损害所致的肠道细菌或毒素移位是ANP时细菌入侵的主要途径[2-4]. Toll样受体(toll-like receptors, TLRs)是病原相关分子模式(pathogen associated molecular pattern, PAMP)的受体, 是内毒素信号转导链中致病的关键环节[5]. TLR2作为脂多糖(LPS)受体, 可能作为急性炎症反应损伤的扳机点, 启动机体的这种病理过程. 本实验制作大鼠ANP模型, 观察ANP时末端回肠组织TLR2的表达情况, 探讨TLR2在ANP肠源性感染中的作用.
健康成年SD大鼠60只, 体质量200 g±20 g, 由东南大学医学院实验动物中心提供. 牛磺胆酸钠(Sigma公司), TRIzol试剂盒(Invitrogen公司), Taq聚合酶、MMLV反转录酶(Promega公司), 10000×Sybergreen(Molecular Probes公司), Rotor-Gene 3000 Real time PCR仪(Corbett Research公司), 一抗为羊抗大鼠TLR2多克隆抗体(Santa cruz公司), 鼠抗羊二抗购自Jacksonimmuno公司.
1.2.1 模型制备: 60只大鼠随机分为2组, 假手术组20只, ANP组40只. 试验前大鼠禁食12-16 h, 自由饮水. ANP组采用逆行胰胆管注射50 g/L牛磺胆酸钠(1 mL/kg体质量), 假手术组仅轻轻翻动胰腺3次后关腹. 关腹后背部sc生理盐水4-6 mL作为补液, 术后将大鼠放回代谢笼. 假手术组在术后8 h处死大鼠, ANP组分别于术后8 h和16 h两个时相点(P8、P16)处死大鼠, 提取部分末端回肠组织. 新鲜回肠组织于40 g/L甲醛溶液中固定12 h后, 常规石蜡包埋、切片. 其余组织-70 ℃冻存备用.
1.2.2 肠黏膜通透性检测及病理学评分: 采用99m锝-亚锡喷替酸法(99mtechnetium diethlene triamine pentacetic acid, 99mTc-DTPA)检测肠黏膜通透性[6]: 术中于近端空肠内缓慢注入1.5 mCi 99mTc-DTPA. 术后放入代谢笼, 留取8 h和16 h尿液, 用放射免疫γ计数器测定上述时点尿中99mTc-DTPA脉冲数. 末端回肠用40 g/L的甲醛固定后, 石蜡包埋、切片, 常规HE染色, 光镜下观察. 按参考文献进行肠黏膜病理学评分[2].
1.2.3 总RNA抽提: 用TRIzol法抽提总RNA, 紫外分光光度计测定总RNA的纯度, 变性琼脂糖凝胶电泳初步评价总RNA. 符合标准的总RNA A260/A280在1.8-2.1之间, 琼脂糖凝胶电泳, 18S和28S电泳条带清晰, 28S和18S亮度之比≥2.1. 抽提的总RNA于-70 ℃保存备用.
1.2.4 实时定量PCR: 应用Primer premier 5.0软件, 参照TLR2基因序列设计引物, β-actin作为内参基因(表1). 引物由上海康成生物公司合成. 每份标本取5 μg总RNA, 在MMLV反转录酶作用下合成cDNA, 针对每一需要测量的基因和管家基因, 进行PCR反应以制备用于绘制标准曲线的梯度稀释DNA模板, 反应体系: cDNA 1 μL, 上下游引物各0.5 μL, Sybergreen 0.5 μL, 总反应体积为25 μL, 反应条件: 94 ℃ 20 s, 58 ℃ 20 s, 72 ℃ 30 s, 45个循环; 72 ℃延伸5 min. 将PCR产物进行10倍梯度稀释: 设定PCR产物浓度为1, 分别稀释为1×10-1, 1×10-2, 1×10-3, 1×10-4, 1×10-5, 1×10-6和1×10-7这几个梯度浓度的DNA. 几个梯度稀释的DNA模板以及所有cDNA样品分别配置Real time PCR反应体系: cDNA 1 μL, 上下游引物各0.5 μL, Sybergreen 0.5 μL, 总反应体积为25 μL. 反应条件: β-actin: 94 ℃ 5 min; 35个PCR循环(94 ℃ 20 s, 60 ℃ 20 s, 72 ℃ 20 s, 88 ℃ 10 s, TLR2: 94 ℃ 5 min; 40个PCR循环(94 ℃ 20 s, 59 ℃ 20 s, 72 ℃ 20 s, 85 ℃ 10 s, TLR4: 94 ℃ 5 min; 35个PCR循环(94 ℃ 20 s, 58 ℃ 20 s, 72 ℃ 20 s, 87.5 ℃ 10 s). 为建立PCR产物的熔解曲线, 每次扩增反应结束后均继续从72 ℃缓慢加热到99 ℃(每5 s升高1 ℃). 最后, 用标准曲线法定量.
| 基因 | 引物序列 | 产物长度(bp) |
| TLR2 | 137 | |
| 上游引物: 5'-AGAGGGAAATCGTGCGTGAC-3' | ||
| 下游引物: 5'-CCATACCCAGGAAGGAAGGCT-3' | ||
| β-actin | 195 | |
| 上游引物: 5'-ACTGGCGTGTTCATCCGTTCT-3' | ||
| 下游引物: 5'-CGCAATCCAGGCCACTACTTC-3' |
1.2.5 免疫印迹: 称取200 mg组织研磨粉碎后, 抽提总蛋白, 按蛋白质定量试剂盒操作说明测定蛋白浓度, 配制含50 μg总蛋白的样品液. 将准备好的样品液和生物素标记的蛋白质分子量标准分别上样, 行SDS-PAGE电泳. 电转移到膜上, 用50 g/L BSA封闭. 封闭过的膜加入一抗(1:300)室温孵育1.5 h, PBS洗膜3次, 加入HRP标记的二抗(1:5000)以结合一级抗体及HRP标记的抗生物素抗体, 室温孵育1 h, PBS洗膜3次. 对反应好的膜进行化学发光, 以X光胶片曝光、显影、定影, 图片扫描保存为电脑文件, 并用Image J分析软件将图片上每个特异条带灰度值数字化.
1.2.6 免疫组化: 石蜡切片常规脱蜡至水, 30 g/L H2O2封闭内源性过氧化物酶10 min, 将切片浸入0.01 mol/L枸橼酸盐缓冲液(pH6.0)煮沸, 10 min后重复1次, 加入一抗(1:100)孵育1 h. 加辣根过氧化物酶标记的二抗(1:100)孵育20 min; PBS洗3次, 加SABC工作液, DAB显色, 最后苏木素复染, 脱水、透明、封片, 光镜下观察.
统计学处理 实验数据用mean±SD表示. 用Prism软件包(美国圣地亚哥GraphPad软件公司)进行统计学分析. 组间差异用Mann-Whitney U检验或精确χ2检验. 相关性分析用Spearmann相关性分析法. P<0.05为差异具有统计学意义.
ANP组血清淀粉酶值在相应时间点均显著高于对照组, 且随时间推移, 其测定值逐渐增加. 开腹后肉眼观察所见: ANP组大鼠腹腔内可见较多血性腹水, 肠系膜、大网膜出现皂化斑, 胰腺可见充血水肿、出血坏死灶及皂化斑, 病变以胰头、体部为重, 结肠及小肠管壁充血水肿, 小肠色泽暗红, 肠蠕动明显减少, 弹力减弱, 对照组大鼠腹腔内无腹水, 胰腺和肠管未见明显异常改变. 肠黏膜组织病理学评分见表2.
| 分组 | 假手术组 | ANP组 | |
| 8 h | 16 h | ||
| 肠黏膜病理学评分 | 0.58±0.18 | 1.90±0.74b | 3.10±0.99b |
| 99mTc-DTPA排泄率 | 5.39±0.78 | 24.61±2.51b | 37.12±2.71b |
与假手术对照组相比, ANP发生8 h后99mTc-DTPA排泄率明显增加, 到16 h时, 其排泄率仍在增加, 提示肠黏膜通透性增加(表2).
TLR2 mRNA在假手术组表达水平较低, 而ANP组8 h则开始明显增高(P<0.05), 8 h后仍继续升高, 到16 h仍维持较高水平(图1).
将所检测的TLR2的mRNA表达量分别与肠黏膜的病理学评分及通透性指数进行相关性分析, 结果发现, TLR2的表达水平分别与肠黏膜的病理学评分(r = 0.42, P<0.01)和肠黏膜通透性指数(r = 0.41, P<0.01)明显相关(图2).
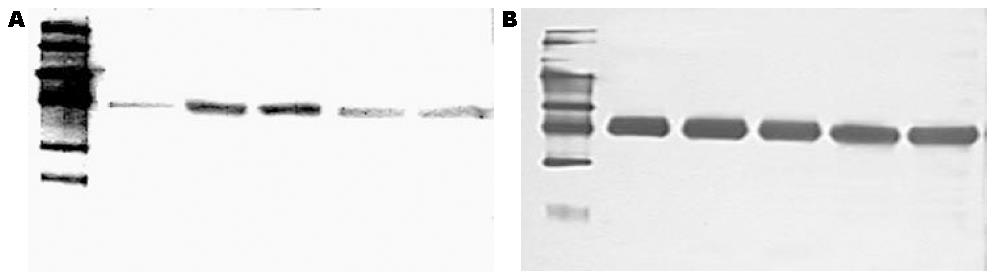
Western blot结果显示, 假手术组末端回肠组织中, TLR2蛋白的表达处于较低水平, 呈一条较淡的灰色蛋白条带. 在ANP组中, TLR2表达则明显增加, 与前者相比, 灰度值间差别具有统计学意义(P<0.05), ANP 8 h和16 h组间, TLR2蛋白的表达则无显著差别(P>0.05, 图3).
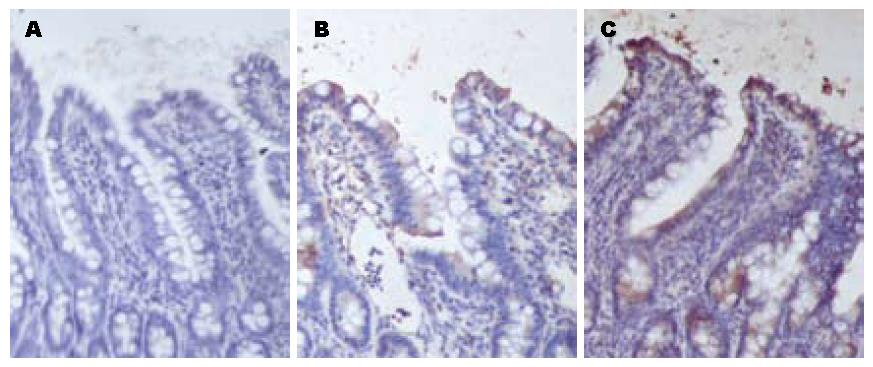
应用免疫组化技术进行假手术组和ANP大鼠末端回肠组织中TLR2的组织学定位. 正常对照组仅在肠黏膜的表面有比较弱的TLR2的表达. 与之相比, ANP组的回肠黏膜表面、黏膜固有层的T、B淋巴细胞、单核细胞、中性粒细胞、嗜酸性细胞、黏膜下层的动静脉、纵形和环形肌层等处都有比较强的TLR2 的表达. 至术后16 h上述细胞仍保持高表达(图4).
胰腺及胰周感染是ANP的严重并发症, 临床上ANP患者的死亡主要是由于胰腺坏死组织继发感染所致[7]. 胰腺感染主要是由移位的肠道细菌或毒素所致的肠源性感染. 在急性胰腺炎早期, 肠道是全身炎症反应的一个靶器官, 而发生的肠道屏障损害则成为肠道细菌移位的一个重要原因. 发生移位的细菌和内毒素进一步使循环中的细胞因子和炎症介质升高, 对全身各脏器造成再次损害, 形成所谓的"二次打击"[8-10], 即使程度并不严重, 也可引发不同程度全身炎症反应综合征(SIRS), SIRS过程中将会引起链式反应, 产生大量的炎症介质, 如肿瘤坏死因子(TNF)、IL-6、IL-8、IL-2和白三烯等, 加重肠黏膜屏障损伤, 导致肠黏膜通透性继续增高, 如此形成恶性循环[11-12]. 因此, 如何保护急性胰腺炎时的肠道屏障功能、降低肠黏膜通透性, 进而减少肠道细菌移位, 成为防治胰腺感染的重要途径.
TLRs属于Ⅰ类跨膜受体, 广泛分布于单核巨噬细胞系统、内皮细胞、树突细胞、部分消化道上皮等[13-14], 其配体包括肽聚糖(PGN)、脂磷壁酸(LTA)和脂蛋白等, 是连接天然免疫和获得性免疫的桥梁. 目前已发现人类的TLR有11位成员(TLR1-11), 其中对TLR4和TLR2的研究最为广泛. TLR2主要识别革兰氏阳性菌细胞壁成分. TLRs的激活将引起一系列下游分子的活化, 最后激活通用转录因子NF-κB, 最终引起以TNF-a等为中心的前炎症因子激活, 导致多种炎症因子的瀑链式释放而产生生物学效应[15]. 因此, TLRs的激活及引发的下游一系列信号分子活化可能是过度炎症反应造成肠黏膜屏障功能受损的关键点.
本试验结果显示: 假手术组大鼠末端回肠组织中仅有少量TLR2的表达, 而ANP时TLR2表达均明显上调, 且TLR2的表达与肠黏膜病理改变和通透性相关. 此结果提示ANP可引起末端回肠组织TLR2的表达的上调, TLR2的过度表达可能参与了ANP的病理生理过程. ANP时末端回肠组织TLR2表达上调的机制尚不清楚, 内毒素和LPS可能是重要的刺激因素之一. 急性胰腺炎时, 肠道屏障的损坏, 可使肠道内大量内毒素和LPS吸收入血, 从而诱导TLR2的表达. 有文献报道, 大量LPS存在时TLR2起着加速炎症反应的作用, 进一步诱导TNF-α产生, 而这些致炎因子也能增强TLR2 mRNA 表达[12], 如此而形成恶性循环, 加重器官损害. 因此, ANP时, 对TLR2基因表达进行适当的调节, 可能为减轻肠屏障的损害、防治肠源性感染提供新的思路.
急性坏死性胰腺炎(ANP)是一类起病急、病死率高、涉及多个脏器的危重症疾病, 胰腺坏死组织继发感染是ANP患者死亡的主要原因. Toll样受体(TLRs)是新近被认识的病原相关分子模式(PAMP)的受体, 是内毒素信号转导链中致病的关键环节, 且被认为是炎症瀑链式反应的闸门. 探讨TLRs在急性坏死性胰腺炎肠源性感染中可能的作用, 可望为阐明ANP肠源性感染的发病机制, 寻找ANP新的干预途径和治疗靶点提供理论基础.
洪天配, 教授, 北京大学第三医院内分泌科
迄今ANP继发肠源性感染的机制尚不清楚. ANP时发生的肠道屏障损害可能是肠道细菌移位的一个重要原因, TLRs 的激活及引发的下游一系列信号分子活化则可能是过度炎症反应造成肠黏膜屏障功能受损的关键点.
有文献报道TLRs 的激活在AP急性肺损伤(ALI)中具有重要作用, 应用TLRs抗体能有效降低脓毒症引起的ALI; 在多病原菌导致的脓毒症中, TRL2/4表达的上调与死亡率的增加密切相关; TLRs作为天然免疫的受体在启动ALI早期的炎症反应及连接特异性免疫中起到了桥梁的作用, 对ALI发生发展及改善预后发挥了重要的作用.
本文通过制作大鼠ANP模型, 观察ANP时末端回肠组织TLR2的表达情况及其与肠黏膜通透性改变的关系, 探讨TLR2在ANP肠源性感染中的作用.
病原相关分子模式(PAMP): 是病原体的小分子序列. 他们被Toll样受体和其他模式识别受体(PRR)来识别. 细菌内毒素脂多糖(LPS)被认为是原型的病原相关分子模式. 其他的病原相关分子模式包括细菌鞭毛, 革兰氏阳性菌脂磷壁酸(LTA), 肽聚糖和病毒的核酸如双链RNA或非甲基化的CpG特征序列.
本文设计较合理, 具有一定的参考价值.
编辑: 李军亮 电编: 何基才
| 2. | Takahashi Y, Fukushima J, Fukusato T, Shiga J, Tanaka F, Imamura T, Fukayama M, Inoue T, Shimizu S, Mori S. Prevalence of ischemic enterocolitis in patients with acute pancreatitis. J Gastroenterol. 2005;40:827-832. [PubMed] [DOI] |
| 3. | Penalva JC, Martínez J, Laveda R, Esteban A, Muñoz C, Sáez J, Such J, Navarro S, Feu F, Sánchez-Payá J. A study of intestinal permeability in relation to the inflammatory response and plasma endocab IgM levels in patients with acute pancreatitis. J Clin Gastroenterol. 2004;38:512-517. [PubMed] [DOI] |
| 4. | Ammori BJ, Fitzgerald P, Hawkey P, McMahon MJ. The early increase in intestinal permeability and systemic endotoxin exposure in patients with severe acute pancreatitis is not associated with systemic bacterial translocation: molecular investigation of microbial DNA in the blood. Pancreas. 2003;26:18-22. [PubMed] [DOI] |
| 5. | Arancibia SA, Beltrán CJ, Aguirre IM, Silva P, Peralta AL, Malinarich F, Hermoso MA. Toll-like receptors are key participants in innate immune responses. Biol Res. 2007;40:97-112. [PubMed] [DOI] |
| 6. | Park PO, Haglund U, Bulkley GB, Fält K. The sequence of development of intestinal tissue injury after strangulation ischemia and reperfusion. Surgery. 1990;107:574-580. [PubMed] |
| 7. | Carnovale A, Rabitti PG, Manes G, Esposito P, Pacelli L, Uomo G. Mortality in acute pancreatitis: is it an early or a late event? JOP. 2005;6:438-444. [PubMed] |
| 8. | Foitzik T. [Pancreatitis and nutrition. Significance of the gastrointestinal tract and nutrition for septic complications]. Zentralbl Chir. 2001;126:4-9. [PubMed] [DOI] |
| 9. | Mole DJ, Taylor MA, McFerran NV, Diamond T. The isolated perfused liver response to a 'second hit' of portal endotoxin during severe acute pancreatitis. Pancreatology. 2005;5:475-485. [PubMed] [DOI] |
| 10. | Furuya T, Soeno T, Komatsu M. [Strategy for bacterial translocation in acute pancreatitis]. Nihon Shokakibyo Gakkai Zasshi. 2004;101:502-509. [PubMed] |
| 11. | Theuer J, Dechend R, Muller DN, Park JK, Fiebeler A, Barta P, Ganten D, Haller H, Dietz R, Luft FC. Angiotensin II induced inflammation in the kidney and in the heart of double transgenic rats. BMC Cardiovasc Disord. 2002;2:3. [PubMed] [DOI] |
| 12. | Wang Z, Castresana MR, Detmer K, Newman WH. An IkappaB-alpha mutant inhibits cytokine gene expression and proliferation in human vascular smooth muscle cells. J Surg Res. 2002;102:198-206. [PubMed] [DOI] |
| 13. | Frantz S, Kelly RA, Bourcier T. Role of TLR-2 in the activation of nuclear factor kappaB by oxidative stress in cardiac myocytes. J Biol Chem. 2001;276:5197-5203. [PubMed] [DOI] |