修回日期: 2008-12-02
接受日期: 2008-12-08
在线出版日期: 2008-12-28
目的: 探讨用门静脉动脉化重建肝血流对肝脏血流动力学的影响.
方法: 大鼠40只, 随机分为4组, 每组各10只, 第1组: 对照组; 第2组: 单纯梗阻性黄疸5 d组; 第3组: 梗阻性黄疸术后5 d, 行胆总管再通, 并游离门腔静脉、结扎肝总动脉; 第4组: 梗阻性黄疸术后5 d, 行胆总管再通, 并行门静脉动脉化. 对大鼠的一般情况、肝脏的结构和功能的改变、肝脏血流量和门静脉压及肝脏微血管的影响进行为期1 mo的观察.
结果: 大鼠在胆总管结扎5 d后, 胆红素(T-BIL、D-BIL)、转氨酶(ALT、AST)和碱性磷酸酶(ALP)显著增高 (141.7±10.6 vs 6.7±2.1, 68.16±7.6 vs 3.25±1.7, 132±22 vs 53±8, 160±38 vs 73±16, 285±60 vs 148±41, 均P<0.01). 胆总管结扎5 d后的大鼠行胆管再通+门静脉动脉化手术后1 mo, 肝脏血流量和门静脉压与正常组比较无显著差异. 血管铸型标本显示肝窦略变粗, 较正常更为充盈, 虽有一定的变形, 但仍呈放射状分布在中央静脉的周围.
结论: 门静脉动脉化后1 mo对肝脏的血流动力学和肝脏的微血管不会造成明显的不良影响. 肝脏功能和结构可顺利恢复.
引文著录: 陈永亮, 黄志强, 黄晓强, 陈明易, 段伟东. 门静脉动脉化重建肝血流对梗阻性黄疸大鼠肝脏血液动力学的影响. 世界华人消化杂志 2008; 16(36): 4093-4097
Revised: December 2, 2008
Accepted: December 8, 2008
Published online: December 28, 2008
AIM: To investigate the liver hemodynamic changes after re-establishment of hepatic blood flow by portal vein arterialization in rats with obstructive jaundice.
METHODS: Forty rats were randomly divided into 4 groups (n = 10, for each group). The first group served as control, and the second group included the rats with 5-day obstructive jaundice. The rats in the third group underwent common bile duct reopening after 5-day obstructive jaundice, while received portal caval vein dissociation and common hepatic artery ligation. The rats in the fourth group underwent common bile duct reopening after 5-day obstructive jaundice, while received portal vein arterialization. The following indicators were observed for 1 month, including general condition, liver structure and function, hepatic blood flow, portal venous pressure and liver microvessels.
RESULTS: After common bile duct ligation for 5 days, the levels of T-BIL, D-BIL, ALT, AST and ALP were significantly increased (141.7 ± 10.6 vs 6.7 ± 2.1, 68.16 ± 7.6 vs 3.25 ± 1.7, 132 ± 22 vs 53 ± 8, 160 ± 38 vs 73 ± 16, 285 ± 60 vs 148 ± 41; all P< 0.01). After 5-day common bile duct ligation, reopening and portal vein arterialization for 1 month, the hepatic blood flow and portal venous pressure had no significant difference from those of normal controls. Cast specimens of blood vessels showed that hepatic sinusoids were slightly thicker and their filling was more obvious than normal. Although there was slight deformation, they were distributed around the central vein in a radial form.
CONCLUSION: Portal vein arterialization has no obvious influence on liver hemodynamics and microvessels. Liver function and structure can successfully restore to normal.
- Citation: Chen YL, Huang ZQ, Huang XQ, Chen MY, Duan WD. Re-establishment of hepatic blood flow by portal vein arterialization and its influence on liver hemodynamics in rats with obstructive jaundice. Shijie Huaren Xiaohua Zazhi 2008; 16(36): 4093-4097
- URL: https://www.wjgnet.com/1009-3079/full/v16/i36/4093.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i36.4093
随着影像学和外科技术的发展, 肝移植在治疗肝衰竭、肝癌和终末期胆病方面取得了巨大的进步[1-5]. 但肝移植术后肝动脉吻合口栓塞率高达20%, 是术后致命的并发症之一[6-7], 为此提出了用门静脉动脉化方法重建血管以避免肝动脉栓塞所造成的肝坏死和胆管狭窄[8-11]. 由于大部分肝胆患者常伴有不同程度的黄疸, 所以我们在大鼠建立了黄疸的门静脉动脉化模型, 并观察了肝血流量(hepatic blood flow, HBF)、肝功能和门静脉压力(portal venous pressure, PVP).
♀Sprague-Dawley大鼠40只, 体质量250-300 g. 随机分为4组, 每组各10只, 第1组: 对照组, 仅行胆总管、门静脉、腔静脉和肝总动脉的单纯游离; 第2组: 单纯梗阻性黄疸5 d; 第3组: 梗阻性黄疸术后5 d, 行胆总管再通, 并游离门腔静脉、结扎肝总动脉; 第4组: 梗阻性黄疸术后5 d, 行胆总管再通, 并行门静脉动脉化.
1.2.1 造模: 按文献[12]方法制作模型, 即将肝动脉与门静脉行端侧吻合, 将门静脉与腔静脉侧侧吻合, 在两个吻合口之间结扎门静脉, 使肝脏仅有动脉血供应, 而门静脉血全部回流入腔静脉. 术后对大鼠的一般状况及体质量恢复情况进行观察. 各组动物除单纯梗阻性黄疸组于术后5 d进行检测外, 其他各组均在术后1 mo进行各指标检测.
1.2.2 肝脏血流量和门静脉压的检测: 术后1 mo, 大鼠用乙醚麻醉后, 取仰卧位, 固定四肢, 由肋缘下横行切口入腹, 游离肝脏并暴露门静脉, 观察小肠、门静脉及吻合口情况. 用LDF-2型激光多普乐血流量测定仪进行肝脏血流量的测定, 波形的平均值与基线之间的距离为平均血流量指标进行统计. 用测压的刻度玻璃管连接针头直接穿刺门静脉测压, 穿刺前刻度玻璃管中加入含肝素的生理盐水, 穿刺后观察玻璃管中的盐水下降情况, 待水柱停止下降后, 记录水柱所在的刻度.
1.2.3 肝脏功能和结构的检测: 下腔静脉穿刺抽血2 mL, 3500 g 10 min, 取上清测总胆红素(total bilirubin, T-BIL)、直接胆红素(direct bilirubin, D-BIL)、丙氨酸氨基转移酶(alanine transminase, ALT)、门冬氨酸氨基转移酶(aspartate transminase, AST)、碱性磷酸酶(alkaline phosphatase, ALP)和白蛋白(albumin, ALB). 然后取肝组织, 用40 g/L甲醛溶液固定后, 石蜡包埋, 切片后, HE染色, 光学显微镜下观察肝组织变化情况. 取直径约1 mm的肝组织块固定于4 ℃ 30 g/L戊二醛溶液中经磷酸缓冲液漂洗, 行透射电子显微镜检查.
1.2.4 透射电镜观察: 采用甲基丙烯酸甲酯预聚体灌注[13]. 将开腹的大鼠暴露肝上和肝下的下腔静脉并将其剪破, 作为灌注液的出路, 阻断门静脉后, 在阻断的远侧端用注射器将生理盐水由门静脉注入肝脏(灌注压以不超过120 mmHg为宜), 直至下腔静脉流出的液体变清为止. 保持灌注压不变, 注入甲基丙烯酸甲酯单体约5 mL, 然后在上述制备的预聚体中加入1%的二甲苯胺, 迅速搅拌混合均匀, 立即用注射器由门静脉注入约3-5 mL. 然后迅速取出肝脏, 用血管钳夹闭门静脉和肝静脉以防预聚体流出, 放置24 h后, 放在盛有200-300 g/L氢氧化钾(钠)水溶液中腐蚀2-3 wk, 腐蚀掉的组织用流水轻轻洗掉, 腐蚀完毕后, 在解剖显微镜下检查标本是否腐蚀干净, 如已腐蚀干净就将腐蚀后的标本放在干净的玻璃器皿中, 在空气中自然干燥. 将干燥后的样品用导电胶粘在样品台上, 放入日立IB-3型离子镀膜机喷镀细粉金, 一般喷镀3-5 min既可. 喷镀后的样本在扫描电镜下观察.
统计学处理 采用SPSS统计软件, 行t检验, P<0.05为差异有显著性.
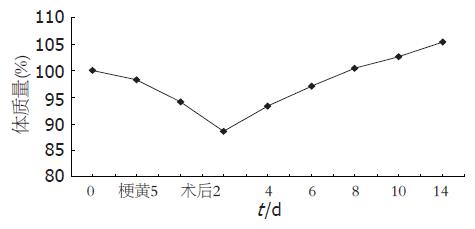
术后大鼠活动如常, 机警, 毛发有光泽, 能自由进食, 黄疸很快消退, 术后7-10 d体质量即可恢复术前水平, 以正常体质量为100%, 记录体质量变化的趋势(图1).
术后1 mo所有大鼠吻合口均通畅, 小肠未见明显充血, 门静脉未见扩张. 肝脏血流量示第4组大鼠肝脏血流量的平均值与其他组相比有所下降, 但无显著性差异(表1).
| 第1组 | 第2组 | 第3组 | 第4组 | |
| 肝脏血流量(mV) | 25.45±2.61 | 21.34±3.68 | 23.37±3.92 | 20.46±4.27 |
| 门静脉压力(mmH2O) | 102.40±3.36 | 108.20±3.96 | 103.60±5.77 | 97.20±5.15 |
胆总管结扎5 d后, 血清胆红素水平显著高于对照组, 且差异有极显著意义(P<0.01). 第3、4组在胆总管再通手术后1 mo与对照组比较差异均无显著意义. 各组血浆蛋白均在正常范围. 梗阻性黄疸组的ALT、AST、ALP均明显增高, 与对照组差异有极显著意义(P<0.01). 而梗阻性黄疸再通组和梗阻性黄疸再通+门静脉动脉化组在术后1 mo时与对照组相比无显著差(表2).
对照组在术后1 mo其肝脏外形结构正常, 肝组织均表现为肝小叶结构正常, 肝细胞排列整齐, 肝细胞及细胞器未见损伤及无明显变性. 胆管梗阻5 d后的第2组可见肝小叶结构基本正常, 肝细胞肿大、变性、点状坏死及肝细胞内淤胆, 尤以肝小叶周边汇管区最为明显并有局部炎性细胞浸润. 电子显微镜示细胞核轻度肿胀、异性. 细胞内线粒体肿胀、异形、内膜上嵴增粗、扭曲. 粗、滑面内织网及高尔基体扩张, 胞质内囊泡增多, 溶酶体增多. 肝Disse间隙缩窄. 细胞间毛细胆管扩张, 管腔内微绒毛减少, 异形, 连接复合体结构紊乱. 第3、4组术后1 mo示肝脏外形结构已完全正常. 肝细胞已基本恢复正常, 无明显水肿、变性及淤积胆汁. 无明显炎性细胞浸润. 门静脉及胆管管腔和管壁未见异常. 电子显微镜下见各细胞器基本恢复正常, 偶可见有线粒体轻度肿胀.
第1组: 门静脉分支, 分布静脉在汇管区的中央行走, 不断发出小末梢支到肝窦, 肝窦形状相同, 呈放射状均匀分布在中央静脉的周围. 第2组: 肝窦略变细, 但仍呈放射状较均匀分布在中央静脉的周围. 第3组: 与第一组基本相同. 第4组: 门静脉分支, 分布静脉在汇管区的中央行走, 形态正常, 并不断发出小末梢支到肝窦, 肝窦略变粗, 较正常更为充盈, 虽有一定的变形, 但仍呈放射状分布在中央静脉的周围.
我们发现胆总管结扎后的大鼠, 胆总管明显扩张, 凝血机制较差, 手术时创面易出血, 类似于人有黄疸时的表现, 通过近似于人的梗阻性黄疸建立了大鼠门静脉动脉化的模型, 不仅对传统的门静脉动脉化模型进行了改进, 使其适合于有梗阻性黄疸的大鼠, 而且更接近于临床. 本实验选用肝动脉行门静脉动脉化优点是: 首先肝动脉不是太粗, 离肝门较近, 容易吻合, 其次是不用过分游离门静脉左侧而造成出血增多. 而且他不仅同时阻断了肝固有动脉对肝脏的供血, 还可通过门静脉适当增加肝脏的血供. 这更符合临床实际, 因为在临床上肝固有动脉分枝早而多, 变异大, 管腔细, 尤其是在被癌组织浸润后癌肿远端的肝动脉更细, 甚至闭塞. 所以在行肝外胆管癌手术后, 肝动脉很难被修复, 绝大多数今留有门静脉血供.
术后大鼠活动如常, 精神佳, 机警, 毛发有光泽, 能自由进食, 黄疸很快消退, 术后7-10 d体质量即可恢复术前水平. 所以本实验模型对大鼠的一般状态不造成明显不利的影响. 所有实验大鼠在1 mo后均未见明显的小肠充血; 门静脉系统未见扩张; 吻合口均通常, 说明此吻合口方法是可行的.
梗阻性黄疸的情况下即可造成肝血流量的减少, 并会随时间延长而进行性减少, 而且表现为肝动脉和门静脉血流量均减少, 肝动脉血流量减少是由于末梢血管对加压反应减低、体循环血压下降所致, 门静脉血流量减少是门静脉阻力增加的结果. 在第2组的大鼠胆总管结扎仅5 d后, 肝脏血流量尽管与对照组无显著性差异, 但已有下降的趋势. 在梗阻胆管再通后1 mo时已完全恢复正常的肝脏血流量(尽管再通组的大鼠的肝总动脉已被结扎). 而在第4组的肝脏血流量较正常略低, 但无显著性差异. 表明在用肝总动脉行门静脉动脉化后基本可达到正常时的肝脏血流量, 使大鼠术后顺利恢复.
门静脉压在梗阻性黄疸时常升高, 并随梗阻的时间延长而增加, 其机制尚不清楚. Ohlsson et al[14]认为门静脉压增高是由于肝内动-静脉瘘所致, 但用标记微球技术测定未能完全证明. 而Franco et al[15]对大鼠的研究表明门静脉压的增高与肝静脉楔入压有关. 在本实验中, 梗阻性黄疸5 d后, 门静脉压亦有增高的趋势. 而梗阻胆管再通后1 mo时门静脉压完全正常. 梗阻胆管再通+门静脉动脉化手术后1 mo平均门静脉压仍低于正常, 但无显著性差异. 所以用肝总动脉行门静脉动脉化后, 其在门静脉中所造成的平均压力较正常门静脉的压力为低, 门静脉未见明显扩张和静脉壁增厚.
既往一些实验表明门静脉动脉化可保持正常的肝功能、血氨、血胆酸水平和肝细胞形态, 保证正常的肝脏解毒功能(例如酚磺溴钠和吲哚氰绿清除率保持正常)[16-17]. 但过量动脉血(门静脉内动脉血灌注量达到分流前门静脉内血流量的1倍以上时)灌注肝内门静脉则对肝脏有害, 如肝内门静脉分枝增宽, 内膜纤维变性, 以及肝细胞微粒体酶活力的改变. 超微结构发现有肝血窦的改变, 内皮细胞的损害, Disse间隙的增宽. 所以Adamons et al[18]经对健康犬的肝脏进行研究后提出, 只要门静脉的动脉血流控制在门静脉的正常血流或略低时, 则肝脏不发生组织学损害. 我们的实验在对梗阻性黄疸的大鼠行门静脉动脉化后进行了为期1 mo的观察, 结果发现大鼠胆红素、肝功能和肝脏结构均可顺利恢复正常, 与未行门静脉动脉化组的大鼠无显著性差异, 而且对门静脉和肝脏未造成任何损害. 所以用肝总动脉行门静脉动脉化的方法对梗阻性黄疸的大鼠肝功能恢复无明显的不良影响.
血管铸型标本显示在正常情况下, 门静脉分支, 分布静脉在汇管区的中央行走, 不断发出小末梢支到肝窦, 肝窦形状相同, 呈放射状均匀分布在中央静脉的周围. 梗阻性黄疸时肝窦略变细, 但肝窦形状仍呈放射状较均匀分布在中央静脉的周围. 梗阻胆道再通后1 mo的第3组则基本同第1组. 说明上述梗阻性黄疸后的可逆性改变可在1 mo内完全恢复正常. 而梗阻胆道再通+门静脉动脉化手术后1 mo的第4组的血管铸型显示, 门静脉分支, 分布静脉在汇管区的中央行走, 形态正常, 并不断发出小末梢支到肝窦, 可见较正常更为充盈, 虽有一定的变形, 但仍呈放射状分布在中央静脉的周围. 这可能是由于压力变化较大的波动性动脉血通过门静脉进入肝窦后, 使肝窦内的压力有所增高而致肝窦增宽, 虽造成肝窦一定的形态改变, 但仍呈放射状分布在中央静脉的周围. 而且因肝脏的总血流量仍较低以及观察时间较短, 所以未发生因门静脉的过度灌注可能造成肝脏的损害, 如肝功的改变、肝内门静脉分枝增宽、内膜纤维变性等[19].
本试验对肝脏的结构、功能以及血流量和门静脉压以肝脏微血管的观测表明用肝动脉进行门静脉动脉化不仅能保证肝脏的血液供应, 使梗阻性黄疸的肝脏功能和结构恢复正常, 使大鼠术后顺利恢复, 而且在1 mo内不引起肝脏血流量的增加和门静脉压的增高, 肝脏微血管无显著改变. 这说明我们所选择的用肝总动脉行门静脉动脉化是合理的, 而且提示该实验模型在临床上具有一定的可行性.
随着影像学和外科技术的发展, 肝移植在治疗肝衰竭、肝癌和终末期胆病方面取得了巨大的进步. 但肝移植术后肝动脉吻合口栓塞率高达20%, 是术后致命的并发症之一, 为此提出了用门静脉动脉化方法重建血管以避免肝动脉栓塞所造成的肝坏死和胆管狭窄.
傅春彬, 主任医师, 吉化集团公司总医院一院消化内科; 程树群, 副教授, 中国人民解放军第二军医大学东方肝胆外科医院综合治疗三科
门静脉压在梗阻性黄疸时常升高, 并随梗阻的时间延长而增加, 其机制尚不清楚.
Ohlsson et al认为门静脉压增高是由于肝内动-静脉瘘所致, 但用标记微球技术测定未能完全证明. 而Franco et al对大鼠的研究表明门静脉压的增高与肝静脉楔入压有关.
本文选题紧密结合临床, 研究方法正确, 结论可信, 对临床有一定的指导意义.
编辑: 李军亮 电编: 何基才
| 1. | Martínez L, López-Santamaría M, Gámez M, Murcia J, Tovar JA. [Primary liver tumors in children: analysis of 62 consecutive cases]. Cir Pediatr. 2000;13:110-115. [PubMed] |
| 2. | Sarasin FP, Giostra E, Mentha G, Hadengue A. Partial hepatectomy or orthotopic liver transplantation for the treatment of resectable hepatocellular carcinoma? A cost-effectiveness perspective. Hepatology. 1998;28:436-442. [PubMed] |
| 3. | Ambrosino G, Naso A, Feltracco P, Carraro P, Basso SM, Varotto S, Cillo U, Zanus G, Boccagni P, Brolese A. Cytokines and liver failure: modification of TNF- and IL-6 in patients with acute on chronic liver decompensation treated with Molecular Adsorbent Recycling System (MARS). Acta Biomed. 2003;74 Suppl 2:7-9. [PubMed] |
| 4. | Tan JW, Jiang Y, Yao HX, Lu LZ, Zhang SG. Early prevention and treatment of biliary tract complications after orthotopic liver transplantation. Hepatobiliary Pancreat Dis Int. 2003;2:48-53. [PubMed] |
| 5. | Wiesner RH, Porayko MK, Hay JE, LaRusso NF, Steers JL, Krom RA, Dickson ER. Liver transplantation for primary sclerosing cholangitis: impact of risk factors on outcome. Liver Transpl Surg. 1996;2:99-108. [PubMed] |
| 6. | Childs T, Hart M. Aggressive surgical therapy for Klatskin tumors. Am J Surg. 1993;165:554-557. [PubMed] |
| 7. | Blumhardt G, Ringe B, Lauchart W, Burdelski M, Bechstein WO, Pichlmayr R. Vascular problems in liver transplantation. Transplant Proc. 1987;19:2412. [PubMed] |
| 8. | Robles R, Fernandez JA, Hernández Q, Marín C, Ramírez P, Sánchez-Bueno F, Luján JA, Rodríguez JM, Acosta F, Parrilla P. Eversion thromboendovenectomy in organized portal vein thrombosis during liver transplantation. Clin Transplant. 2004;18:79-84. [PubMed] |
| 9. | Orlando G, De Luca L, Toti L, Zazza S, Angelico M, Casciani CU, Tisone G. Liver transplantation in the presence of portal vein thrombosis: report from a single center. Transplant Proc. 2004;36:199-202. [PubMed] |
| 10. | Ott R, Böhner C, Müller S, Aigner T, Bussenius-Kammerer M, Yedibela S, Kissler H, Hohenberger W, Reck T, Müller V. Outcome of patients with pre-existing portal vein thrombosis undergoing arterialization of the portal vein during liver transplantation. Transpl Int. 2003;16:15-20. [PubMed] |
| 11. | Sheil AG, Halliday JP, Drummond JM, Bookallil MJ, Gaudry PL, Yezerski SD. A modified technique for orthotopic liver transplantation. Arch Surg. 1972;104:720-724. [PubMed] |
| 13. | 田 牛, 刘 育英, 刘 凤英. 微循环方法学(增订版). 北京: 原子能出版社 1993; 237-239. |
| 14. | Ohlsson EG, Rutherford RB, Boitnott JK, Haalebos MM, Zuidema GD. Changes in portal circulation after biliary obstruction in dogs. Am J Surg. 1970;120:16-22. [PubMed] |
| 15. | Franco D, Gigou M, Szekely AM, Bismuth H. Portal hypertension after bile duct obstruction: effect of bile diversion on portal pressure in the rat. Arch Surg. 1979;114:1064-1067. [PubMed] |
| 16. | Adamsons RJ, Kinkhabwala M, Moskowitz H, Himmelfarb E, Minkowitz S, Lerner B. Portacaval shunt with arterialization of the hepatic portion of the portal vein. Surg Gynecol Obstet. 1972;135:529-535. [PubMed] |
| 17. | Saric J, Faugon H, Beliard R, Perissat J, Balabaud C, Dubuisson L, Bioulac P. Liver arterialization improves hepatocytes ultrastructure in rats with portacaval shunts. Dig Dis Sci. 1981;26:225-231. [PubMed] |
| 18. | Adamons RJ, Butt K, Iyer S, DeRose J, Dennis CR, Kinkhabwala M, Gordon D, Martin E. Portacaval shunt with arterialization of the portal vein by means of a low flow arteriovenous fistula. Surg Gynecol Obstet. 1978;146:869-876. [PubMed] |
| 19. | Adamsons RJ, Arif S, Babich A, Butt K, Lam A, Minkowitz S. Arterialization of the liver in combination with a portacaval shunt in the dog. Surg Gynecol Obstet. 1975;140:594-600. [PubMed] |