修回日期: 2008-11-11
接受日期: 2008-11-17
在线出版日期: 2008-12-28
目的: 探讨直视下胃十二指肠动脉逆行肝动脉插管法对动物实验中肝动脉插管的应用.
方法: 24只兔VX2 肝瘤模型及65只正常SD大鼠行胃十二指肠动脉逆行肝动脉插管法, 观察其成功率、术后情况等.
结果: 24只兔VX2肝瘤模型均行开腹胃十二指肠动脉逆行肝动脉插管造影和栓塞术, 成功20例, 成功率为83.3%. 术后肿瘤缩小, 肝功能无明显改变. 65只正常SD大鼠, 其中58只采取相同方法插管成功, 成功率为89.3%.
结论: 经胃十二指肠动脉逆行肝动脉插管法在动物实验中能够得到理想的实验结果, 是介入放射学方法在动物实验中的新应用, 值得推广.
引文著录: 王于, 李鹤平, 连帆, 谭国胜, 向贤宏, 许卫国, 陈伟, 杨建勇. 胃十二指肠动脉逆行肝动脉插管技术在动物实验中的应用. 世界华人消化杂志 2008; 16(36): 4088-4092
Revised: November 11, 2008
Accepted: November 17, 2008
Published online: December 28, 2008
AIM: To evaluate trans-gastroduodenal reverse artery catheterization of hepatic artery catheterization in an animal experiment.
METHODS: Trans-gastroduodenal artery catheterization of hepatic artery was performed on 24 New Zealand white rabbits with liver VX2 tumor and 65 SD rats after laparotomy. Success rate and postoperative conditions were assessed.
RESULTS: Twenty-four rabbit VX2 liver tumor model lines underwent open gastroduodenal artery retrograde hepatic artery angiography and embolization. Twenty were successful with a success rate of 83.3%. Postoperative tumor was decreased with not significant changes in liver function. Sixty-five SD rats received incubation, and 58 were successful with a success rate of 89.3%.
CONCLUSION: The new interventional radiological methods, trans-gastroduodenal artery catheterization of hepatic artery and embolization is feasible and promising.
- Citation: Wang Y, Li HP, Lian F, Tan GS, Xiang XH, Xu WG, Chen W, Yang JY. Application of trans-gastroduodenal artery reverse catheterization of hepatic artery in an animal experiment. Shijie Huaren Xiaohua Zazhi 2008; 16(36): 4088-4092
- URL: https://www.wjgnet.com/1009-3079/full/v16/i36/4088.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i36.4088
经过数十年发展, 介入放射学已经成为和内、外科并列的医学支柱学科[1]. 当前介入放射学研究集中于肿瘤和血管病变方面, 结合国内实际情况, 肝癌等疾病的治疗成为介入放射学的热点. 经肝动脉灌注化疗栓塞术(transcatheter arterial chemoembolization, TACE)是肝癌等介入治疗的重要手段, 也是介入动物实验研究的基础之一. 介入动物实验中常因动物血管细小, 容易痉挛, 导致传统血管性介入方法, 如经股动脉入路的肝动脉插管术式在小动物就较难达到理想的结果, 所以介入动物实验亟需研究如何采用有效及合理的肝动脉插管技术进行干预, 从而得到满意的, 接近临床实践的实验结果. 本文针对动物实验中的现状, 对肝动脉插管技术进行了改进, 就两项动物实验中共同采用的经胃十二指肠动脉逆行肝动脉插管技术应用的价值和心得进行讨论.
本研究中采用两种动物, 其一为新西兰大白兔24只, 雌雄不限, 体质量2-3.5 kg, 其中♂13只, ♀11只, 分别在CT导引下肝叶种植VX2瘤, 目的在于进行肝动脉插管化疗栓塞治疗; 其二为清洁级SD大鼠65只, 雌雄不限, 体质量170-350 g, 其中♂ 25只, ♀40只, 也采用相同方法进行肝动脉插管, 目的在于经导管向肝脏内注入免疫修饰脾细胞. 所有动物来源于并饲养于中山大学中山医学院动物实验中心. 24G、26G小儿留置静脉针; 显微器械及普通手术器械; 介入器械: 1.5F漂浮导管、3F微导管, 自制导管(硬外麻醉管), 上述导管均截短至约20 cm长, 取头端, 尾端接上鲁尔连接器. 主要设备: Toshiba Xpress单排螺旋CT; Toshiba大C臂DSA.
1.2.1 造模: 采取CT导引下肝叶穿刺种植法, 建立新西兰大白兔肝VX2肿瘤模型后, 7-14 d后经CT平扫证实建模成功. 所有瘤兔肝肿瘤均位于肝左叶, 得到24只肝VX2瘤瘤兔. 65只正常SD大鼠是用于研究免疫修饰脾细胞经肝动脉注入后正常肝脏内存活及免疫功能的情况, 故无需建立疾病模型.
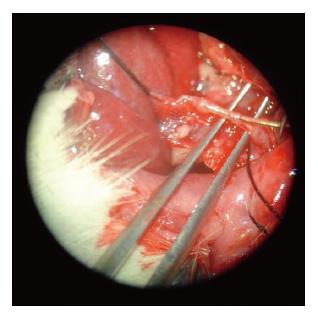
1.2.2 经胃十二指肠动脉逆行插管行肝动脉造影术: 将CT证实已经成模的瘤兔禁食水6 h, 耳缘静脉留置26G留置针, 经留置针注入戊巴比妥钠溶液进行静脉麻醉. 麻醉起效后, 将瘤兔仰卧位固定, 上腹部常规消毒铺巾, 腹中线切口, 长约5 cm, 逐层分离进腹腔, 暴露位于十二指肠后方的胃十二指肠动脉. 用显微手术器械进行分离胃十二指肠动脉主干, 分离段长度5 mm以上, 分别在近心端和远心端以丝线悬吊. 在暴露分离的胃十二指肠动脉主干前壁处, 用显微剪横向剪开约1/3血管壁, 将经过改装后的3F微导管插入胃十二指肠动脉, 在DSA导引下, 超选择插管至肝动脉行造影, 大多数时候微导管可以到达肝动脉一级分支. 必要时可以应用1.5F漂浮导管前端进行插管至肝动脉的二三级分支. 术后拔管, 结扎胃十二指肠动脉. 腹腔内注入8万单位庆大霉素的生理盐水10 mL, 逐层关腹.
大鼠同样术前禁食水6 h, 以水合氯醛进行腹腔麻醉. 麻醉起效后, 仰卧位固定, 上腹部常规消毒铺巾, 腹正中切口, 长约3 cm, 逐层分离进入腹腔. 推开肝叶, 钝性分离肝脏乳头叶, 向前掀起胃, 在其下方可找到肝总动脉分支胃十二指肠动脉, 钝性分离暴露胃十二指肠动脉主干, 同时充分分离肝固有动脉和肝总动脉, 将肝固有动脉用丝线轻柔吊起, 并将肝总动脉暂时夹闭. 在胃十二指肠动脉前壁用显微剪横向剪开血管壁, 不超过1/2血管壁, 插入自制导管或1.5F微导管到肝固有动脉开口处, 确认导管内血流通畅后, 将导管前端用丝线固定, 夹闭肝总动脉. 进行造影或者灌注药物. 术闭拔管, 结扎胃十二指肠动脉, 腹腔内灌注庆大生理盐水3 mL, 逐层关腹.
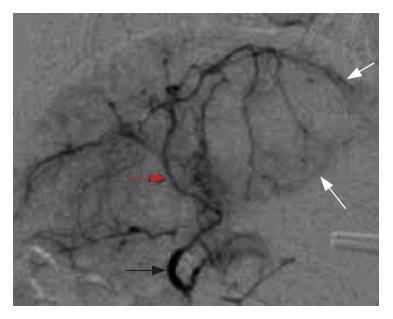
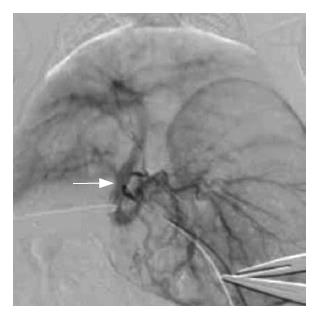
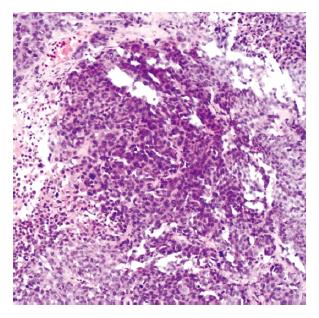
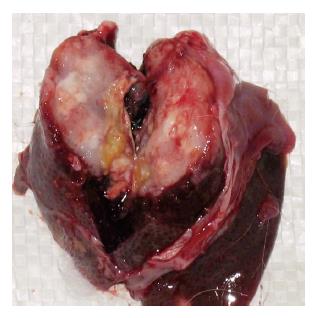
上述24只肝内荷瘤成功的瘤兔均采用胃十二指肠逆行肝动脉插管法进行肝动脉造影和栓塞(图1-2). 其中2只兔因为术中胃十二指肠动脉离断造成手术无法进行; 1只兔由于导管强行进入引起肝固有动脉损伤性血管瘤形成, 致使手术无法继续进行(图3); 1只兔由于术中栓塞剂用量过大, 手术后第1天死亡. 其余兔均术后存活10-15 d. 本研究中手术成功率约为83.3%. 术后肿瘤大小变化情况及术后第1天肝功能变化情况如表1. 肿瘤在栓塞后出现明显坏死, 边缘较清楚(图4-5).
| 术前 | 术后 | P | |
| 肿瘤大小(cm) | 2.51±1.23 | 1.89±0.76 | <0.05 |
| AST(U/L) | 23.54±12.52 | 28.42±16.03 | >0.05 |
| ALT(U/L) | 34.71±10.22 | 37.92±9.78 | >0.05 |
| ALB(g/L) | 24.24±8.71 | 31.29±5.65 | >0.05 |
| TB(μmol/L) | 1.23±0.65 | 0.93±0.52 | >0.05 |
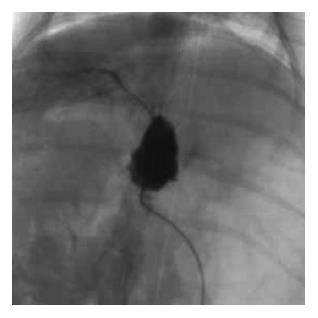
总共65只大鼠采用该方法进行胃十二指肠逆行肝动脉插管法进行药物灌注或栓塞(图6). 2只大鼠由于肝动脉变异导致逆行插管不成功; 肝叶损伤造成大量出血死亡1只; 2只大鼠由于操作粗鲁造成胃十二指肠及肝动脉损伤死亡; 麻醉意外2只. 手术成功率约为89.2%.
所有存活实验动物均在麻醉后1-2 h内苏醒, 6 h基本清醒, 可以行走和正常进食. 手术切口在1 wk之内愈合.
随着介入医学的飞速发展, 现代介入医学不仅是着眼于单纯的局部灌注化疗和栓塞等治疗手段, 而密切结合新治疗方案和药物, 如分子靶向药物等[2-3], 并能对其进行改进. 对于肿瘤治疗的研究分为基因、分子、动物实验和临床试验等部分. 其中动物实验是连接基础研究和临床研究的中间关键环节. 兔肝脏VX2肉瘤模型及大鼠肝转移瘤模型, 均是肝癌研究的比较好的动物模型, 常被众多研究者作为动物实验的重要部分[4-7].
我们认为按照常规的股动脉穿刺选择性插管至腹腔动脉[8-9], 再进一步超选择性插管至肝动脉分支的操作是相当困难的. 在本实验中, 作者采用开腹暴露分离胃十二指肠动脉,逆行插管, 行肝动脉超选择性插管, 借助3F微导管或自制导管可以轻易到达一级分支, 而如有1.5F漂浮导管, 可以到达二、三级分支到达超选择插管的目的. 采用开腹的方法进行肝动脉插管, 是由于兔腹腔动脉变异较多, 和人体的腹腔动脉分支情况存在着极大的不同. 在许多作者的文献里都对此有详细的描述[10], 本文在此不作重复讨论. 兔本身生命力相对比较脆弱, 动脉纤细, 且在轻微刺激下就易发生痉挛. 兔股动脉插管需分离悬吊股动脉, 术后还需结扎股动脉, 对兔造成的伤害较大. 经兔股动脉插管至腹腔动脉需用3F微导管, 但是由于腹腔动脉分支变异大, 往往微导丝头在探寻腹腔动脉分支过程中就已经引起动脉痉挛, 导致后续工作无法进行[11]. 本实验中所采取的方法, 可以避免了腹腔动脉分支变异较大对于肝动脉超选择性插管的影响. 因为胃十二指肠动脉和肝总动脉、肝固有动脉之间的解剖变异相对较少, 位置比较固定. 只要操作者有足够的耐心和过硬的外科手术能力, 基本上能够达到超选择插管至肝动脉, 并行造影和/或栓塞等操作. 同时也要特别注意兔肝动脉分支纤细, 极易痉挛, 最好再插管前用温热生理盐水或lidocaine湿敷, 保持动脉管腔通畅.
大鼠腹腔动脉及胃十二指肠动脉的走行较固定, 变异较少[12-13]. 但由于体型较小, 操作困难不小. 大鼠作为常用实验动物, 其耐受性强, 生命力旺盛, 成本低. 虽血管细小, 但耐心熟练操作也可以达到良好的实验结果. 必要时应用手术显微镜可达到理想的效果. 本方法的优点在于: (1)胃十二指肠逆行插管对于肝动脉本身损伤较小. 虽然肝脏有双重血供, 但在荷瘤肝脏, 肝动脉血供会明显增加, 如过度影响动脉血流, 也会导致术后肝功能衰竭. 故本研究中采用暂时夹闭肝总动脉的方法获得超选择结果, 同时也避免了肝动脉的过度损伤; (2)采用自制导管或裁短的1.5F微导管可进入肝动脉一级分支, 但是难度较大, 手法尽量温柔; (3)操作基本上可单人完成, 也不一定需在DSA导引下进行, 可减少操作者接受射线照射.
本研究中的经验是: (1)动物体型不能太小, 体型较大者, 血管相对较粗, 操作难度较小, 大鼠体质量不能低于180 g, 而兔要超过2.3 kg; (2)术前应充分了解实验动物的血管解剖学, 注意解剖变异, 而不应盲目实验; (3)操作时, 动作温柔是关键, 不要强行插管以免造成血管损伤; (4)注意适时适量补充液体, 在兔实验中可保持耳缘静脉通道通畅, 而在大鼠实验中可经腹腔注入生理盐水来补充体液的丢失; (5)实验要尽量防止胃十二指肠动脉痉挛, 可用温热生理盐水, 或者用lidocaine湿敷; (6)兔胃十二指肠动脉和肝固有动脉两者之间的解剖位置相对较固定, 通常位于前右方, 常呈锐角相交, 必要时应将导丝头做相应的塑形, 以便于超选择性插管至肝动脉及其分支. (7)术中后注意无菌操作, 术后需用抗生素3 d. 兔可采用肌肉注射, 大鼠一般采用腹腔内给药.
总之, 随着介入医学的发展, 对于肿瘤介入治疗的深入, 相应的动物实验的要求也随之提高. 能达到最大限度的模拟临床, 将对相关实验的进程和结果起到极其重要的作用. 开腹分离暴露胃十二指肠动脉逆行插管肝动脉法能够避免实验动物血管纤细和腹腔动脉分支变异带来的手术难度, 可直接而简单的超选择性插管到肝固有动脉或肝动脉及其分支, 从而到达肝动脉造影或者灌注化疗及栓塞等操作. 此方法切实可行, 并具有极大的优势, 能够深化动物实验和介入医学研究, 值得推广和继续深入研究.
介入放射学的发展对于肿瘤治疗具有重要的意义, 在动物实验中应用也非常广泛, 但是传统股动脉入路方式在动物实验实施困难, 并发症多, 效果欠佳, 亟需改进.
程英升, 主任医师, 上海交通大学附属第六人民医院放射科、上海交通大学影像医学研究所; 秦环龙, 教授, 上海交通大学附属第六人民医院外科
本文中所详述方法适用于动物实验, 尤其适用于小动物实验, 对于模拟临床实践具有理想效果.
本文报道了利用兔和大鼠对胃十二指肠动脉逆行肝动脉插管技术进行的研究, 具有一定的科学性.
编辑: 史景红 电编: 何基才
| 1. | 杨 建勇, 陈 伟. 介入放射学理论与实践. 第2版. 北京: 科学出版社 2005; 1-21. |
| 5. | Yoon CJ, Chung JW, Park JH, Yoon YH, Lee JW, Jeong SY, Chung H. Transcatheter arterial chemoembolization with paclitaxel-lipiodol solution in rabbit VX2 liver tumor. Radiology. 2003;229:126-131. [PubMed] |
| 6. | Yoon CJ, Chung JW, Park JH, Kim YI, Lee KH, Jeong JM, Paeng JC. Transcatheter arterial embolization with 188Rhenium-HDD-labeled iodized oil in rabbit VX2 liver tumor. J Vasc Interv Radiol. 2004;15:1121-1128. [PubMed] |
| 7. | Geschwind JF, Artemov D, Abraham S, Omdal D, Huncharek MS, McGee C, Arepally A, Lambert D, Venbrux AC, Lund GB. Chemoembolization of liver tumor in a rabbit model: assessment of tumor cell death with diffusion-weighted MR imaging and histologic analysis. J Vasc Interv Radiol. 2000;11:1245-1255. [PubMed] |
| 8. | 陈 晟, 邓 钢, 牛 焕章, 何 仕诚, 方 文, 汪 盛齐, 马 占龙, 郭 金和, 李 国昭, 滕 皋军. 兔VX2肝种植肿瘤模型制作的完善及综合影像学评价. 介入放射学杂志. 2007;16:48-52. |