修回日期: 2008-12-08
接受日期: 2008-12-15
在线出版日期: 2008-12-28
肿瘤干细胞理论认为结肠癌的发病、转移与复发与大肠癌干细胞(colorectal cancer stem cells, CCSCs)有关, 因此分离纯化大肠癌干细胞对于结肠癌的预防, 诊断及治疗具有重要意义. 本文就大肠癌干细胞的分选与鉴定方法作一综述.
引文著录: 张鹏, 秦环龙. 大肠癌干细胞分选与鉴定的研究进展. 世界华人消化杂志 2008; 16(36): 4031-4035
Revised: December 8, 2008
Accepted: December 15, 2008
Published online: December 28, 2008
According to cancer stem cell theory, colorectal cancer stem cells (CCSCs) are involved in the incidence, metastasis and recurrence of colon caner, so it's of great significance to separate and purify the CCSCs for colon cancer prevention, diagnosis and treatment. This article reviews the methods for the sorting and identification of CCSCs.
- Citation: Zhang P, Qin HL. Progress in the sorting and identification of colon cancer stem cells. Shijie Huaren Xiaohua Zazhi 2008; 16(36): 4031-4035
- URL: https://www.wjgnet.com/1009-3079/full/v16/i36/4031.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i36.4031
大肠癌(colorectal cancer)是严重危害人类健康也是最常见的恶性肿瘤之一, 在西方发达国家其发病率居于恶性肿瘤的第2位, 在我国其发病率和死亡率均呈明显上升趋势. 关于肿瘤的起始原因存在两种理论: 一种理论(Stochastic理论)认为所有癌细胞的形状、大小及细胞容积都是相同的, 都可进行分化形成新的肿瘤, 但其增生分裂是一些低概率的随机事件. 另一种理论(Hierarchy理论)则强调, 在癌细胞中, 只有少许具有选择性的细胞可以分裂成新的癌细胞, 进而形成肿瘤. 这些少量的具有选择性的细胞被称为肿瘤干细胞, 其自我更新和分化能力, 是肿瘤不停生长、死灰复燃的罪魁祸首[1], 目前肿瘤的干细胞起源得到越来越多的研究结果支持[2]. 大肠癌干细胞是消化系恶性肿瘤中第1个被发现的肿瘤干细胞, 分选并鉴定大肠癌干细胞对消化系肿瘤的预防、诊断及开拓新一代肿瘤治疗方案有着重要意义.
肿瘤干细胞(cancer stem cells, CSCs)是一类存在于癌细胞中具有自我更新、无限增殖及多分化潜能等干细胞特性的未成熟细胞, 少许此类细胞就可以分化成新的肿瘤细胞, 进而形成肿瘤. 人类认识CSCs起源于对白血病的研究, 20世纪70年代Nowell[3]发现在白血病组织中仅有极少数细胞能在体内进一步增殖, 并在体内移植后形成集落, 从而提出了白血病干细胞的概念. 2002年, Clarke et al[4]的研究小组利用流式细胞仪首次从乳腺癌肿瘤分离出肿瘤干细胞. 2003年Al-Hajj et al[5]通过特异性的细胞表面标志Lin-ESA+CD44+CD24-/low分离纯化出乳腺癌干细胞, 这种干细胞只占乳腺癌细胞的2%, 但只需要200左右个细胞就可在小鼠乳腺中形成肿瘤. 此后, 研究人员又根据不同的细胞表面分选标记, 分别从脑神经胶质瘤[6]、肉瘤[7]、结肠癌[8-10]、头颈癌[11]、肝癌[12-14]、肺癌[15]、黑素瘤[16]、胰腺癌[17]、前列腺癌[18]、卵巢癌[19]、肾癌[20]中分离出肿瘤干细胞.
大肠癌干细胞的分选可通过肿瘤细胞的体外培养分选、免疫学分选[21]以及功能学分选[22]等方法, 其中最为常用、有效的是免疫学分选法.
体外培养分选法是将结肠癌的肿瘤标本通过机械法和酶消化法分散, 将得到的肿瘤细胞群用含有表皮生长因子和成纤维细胞生长因子的无血清培养基培养, 观察细胞能否悬浮生长、生长速度、增殖能力及细胞球形成情况. 大部分分化的肿瘤细胞不能耐受无血清培养, 只有少数未分化的肿瘤干细胞和祖细胞以指数的速度增长并且形成漂浮的肿瘤干细胞球, 这些肿瘤干细胞球中富集肿瘤干细胞, 但通过这种方法得到的肿瘤干细胞含量并不高, 一般需要通过免疫法或功能法进行纯化. 在国内, 王锡山 et al[23]首次把Lovo细胞系培养于无血清干细胞培养基中, 待增殖形成细胞球后, 分离呈悬浮球样生长的细胞群并机械吹打成单细胞悬液, 利用有限稀释试验计算出该细胞大约占0.54%-0.62%, 并进一步利用含血清的干细胞培养基和无血清的干细胞培养基交替培养及Musashi-1免疫化学染色试验来鉴定其具有肿瘤干细胞的特性[24]. Li et al[22]通过用含生长因子的无血清培养基(SFM)培养大肠癌Colo205细胞, 后者能在无血清培养基中存活、增殖并形成肿瘤干细胞球, 高表达Musashi-1. 这种细胞球富集了大肠癌肿瘤干细胞.
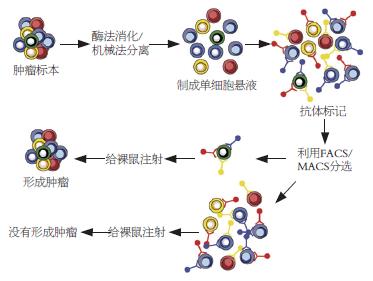
免疫学分选, 待测标本通过机械法分离成单细胞悬液然后置于利于悬浮的高表达CD133结肠癌细胞球生长的条件中培养. 利用免疫组织化学检查, 用流式细胞仪将细胞分选出CD133+以及CD133-两组细胞, 然后直接注射到裸鼠身上, 新分选的CD133+细胞和培养的结肠癌细胞球都能生成与原始标本组织学特征(H&E染色)一致的肿瘤(图1).
目前作为大肠癌干细胞的主要分选方法-免疫学分选包括: 荧光活化细胞分选(fluorescence activated cell sorting, FACS)及磁性活化细胞分选(magnetic activated cell sorting, MACS), FACS方法是利用干细胞表面一些膜蛋白(主要是一些CD抗原, 如CD117、CD133、CD34、CD44/CD24等)的某些成员的表达上调, 另一些成员则下调的特点, 用其一种或两种以上的不同激发波长的荧光素标记的mAb标记单细胞悬液后用流式细胞仪分选干细胞, 如急性单核细胞性白血病干细胞、脑瘤、乳腺癌、室管膜瘤、前列腺癌、视网膜母细胞瘤、胰腺癌等肿瘤干细胞的研究就是采用了这种方法. MACS的原理则是利用未标记的CD抗原等蛋白的mAb作为第一抗体与单细胞悬液孵育后, 再用免疫磁珠(micro-beads)标记的第二抗体结合, 利用这种特异性一抗、二抗标记的细胞悬液流过特制的永久磁铁的磁场时, 可吸附在磁式分选柱内, 再将磁式分选柱移开磁场从柱内洗脱、收集干细胞[25]. 这两种分离技术均需将待测标本制成单细胞悬液, 且有赖于对大肠癌干细胞表面标志物的识别. 迄今仍未找到大肠癌干细胞特异性的表面标志物, 故认为寻找大肠癌干细胞的特异性表面标志物对分离鉴别大肠癌肿瘤干细胞有十分重要的意义.
O'Brien et al[9]和Ricci-Vitiani et al[10]已经成功地分离并鉴定了富含大肠癌干细胞的CD133+表型大肠癌细胞亚群. O'Brien et al研究发现所有的大肠癌干细胞都是CD133+表型的, 这些大肠癌干细胞包括一些表达CD133分子的未分化细胞. CD133分子是一种跨膜蛋白, 定位于细胞膜及细胞质, 在各种组织的干细胞或者起始细胞通常都有表达[26-27]. CD133+细胞表达上皮细胞黏附抗原分子(即EpCAM), 而不表达一些分化标志物, 比如一种通常存在于胃肠上皮成熟细胞中的中间丝状蛋白CK20. Ricci-Vitiani et al[10]通过向裸鼠sc 3000个刚刚从肿瘤切除样本中分选出来的CD133+大肠癌干细胞可以很容易复制原来的肿瘤. 在已经发生异体种植肿瘤的裸鼠模型中能引起肿瘤异体种植的CD133+细胞大大减少, 而在此种小鼠肾脏被膜下仅仅注射100个CD133+细胞都能复制原来的大肠癌肿瘤. 这个模型促使研究者在体内进行有限稀释法实验以估计大肠癌肿瘤组织中干细胞出现的频率. 有限稀释分析试验表明5.7×104个未分选的肿瘤细胞中含有一个大肠癌干细胞, 而在262个CD133+肿瘤细胞中就含有一个, 说明CD133+结肠癌细胞中富含大肠癌干细胞的量为未分选的肿瘤细胞的200倍. 相反, 从大肠肿瘤标本中分选出的CD133-细胞群仍然不具有致瘤性. 而且他们发现, 尽管可能性很小, 但CD133+细胞也能在正常的结肠组织中观察到, 这提示肿瘤样本中CD133+细胞数量的增长是由于正常结肠干细胞发生致癌性转化所导致的.
除了基于CD133分子阳性表达的分选外, Dalerba et al[8]利用细胞表面标志物EpCAMhigh/CD44+/CD166+的表达进行了分选. 上皮细胞黏附分子(epithelial cell adhesion molecule, EpCAM)和CD44均是一种跨膜糖蛋白, 定位于胞膜, 在大肠癌腺瘤组织中高表达. CD166作为间充质干细胞的标志物已被人们所熟知, 其在大肠癌上皮细胞胞质中呈异质性分布, 在大肠癌中的高表达与较差的临床预后相关[29]. Clarke et al认为大肠癌干细胞的表型应该是EpCAMhigh/CD44+, 因为在有的肿瘤组织中可能不表达CD133分子[26,28], 但可以表达CD44表面分子. 他们[8]将人大肠癌肿瘤解离为单细胞悬液, 根据细胞上CD44和EpCAM的表达利用流式细胞仪将肿瘤细胞分为两群(EpCAMhigh/CD44+和EpCAMlow/CD44-), 并取癌组织附近的正常肠黏膜作为对照. 利用注射原始肿瘤细胞样本获得肿瘤的实验显示: 致瘤能力的大小与EpCAM+细胞群里的CD44+/CD166+细胞密切相关, 且肿瘤组织中EpCAMhigh/CD44+的表达要比正常组织中高. 从一个小鼠的大肠癌异种种植肿瘤传代得到的EpCAMhigh/CD44+细胞表达其他的干细胞相关标志物, 比如CD49f和醛脱氢酶的活性, 给裸鼠注射200-500个EpCAMhigh/CD44+的细胞就能长出肿瘤, 所致肿瘤和原始肿瘤有相似的形态异质性和表型异质性, 同时保留分化的表型特征. 并且EpCAMhigh/CD44+和EpCAMlow/CD44-所占比例和原始肿瘤组织相似; 而104个EpCAMlow/CD44-的细胞也不能致瘤. CD133+细胞上这些另外的细胞表型标志物的存在将使得细胞的分选更加容易, 但是这仍然需要对更广泛的肿瘤样本的分析来验证[30].
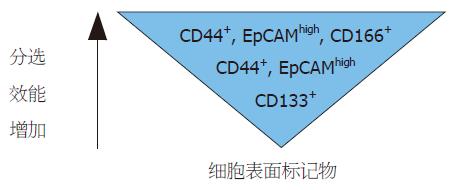
综合目前的研究[8-10], 可以联合选用CD133, CD44, EpCAM和CD166这四个细胞表面生物标记通过免疫学分选法来不断纯化大肠癌干细胞群. 仅仅依靠CD133分子阳性表达来分选大肠癌干细胞得到的只是一些成瘤能力很低的细胞, 相比而言, 在CD133+肿瘤细胞群中联合CD44+/EpCAMhigh/CD166+这三种分子特征标记分选, 获得细胞中大肠癌干细胞所占比例更高, 成瘤能力会强[26,28]. 大肠癌肿瘤干细胞可以根据细胞表面蛋白组成成分的表达借助流式细胞术从大量肿瘤细胞中分选出来. 联合选用不同的细胞表面标志物, 分选的效能有所不同, 获得的细胞也表现出不同的致瘤能力[8-10](图2).
正常干细胞可以主动转运出一些特定的荧光探针(如Hoechst 33342), 从而不被着色, 功能学分选就是根据这一特点利用流式细胞术把肿瘤细胞分离纯化成不同的细胞亚群, 然后对不同亚群进行成瘤性检测, 筛选出能够连续性成瘤的亚群, 并进一步证实该亚群细胞具有自我更新、多向分化的干细胞特性, 就可以初步分选出肿瘤干细胞. 采用流式细胞术可以从肿瘤单细胞悬液中分选出未着色的干细胞, 这样得到的细胞通常称为侧群(side population, SP)细胞. SP细胞的分离最初是应用于鉴定造血干细胞[31], 在肿瘤中也分离得到了SP细胞, 并且这些细胞具有肿瘤干细胞的特性[32], 因此可以将分选SP细胞作为分离纯化肿瘤干细胞的一种途径, 功能学分选由此亦可称为SP分选. 在Huh7和PLC/PRF/5两种肝癌细胞株中发现, SP细胞的成瘤能力是非SP细胞的1000倍[33]. 人及小鼠卵巢癌和C6神经胶质瘤细胞株中SP性状的肿瘤干细胞, 在裸鼠体内成瘤率也明显高于非SP肿瘤细胞[34-35].
目前认为在消化系肿瘤细胞中也存在着干细胞样肿瘤细胞富含于SP细胞中[36]. Haraguchi et al[37]指出, 在不同的胃肠道癌症细胞系中鉴定出含有0.3%-2.2%的SP细胞, 在干细胞培养基中一般呈悬浮的肿瘤球样生长. 目前未见采用此方法分选大肠癌肿瘤干细胞的报道.
肿瘤干细胞是一个功能学概念, 所以肿瘤干细胞功能测定具有非常重要意义, 因为干细胞本身不具有任何特异的形态学特征[38]. 能够鉴定肿瘤干细胞的金标准就是连续传代培养并在动物模型上进行体内成瘤性实验. 虽然这并不是完美无缺的标准, 但已经是公认的最好的功能鉴定的办法[39]. 现在多通过免疫组织化学法观察移植肿瘤与原发瘤形态结构、生物学特征和细胞表型的相似性以及在动物体内进行成瘤性实验进行验证.
Li et al[22]以无血清培养基(SFM)培养大肠癌Colo205细胞, 以含血清培养基(SSM)组作为对照观察细胞生长形态、诱导其分化, 分别检测无血清培养基(SFM)组细胞分化前、分化后以及含血清培养基(SSM)组细胞表面标志CD133、CD44以及正常肠道干细胞标志Musashi-1表达的改变, 分析各细胞周期的比例, 最后进行核型分析以验证肿瘤干细胞. O'Brienet al[9]用鼠致瘤试验证明大肠癌干细胞具有自我更新能力, 并且能分化成其他类型的肿瘤细胞. 将离散的大量未分选的肿瘤细胞、根据CD133+分选获得的肿瘤细胞分别移植于裸鼠所获得的肿瘤与人大肠癌的原始肿瘤相比较: 三组肿瘤在组织化学染色(H&E染色)以及含有的免疫化学标志物(CK20, CK7, CEA, Muc2, MIB-1, p53)极为相似. Ricci-Vitiani et al[10]用无血清培养基培养的CD133+结肠肿瘤细胞, 在体外能以未分化的肿瘤球的形式迅速增殖生长并持续1年以上, 并且移植后产生的肿瘤与原始肿瘤表型相同. Dalerba et al[8]在对六个不同的异种种植细胞系的几个独立的裸鼠实验中, 发现EpCAMhigh/CD44+细胞引起的大肠癌异种种植肿瘤维持了原始肿瘤的分化表型, 再现了他们的形态学上以及表现型遗传方面的特征包括上皮腺样结构的形成, 并表达中性上皮黏蛋白和结肠特殊分化标志物CK20, 从而验证了分选得到的细胞即大肠癌肿瘤干细胞.
肿瘤干细胞理论从细胞水平上研究肿瘤形成机制与生物学特征, 为肿瘤研究和治疗提供了新的途径, 对肿瘤的预防、诊断、病理分期的评估及预后有重要意义, 大肠癌肿瘤干细胞的发现与分选, 将会使得治疗大肠癌有的放矢. 但肿瘤干细胞理论也面临诸多挑战, 由于理论的不成熟和实验方法差异, 给实体瘤干细胞的分离和纯化带来了许多困难, 一些学者对肿瘤干细胞的存在表示怀疑. Kelly et al[40]对目前的实验方法提出了质疑, 认为由于细胞周围微环境对细胞生长增殖非常重要, 动物移植模型的不同可能会对致瘤细胞的数量产生影响, 因此, 能够在裸鼠导致肿瘤的细胞数只能认为是能够在异体微环境中生存的细胞数. 而且分选肿瘤干细胞主要依赖细胞表面标志物, 但由于干细胞本身未分化的特性, 目前没有一个公认的干细胞表面标志物用于分选获得纯净的大肠癌干细胞. 所以不能仅仅依靠在肿瘤干细胞成长过程中的某一阶段所表现出的细胞表面标志物来分选, 也许可以通过发现更多的肿瘤干细胞表面标志物来进一步纯化, 或者可以尝试FACS以及MACS以外的更多分选办法. 所以, 需要更加科学的方法来验证肿瘤干细胞的存在并加以分选.
肿瘤干细胞理论认为肿瘤干细胞是存在于肿瘤组织中具有干细胞特性的未分化细胞, 少许细胞就可分化成新肿瘤细胞, 是肿瘤形成的来源, 该理论得到了越来越多研究结果的支持. 而肿瘤干细胞研究的首要重点即肿瘤干细胞的分选与鉴定, 包括大肠癌肿瘤干细胞在内的多种肿瘤干细胞已经被成功分选鉴定.
蔡开琳, 副教授, 华中科技大学同济医学院附属协和医院普通外科
2006年Clarke et al成功分选出大肠癌干细胞以来, 研究人员为得到纯化的大肠癌干细胞并进行细胞株建系, 围绕大肠癌肿瘤干细胞表面免疫学标记做了深入研究, 但是迄今为止仍然没有找到高特异性的标记物加以纯化, 因此发现大肠癌干细胞高特异性表面标记物成为目前亟待解决的问题.
有学者把Sca-1、keratin-6、inte-grinβ1, Musashi-1与Hes1等表面标志作为参考标志来分选大肠癌干细胞, 通过单细胞克隆方式纯化.
本文阐明了大肠癌干细胞研究的重要意义, 同时从三种不同的分选方式, 对目前大肠癌肿瘤干细胞的分选鉴定方法进行了对比, 为大肠癌干细胞建系奠定基础, 对大肠癌的早期诊断, 研究具有重要意义.
侧群细胞(SP): 干细胞能够主动将Hoechst 33342等染料转运出而不被染色, 利用这一特性, 采用流式细胞术可以从肿瘤单细胞悬液中分选出不染色的细胞, 这种细胞被成为侧群细胞.
大肠癌干细胞目前还没得到公认, 但这方面的研究有重要意义, 是胃肠道肿瘤干细胞研究的前沿. 本文就此对相关研究进行了及时总结, 值得关注.
编辑: 李军亮 电编: 何基才
| 2. | Lapidot T, Sirard C, Vormoor J, Murdoch B, Hoang T, Caceres-Cortes J, Minden M, Paterson B, Caligiuri MA, Dick JE. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature. 1994;367:645-648. [PubMed] [DOI] |
| 3. | Nowell PC. The clonal evolution of tumor cell populations. Science. 1976;194:23-28. [PubMed] [DOI] |
| 4. | Clarke MF, Morrison SJ, Wicha MS, Al-Hajj M, inventors; Regents of the University of Michigan, assignee. Isolation and use of solid tumor stem cells. United States Patent Application 2002119565. 2001;Aug 1. |
| 5. | Al-Hajj M, Wicha MS, Benito-Hernandez A, Morrison SJ, Clarke MF. Prospective identification of tumorigenic breast cancer cells. Proc Natl Acad Sci USA. 2003;100:3983-3988. [PubMed] [DOI] |
| 6. | Singh SK, Hawkins C, Clarke ID, Squire JA, Bayani J, Hide T, Henkelman RM, Cusimano MD, Dirks PB. Identification of human brain tumour initiating cells. Nature. 2004;432:396-401. [PubMed] [DOI] |
| 7. | Gibbs CP, Kukekov VG, Reith JD, Tchigrinova O, Suslov ON, Scott EW, Ghivizzani SC, Ignatova TN, Steindler DA. Stem-like cells in bone sarcomas: implications for tumorigenesis. Neoplasia. 2005;7:967-976. [PubMed] [DOI] |
| 8. | Dalerba P, Dylla SJ, Park IK, Liu R, Wang X, Cho RW, Hoey T, Gurney A, Huang EH, Simeone DM. Phenotypic characterization of human colorectal cancer stem cells. Proc Natl Acad Sci USA. 2007;104:10158-10163. [PubMed] [DOI] |
| 9. | O'Brien CA, Pollett A, Gallinger S, Dick JE. A human colon cancer cell capable of initiating tumour growth in immunodeficient mice. Nature. 2007;445:106-110. [PubMed] [DOI] |
| 10. | Ricci-Vitiani L, Lombardi DG, Pilozzi E, Biffoni M, Todaro M, Peschle C, De Maria R. Identification and expansion of human colon-cancer-initiating cells. Nature. 2007;445:111-115. [PubMed] [DOI] |
| 11. | Prince ME, Sivanandan R, Kaczorowski A, Wolf GT, Kaplan MJ, Dalerba P, Weissman IL, Clarke MF, Ailles LE. Identification of a subpopulation of cells with cancer stem cell properties in head and neck squamous cell carcinoma. Proc Natl Acad Sci USA. 2007;104:973-978. [PubMed] [DOI] |
| 12. | Ma S, Chan KW, Hu L, Lee TK, Wo JY, Ng IO, Zheng BJ, Guan XY. Identification and characterization of tumorigenic liver cancer stem/progenitor cells. Gastroenterology. 2007;132:2542-2556. [PubMed] [DOI] |
| 13. | Yin S, Li J, Hu C, Chen X, Yao M, Yan M, Jiang G, Ge C, Xie H, Wan D. CD133 positive hepatocellular carcinoma cells possess high capacity for tumorigenicity. Int J Cancer. 2007;120:1444-1450. [PubMed] [DOI] |
| 14. | Suetsugu A, Nagaki M, Aoki H, Motohashi T, Kunisada T, Moriwaki H. Characterization of CD133+ hepatocellular carcinoma cells as cancer stem/progenitor cells. Biochem Biophys Res Commun. 2006;351:820-824. [PubMed] [DOI] |
| 15. | Kim CF, Jackson EL, Woolfenden AE, Lawrence S, Babar I, Vogel S, Crowley D, Bronson RT, Jacks T. Identification of bronchioalveolar stem cells in normal lung and lung cancer. Cell. 2005;121:823-835. [PubMed] [DOI] |
| 16. | Fang D, Nguyen TK, Leishear K, Finko R, Kulp AN, Hotz S, Van Belle PA, Xu X, Elder DE, Herlyn M. A tumorigenic subpopulation with stem cell properties in melanomas. Cancer Res. 2005;65:9328-9337. [PubMed] [DOI] |
| 17. | Li C, Heidt DG, Dalerba P, Burant CF, Zhang L, Adsay V, Wicha M, Clarke MF, Simeone DM. Identification of pancreatic cancer stem cells. Cancer Res. 2007;67:1030-1037. [PubMed] [DOI] |
| 18. | Collins AT, Berry PA, Hyde C, Stower MJ, Maitland NJ. Prospective identification of tumorigenic prostate cancer stem cells. Cancer Res. 2005;65:10946-10951. [PubMed] [DOI] |
| 19. | Zhang S, Balch C, Chan MW, Lai HC, Matei D, Schilder JM, Yan PS, Huang TH, Nephew KP. Identification and characterization of ovarian cancer-initiating cells from primary human tumors. Cancer Res. 2008;68:4311-4320. [PubMed] [DOI] |
| 20. | Bussolati B, Bruno S, Grange C, Ferrando U, Camussi G. Identification of a tumor-initiating stem cell population in human renal carcinomas. FASEB J. 2008;22:3696-3705. [PubMed] [DOI] |
| 21. | Cammareri P, Lombardo Y, Francipane MG, Bonventre S, Todaro M, Stassi G. Isolation and culture of colon cancer stem cells. Methods Cell Biol. 2008;86:311-324. [PubMed] [DOI] |
| 22. | Li YF, Xiao B, Lai ZS, Tu SF, Wang YY, Zhang XL. [Spheres isolated from Colo205 cell line possess cancer stem-like cells under serum-free culture condition]. Nanfang Yike Daxue Xuebao. 2008;28:236-240. [PubMed] |
| 24. | Potten CS, Booth C, Tudor GL, Booth D, Brady G, Hurley P, Ashton G, Clarke R, Sakakibara S, Okano H. Identification of a putative intestinal stem cell and early lineage marker; musashi-1. Differentiation. 2003;71:28-41. [PubMed] [DOI] |
| 25. | Roberts PE. Isolation and establishment of human tumor stem cells. Methods Cell Biol. 2008;86:325-342. [PubMed] [DOI] |
| 26. | Shmelkov SV, Butler JM, Hooper AT, Hormigo A, Kushner J, Milde T, St Clair R, Baljevic M, White I, Jin DK. CD133 expression is not restricted to stem cells, and both CD133+ and CD133- metastatic colon cancer cells initiate tumors. J Clin Invest. 2008;118:2111-2120. [PubMed] |
| 27. | Shmelkov SV, St Clair R, Lyden D, Rafii S. AC133/CD133/Prominin-1. Int J Biochem Cell Biol. 2005;37:715-719. [PubMed] [DOI] |
| 28. | LaBarge MA, Bissell MJ. Is CD133 a marker of metastatic colon cancer stem cells? J Clin Invest. 2008;118:2021-2024. [PubMed] |
| 29. | Weichert W, Knösel T, Bellach J, Dietel M, Kristiansen G. ALCAM/CD166 is overexpressed in colorectal carcinoma and correlates with shortened patient survival. J Clin Pathol. 2004;57:1160-1164. [PubMed] [DOI] |
| 30. | Ricci-Vitiani L, Pagliuca A, Palio E, Zeuner A, De Maria R. Colon cancer stem cells. Gut. 2008;57:538-548. [PubMed] [DOI] |
| 31. | Goodell MA, Brose K, Paradis G, Conner AS, Mulligan RC. Isolation and functional properties of murine hematopoietic stem cells that are replicating in vivo. J Exp Med. 1996;183:1797-1806. [PubMed] [DOI] |
| 32. | Seigel GM, Campbell LM, Narayan M, Gonzalez-Fernandez F. Cancer stem cell characteristics in retinoblastoma. Mol Vis. 2005;11:729-737. [PubMed] |
| 33. | Chiba T, Kita K, Zheng YW, Yokosuka O, Saisho H, Iwama A, Nakauchi H, Taniguchi H. Side population purified from hepatocellular carcinoma cells harbors cancer stem cell-like properties. Hepatology. 2006;44:240-251. [PubMed] [DOI] |
| 34. | Szotek PP, Pieretti-Vanmarcke R, Masiakos PT, Dinulescu DM, Connolly D, Foster R, Dombkowski D, Preffer F, Maclaughlin DT, Donahoe PK. Ovarian cancer side population defines cells with stem cell-like characteristics and Mullerian Inhibiting Substance responsiveness. Proc Natl Acad Sci USA. 2006;103:11154-11159. [PubMed] [DOI] |
| 35. | Kondo T, Setoguchi T, Taga T. Persistence of a small subpopulation of cancer stem-like cells in the C6 glioma cell line. Proc Natl Acad Sci USA. 2004;101:781-786. [PubMed] [DOI] |
| 36. | Hadnagy A, Gaboury L, Beaulieu R, Balicki D. SP analysis may be used to identify cancer stem cell populations. Exp Cell Res. 2006;312:3701-3710. [PubMed] [DOI] |
| 37. | Haraguchi N, Utsunomiya T, Inoue H, Tanaka F, Mimori K, Barnard GF, Mori M. Characterization of a side population of cancer cells from human gastrointestinal system. Stem Cells. 2006;24:506-513. [PubMed] [DOI] |
| 38. | Willis ND, Przyborski SA, Hutchison CJ, Wilson RG. Colonic and colorectal cancer stem cells: progress in the search for putative biomarkers. J Anat. 2008;213:59-65. [PubMed] [DOI] |
| 39. | Clarke MF, Dick JE, Dirks PB, Eaves CJ, Jamieson CH, Jones DL, Visvader J, Weissman IL, Wahl GM. Cancer stem cells--perspectives on current status and future directions: AACR Workshop on cancer stem cells. Cancer Res. 2006;66:9339-9344. [PubMed] |