修回日期: 2008-11-18
接受日期: 2008-11-24
在线出版日期: 2008-12-18
目的: 研究人胰腺癌组织中Midkine(MK)和Caspase-3蛋白的表达特点, 探讨其表达与胰腺癌细胞凋亡的关系.
方法: 收集人胰腺癌组织标本49例, 免疫组织化学SP法检测MK和Caspase-3蛋白的表达, 原位凋亡检测试剂盒辣根过氧化物酶(TUNEL)检测细胞凋亡指数. 以同期15例正常胰腺组织标本为对照.
结果: MK蛋白、Caspase-3蛋白在胰腺癌组织中的阳性表达率高于正常胰腺组织(71.4% vs 0, P<0.01; 77.6% vs 46.7%, P<0.05), MK蛋白表达与胰腺癌组织学分化、临床分期和淋巴转移相关(P<0.05), Caspase-3蛋白表达仅与组织学分化有关; 胰腺癌组织标本中, MK阳性表达组凋亡指数显著低于MK阴性表达组(5.13±2.69 vs 7.93±6.65, P<0.05); 胰腺癌组织中MK与Caspase-3蛋白的表达呈负相关(r = -0.34, P<0.05).
结论: MK和Caspase-3参与了胰腺癌的发生发展, MK在胰腺癌组织中的高表达具有抑制细胞凋亡的生物学功能, 其作用机制可能是通过抑制Caspase-3的活性.
引文著录: 龙辉, 吴清明, 马松林, 刘群, 张金华, 陈新胜, 汪得胜, 赵丽莎, 李欢. Midkine和Caspase-3在胰腺癌中的表达与细胞凋亡的关系. 世界华人消化杂志 2008; 16(35): 4015-4019
Revised: November 18, 2008
Accepted: November 24, 2008
Published online: December 18, 2008
AIM: To study the expression of Midkine (MK) protein and Caspase-3 protein in human pancreatic cancer and to investigate their association with cell apoptosis.
METHODS: The immunohistochemical staining (SP) method was used to detect the expression of MK protein and Caspase-3 in 49 cases of pancreatic cancer tissues and 15 cases of normal pancreatic tissues. The TUNEL method was used to detect apoptotic index in pancreatic cancer tissues.
RESULTS: The positive rates of MK protein and Caspase-3 protein were significantly higher in pancreatic cancer tissue than in normal pancreatic tissue (71.4% vs 0, P < 0.01; 77.6% vs 46.7%, P < 0.05). Expression of MK protein was correlated with tumor's histological grading, clinical stages and lymph node metastasis (P < 0.05) while expression of Caspase-3 protein was only correlated with tumor's histological grading (P < 0.05). The mean apoptotic index was significantly lower in MK positive expression group than in MK negative expression group (5.13 ± 2.69 vs 7.93 ± 6.65, P < 0.05). The expression level of MK protein had a negative correlation with Caspase-3 (r = -0.34, P < 0.05).
CONCLUSION: The gene of Midkine and Caspase-3 participate in development of pancreatic cancer, and high express of Midkine has a biological function of inhibiting cell apoptosis possibly through suppressing cell activity of Caspase-3 protein.
- Citation: Long H, Wu QM, Ma SL, Liu Q, Zhang JH, Chen XS, Wang DS, Zhao LS, Li H. Expression of Midkine and Caspase-3 and their relationship with apoptosis in pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2008; 16(35): 4015-4019
- URL: https://www.wjgnet.com/1009-3079/full/v16/i35/4015.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i35.4015
细胞凋亡(apoptosis)是一种由基因控制的细胞自主性死亡方式. 正常状态下细胞凋亡与细胞增殖维持着动态平衡, 对维护机体内环境的稳定具有至关重要的作用. 大量体内外相关研究表明, 肿瘤的发生发展与肿瘤细胞的凋亡现象共存, 与细胞的凋亡速度密切相关, 促进细胞凋亡在抑制肿瘤发生、发展中的作用日益为人们所重视[1]. Midkine(MK)是一种新的肝素结合性生长分化因子, 近年来被越来越多的研究证实其在多种恶性肿瘤中高度表达, 由于其独特的结构、特殊的组织分布与抗凋亡、促血管新生等生物学功能, 引起了肿瘤研究工作者的浓厚兴趣, 使其成为目前研究的热点之一[2], 在胰腺癌中也证实MK的过表达[3], 但具体的生物学功能及作用机制尚不清楚. Caspase-3是凋亡信号传导通路中的重要执行分子, 其表达具有反映凋亡启动因素存在和凋亡发生的双重生物学效应, 其激活后导致细胞的不可逆性凋亡[4].
本实验采用免疫组织化学SP法检测胰腺癌组织中MK和Caspase-3蛋白的表达情况, 并用原位凋亡检测TUNEL法检测胰腺癌组织中的细胞凋亡, 拟探讨MK和Caspase-3蛋白在胰腺癌组织中的表达特点及其与细胞凋亡的关系.
收集武汉同济医院及武汉科技大学附属天佑医院2000-01/2007-10外科手术切除的胰腺癌标本49例, 患者术前均未行放疗及化疗, 术后经组织病理学证实为胰腺腺癌. 其中男30例, 女19例, 年龄21-75岁; 组织学分级高中分化30例, 低分化19例; 伴有淋巴结转移31例, 无淋巴结转移18例; 按TNM分期标准Ⅰ、Ⅱ期21例, Ⅲ、Ⅳ期28例. 另取同期病理证实的15例正常胰腺组织作为对照, 主要来自尸检标本. 所有标本常规石蜡包埋, 4 μm连续切片.
兔抗人MK、Caspase-3多克隆抗体购自武汉博士德生物工程有限公司, 工作浓度1:50; 兔抗SP试剂盒、DAB显色试剂盒、原位凋亡检测试剂盒购自北京中杉金桥生物技术有限公司.
1.2.1 检测: 免疫组化实验步骤按SP试剂盒说明书进行, 以微波枸橼酸盐进行抗原热修复, DAB显色, 苏木素复染. 用已知的MK和Ki67阳性片作为阳性对照, PBS代替一抗作为阴性对照. TUNEL法检测凋亡按试剂盒说明进行, DAB显色, 苏木素复染.
1.2.2 结果判定: MK及Caspase-3蛋白的表达以细胞胞质中出现清晰棕黄色颗粒为阳性细胞, 计算阳性细胞百分率, 阳性细胞数<5%为阴性(-), ≥5%为阳性(+). 凋亡细胞以细胞胞核被染成棕黄色为阳性细胞, 高倍镜下随机计数至少10个视野1000个细胞, 计算凋亡指数(Apoptosis index, AI) = 阳性细胞总数/1000×100%.
统计学处理 MK及Caspase-3蛋白的表达用阳性例数计数表示, 凋亡指数用mean±SD表示, 所有数据均用SPSS12.0统计软件包进行统计学处理, 结果分析用χ2检验或Fisher精确概率法及相关性分析, 两组间AI分析用t检验. 以P<0.05为有显著统计学意义.
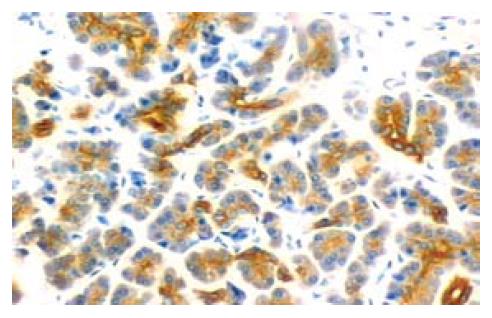
49例胰腺癌组织中MK蛋白阳性表达率为71.4%, 其阳性表达主要定位于肿瘤细胞胞质, 细胞外间质中血管密集处血管内皮细胞也有阳性染色(图1). MK蛋白在胰腺癌组织中的表达与性别、年龄无关, 组织学分级低分化者MK表达阳性率高于高中分化者(P<0.05), TNM分期Ⅲ、Ⅳ期者高于Ⅰ、Ⅱ期者(P<0.05), 有淋巴转移者高于无淋巴转移者(P<0.05, 表1) .15例正常胰腺组织中均未见MK阳性表达, 与胰腺癌组织组织统计学差异性极其显著(P<0.01).
| 分组 | n | Midkine | 细胞凋亡 | ||
| 阳性数 | P值 | AI | P值 | ||
| 性别 | |||||
| 男 | 30 | 21 | 0.781 | 5.56±3.94 | 0.440 |
| 女 | 19 | 14 | 6.51±4.54 | ||
| 年龄 | |||||
| ≥50 | 37 | 27 | 0.958 | 5.97±4.23 | 0.850 |
| <50 | 12 | 8 | 5.86±3.57 | ||
| 组织学分级 | |||||
| 高中分化 | 30 | 18 | 0.026 | 7.04±4.77 | 0.023 |
| 低分化 | 19 | 17 | 4.17±2.99 | ||
| 临床分期 | |||||
| Ⅰ+Ⅱ期 | 21 | 11 | 0.011 | 7.83±4.91 | 0.008 |
| Ⅲ+Ⅳ期 | 28 | 24 | 4.51±3.54 | ||
| 淋巴转移 | |||||
| 有 | 31 | 26 | 0.011 | 4.73±3.79 | 0.011 |
| 无 | 18 | 9 | 7.99±4.79 | ||
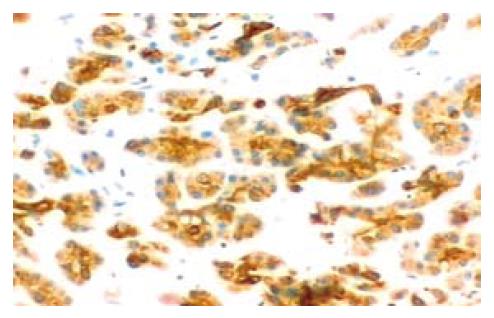
49例胰腺癌组织中有38例Caspase-3蛋白阳性表达率为77.6%(38/49). 胰腺癌组织中Caspase-3蛋白的阳性表达主要定位于细胞胞质(图2). Caspase-3蛋白在胰腺癌组织中的表达与性别、年龄无关, 组织学分级低分化者低于高中分化者(P<0.01), TNM分期Ⅲ、Ⅳ期者与Ⅰ、Ⅱ期者无显著统计学差异性, 有淋巴转移者与无淋巴转移者也无显著统计学差异性. Caspase-3蛋白在15例正常胰腺组织中有7例阳性表达, 阳性率为46.7%(7/15), 低于胰腺癌组织(P<0.05).
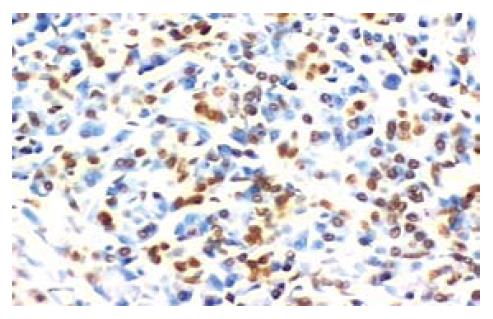
15例正常胰腺组织中细胞凋亡程度较低, 平均凋亡指数为0.63±0.21. 所有胰腺癌组织标本均可检测到凋亡细胞(图3), 49例胰腺癌组织平均凋亡指数为5.93±4.18. 胰腺癌组织中的凋亡指数高于正常胰腺组织, 两者有显著统计学差异性(P<0.01).
胰腺癌组织标本中, 凋亡指数与性别、年龄无关(P>0.05), AI有随肿瘤进展而降低的趋势, 组织学分级高中分化者AI大于低分化者(P<0.05), TNM分期Ⅰ、Ⅱ期者AI大于Ⅲ、Ⅳ期者(P<0.01), 无淋巴转移者AI大于有淋巴转移者(P<0.05, 表1).
细胞凋亡又称程序性细胞死亡(programmed cell death, PCD), 是一种基因控制的细胞自主性死亡过程, 是维持机体内环境稳定的重要机制之一. 他是多细胞生物体内的一个重要生命现象, 既出现在个体发育过程中, 也出现在正常生理状态或疾病中, 既在体内发生, 也出现在体外培养物中. 细胞凋亡在胚胎发育、神经系统的功能完善以及免疫功能调节等方面具有关键性的作用. 细胞凋亡功能亢进与组织损伤和器官功能衰竭的发病密切相关, 而细胞凋亡功能的抑制将导致肿瘤的发生及免疫功能的异常[1].
细胞凋亡的机制尚不完全清楚. 但在过去的几年里, 凋亡的基础研究已取得了巨大进展, 认为细胞内所发生的与凋亡有关的一系列有序的级联反应, 关键是激活了一组被称为Caspase的蛋白酶[5].
Caspase是一组半胱氨酸蛋白酶家族, 其家族成员在细胞凋亡过程中起重要作用. 他们通过切断与周围细胞的联络、重组细胞骨架、关闭DNA复制核修复、破坏DNA和核结构、诱导凋亡小体的形成等途径促使细胞凋亡. 通过生物化学和遗传学研究表明, Caspase蛋白酶家族在细胞凋亡发生过程中的各个阶段都发挥重要作用. 在细胞凋亡过程中根据Caspase的作用不同, 研究者将Caspase分为始动Caspase和执行Caspase, 前者包括Caspase-8、Caspase-9、 Caspase-10, 后者包括Caspase-3、Caspase-6、Caspase-7. 其中Caspase-3是已知的该家族成员中执行细胞凋亡的关键酶之一, 许多的细胞外凋亡信号使之激活, 使胞质、胞核及细胞骨架的重要蛋白酶失活, 引发细胞凋亡. 目前相关研究认为Caspase-3与胰腺癌细胞凋亡也是密切相关的[6-8].
MK表达于多种恶性肿瘤中, 在消化系统肝癌、胆囊癌、食管癌、胃癌、大肠癌均有MK过表达报导[9-10], 但目前有关MK基因在胰腺癌中表达及其生物学功能的报道尚少. 从本实验研究结果我们看到MK蛋白在正常胰腺组织中不表达, 而在胰腺癌组织中呈高表达71.4%(35/49), 且MK蛋白的表达与胰腺癌组织学分级、临床分期、淋巴转移密切相关, 在胰腺癌早期就存在MK的过表达, 但随肿瘤进展其表达增高. 提示我们MK不仅参与了胰腺癌的发生, 且与胰腺癌的进展密切相关. 而其在正常胰腺组织中完全不表达, 提示MK蛋白不仅可望成为胰腺癌早期诊断的标志物之一, 并可作为评估胰腺癌手术治疗后疗效及判断预后的一个辅助指标.
在分析Caspase-3表达特点时发现, Caspase-3在正常胰腺组织和胰腺癌组织标本中均高表达, 但在胰腺癌组织中表达更高, 其表达与组织学分级相关, 低分化者低于高中分化者(P<0.05), 提示在肿瘤分化的不同阶段肿瘤凋亡蛋白Caspase-3的表达程度亦不同.
有意义的是, 本实验中我们发现, 胰腺癌组织中细胞凋亡明显强于正常胰腺组织细胞凋亡, 但在胰腺癌进展过程中, 细胞凋亡有随肿瘤进展而降低的趋势, 高中分化者大于低分化者(P<0.05), TNM分期Ⅰ、Ⅱ期者大于Ⅲ、Ⅳ期者(P<0.01), 无淋巴转移者大于有淋巴转移者(P<0.05). 提示我们在胰腺癌发生发展过程中, 细胞凋亡被抑制起着非常重要的作用: 在胰腺癌早期, 机体存在较高的细胞凋亡, 这种较高的细胞凋亡可能是机体的一种防御性反应来清除病变细胞. 但随着肿瘤进展, 由于各种因素导致凋亡受抑, 肿瘤细胞呈无限制增殖状态从而使胰腺癌病变不断进展恶化.
本实验在研究MK蛋白的表达与肿瘤细胞凋亡关系时发现: 35例MK阳性表达组中平均凋亡指数为5.13±2.69, 显著低于MK阴性表达组平均凋亡指数7.93±6.65, 差异具有显著性(P<0.05), 提示MK蛋白在胰腺癌组织中的高表达可能抑制细胞凋亡.
目前已有相关的实验在研究MK抑制细胞凋亡的具体途径. Salama et al[11]发现MK可与层黏蛋白连接蛋白前体结合, 之后转移至细胞核发挥作用; Stoica et al[12]证实MK可紧密连接于细胞表面受体间变性淋巴瘤激酶(ALK), 并进一步激活磷脂酰肌醇3激酶和丝裂素活化蛋白激酶转导途径; Shibata et al[13]发现外源性MK通过低密度脂蛋白受体相关蛋白结合后, 经胞饮作用进入细胞膜后转移至核内发挥其生理、病理作用, 此过程可能与MK抗凋亡作用相关. 确切的生物学机制仍有待进一步实验研究.
从我们实验结果中进一步分析MK和Caspase-3蛋白在胰腺癌组织中表达与细胞凋亡关系时发现, 35例MK蛋白阳性表达组Caspase-3蛋白阳性率为68.6%, 14例MK蛋白阴性表达组中有全部Caspase-3蛋白阳性表达, 阳性率为100%, 两者差异有显著性且存在负相关(r = -0.34, P<0.05). 即MK蛋白在胰腺癌组织中的高表达与Caspase-3蛋白的表达负相关, 提示MK可能是通过调控Caspase-3的表达从而实现其部分生物学功能的. 而Caspase-3是已知的执行细胞凋亡的关键酶之一, 故进一步提示我们MK可能是通过抑制Caspase-3的活性从而抑制胰腺癌细胞凋亡. 这对于更深层次的研究MK在胰腺癌中过表达的生物学意义很有帮助.
由于胰腺癌早期诊断率低, 确诊时往往已属晚期, 因此根治手术机会较小, 且胰腺癌对放化疗均不敏感, 故基因治疗成为目前胰腺癌治疗研究的热点之一. 胰腺癌基因治疗的关键是由载体将目的基因安全、特异、高效地转染至靶细胞, 目前多采用病毒及脂质体方法, 但转染效率较低[14]. 近年来MK基因已成为抗肿瘤治疗的研究方向之一[15-16]. Takei et al在体外和动物实验中设计MK反义寡脱氧核糖核苷酸用于直肠癌等肿瘤基因治疗, 实验结果显示能够抑制肿瘤细胞生长[17-18]. Inoh et al[19]试验将阿霉素结合的抗MK mAb用于抗肿瘤治疗. 本研究发现MK在胰腺癌组织中高表达而不表达于相应正常胰腺组织, 且MK在胰腺癌组织中可能具有的抑凋亡作用, 并与Caspase-3的表达具有负相关关系, 从而提示我们提示通过基因或药物方法特异性阻断MK的表达, 和(或)抑制Caspase-3活性从而阻断其作用途径, 可能达到促进胰腺癌肿瘤细胞凋亡的目的从而使MK基因成为胰腺癌基因治疗的新靶点和基因方法, 这也是我们下一步实验的目的.
胰腺癌因恶性程度高、治疗困难、预后差, 仍是肿瘤病学的一大挑战. 研究并找到一种与胰腺癌发生发展密切相关的分子生物学标志物, 使其能够运用于筛查、早期诊断和(或)使其成为治疗靶标是当前胰腺肿瘤研究工作者最迫切的任务之一.
李淑德, 主任医师, 中国人民解放军第二军医大学长海医院消化内科; 刘海林, 主任医师, 上海交通大学医学院附属第九人民医院消化科
Midkine基因自从1988年Ka et al从小鼠胚胎肿瘤细胞(HM-1)的cDNA文库中发现至今, 被越来越多的研究证实其在多种恶性肿瘤中高度表达, 而不见表达于相应的正常组织. 在恶性肿瘤患者血液和尿液中能够检测到Midkine表达, 且其表达浓度明显高于正常人并与肿瘤临床病理存在一定相关性, 这使Midkine很有希望成为一种新的肿瘤标志物在肿瘤的诊断、治疗和判断预后中发挥作用.
Owada et al发现Midkine基因可以抑制Caspase介导的细胞凋亡.
本研究显示, Midkine在胰腺癌组织中存在过表达, 其过表达可能起到抑制胰腺肿瘤细胞凋亡的目的, 其机制可能是通过抑制凋亡相关蛋白Caspase-3的活性, 为进一步研究其生物学意义打开思路.
本文探讨胰腺癌Midkine和Caspase-3表达, 有重要理论和临床意义.
编辑: 史景红 电编: 何基才
| 1. | Evan GI, Vousden KH. Proliferation, cell cycle and apoptosis in cancer. Nature. 2001;411:342-348. [PubMed] [DOI] |
| 2. | Kadomatsu K, Muramatsu T. Midkine and pleiotrophin in neural development and cancer. Cancer Lett. 2004;204:127-143. [PubMed] [DOI] |
| 3. | Ohhashi S, Ohuchida K, Mizumoto K, Egami T, Yu J, Cui L, Toma H, Takahata S, Nabae T, Tanaka M. Midkine mRNA Is Overexpressed in Pancreatic Cancer. Dig Dis Sci. 2008; Aug 21. [Epub ahead of print]. [PubMed] [DOI] |
| 4. | Sun BH, Zhang J, Wang BJ, Zhao XP, Wang YK, Yu ZQ, Yang DL, Hao LJ. Analysis of in vivo patterns of caspase 3 gene expression in primary hepatocellular carcinoma and its relationship to p21(WAF1) expression and hepatic apoptosis. World J Gastroenterol. 2000;6:356-360. [PubMed] [DOI] |
| 5. | Gao C, Tsuchida N. Activation of caspases in p53-induced transactivation-independent apoptosis. Jpn J Cancer Res. 1999;90:180-187. [PubMed] [DOI] |
| 6. | Satoh K, Kaneko K, Hirota M, Toyota T, Shimosegawa T. The pattern of CPP32/caspase-3 expression reflects the biological behavior of the human pancreatic duct cell tumors. Pancreas. 2000;21:352-357. [PubMed] [DOI] |
| 7. | Meggiato T, Calabrese F, De Cesare CM, Baliello E, Valente M, Del Favero G. C-JUN and CPP32 (CASPASE 3) in human pancreatic cancer: relation to cell proliferation and death. Pancreas. 2003;26:65-70. [PubMed] [DOI] |
| 8. | Chen MJ, Chang WH, Lin CC, Liu CY, Wang TE, Chu CH, Shih SC, Chen YJ. Caffeic acid phenethyl ester induces apoptosis of human pancreatic cancer cells involving caspase and mitochondrial dysfunction. Pancreatology. 2008;8:566-576. [PubMed] [DOI] |
| 11. | Salama RH, Muramatsu H, Zou K, Inui T, Kimura T, Muramatsu T. Midkine binds to 37-kDa laminin binding protein precursor, leading to nuclear transport of the complex. Exp Cell Res. 2001;270:13-20. [PubMed] [DOI] |
| 12. | Stoica GE, Kuo A, Powers C, Bowden ET, Sale EB, Riegel AT, Wellstein A. Midkine binds to anaplastic lymphoma kinase (ALK) and acts as a growth factor for different cell types. J Biol Chem. 2002;277:35990-35998. [PubMed] [DOI] |
| 13. | Shibata Y, Muramatsu T, Hirai M, Inui T, Kimura T, Saito H, McCormick LM, Bu G, Kadomatsu K. Nuclear targeting by the growth factor midkine. Mol Cell Biol. 2002;22:6788-6796. [PubMed] [DOI] |
| 14. | 巩 鹏, 王 忠裕. 胰腺癌基因治疗进展. 国外医学·肿瘤学分册. 2003;30:463-465. |
| 15. | Hoffmann D, Wildner O. Restriction of adenoviral replication to the transcriptional intersection of two different promoters for colorectal and pancreatic cancer treatment. Mol Cancer Ther. 2006;5:374-381. [PubMed] [DOI] |
| 16. | Toyoda E, Doi R, Kami K, Mori T, Ito D, Koizumi M, Kida A, Nagai K, Ito T, Masui T. Midkine promoter-based conditionally replicative adenovirus therapy for midkine-expressing human pancreatic cancer. J Exp Clin Cancer Res. 2008;27:30. [PubMed] [DOI] |
| 17. | Takei Y, Kadomatsu K, Matsuo S, Itoh H, Nakazawa K, Kubota S, Muramatsu T. Antisense oligodeoxynucleotide targeted to Midkine, a heparin-binding growth factor, suppresses tumorigenicity of mouse rectal carcinoma cells. Cancer Res. 2001;61:8486-8491. [PubMed] [DOI] |
| 18. | Takei Y, Kadomatsu K, Itoh H, Sato W, Nakazawa K, Kubota S, Muramatsu T. 5'-,3'-inverted thymidine-modified antisense oligodeoxynucleotide targeting midkine. Its design and application for cancer therapy. J Biol Chem. 2002;277:23800-23806. [PubMed] [DOI] |
| 19. | Inoh K, Muramatsu H, Torii S, Ikematsu S, Oda M, Kumai H, Sakuma S, Inui T, Kimura T, Muramatsu T. Doxorubicin-conjugated anti-midkine monoclonal antibody as a potential anti-tumor drug. Jpn J Clin Oncol. 2006;36:207-211. [PubMed] [DOI] |