修回日期: 2008-11-16
接受日期: 2008-11-17
在线出版日期: 2008-12-18
目的: 研究酪氨酸激酶RON(recepteur d'origine nantais)在胰腺癌组织中的表达及其意义.
方法: 收集胰腺癌组织及相关癌旁组织31例, 正常胰腺组织8例, 采用免疫组织化学技术检测组织中RON的表达.
结果: RON在正常胰腺组织、癌旁组织、胰腺癌组织中均见阳性表达, 胰腺癌及癌旁中的表达强度高于正常胰腺组织, 胰腺癌RON的表达强度强于癌旁组织(P<0.05). RON表达与患者年龄、肿瘤大小、组织学类型和肿瘤部位等均无关, 与胰腺癌临床分期、分化程度及淋巴结转移相关(P<0.05).
结论: RON表达量的增多与胰腺癌的发生、发展有关.
引文著录: 周坤, 汪宏, 涂从银, 吴立胜. 酪氨酸激酶受体RON在胰腺癌中的表达及意义. 世界华人消化杂志 2008; 16(35): 4012-4014
Revised: November 16, 2008
Accepted: November 17, 2008
Published online: December 18, 2008
AIM: To examine the expression and significance of Tyrosine Kinase Receptor RON in pancreatic cancer and its significance.
METHODS: The expression of RON was detected in 31 pancreatic cancer tissue specimens and 31 adjacent pancreatic tissue specimens and 8 normal pancreatic tissues were using immunohistochemistry.
RESULTS: The expression of RON was detected in all the pancreatic cancer tissues, the normal pancreatic tissues and in adjacent tissues. The RON expression level in all the pancreatic cancer tissues and adjacent tissues was significantly higher than those of the normal pancreatic tissues; RON expression was higher in pancreatic cancer tissues than in adjacent tissues (P < 0.05). The expression level of RON in pancreatic cancer tissue was correlated with tumor differentiation and clinical stage and lymph node metastasis, and not correlated with age, tumor size, histological type or tumor location (P < 0.05).
CONCLUSION: Elevated RON expression may contribute to pancreatic carcinogenesis.
- Citation: Zhou K, Wang H, Tu CY, Wu LS. Expression of recepteur d'origine nantais in pancreatic cancer and its significance. Shijie Huaren Xiaohua Zazhi 2008; 16(35): 4012-4014
- URL: https://www.wjgnet.com/1009-3079/full/v16/i35/4012.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i35.4012
胰腺癌起病隐匿, 恶性程度高. 美国由癌症导致的死亡, 胰腺癌居于第4位, 2006年约32000名患者死于胰腺癌, 中位生存期<1年, 确诊后的5年生存率<4%[1]. RON属于RTK亚家族中成员之一, 主要表达在上皮来源的细胞, RON活化后引起细胞转化、生长、迁移和基质侵袭. 目前研究已经证实, RON在人和小鼠胰腺癌细胞株[2]和大肠癌临床标本[3]中均有表达, 明显高于正常上皮. 本研究采用免疫组织化学法检测RON在胰腺癌组织、癌旁组织和正常胰腺组织中的表达情况, 并探讨RON与胰腺癌组织病理意义的关系.
收集安徽医科大学第三附属医院普外科2005-01/2008-05胰腺癌手术标本31例, 以及8例正常胰腺组织来源于同期良性胰腺肿瘤切除距病变部位边缘2 cm的正常组织. 癌症患者男21例, 女10例; 年龄34-70(中位年龄为53)岁; 肿瘤部位: 胰头部22例, 胰体尾部9例; 组织类型: 导管腺癌29例, 腺泡细胞癌1例, 囊腺癌1例; TNM分期: Ⅰ-Ⅱ期14例. Ⅲ-Ⅳ期17例; 淋巴结阳性19例, 淋巴结阴性12例; 肿瘤直径<2 cm 10例, ≥2 cm 21例; 所有患者术前均未进行化疗或放疗; 所有病例均同时取新鲜癌组织和癌旁组织标本, 取材后用250 g/L甲醛固定, 石蜡包埋; 所有肿瘤标本均经病理诊断证实. 兔抗人RON抗体(RON-βc-20, Santa Cruz公司); 即用型免疫组织化学超敏SP试剂盒购自福州迈新生物技术开发公司; 免疫组化染色结果判定采用HPIAS-100高清晰度彩色病理图文分析系统9.0.
全部组织标本以100 g/L甲醛固定, 石蜡包埋, 4 µm连续切片后进行免疫组化染色. 本实验采用免疫组织化学方法(SP法), 按照SP试剂盒说明书操作. 一抗作用时间为室温条件下0.5 h, 稀释浓度为1:100. 以转染RON的NIH-3T3细胞为阳性对照, 以PBS代替一抗作为阴性对照. 镜下观察肿瘤细胞胞质内出现淡黄色至棕黄色颗粒为阳性染色; 采用灰度扫描, 染色强度越高, 灰度值越小.
统计学处理 采用SPSS11.0统计软件进行数据分析, 计量资料采用单因素方差分析, P<0.05为差异有统计学意义.
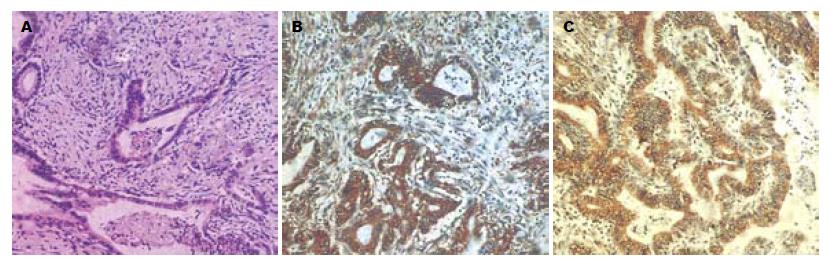
RON在正常胰腺组织、癌旁组织、胰腺癌组织中均见阳性表达. 胰腺癌及癌旁中的表达强度高于正常胰腺组织, 胰腺癌RON的表达强度强于癌旁组织(P<0.05). 几乎所有的肿瘤细胞均见RON阳性表达(图1).
RON蛋白表达与患者年龄、肿瘤大小、组织学类型和肿瘤部位等均无关. 胰腺癌组织中RON的表达与肿瘤的分化程度和临床分期有关, 分化程度越低, RON的表达强度越高, Ⅲ、Ⅳ期肿瘤RON的表达高于Ⅰ、Ⅱ期, 且RON表达强度随淋巴结转移而增高(P<0.05, 表1).
| n | RON表达灰度值 | |
| 年龄(岁) | ||
| <55 | 18 | 82.41±5.74 |
| ≥55 | 13 | 79.69±5.12 |
| 肿块大小(cm) | ||
| <2 | 10 | 81.31±4.79 |
| ≥2 | 21 | 80.63±4.98 |
| 淋巴结转移 | ||
| 有 | 19 | 74.53±4.33 |
| 无 | 12 | 83.03±4.47 |
| TNM分期 | ||
| Ⅰ-Ⅱ | 14 | 87.28±5.78 |
| Ⅲ-Ⅳ | 17 | 78.09±4.27 |
| 病理类型 | ||
| 导管腺癌 | 29 | 80.21±5.22 |
| 腺泡细胞癌 | 1 | 78.19 |
| 囊腺癌 | 1 | 77.72 |
| 肿瘤位置 | ||
| 胰头部 | 22 | 79.27±4.46 |
| 胰体尾部 | 9 | 78.23±5.61 |
RON基因含有20个外显子和19个内含子, 位于人染色体3p21, 其在胚胎发育中是不可或缺的. 成熟的RON蛋白是由40 kDa α链和150 kDa β链组成的180 kDa异二聚体, 跨膜β链具有酪氨酸激酶活性, 前体(pro-RON)以单链形式存在[4-5]. RON胞外序列包含氨基末端semaphoring(Sema), plexin, semaphor-, integrin(PSI), 以及四个免疫球蛋白样IPT域等结构域. 目前已知6种变异体[6-8], 根据分子质量大小命名为RON△170, RON△165, RON△160, RON△155, RON△110和RON△55. 主要通过交变的pre-mRNA剪接、蛋白质平截和替代转录等机制产生变异体[9]. MSP是RON特异性配体, 也称为肝细胞生长因子样蛋白, 人MSP基因在3号染色体上, MSP并非胚胎发育所必须的. RON激活后通过不同级联途径转导信号, 这些途径包括Ras/MAPK, PI/3K/AKT, junN-末端激酶(JNK)/应激激活蛋白激酶, β-catenin, Smad和核因子-κB(NF-κB)分子等[9].
免疫组织化学染色显示, 胰腺癌中RON表达显著高于正常胰腺组织. 实验中我们还发现胰腺上皮内瘤变(pancreatic intraepithelial neoplasias, PanINs)中RON的高表达, 也暗示了RON与肿瘤的早期发生相关, 但其作用机制尚未十分知晓, 有待进一步研究证实. 在上皮性肿瘤细胞中RON的表达发生了改变[10-14], 其异常变化如细胞黏附力、运动、侵袭性的增加、促使EMT(epithelial-mesenchymal transition)形成等可能参与了胰腺组织恶性变过程. 本实验证实了RON在肿瘤细胞内呈过表达; 且强度与肿瘤临床分期、分化程度及淋巴结转移相关. 根据以上结果我们初步推测, 在胰腺癌的发生发展过程中, RON过度激活, 促进胰腺导管上皮细胞中的干细胞自我更新, 然而长期慢性刺激使下游信号持续活化, 最终导致干细胞恶性转化和过度增殖.
本研究初步证明, RON与胰腺癌的发生密切相关. 同时应进一步探寻RON及其信号通路与肿瘤的内在联系, 深入阐明其分子作用机制、配体与受体结合机制, 洞悉其靶基因的转录机制及在细胞增殖和细胞转化中的作用机制. 以开展针对RON为靶点的生物治疗研究, 为胰腺癌临床治疗提供新手段. RON表达量的增多、异常突变体的出现与胰腺癌的发生、发展有关.
胰腺癌是消化外科恶性肿瘤死亡率最高的疾病之一, 胰腺癌发生发展的分子机制, 探寻各种上游蛋白表达、信号通路与胰腺癌的内在联系成为当前研究的热点. 酪氨酸激酶受体(RTK)介导许多关键的细胞功能, 在肿瘤的发生、发展和转移中扮演着重要的角色. RON属于RTK亚家族中成员之一, 主要表达在上皮来源的细胞, RON活化后引起细胞转化、生长、迁移和基质侵袭. 有关RON在胰腺肿瘤细胞运动、黏附、侵袭性增加中的作用, 目前尚未十分清楚.
巩鹏, 教授, 大连医科大学附属第一医院普外二科; 周国雄, 主任医师, 南通大学附属医院消化内科
近年的研究热点主要集中在研究RON在肿瘤发生、发展的分子机制, 探寻RON表达与肿瘤的内在联系, 确定RON表达强度与胰腺上皮内瘤变(PanINs)演变至胰腺癌之间的关系, 以及激活后下游信号通路之间的交互作用.
近年来研究发现, RON可在某些正常细胞被发现, 但在多数上皮源性肿瘤等可以检测到RON高表达. 转基因小鼠中高表达RON的肺模型, 最终导致肺腺癌的发生和发展. RON表达在小鼠乳腺中, 不仅可导致腺癌的发生, 还会引起肿瘤的快速转移.
本实验证实了RON在胰腺癌细胞内呈过表达; 且强度与肿瘤临床分期、分化程度及淋巴结转移相关, 为进一步研究RON在胰腺癌中的作用奠定了基础.
本文研究了酪氨酸激酶RON在胰腺癌组织中的表达及其意义, 选题较好, 层次分明, 统计正确, 有一定的学术价值, 但内容过于简单.
编辑: 史景红 电编: 何基才
| 1. | American Cancer Society. Cancer Facts and Figures 2006. Atlanta: American Cancer Society, Inc 2006; 1-51. |
| 2. | Camp ER, Yang A, Gray MJ, Fan F, Hamilton SR, Evans DB, Hooper AT, Pereira DS, Hicklin DJ, Ellis LM. Tyrosine kinase receptor RON in human pancreatic cancer: expression, function, and validation as a target. Cancer. 2007;109:1030-1039. [PubMed] [DOI] |
| 4. | Ronsin C, Muscatelli F, Mattei MG, Breathnach R. A novel putative receptor protein tyrosine kinase of the met family. Oncogene. 1993;8:1195-1202. [PubMed] [DOI] |
| 5. | Gaudino G, Follenzi A, Naldini L, Collesi C, Santoro M, Gallo KA, Godowski PJ, Comoglio PM. RON is a heterodimeric tyrosine kinase receptor activated by the HGF homologue MSP. EMBO J. 1994;13:3524-3532. [PubMed] [DOI] |
| 6. | Lu Y, Yao HP, Wang MH. Multiple variants of the RON receptor tyrosine kinase: biochemical properties, tumorigenic activities, and potential drug targets. Cancer Lett. 2007;257:157-164. [PubMed] [DOI] |
| 7. | Xu XM, Zhou YQ, Wang MH. Mechanisms of cytoplasmic {beta}-catenin accumulation and its involvement in tumorigenic activities mediated by oncogenic splicing variant of the receptor originated from Nantes tyrosine kinase. J Biol Chem. 2005;280:25087-25094. [PubMed] [DOI] |
| 8. | Xu XM, Wang D, Shen Q, Chen YQ, Wang MH. RNA-mediated gene silencing of the RON receptor tyrosine kinase alters oncogenic phenotypes of human colorectal carcinoma cells. Oncogene. 2004;23:8464-8474. [PubMed] [DOI] |
| 9. | Wang MH, Wang D, Chen YQ. Oncogenic and invasive potentials of human macrophage-stimulating protein receptor, the RON receptor tyrosine kinase. Carcinogenesis. 2003;24:1291-1300. [PubMed] [DOI] |
| 10. | Zhou YQ, He C, Chen YQ, Wang D, Wang MH. Altered expression of the RON receptor tyrosine kinase in primary human colorectal adenocarcinomas: generation of different splicing RON variants and their oncogenic potential. Oncogene. 2003;22:186-197. [PubMed] [DOI] |
| 11. | Lee WY, Chen HH, Chow NH, Su WC, Lin PW, Guo HR. Prognostic significance of co-expression of RON and MET receptors in node-negative breast cancer patients. Clin Cancer Res. 2005;11:2222-2228. [PubMed] [DOI] |
| 12. | Cheng HL, Liu HS, Lin YJ, Chen HH, Hsu PY, Chang TY, Ho CL, Tzai TS, Chow NH. Co-expression of RON and MET is a prognostic indicator for patients with transitional-cell carcinoma of the bladder. Br J Cancer. 2005;92:1906-1914. [PubMed] [DOI] |
| 13. | Maggiora P, Lorenzato A, Fracchioli S, Costa B, Castagnaro M, Arisio R, Katsaros D, Massobrio M, Comoglio PM, Flavia Di Renzo M. The RON and MET oncogenes are co-expressed in human ovarian carcinomas and cooperate in activating invasiveness. Exp Cell Res. 2003;288:382-389. [PubMed] [DOI] |