修回日期: 2008-11-15
接受日期: 2008-11-17
在线出版日期: 2008-12-18
目的: 拟明确CacyBP/SIP在结肠癌细胞中的表达及定位, 探讨CacyBP/SIP在结肠癌发生发展中的意义.
方法: 采用Western blot对3种结肠癌细胞系中CacyBP/SIP的表达进行检测; 间接免疫荧光细胞内染色检测CacyBP/SIP在结肠癌细胞中的定位以及给予KCl、胃泌素(10-8 mol/L)刺激后CacyBP/SIP的定位; 激光共聚焦检测胃泌素刺激后结肠癌细胞中Ca2+ 浓度的变化.
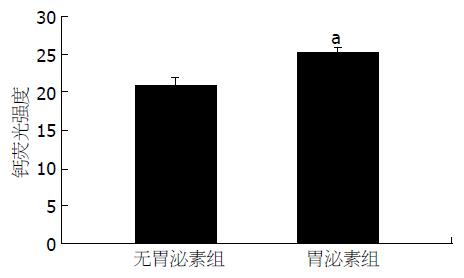
结果: HT29及SW480结肠癌细胞中均表达CacyBP/SIP, Lovo细胞中未检测出CacyBP/SIP. 间接免疫荧光显示CacyBP/SIP主要位于结肠癌细胞的胞质中, 给予KCl刺激后CacyBP/SIP转位至细胞核, 洗脱KCl后, CacyBP/SIP位于胞质; 给予胃泌素刺激后亦可观察到CacyBP/SIP转位至细胞核; 与无胃泌素刺激的细胞相比, 给予胃泌素刺激的细胞内Ca2+浓度显著高于对照组(25.33±0.57 vs 21±1, P<0.05).
结论: CacyBP/SIP在结肠癌细胞中表达, 且主要定位于胞质, 当细胞内Ca2+浓度升高后转位至细胞核, 提示CacyBP/SIP可能通过入核来参与结肠癌的发生发展.
引文著录: 翟惠虹, 陈雄, 卢媛媛, 王新, 樊代明. 结肠癌细胞中CacyBP/SIP的表达及核转位现象. 世界华人消化杂志 2008; 16(35): 3953-3957
Revised: November 15, 2008
Accepted: November 17, 2008
Published online: December 18, 2008
AIM: To verify expression and location of CacyBP/SIP in colon cancer cells, so to explore the role of CacyBP/SIP in colon cancer.
METHODS: The expression of CacyBP/SIP in the three colon cancer cell lines was detected using Western blot. The location of CacyBP/SIP in the colon cancer cell and location after stimulation by KCl, gastrin(10-8 mol/L) were determined separately by indirect immunofluorescence. The change of Ca2+ concentration in the colon cancer cells stimulated by gastrin was detected by laser copolymerization focal.
RESULTS: CacyBP/SIP was detected in the HT29 and SW480 colon cancer cells and undetected in the Lovo colon cancer cells. CacyBP/SIP was located in the cytoplasm of colon cancer cells. After stimulation by KCl, CacyBP/SIP translocated into nucleus; after KCl was washed off, CacyBP/SIP was relocated in the cytoplasm. Upon stimulation by gastrin, CacyBP/SIP also translocated into the nucleus. Compared with the colon cancer cell without gastrin, intra-cellular Ca2+ concentration with gastrin was increased (25.33 ± 0.57 vs 21 ± 1, P < 0.05).
CONCLUSION: CacyBP/SIP is expressed in the colon cancer cells and located in the cytoplasm. CacyBP/SIP could translocate into the nucleus after increased intra-cellular Ca2+ concentration. These results suggest that CacyBP/SIP may be involved in the progression of colon cancer through nuclear translocation.
- Citation: Zhai HH, Chen X, Lu YY, Wang X, Fan DM. Expression and nucleus translocation of calcyclin binding protein in colon cancer cells. Shijie Huaren Xiaohua Zazhi 2008; 16(35): 3953-3957
- URL: https://www.wjgnet.com/1009-3079/full/v16/i35/3953.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i35.3953
在我国, 结肠癌已位居恶性肿瘤第五位, 随着饮食结构变化及人口老龄化, 其发病率呈逐年上升的趋势. 虽然目前已明确, 在结肠癌进展中, K-ras、APC基因的突变及p53基因的失活与其密切相关, 但对于结肠癌的早期诊断仍特异性欠佳. 所以全面理解结肠癌发生发展过程中诸多基因表达的变化尤其是早期基因表达的变化, 可以提高其早期诊断率并为结肠癌的基因治疗提供理论依据.
钙周期素结合蛋白(Calcyclin-binding-protein, 亦称siah-interaction-protein, CacyBP/SIP)是一个26 kDa大小以钙依赖的方式结合S100家族的蛋白, 最早从艾氏腹水瘤细胞中克隆[1]. 我所在2001年研究胃癌多药耐药时发现CacyBP/SIP在胃癌阿霉素耐药细胞SGC7901/ADR中高表达并参与胃癌细胞的多药耐药[2-3], 为进一步研究其功能, 制备了小鼠源性抗人CacyBP/SIP mAb[4], 在组织分布的研究中发现, CacyBP/SIP在正常结肠组织不表达, 高表达于结肠癌组织, 定位于细胞胞质及胞核[5]. 本研究旨在上述研究的基础上, 应用蛋白质印迹法(Western blot)和细胞免疫荧光染色, 明确结肠癌细胞中CacyBP/SIP的表达及定位, 进一步探讨CacyBP/SIP在结肠癌发生发展中的意义.
RPMI 1640购于Gibco公司; 小牛血清购于四季青公司; BCA蛋白定量试剂盒购自碧云天公司; CacyBP/SIP mAb由本实验室自制; HRP标记羊抗鼠抗体、FITC标记的羊抗鼠IgG为中山公司产品; HEPES、NC膜购自Merck公司; 超级化学发光试剂盒购自Pierce公司; X光片购自Kodak公司; 鼠抗人β-actin、胃泌素、Fluo-3-AM为Sigma公司产品; 激光共聚焦显微镜为Bio-Rad公司; 35 mm Petri细胞培养皿由Meridian提供.
1.2.1 细胞株及其培养条件: 人结肠癌细胞HT29、SW480、Lovo细胞引自中国人民解放军军事医学科学院, 本实验室传代保存, 细胞在37 ℃、50 mL/L CO2、饱和湿度培养箱中培养, 培养基为含100 mL/L热灭活小牛血清、100000 U/L青霉素和100000 U/L链霉素的RPMI 1640培养基.
1.2.2 Western blot法检测: 参照Santa Cruz公司提供的方法, 应用RIPA组织裂解液分别裂解结肠癌细胞, 提取细胞总蛋白, 按照蛋白定量试剂盒的说明测定细胞提取液的蛋白浓度. 取相同的细胞上样量行120 g/L SDS-PAGE, 电转移至NC膜, 封闭后, 加入一抗(CacyBP/SIP单抗, 1:100)及用HRP标记的山羊抗小鼠Ig(1:2000), 按常规方法进行化学发光, 曝光, 显影. 以β-actin作为内对照.
1.2.3 细胞免疫荧光染色: 收获对数生长期的HT29细胞, 计数并调整细胞密度2-3×104, 接种于无菌盖玻片上; 37 ℃培养24-36 h后, 取出盖玻片, PBS冲洗3次, 经无水乙醇固定, 0.3% Triton-100增加通透性, 山羊非免疫血清去除非特异结合, 加入抗CacyBP/SIP mAb(1:10), 湿盒中4 ℃过夜; 加FITC标记羊抗鼠IgG(1:50), 湿盒中37 ℃孵育2 h; 500 mL/L甘油缓冲液封片, 激光共聚焦显微镜观察并拍照. 以上实验细胞分KCL实验组及胃泌素实验组; 在KCL实验组中, 细胞培养液中加入KCL(终浓度30 mmol/L)作用10 min后, 行细胞爬片及免疫荧光染色; KCL洗脱组中, 加入KCL作用10 min后用PBS洗脱后, 行细胞爬片及免疫荧光染色. 在胃泌素实验组中, 细胞培养液中加入胃泌素(10-8 mol/L), 与细胞共同孵育4 h后行细胞爬片及免疫荧光染色; 无胃泌素组中细胞直接行细胞免疫荧光染色.
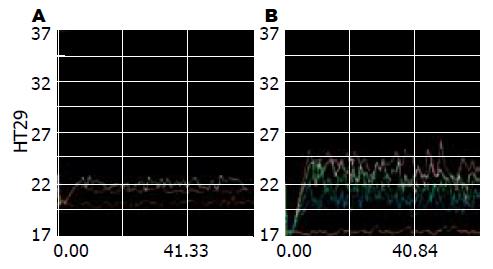
1.2.4 激光共聚焦显微镜检测细胞内Ca2+浓度: 取HT29细胞以5×105/cm2的浓度接种于35 mm Petri培养皿底部的盖玻片上, 培养24 h后, 吸除培养皿内的培养液, 用10 mmol/L HEPES冲洗3次, 加人浓度为20 µmol/L钙荧光探针Fluo-3-AM 20 µL、37 ℃避光孵育30 min, HEPES冲洗3次, 加入0.5 mL HEPES缓冲液, 将培养皿置于激光扫描共聚焦显微镜载物台上, 选用40倍物镜.确定激发光波长为488 nm, 选择合适视野, 预扫描后确定最佳扫描参数, 波长为488 nm时开始扫描, 计算机记录扫描结果并计算出整张照片细胞的平均荧光强度和标准差.
统计学处理 应用SPSS11.0统计软件行统计学处理, 采用t检验.
对3种人结肠癌细胞系中CacyBP/SIP的表达进行Western blot检测, 结果显示结肠癌细胞系HT29及SW480均有较高水平的CacyBP/SIP表达, 而Lovo细胞中CacyBP/SIP表达缺失(图1). 提示结肠癌细胞系中普遍表达CacyBP/SIP.
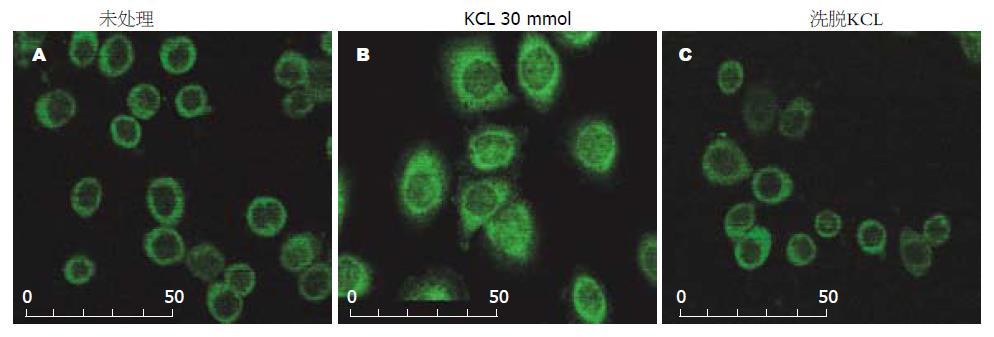
激光共聚焦显示, CacyBP/SIP在HT29细胞中主要分布在胞质内(图2A); 给予KCL刺激后, CacyBP/SIP在细胞胞质和胞核中都有分布, 主要集中于核膜处(图2B); 洗脱KCL后, CacyBP/SIP重新分布于胞质中(图2C). 提示CacyBP/SIP在给予KCL刺激后, 细胞内Ca2+浓度后升高后可转位至细胞核.
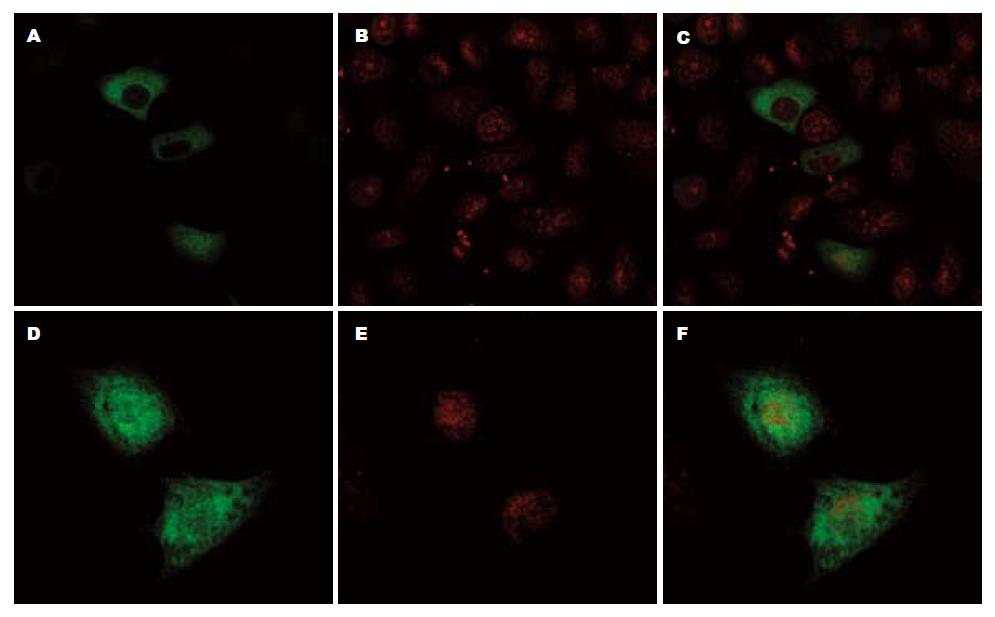
激光共聚焦显示, 在无胃泌素刺激的结肠癌细胞HT29中, CacyBP/SIP主要分布在胞质内(图3A); 给予10-8 mol/L胃泌素刺激后, CacyBP/SIP在胞核和胞质都有分布(图3D). 提示胃泌素可诱导CacyBP/SIP核转位(图3).
CacyBP/SIP, 1998年从艾氏腹水瘤细胞中克隆, 是一个26 kDa大小以钙依赖的方式结合Calcyclin的蛋白. CacyBP/SIP可做为S100蛋白家族的靶蛋白, S100蛋白家族是Ca2+结合蛋白家族中最大的亚类, 以组织特异性的方式作为钙信号的传导器, 与特异的靶蛋白相互作用, 介导钙信号对细胞的调控. 现发现CacyBP/SIP可与S100A1、A6、A12、B、P结合, 他们均与肿瘤的进展及转移有关[6].
Matsuzawa et al[7]在研究泛素降解途径时发现: SIP(siah binding protein), 与CacyBP/SIP编码氨基酸完全相同的cDNA全长, 可与Skp1-cullin-Fbox Ebi泛肽连接酶结合. 泛素-蛋白酶体通路是生物体内进行蛋白质选择性降解的重要途径之一, 而细胞周期调控蛋白P27、细胞周期蛋白D1、B、E等均是通过泛素酶SCF降解的[8]. CacyBP/SIP/SIP可与SCF结合, 参与泛素化蛋白降解具有重要意义.
我所在制备CacyBP/SIP单克隆抗体的基础上, 检测了CacyBP/SIP在正常组织及肿瘤组织中的表达分布, 结果发现: CacyBP/SIP在正常结肠组织中不表达, 在结肠癌组织中高表达, 主要定位于胞质/胞核. 这种现象有何意义, 定位于细胞核对其功能的发挥到底有何作用值得进一步研究.
为探讨这种现象在结肠癌细胞中是否存在, 我们首先应用Western blot检测了结肠癌细胞SW480、HT29及Lovo中CacyBP/SIP的表达, 结果发现: CacyBP/SIP在SW480及HT29中均表达, 说明结肠癌细胞中普遍表达CacyBP/SIP. 随后行细胞免疫荧光检测CacyBP/SIP在结肠癌细胞中的定位, 研究表明CacyBP/SIP主要定位于胞质.
Filipek et al[9]及Wu et al[10]均发现CacyBP/SIP具有依赖Ca2+浓度的核转位及磷酸化现象, 那么在结肠癌细胞中存在这种现象吗? 我们首先给予KCL, 可诱发细胞游离钙离子浓度升高, 给予KCL刺激后发现CacyBP/SIP可转位至细胞核, 洗脱KCL后, 这种转位现象即消失, 此时CacyBP/SIP分布于胞质. 这同其他研究报道一致.
在生物体内, 细胞通过激素、生长因子等将信号由胞膜传递至胞质/胞核. 钙信号通路在其中起着重要的作用. 那么, CacyBP/SIP这种依赖于Ca2+浓度的核转位现象是否与胞外信号传递相关呢? CacyBP/SIP入核后究竟引起细胞何种功能的变化?
为进一步回答这些问题, 我们选用胃泌素作为刺激剂, 因为即往研究已表明, 胃泌素除了对正常的胃肠道黏膜起生长促进的作用[11-12], 亦可促进结肠癌的增殖、迁移及浸润[13-14], 是促结肠癌增殖的生长因子. 流行病学调查及动物体内研究均证实: 高胃泌素血症促进结肠癌的发生并且在肿瘤的生长中起重要作用[15]. 此外, 在动物模型中发现: 应用胃泌素受体CCK-2拮抗剂可逆转高胃泌素血症促结肠癌生长的作用, 说明扰乱胃泌素的信号可降低肿瘤的增殖[16].
胃泌素与相应受体结合后可增加细胞内Ca2+浓度, 那么此时CacyBP/SIP在胃泌素诱导下可入核吗? 我们的研究发现: 胃泌素可以诱导CacyBP/SIP入核. 那么是否通过升高细胞内Ca2+从而诱导CacyBP/SIP入核呢?
胃泌素的CCK-2受体属于G蛋白偶联受体超家族, 与胃泌素结合后可活化磷脂酶c(PLC), 水解磷脂酰肌醇二磷酸成为肌醇-1, 4, 5-三磷酸(IP3)和二酰基甘油(DAG), IP3可促进Ca2+自内质网释放, 细胞内Ca2+增高, DAG则能激活蛋白激酶c(PKC), 亦增高细胞内Ca2+[17-18]. 给予胃泌素后, 我们测定结肠癌细胞内的Ca2+浓度, 与无胃泌素组相比, 发现其明显升高(P<0.05), 由此我们得出结论: 胃泌素通过升高结肠细胞内Ca2+浓度, 从而诱导CacyBP/SIP核转位.
总之, CacyBP/SIP在结肠癌细胞中表达, 胃泌素可诱导CacyBP/SIP核转位, 具有依赖Ca2+浓度的核转位现象. 细胞核是细胞增殖、分化、代谢的控制中枢, 蛋白转位至细胞核且发生磷酸化对于传递细胞外信号, 调控下游基因表达具有重要意义. CacyBP/SIP在外界刺激下可入核, 从组织学及细胞水平均得到证实, 均提示CacyBP/SIP可能通过入核来参与结肠癌的发生发展. 这使得我们进一步思考, 其他生长因子刺激后有核转位现象吗? 胃泌素是促结肠癌增殖的生长因子, 他诱导CacyBP/SIP核转位后是否传递其促结肠癌增殖的信号? 这均为我们下一步的研究方向.
在我国, 结肠癌已位居恶性肿瘤第五位, 随着饮食结构变化及人口老龄化, 其发病率呈逐年上升的趋势. 虽然目前已明确, 在结肠癌进展中, K-ras、APC基因的突变及p53基因的失活与其密切相关, 但对于结肠癌的早期诊断特异性欠佳.
刘连新, 教授, 哈尔滨医科大学第一临床医学院普通外科三病房
CacyBP/SIP, 1998年从艾氏腹水瘤细胞中克隆, 是一个26 kDa大小以钙依赖的方式结合Calcyclin的蛋白. 可与S100A1、A6、A12、B、P结合, 他们均与肿瘤的进展及转移有关.
Zhao et al在2001年研究胃癌多药耐药时发现CacyBP/SIP在胃癌阿霉素耐药细胞SGC7901/ADR中高表达并参与胃癌细胞的多药耐药, Zhai et al的研究发现, CacyBP/SIP在正常结肠组织不表达, 高表达于结肠癌组织, 定位于细胞胞质及胞核.
本文科学性较强, 有一定的创新性, 对于后续的研究工作有一定的参考意义.
编辑: 史景红 电编: 吴鹏朕
| 1. | Filipek A, Kuznicki J. Molecular cloning and expression of a mouse brain cDNA encoding a novel protein target of calcyclin. J Neurochem. 1998;70:1793-1798. [PubMed] |
| 2. | Zhao Y, You H, Liu F, An H, Shi Y, Yu Q, Fan D. Differentially expressed gene profiles between multidrug resistant gastric adenocarcinoma cells and their parental cells. Cancer Lett. 2002;185:211-218. [PubMed] [DOI] |
| 3. | Shi Y, Hu W, Yin F, Sun L, Liu C, Lan M, Fan D. Regulation of drug sensitivity of gastric cancer cells by human calcyclin-binding protein (CacyBP). Gastric Cancer. 2004;7:160-166. [PubMed] [DOI] |
| 4. | Zhai H, Shi Y, Yu J, Hong L, Tang H, Wang J, Hu S, Bai F, Fan D. Establishment and characterization of calcyclin binding protein (CacyBP) monoclonal antibody. Hybridoma (Larchmt). 2006;25:91-94. [PubMed] [DOI] |
| 5. | Zhai H, Shi Y, Jin H, Li Y, Lu Y, Chen X, Wang J, Ding L, Wang X, Fan D. Expression of calcyclin-binding protein/Siah-1 interacting protein in normal and malignant human tissues: an immunohistochemical survey. J Histochem Cytochem. 2008;56:765-772. [PubMed] [DOI] |
| 6. | Marenholz I, Heizmann CW, Fritz G. S100 proteins in mouse and man: from evolution to function and pathology (including an update of the nomenclature). Biochem Biophys Res Commun. 2004;322:1111-1122. [PubMed] [DOI] |
| 7. | Matsuzawa SI, Reed JC. Siah-1, SIP, and Ebi collaborate in a novel pathway for beta-catenin degradation linked to p53 responses. Mol Cell. 2001;7:915-926. [PubMed] [DOI] |
| 8. | Nakayama KI, Nakayama K. Ubiquitin ligases: cell-cycle control and cancer. Nat Rev Cancer. 2006;6:369-381. [PubMed] [DOI] |
| 9. | Filipek A, Jastrzebska B, Nowotny M, Kwiatkowska K, Hetman M, Surmacz L, Wyroba E, Kuznicki J. Ca2+-dependent translocation of the calcyclin-binding protein in neurons and neuroblastoma NB-2a cells. J Biol Chem. 2002;277:21103-21109. [PubMed] [DOI] |
| 10. | Wu J, Tan X, Peng X, Yuan J, Qiang B. Translocation and phosphorylation of calcyclin binding protein during retinoic acid-induced neuronal differentiation of neuroblastoma SH-SY5Y cells. J Biochem Mol Biol. 2003;36:354-358. [PubMed] |
| 11. | Sobhani I, Lehy T, Laurent-Puig P, Cadiot G, Ruszniewski P, Mignon M. Chronic endogenous hypergastrinemia in humans: evidence for a mitogenic effect on the colonic mucosa. Gastroenterology. 1993;105:22-30. [PubMed] |
| 12. | Johnson LR. The trophic action of gastrointestinal hormones. Gastroenterology. 1976;70:278-288. [PubMed] |
| 13. | Smith JP, Solomon TE. Effects of gastrin, proglumide, and somatostatin on growth of human colon cancer. Gastroenterology. 1988;95:1541-1548. [PubMed] |
| 14. | Watson SA, Durrant LG, Crosbie JD, Morris DL. The in vitro growth response of primary human colorectal and gastric cancer cells to gastrin. Int J Cancer. 1989;43:692-696. [PubMed] [DOI] |
| 15. | Thorburn CM, Friedman GD, Dickinson CJ, Vogelman JH, Orentreich N, Parsonnet J. Gastrin and colorectal cancer: a prospective study. Gastroenterology. 1998;115:275-280. [PubMed] [DOI] |
| 16. | Watson SA, Smith AM. Hypergastrinemia promotes adenoma progression in the APC(Min-/+) mouse model of familial adenomatous polyposis. Cancer Res. 2001;61:625-631. [PubMed] |
| 17. | Seva C, Scemama JL, Pradayrol L, Sarfati PD, Vaysse N. Coupling of pancreatic gastrin/cholecystokinin-B (G/CCKB) receptors to phospholipase C and protein kinase C in AR4-2J tumoral cells. Regul Pept. 1994;52:31-38. [PubMed] [DOI] |
| 18. | Bertrand V, Bastie MJ, Vaysse N, Pradayrol L. Inhibition of gastrin-induced proliferation of AR4-2J cells by calcium channel antagonists. Int J Cancer. 1994;56:427-432. [PubMed] [DOI] |