修回日期: 2008-11-10
接受日期: 2008-11-10
在线出版日期: 2008-12-18
目的: 通过CD/5-FC自杀基因体系对肝BEL-7402、胆QBC、胰BXPC-3三系肿瘤细胞杀伤效率的比较, 探讨影响这种杀伤差异的可能机制.
方法: 测定BEL-7402、QBC、BXPC-3三系肿瘤细胞的生长周期及倍增时间. FACS测定阳离子脂质体介导的三系肿瘤细胞瞬时转染效率. MTT法测定阳离子脂质体介导CD/5-FC自杀基因体系对瞬时转染的肝胆胰三系肿瘤细胞体外杀伤效率. 观察细胞倍增时间与转染效率与杀伤效率之间的关系. FACS对三系肿瘤细胞瞬时转染自杀基因后凋亡进行比较, 并用Hochest33342染色后进行观察.
结果: BEL-7402、QBC、BXPC-3的倍增时间分别是34.48、64.94、26.29 h. QBC细胞同BEL-7402及BXPC-3相比差异有显著性(P<0.05); BEL-7402、QBC、BXPC3三系细胞阳离子脂质体介导的转染率分别为26.99%、2.25%、30.36%. BEL-7402和BXPC-3同QBC细胞有显著差异(P<0.05); 瞬时转染自杀基因后抑制效率分别为83.24%, 16.97%, 92.32%; 在CD/5-FC杀伤三系细胞可能的机制-凋亡的研究中, 三者凋亡率分别为27.8%, 5.49%, 36.5%.
结论: 生长周期短, 倍增时间快的细胞系瞬时转染率高, 对CD/5-FC自杀基因疗法比较敏感, 该自杀基因疗法可能对临床晚期消化系恶性肿瘤是一种很有前景的治疗方法.
引文著录: 刘国彦, 罗琪, 庄维纯, 杨素梅, 魏黎煜. CD/5-FC自杀基因体系对肝、胆、胰肿瘤细胞的杀伤作用及机制. 世界华人消化杂志 2008; 16(35): 3946-3952
Revised: November 10, 2008
Accepted: November 10, 2008
Published online: December 18, 2008
AIM: To investigate the anticancer effect of the CD/5-FC suicide gene system on carcinoma cells of liver (Bel7402), bililary duct (QBC) and pancreas (Bxpc3), and to explore the possible anticancer mechanism.
METHODS: The growth curve and multiplication time of Bel-7402 QBC and Bxpc-3 were monitored by MTT; the transfection efficiency of the three kinds of carcinoma cells were detected by FACS after instant transfection. The anticancer efficiency of cation lipofectin-mediated CD/5-FC suicide gene system were monitored by MTT in vitro. Then, we analyzed the relation among multiplication time, transfection efficiency and anticancer effect; the apoptosis of CD/5-FC on the three cell lines were analyzed by FAM, and the apoptosis cells were stained by Hochest33342.
RESULTS: The multiplication time of Bel-7402, QBC and Bxpc-3 was 34.48, 64.94 and 26.29 h respectively, and difference between QBC and BEL-7402, BXPC-3 was significant (P < 0.05); the transfection efficiency of the three cell line were 26.99%, 2.25% and 30.36%, and the difference between QBC, and BEL-7402 and BXPC-3 was significant (P < 0.05); the anticancer efficiency was 83.24%, 16.97% and 92.32%, respectively. The apoptosis rates of the three kinds of carcinoma cells induced by CD/5-FC suicide gene system were 27.8%, 5.49% and 36.5%, respectively.
CONCLUSION: Carcinoma cells with shorter growth cycle and less multiplication time have higher instant transfection efficiency, and are more responsive to CD/5-FC suicide gene therapy. This suicide gene therapy may be a promising method for later malignant tumor in clinic.
- Citation: Liu GY, Luo Q, Zhuang WC, Yang SM, Wei LY. Anticancer effect of cation lipofectin-mediated CD/5-FC suicide gene system on liver, biliary duct and pancreas carcinoma cells in vitro. Shijie Huaren Xiaohua Zazhi 2008; 16(35): 3946-3952
- URL: https://www.wjgnet.com/1009-3079/full/v16/i35/3946.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i35.3946
自杀基因(suicide gene)[1-3]又称化疗敏感基因(chemosensitive gene)[4], 化疗药物前体活化基因(prodrug activation gene)[5], 是存在于细菌或真菌中的一类基因, 哺乳动物体内缺乏. 他通过编码特异的酶而转化低毒的或无毒的前体药物为具有毒性的代谢产物而发挥很强的抗肿瘤活性[6], 其中CD/5-FC[7-8]自杀基因体系杀伤效果好、旁观者效应(bystander effect)[9]显著, 目前逐渐成了研究的热点. 本工作通过对消化系三种不同器官来源细胞系的体外杀伤比较研究阳离子脂质体介导CD/5-FC自杀基因体系, 以期为临床应用提供更多的依据.
细胞: 肝癌BEL-7402、胆管癌QBC为北京军事医学科学院王玉芝研究员惠赠, 胰腺癌BXPC-3为本课题组保存; 绿色荧光蛋白的真核表达质粒pEGFP-N1为北京军事医学科学院王玉芝教授惠赠. MTT购自Sigma公司, Hochest33342购自Sigma公司, RNA酶购自Gibco公司, 阳离子脂质体LipofectamineTM购自Invetrogeon, 胎牛血清购自北京军马所, RPMI 1640培养基购自Hyclone公司. 流式细胞仪(FCM)BD公司FACS tar, America, 荧光显微成像系统Olympus os701.
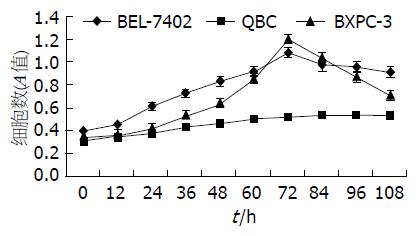
1.2.1 细胞生长曲线及倍增时间: 将指数生长期的三系细胞2×103、0.1 mL接种于96孔板, 37 ℃, CO2恒温箱中培育4 h, 将第一组加入MTT液15 mL, 再恒温箱中培养5 h, 取出加入0.1 mL、100 mL/L SDS继续恒温培养, 此组细胞数为起点, 计为时间0 h, 后在12、24、36、48、60、72、84、96、108 h分别加入MTT液15 mL及100 mL/L SDS、0.1 mL, 每组重复4孔. 最后在酶标仪492 nm上测定吸收值(A). 将A值连起绘制细胞生长曲线, 按照公式: TD = t×log2/(logN-logN0) 计算各细胞倍增时间.
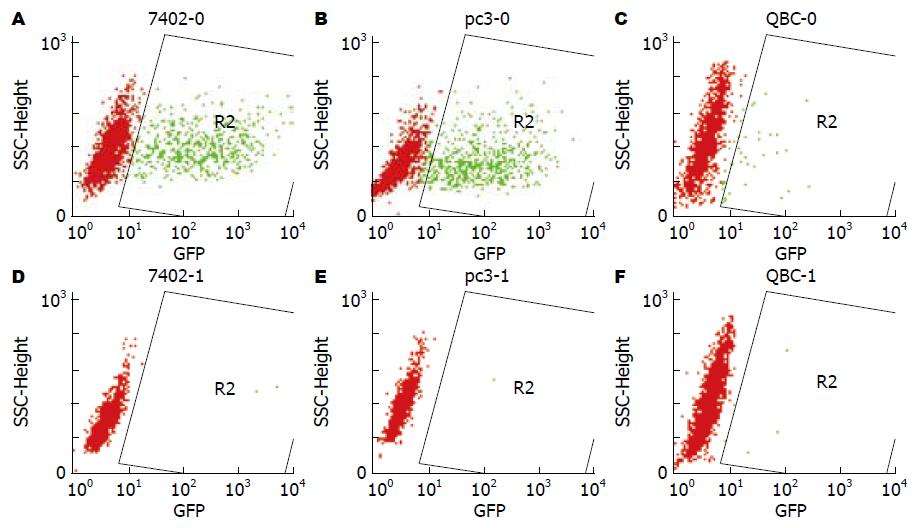
1.2.2 三细胞系瞬时转染效率的比较: 将指数生长期细胞各1×105接种于6孔板中, 37 ℃恒温CO2孵箱中培育12 h, 取出生理盐水洗两次, 加入配制好的转染液(脂质体:质粒PEGFP-N1 = 10 L:2 g), 再37 ℃恒温培养5 h, 去掉转染液, 加入含200 mL/L胎牛血清RPMI 1640培养液同上培养12 h, 换100 mL/L胎牛血清RPMI 1640培养基培养36 h, 去掉培养液, 胰酶消化制成单细胞悬液, FACS测定各细胞系转染率. 设定同样的条件下无脂质体介导的裸质粒转染为对照.
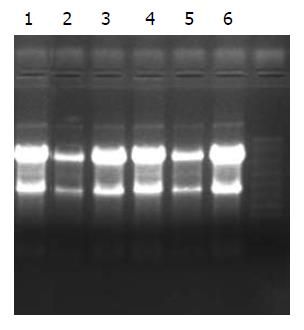
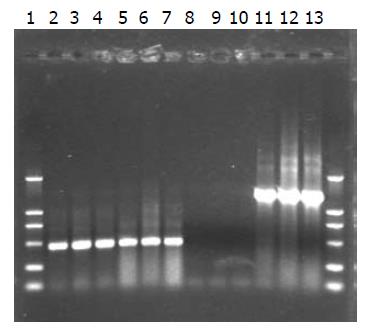
1.2.3 脂质体介导瞬时转染CD基因表达的检测: 将三系细胞各5×105个接种于90 mm培养皿中, 转染方法同"1.2.2", 脂质体:质粒 = 30 L:6 g, 培养48 h, RNA提取试剂盒(Sigama公司试剂盒)提取RNA, 设计引物序列进行RT-PCR反应. CD基因引物上游序列: 5'-GTGAATTCAGGCTAGCAATGTCGAATAACGCT-3', 下游序列: 5'-GTGGATCCTCAACGTTTGTAATCGATGGCTTC-3'. 看家基因为GAPDH, CD基因的PCR条件为: 94 ℃变性40 s, 55 ℃退火40 s, 72 ℃延长1 min, 32个循环, PCR产物经10 g/L琼脂糖凝胶电泳(80 V、1 h)鉴定结果.
1.2.4 5-FC对细胞瞬时转染CD基因杀伤及抑制的比较: 将指数生长期细胞5×103接种于96孔板, 每组重复4孔, 培养12 h, 去掉培养液, 生理盐水洗过2次, 加入瞬时转染液(方法同2)37 ℃培养5 h, 换200 mL/L胎牛血清培养液, 加入5-FC(5 mmol/L的终浓度)37 ℃恒温培养, MTT法(方法同1.2.1)检测24、48、72 h杀伤及抑制效率, 每组重复4孔, 绘制杀伤及抑制曲线. 生长抑制率(%) = (对照组A值-实验组A值)/对照组A值, 杀伤率(%) = (起点A值-实验组A值)/起点A值.
1.2.5 细胞凋亡的比较: 将指数生长期细胞5×105个接种于90 mm培养皿, 100 mL/L胎牛血清RMPI 1640培养12 h, 加入配置好的瞬时转染液(脂质体:pCDNA3-CD = 30 L:6 g), 培养5 h, 换成200 mL/L胎牛血清RMPI 1640培养基培养12 h, 换成100 mL/L胎牛血清RMPI培养并加入5-FC(终浓度5 mmol/L), 分别取4、12、24、48 h四个时间点, 胰酶消化制成单细胞悬液, 取出0.1 mL用于Hochest33342染色镜下观察. 余下700 mL/L乙醇固定, RNA酶处理30 min后FACS检测细胞凋亡.
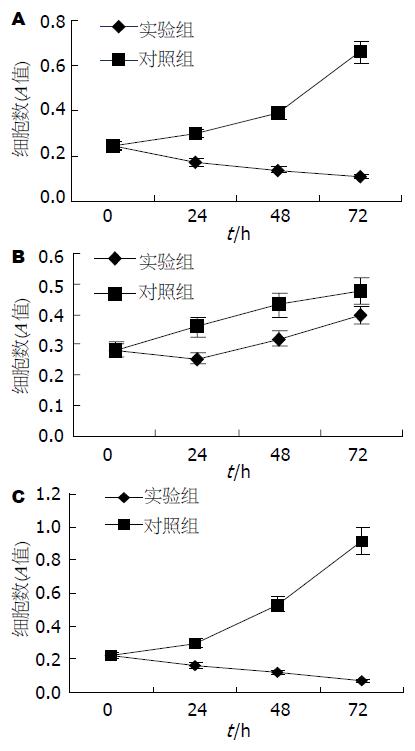
按MTT值绘制三种细胞的生长曲线图, 由各增长最快时间段计算BEL-7402、QBC、BXPC-3细胞的倍增时间 (计算公式: TD = t×log2/(logN-logN0)分别是: 34.48、64.94、26.29 h. BEL-7402和BXPC-3同QBC相比倍增时间差异有显著性意义(P<0.05), 而BEL-7402和BXPC-3之间差异没有显著性(图1).
阳离子脂质体介导的BEL-7402, QBC, BXPC-3的瞬时转染率分别为26.99%、2.2%、30.3%, BEL-7402和BXPC-3同QBC相比差异有显著性; 三种细胞裸质粒的转染率分别为0.22%、0.29%、0.18%, 三者差异没有显著性(图2). 这表明阳离子脂质体介导的转染同前面细胞的倍增时间有很好的相关性, 倍增时间快的细胞, 脂质体有更高的转染效率. 而裸质粒的转染则与这关系不大.
采用RT-PCR法检测, 设脂质体介导的不带CD基因的PCDNA3.1质粒为对照. 10 mL/L琼脂糖凝胶(80 V, 1 h)电泳检测. 结果显示CD基因表达很好(图3-4).
MTT法测细胞的相对数量. 红线为对照组细胞, 瞬时转染后不加入5-FC, 蓝线为实验组细胞, 加入5-FC(终浓度5 mmol/L), 均每组重复四孔. CD/5-FC对BEL-7402细胞的杀伤率72 h为55.08%, 对其生长的抑制率为83.24%; CD/5-FC对QBC细胞的杀伤率为10.02%, 对其生长的抑制率为16.97%, CD/5-FC对BXPC3的杀伤率72 h为68.14%, 生长抑制率为92.32%, 比较CD/5-FC对BEL-7402细胞、QBC、BXPC3的杀伤和抑制, BEL7402、BXPC3均和QBC有显著差异(P<0.05), 而BEL7402和BXPC3没有显著差异(P>0.05, 图5).
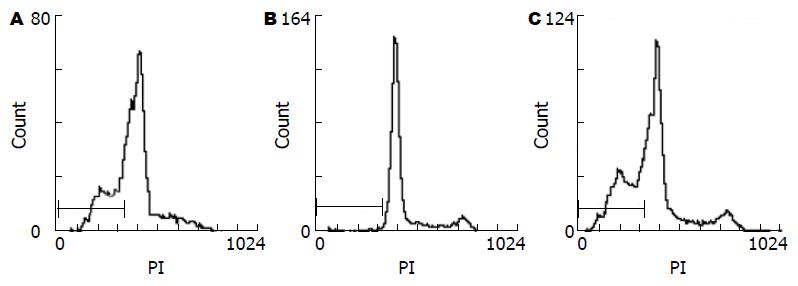
BEL-7402细胞凋亡高峰在48 h, 凋亡率为27.8%, QBC细胞凋亡高峰在48 h, 凋亡率为5.49%, BXPC3细胞凋亡高峰在24 h, 凋亡率为36.5%. 按4、12、24、48 h时间点BEL-7402凋亡率分别为: 4.88%, 7.27%. 19.8%和27.8%; QBC细胞凋亡率分别为: 2.82%, 3.98%, 3.55%, 5.44%和5.49%; BXPC3凋亡率分别为: 5.30%、8.82%、8.86%、36.5%和16.7%(图6).
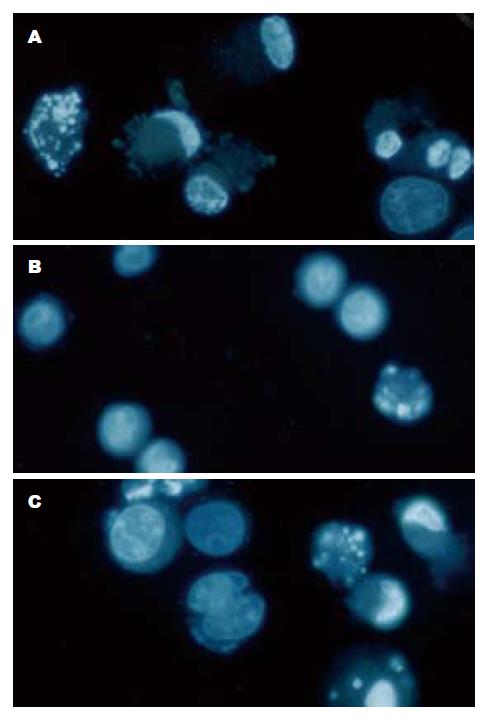
BEL7402凋亡染色可见有典型的凋亡出现, 且凋亡的细胞较多; QBE中凋亡细胞少. BXPC3中凋亡细胞较多(图7).
随着分子生物学技术的迅猛发展, 基因治疗迅速成为肿瘤治疗领域极有希望的一种治疗措施, 已成为包括肝癌、胰腺癌、胆管癌在内的肿瘤治疗研究领域的一大热点[10-12]. 基因治疗临床具体实现的方法之一就是利用载体在肿瘤所在的部位瞬时转染治疗基因, 本课题则就瞬时转染后的自杀基因治疗做一系列研究. 当前的转染载体都存在一个转染率低和安全的问题. 脂质体(liposome)以无毒、无免疫源性、使用方便、重复性好、能携带大片段DNA. 同时, 作为基因或核酸载体脂质体可以抵御核酸酶的水解, 延缓基因内含物的降解, 安全可靠等优点, 现已被美国癌症协会批准为临床基因治疗的首选方案,并且已有商品化的脂质体用于临床应用.
细胞分裂在阳离子脂质体介导的基因转染中有促进的作用[13], Mortimer et al[13]表明: 当SK-OV-3细胞aphidiodin处理, 同步化在G1期则不能被有效转染, 而当细胞重新通过细胞周期时, 特别是在使用阳离子转染试剂之后, 细胞即时已具有分裂活性, 则转染效率最高. Wilke et al[14]研究表明: 生长在无血清培养基中增殖受阻的LLC-PK1细胞, 当用Lipofectin进行转染时, 其转染效率低于生长在有血清的对照增殖细胞. 此外当NIH3T3细胞暴露于胸腺嘧啶中而被阻止在S期时, 不能被脂质体有效转染, 而当阻止剂被去掉, 细胞恢复通过细胞周期时, 则被转染的能力又恢复.
不同的细胞类型有着自己不同的细胞特性, 不同的细胞周期、生长曲线、倍增时间, 阳离子脂质体介导的转染效率可能有显著的差别, CD/5-FC自杀基因治疗的结果则有显著的差异. 在机体内一般细胞处于分裂期的细胞数小于20%. 通常肿瘤组织和那些生长旺盛的细胞分裂期的细胞比例较高, 这实际上就形成了一定的阳离子脂质体介导转染的定向导向性, 当脂质体介导CD/5-FC用于高度恶性肿瘤的基因治疗时, 阳离子脂质体定向的介导转染那些生长旺盛的恶性肿瘤组织细胞, 导致被CD/5-FC自杀基因体系定向杀伤, 且治疗效果较好, 而当用于低度恶性肿瘤的治疗时则效果不理想, 这有很重要的临床意义: 临床上, 高度恶性肿瘤细胞生长旺盛, 倍增时间短, 容易早期就有转移和远处的转移, 临床手术的效果不理想. 该项自杀基因研究表明: 高度恶性实体肿瘤的CD/5-FC治疗方法脂质体瞬时转染效率高、肿瘤抑杀效果好, 可能成为手术治疗的较好补充, 为提高该类疾病的治疗提出了新的思路; 而低度恶性肿瘤细胞生长周期长, 倍增时间要长, 转移及远处转移发生晚, 手术为治疗的首选, 且效果也比较好, 该类型脂质体转染效率差, 自杀基因疗法效果差, 且也无需基因治疗来作为补充.
CD/5-FC体系治疗肿瘤时可产生具有临床应用实际价值的BE[15-16], 即肿瘤细胞少量的转染可导致更多的肿瘤细胞被抑杀, 为高度恶性肿瘤细胞的"根治性抑杀"带来希望. 谭宇蕙 et al[17]构建的大鼠肝癌细胞HSV-tk/GCV自杀基因系统体外旁观者效应的研究中, 当转染率为5%-10%就已有较低的BE. 陈海金 et al[18]研究慢病毒介导的KDR启动子驱动CD/TK双自杀基因系统对大肠肿瘤细胞选择性杀伤作用, 观察到双自杀基因在体外的显著的BE. 张雷 et al[19]研究比较了CD/5-FC系统和HSV-tk/GCV系统对人胰腺癌细胞的疗效, 发现两者都有很好的抗肿瘤活性, 但前者BE要显著大于后者. 其良好的BE与以下一些机制有关: (1)细胞间缝隙连接(gap junctional intercellular communication, GJIC)介导的细胞毒性药物或(和)凋亡小体传递[20-23]. 多数学者认为GJIC是自杀基因表达产物前药代谢为细胞毒性产物5-FU的良好通道. Kuriyama et al和Huber et al认为CD/5-FC的BE是由于5-FC的代谢产物5-FU通过非易化扩散自由进出细胞, 并不仅仅依靠GJIC[[24-25]]. BE使靶细胞内基因表达产物通过GJIC传递到周围细胞, 在杀伤周围细胞同时延长了自杀基因的表达和其自身的存活时间, 这无疑增强了BE[26]. (2)激活免疫机制. 肿瘤细胞被自杀基因杀伤后, 其残余碎片含有肽类物质, 这些肽类物质被浸润的巨嗜细胞等抗原递呈细胞摄取加工, 然后递呈给CD4+ T淋巴细胞, 进而激活CD8+T淋巴细胞, 并使其增殖, 扩大其肿瘤杀伤作用及产生杀灭机体远处部位接种的肿瘤细胞. 具有弱免疫原性的靶细胞转入CD基因后, 能被5-FC抑杀, 而且能够产生免疫记忆, 故经5-FC抑杀后的肿瘤细胞可作为抗瘤疫苗[27-28]. CD/5-FC自杀基因体系良好的旁观者效益, 结合该脂质体介导瞬时转染肿瘤抑杀研究, 对高度恶性实体肿瘤的手术疗效不足可能可起到较好的补充. 拓展了新的思路.
许多研究表明自杀基因导致肿瘤细胞死亡以及旁观者效应可能的机制为细胞凋亡, 本实验研究表明, 凋亡是导致细胞死亡的可能途径之一. 目前在自杀基因的研究中, 针对驱动子选择性的双自杀基因的研究则成了该研究领域的热点. 如利用肿瘤特异性基因调控元件调控自杀基因表达, erbB-2, α-人乳白蛋白(hALA)启动子驱动自杀基因进行乳腺癌基因治疗, 甲胎蛋白(AFP)基因启动子用于肝癌自杀基因疗法, 癌胚抗原(CEA)基因启动子用于肠道肿瘤自杀基因疗法. 又如李强 et al[29]的研究表明: KDR启动子驱动双自杀基因靶向选择性地杀伤人胃癌SCG7901细胞, 并存在BE, 且较单自杀基因有更好的抑杀效果. Rogulski et al[30]实验表明转导CD/HSV-1TK融合基因的神经胶质瘤细胞易被杀灭, 该基因表达具有双重作用的融合蛋白(CDglyTK), 他导致的协同细胞毒作用是单用的2-3倍, 且可使表达细胞有更好的放射敏感性, 是单用CD/5-FC体系的2.44倍. Rogulski et al[31]的研究表明, 双自杀基因(CD-HSV-TK)治疗对大的肿瘤组织更加有效, 可使其体积减少99%, 显著降低肿瘤的压迫效应. 在刘国彦 et al[32]针对有免疫力动物的体内CD/5-FC实验研究中表明: 正常免疫力可有效增强CD/5-FC的旁观者效益, 且在配合使用γ-IFN条件下旁观者效益进一步增强. 将来脂质体介导瞬时转染下的特异性的启动子、多自杀基因联合及辅助免疫增强生物因子将很大的提高了自杀基因的应用前景, 对高度恶性实体肿瘤的治疗提供有效的帮助.
自杀基因又称化疗敏感基因, 化疗药物前体活化基因, 是存在于细菌或真菌中的一类基因, 哺乳动物体内缺乏. 他通过编码特异的酶而转化低毒的或无毒的前体药物为具有毒性的代谢产物而发挥很强的抗肿瘤活性.
沈柏用, 副教授,上海市交通大学医学院瑞金医院肝胆胰外科中心
CD/5-FC自杀基因体系杀伤效果好、旁观者效应显著, 目前逐渐成了研究的热点.
刘国彦 et al针对有免疫力动物的体内CD/5-FC实验研究中表明: 正常免疫力可有效增强CD/5-FC的旁观者效益, 且在配合使用γ-IFN条件下旁观者效益进一步增强.
脂质体介导瞬时转染下的特异性的启动子、多自杀基因联合及辅助免疫增强生物因子将很大的提高了自杀基因的应用前景, 对高度恶性实体肿瘤的治疗提供有效的帮助.
本研究选题符合该领域的研究热点, 设计科学、合理, 作者掌握了相关的实验基础理论和专门实验技术, 统计处理符合统计学方法, 结论可靠, 但讨论不够深入、全面, 若结合实验结果做出相关分析, 提出自己的见解则更好.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Gabel M, Kim JH, Kolozsvary A, Khil M, Freytag S. Selective in vivo radiosensitization by 5-fluorocytosine of human colorectal carcinoma cells transduced with the E. coli cytosine deaminase (CD) gene. Int J Radiat Oncol Biol Phys. 1998;41:883-887. [PubMed] [DOI] |
| 2. | Huber BE, Austin EA, Richards CA, Davis ST, Good SS. Metabolism of 5-fluorocytosine to 5-fluorouracil in human colorectal tumor cells transduced with the cytosine deaminase gene: significant antitumor effects when only a small percentage of tumor cells express cytosine deaminase. Proc Natl Acad Sci USA. 1994;91:8302-8306. [PubMed] [DOI] |
| 3. | Wasserman D, Geijer T, Sokolowski M, Rozanov V, Wasserman J. Nature and nurture in suicidal behavior, the role of genetics: some novel findings concerning personality traits and neural conduction. Physiol Behav. 2007;92:245-249. [PubMed] [DOI] |
| 4. | Bachvarov D, L'esperance S, Popa I, Bachvarova M, Plante M, Têtu B. Gene expression patterns of chemoresistant and chemosensitive serous epithelial ovarian tumors with possible predictive value in response to initial chemotherapy. Int J Oncol. 2006;29:919-933. [PubMed] |
| 5. | Aghi M, Hochberg F, Breakefield XO. Prodrug activation enzymes in cancer gene therapy. J Gene Med. 2000;2:148-164. [PubMed] [DOI] |
| 6. | Khalighinejad N, Hariri H, Behnamfar O, Yousefi A, Momeni A. Adenoviral gene therapy in gastric cancer: a review. World J Gastroenterol. 2008;14:180-184. [PubMed] [DOI] |
| 7. | Lü SQ, Liu YS, Yang H. [Effects of CD/5-FC suicide gene therapy system on human malignant glioma cells in vitro]. Zhongnan Daxue Xuebao Yixueban. 2004;29:174-176, 180. [PubMed] |
| 8. | Lv SQ, Yang H, He JQ, Wang B, Yoshimura I, Liu YS. Effects of CD/5-FC suicide gene therapy system on human malignant glioma cells in vitro. Shengwu Huaxue Yu Shengwu Wuli Xuebao (Shanghai). 2003;35:430-434. [PubMed] |
| 9. | Ballarini F, Alloni D, Facoetti A, Mairani A, Nano R, Ottolenghi A. Modelling radiation-induced bystander effect and cellular communication. Radiat Prot Dosimetry. 2006;122:244-251. [PubMed] [DOI] |
| 10. | Bochner BH. Gene therapy in bladder cancer. Curr Opin Urol. 2008;18:519-523. [PubMed] |
| 11. | Russ V, Wagner E. Cell and tissue targeting of nucleic acids for cancer gene therapy. Pharm Res. 2007;24:1047-1057. [PubMed] [DOI] |
| 12. | Takahashi S, Sugimoto Y. [Gene therapy for breast cancer]. Nippon Rinsho. 2007;65 Suppl 6:135-141. [PubMed] |
| 13. | Mortimer I, Tam P, MacLachlan I, Graham RW, Saravolac EG, Joshi PB. Cationic lipid-mediated transfection of cells in culture requires mitotic activity. Gene Ther. 1999;6:403-411. [PubMed] [DOI] |
| 14. | Wilke M, Fortunati E, van den Broek M, Hoogeveen AT, Scholte BJ. Efficacy of a peptide-based gene delivery system depends on mitotic activity. Gene Ther. 1996;3:1133-1142. [PubMed] |
| 15. | Moolten FL. Tumor chemosensitivity conferred by inserted herpes thymidine kinase genes: paradigm for a prospective cancer control strategy. Cancer Res. 1986;46:5276-5281. [PubMed] |
| 16. | Mullen CA. Metabolic suicide genes in gene therapy. Pharmacol Ther. 1994;63:199-207. [PubMed] [DOI] |
| 17. | 谭 宇蕙, 吴 映雅, 杜 标炎, 胡 岳山, 赵 鹏, 李 杰芬. 大鼠肝癌细胞HSV-tk/GCV自杀基因系统的构建及其旁观者效应. 世界华人消化杂志. 2005;13:2069-2073. [DOI] |
| 20. | Deonarain MP, Epenetos AA. Targeting enzymes for cancer therapy: old enzymes in new roles. Br J Cancer. 1994;70:786-794. [PubMed] |
| 21. | Dilber MS, Abedi MR, Christensson B, Björkstrand B, Kidder GM, Naus CC, Gahrton G, Smith CI. Gap junctions promote the bystander effect of herpes simplex virus thymidine kinase in vivo. Cancer Res. 1997;57:1523-1528. [PubMed] |
| 22. | Ishii-Morita H, Agbaria R, Mullen CA, Hirano H, Koeplin DA, Ram Z, Oldfield EH, Johns DG, Blaese RM. Mechanism of 'bystander effect' killing in the herpes simplex thymidine kinase gene therapy model of cancer treatment. Gene Ther. 1997;4:244-251. [PubMed] [DOI] |
| 23. | Mesnil M, Piccoli C, Tiraby G, Willecke K, Yamasaki H. Bystander killing of cancer cells by herpes simplex virus thymidine kinase gene is mediated by connexins. Proc Natl Acad Sci USA. 1996;93:1831-1835. [PubMed] [DOI] |
| 24. | Kuriyama S, Masui K, Sakamoto T, Nakatani T, Kikukawa M, Tsujinoue H, Mitoro A, Yamazaki M, Yoshiji H, Fukui H. Bystander effect caused by cytosine deaminase gene and 5-fluorocytosine in vitro is substantially mediated by generated 5-fluorouracil. Anticancer Res. 1998;18:3399-3406. [PubMed] |
| 25. | Huber BE, Austin EA, Good SS, Knick VC, Tibbels S, Richards CA. In vivo antitumor activity of 5-fluorocytosine on human colorectal carcinoma cells genetically modified to express cytosine deaminase. Cancer Res. 1993;53:4619-4626. [PubMed] |
| 26. | Wygoda MR, Wilson MR, Davis MA, Trosko JE, Rehemtulla A, Lawrence TS. Protection of herpes simplex virus thymidine kinase-transduced cells from ganciclovir-mediated cytotoxicity by bystander cells: the Good Samaritan effect. Cancer Res. 1997;57:1699-1703. [PubMed] |
| 27. | Mullen CA, Coale MM, Lowe R, Blaese RM. Tumors expressing the cytosine deaminase suicide gene can be eliminated in vivo with 5-fluorocytosine and induce protective immunity to wild type tumor. Cancer Res. 1994;54:1503-1506. [PubMed] |
| 28. | Nielsen CS, Moorman DW, Levy JP, Link CJ Jr. Herpes simplex thymidine kinase gene transfer is required for complete regression of murine colon adenocarcinoma. Am Surg. 1997;63:617-620. [PubMed] |
| 30. | Rogulski KR, Kim JH, Kim SH, Freytag SO. Glioma cells transduced with an Escherichia coli CD/HSV-1 TK fusion gene exhibit enhanced metabolic suicide and radiosensitivity. Hum Gene Ther. 1997;8:73-85. [PubMed] [DOI] |
| 31. | Rogulski KR, Zhang K, Kolozsvary A, Kim JH, Freytag SO. Pronounced antitumor effects and tumor radiosensitization of double suicide gene therapy. Clin Cancer Res. 1997;3:2081-2088. [PubMed] |