修回日期: 2008-11-03
接受日期: 2008-11-10
在线出版日期: 2008-12-18
目的: 研究短发夹RNA(short hairpin RNA, shRNA)对人胰腺癌细胞PANC-1中突变型K-ras基因表达的抑制作用.
方法: 构建特异性针对胰腺癌PANC-1细胞突变型K-ras基因的重组质粒pGensil-1-P1, 阴性对照质粒pGensil-1-HK并采用脂质体介导的方法转染胰腺癌细胞. 应用逆转录聚合酶链反应(RT-PCR)和蛋白免疫印迹(Western blot)检测K-ras基因mRNA和蛋白的表达, CCK-8方法测量细胞生长曲线. 并建立人胰腺癌细胞PANC-1裸鼠皮下移植瘤模型, 分别注射Pgenesil-1-P1、Pgenesil-1-HK质粒, 动态观察并处死裸鼠计算肿瘤体积.
结果: 测序证实质粒表达载体构建成功, 短发夹RNA(shRNA)使胰腺癌细胞PANC-1突变型K-ras基因的mRNA较未治疗组、阴性对照组相比明显减少(P = 0.01); 未治疗组、阴性对照组及治疗组的K-ras蛋白表达率分别为100%, 99.0%±0.73%, 39.9%±2.1%, 前两组K-ras蛋白表达差异无统计学意义, 治疗组较未治疗组K-ras蛋白表达下调了约60.1%; 细胞生长受到明显抑制(P = 0.02); 经重组质粒治疗14 d后, 裸鼠皮下移植瘤生长缓慢, 相较于对照组瘤体明显缩小(P = 0.03).
结论: shRNA对特异性转染组的胰腺癌细胞的突变K-ras基因表达有抑制作用, 使细胞以及裸鼠移植瘤的生长受到抑制.
引文著录: 李冬斌, 郑志刚, 许香梅, 郭华, 赵雪莲, 黄林凤, 蔡建辉. 短发夹RNA对胰腺癌细胞PANC-1突变型K-ras基因表达的影响. 世界华人消化杂志 2008; 16(35): 3941-3945
Revised: November 3, 2008
Accepted: November 10, 2008
Published online: December 18, 2008
AIM: To study the specific inhibitory effect of short hairpin RNA (shRNA) on the mutant K-ras gene expression in PANC-1 cells.
METHODS: Plasmid pGensil-1 recombinant plasmids targeting mutant K-ras gene was established. After transfection into PANC-1 cells, the expression of K-ras gene was detected using RT-PCR, Western blot techniques, and the effect of cell proliferation was determined by CCK-8 test. And a tumor model of nude mouse was constructed through rejecting the recombination plasmids to observe the volume of tumor.
RESULTS: The recombinant plasmid encoding mutant-specific shRNA for K-ras inhibited the expression of mutant K-ras significantly (P = 0.01). Rates of K-ras protein expression in non-treatment group, negative control group and treatment group were 100%, 99.0% ± 0.73%, 39.9% ± 2.1%, respectively. No significant difference in K-ras protein expression was observed between non-treatment group and negative control group. A 60.1% reduction in K-ras protein expression from the treatment group to non-treatment group indicated that cell growth was significantly inhibited (P = 0.02); and after fourteen day's recombinant plasmid treatment, the volume of tumor grew slowly in nude mice and was significantly decreased compared with the control group (P = 0.03).
CONCLUSION: The specific shRNA inhibits the K-ras expression efficiently, and the growth of cells and nude mice is inhibited.
- Citation: Li DB, Zheng ZG, Xu XM, Guo H, Zhao XL, Huang LF, Cai JH. Effect of short hairpin RNA on K-ras expression in human pancreatic cancer cell line. Shijie Huaren Xiaohua Zazhi 2008; 16(35): 3941-3945
- URL: https://www.wjgnet.com/1009-3079/full/v16/i35/3941.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i35.3941
胰腺癌(pancreatic carcinoma)是严重危害人类生命健康的恶性肿瘤之一, 其恶性程度极高而且发病隐匿, 难以早期诊断和治疗, 预后极差. 在所有参与胰腺癌发生、发展的基因中, 与其最为密切的是K-ras基因. K-ras基因在胰腺癌中的突变率平均在80%左右, 其中以12位密码子突变最为常见. 第12位密码子的点突变以GAT(46%), GTT(32%)和CGT(13%)三种形式最为多见[1]. Ras基因定位于11q13, 其基因家族包括H-ras、K-ras和N-ras. 其编码的蛋白是位于细胞膜上的鸟苷酸结合蛋白, 负责将外部信号转导到细胞内部. 有研究表明抑制突变K-ras的表达, 可有效抑制胰腺癌细胞的生长[2-3]. RNA干扰(RNA interference, RNAi)技术是一项近年来发现的抑制基因表达的新技术, 由于其具有特异性强、效率高等优点而成为在肿瘤研究中的热点. 本实验构建针对胰腺癌细胞PANC-1突变型K-ras基因的质粒载体, 建立裸鼠皮下移植瘤模型, 在体外及体内水平观察RNA干扰作用于K-ras基因突变型胰腺癌的治疗效果, 为胰腺癌的基因治疗寻找新的途径.
人胰腺癌细胞株PANC-1(K-ras第12位密码子突变形式为GAT)购自中科院上海细胞库. Pgenesi-l质粒购自武汉晶赛公司, 质粒中量抽提纯化的试剂盒购自Promerga公司. 小牛血清购自杭州四季青生物有限公司, DMEM培养基购自美国Gibco公司. TRIzol及LipofectamineTM 2000转染试剂盒均购自Invitrogen公司. cDNA第一链反应试剂盒购自Fermentas公司, PCR引物序列由上海生工生物公司合成. K-ras小鼠mAb购自Abcam公司, Actin小鼠多克隆抗体. 辣根过氧化酶标记的羊抗鼠二抗购自北京中杉金桥生物技术有限公司, 细胞裂解液购自华瑞公司. 主要实验仪器: 日本Olympus倒置显微镜; 二氧化碳细胞培养箱, 日本Sanyo公司; 超净工作台, 苏州安泰公司; HITACHI HIMAC低温离心机; 电泳仪, 双垂直电泳槽, 水平电泳槽, 北京六一仪器厂; GIS凝胶图像处理系统, 上海天能科技公司; 紫外线分光光度计, 山东高密分析仪器厂; PCR扩增仪, 美国Thermo Hybaid公司.
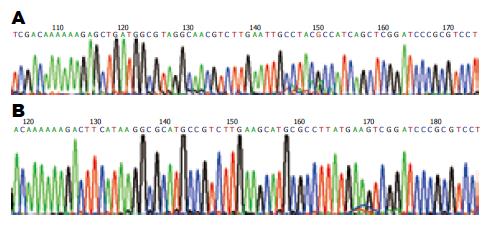
1.2.1 质粒载体的构建, 扩增和纯化: 根据GenBank数据库提供的已知K-ras基因[GI: 20147726]的序列, 在29-48 bp位点, 选择一段19个碱基的核苷酸片段, 把第12位密码子的GGT换成GAT作为靶序列, 经Blast同源序列分析软件证实与人类其他基因无同源性. 人工合成一对针对PANC-1细胞K-ras基因的特异性shRNA的DNA插入片段. 构建治疗组重组质粒载体pGensil-1-P1以及阴性对照组质粒pGensil-1-HK. pGensil-1-P1质粒序列: 5'-gatccGAGCTGATGGCGTAGGCAAttcaagacgTTGCCTACGCCATCAGCTCttttttgtcgaca-3', 3'-gCTCGACTACCGCATCCGTTaagttctgcAACGGATGCGGTAGTCGAGaaaaaacagctgttcga-5. 阴性对照组Pgenesil-1-hk质粒不针对任何mRNA 序列, pGensil-1-hk质粒序列: 5'-gatccGACTTCATAAGGCGCATGCttcaagacgGCATGCGCCTTATGAAGTCttttttgtcgaca-3', 3'-gCTGAAGTATTCCGCGTACGaagttctgcCGTACGCGGAATACTTCAGaaaaaacagctgttcga-5'将重组质粒以常规方法转化感受态大肠杆菌DH5α后, 在含有卡那霉素的LB固体培养皿里培养, 12 h后, 挑取单克隆摇菌, 重组质粒经测序证实. 两种重组质粒的扩增及纯化, 参照Promega质粒中量抽提纯化试剂盒中的说明书进行.
1.2.2 细胞的培养和转染: 人胰腺癌细胞株PANC-1(K-ras第12位密码子突变形式为GAT)和Miapaca-2细胞, 用含100 mL/L小牛血清的DMEM培养基, 置于50 mL/L CO2, 37 ℃条件下培养, 当细胞生长至80%融合时传代. 转染前1天, 将细胞置于无抗生素的培养基中, 当细胞融合达90%-95%时按LipofectamineTM 2000转染试剂盒的说明书进行转染.
1.2.3 RT-PCR方法检测K-ras mRNA的表达: 按cDNA第一链反应试剂盒说明书采用随机引物法合成cDNA. 用β-action作为内参照进行PCR扩增. 提取的总RNA通过紫外分光光度计法, 进行定量, 并调整RNA浓度, 按照cDNA第一链反应试剂盒说明, 加入各种试剂后, 用PCR仪以Oligo引物为引物合成cDNA第一链. 以β-action为内参进行PCR. K-ras引物上游为: 5'-AGAGTGCCTTGACGATACAGC-3', 下游: 5'-ACAAAGAAAGCCCTCCCCAGT-3', 扩增长度为198 bp. β-actin引物, 上游: 5'-AGCGGGAAATCGTGCGTGAC-3', 下游: 5'-TGGAAGGTGGACAGCGAGGC-3', 扩增长度为445 bp. PCR反应条件: 94 ℃ 5 min变性; 94 ℃ 1 min, 59 ℃ 1 min, 72 ℃ 30 s, 30个循环; 72 ℃延伸5 min. 反应产物于20 g/L琼脂糖凝胶中电泳, 电压100 V, 45 min, 并用Gel 1D凝胶图像分析系统分析其光密度.
1.2.4 Western blot检测K-ras蛋白的表达: 转染48 h后, 用细胞裂解液提取胞质蛋白, 总胞质蛋白用考马斯亮蓝试剂盒定量. 根据测定的蛋白样品的实际浓度, 按每个加样孔120 μg的上样量计算各组样品的实际上样量, SDS-PAGE凝胶电泳分离蛋白后, 100 V转膜60 min, 凝胶上的蛋白转移至PVDF膜; 50 g/L脱脂奶粉封闭1 h, 按1:200加入K-ras一抗, 37 ℃孵育2 h, 封闭液漂洗3次, 每次5 min. 按1:2500加入辣根过氧化物酶标及的二抗, 37 ℃孵育1 h, PBST缓冲液漂洗3次, 每次5 min. 化学发光法显影于胶片上. Gel 1D凝胶图像分析系统分析其光密度.
1.2.5 测定细胞生长曲线: 细胞转染后, 以1×107/L接种于96孔板, 每孔100 μL, 自转染当天开始, 每天取3孔细胞应用CCK-8法检测各孔吸光度值, 绘制细胞生长曲线.
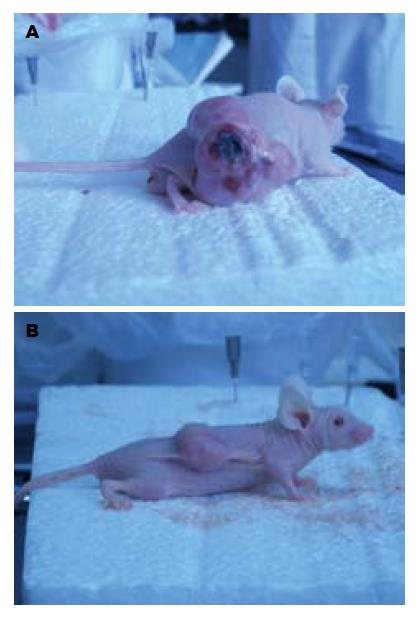
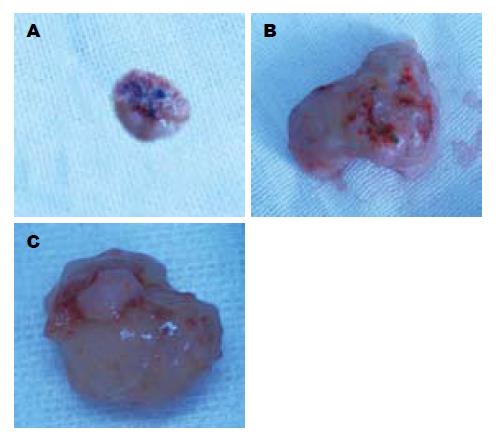
1.2.6 裸鼠皮下移植瘤实验: 将裸鼠置于SPF级环境中饲养1 wk以适应环境, 将PANC-1细胞浓度调整为4×106/0.2 mL, 选取裸鼠颈部背侧皮肤为接种点, 每次接种0.2 mL. 定期测量肿瘤的长径和短径, 计算肿瘤体积 = 0.5×长径×短径2. 待肿瘤体积长至40-50 mm3时将裸鼠随机分为3组, 每组5只, 治疗组和阴性对照组分别注射pGensil-1-P1、pGensil-1-HK质粒, 每次50 μg, 隔日1次, 共7次, 未治疗组不予干预. 14 d后处死, 剥离皮下肿瘤并用游标卡尺测量肿瘤体积.
统计学处理 数据用mean±SD表示, 采用SPSS13.0统计软件行t检验.
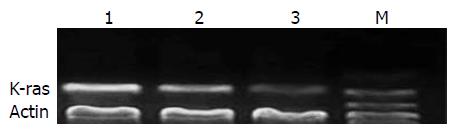
RT-PCR扩增产物琼脂糖凝胶电泳结果显示, 治疗组细胞的K-ras基因mRNA表达较阴性对照组和未治疗组的K-ras基因mRNA表达明显下降, 差异有统计学意义(P = 0.01<0.05, 图2).
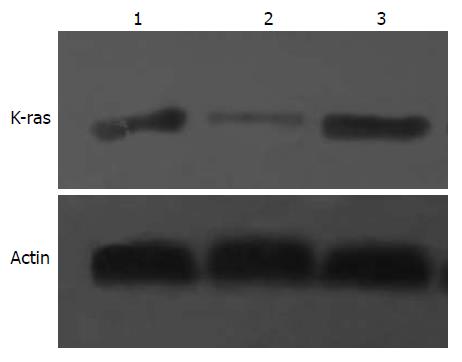
Western blot结果显示, 其中1为未治疗组K-ras蛋白的表达, 2和3分别为治疗组及阴性对照组的K-ras蛋白的表达. 蛋白表达率分别为100%、39.9%±2.1%, 99.0%±0.73%. 统计分析结果表明, 1、3中K-ras蛋白的表达差异无统计学意义; 2较1中K-ras蛋白表达下调了约60.1%(图3).
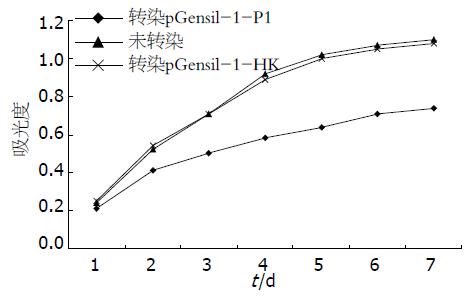
CCK-8所测细胞生长曲线显示特异性转染组较未转染组和阴性对照转染组相比细胞生长受到抑制, 差异有统计学意义(P = 0.02<0.05, 图4).
胰腺癌是常见严重危害人类生命健康的恶性肿瘤, 是死亡率最高的人类恶性肿瘤之一, 近年来发病率逐年上升. RNAi是由双链RNA分子介导的序列特异性转录后基因沉默现象(post transcriptional gene silencing, PTGS)[4]. RNAi作为一种新的、强有力的研究工具, 具有快速、有效、序列特异性强等优点, 在某种程度上可以替代传统的反义核酸技术和基因敲除技术. 研究发现RNAi 抑制目的基因的作用强于反义寡核苷酸[5].
近年来RNAi技术已逐渐应用于肿瘤的基因治疗研究[6-9], 并已取得初步效果. 肿瘤的形成是一个多阶段多步骤的发生过程, 是细胞内多种基因突变累积的结果. 胰腺癌是人类常见的恶性肿瘤, 自1992年Cerny et al[10]发现在胰腺癌的早期就有K-ras的突变后, 掀起了人们对胰腺癌基因治疗研究的热潮. Brummelkamp et al[2]最先用逆转录病毒介导的RNAi技术抑制了第12位密码子突变形式为GTT的胰腺癌突变型K-ras基因, 未发现对野生型K-ras的影响. 随后, Chen et al[11]和Fleming et al[12]也用RNAi技术特异地抑制了K-ras基因的表达.
多数学者认为, 抑制细胞生长的机制是诱导细胞凋亡或阻滞细胞周期. 但也有少数结果显示单纯阻断突变型K-ras基因的表达并不能有效诱导细胞凋亡, 因此, RNAi作用于胰腺癌K-ras基因的确切的机制尚需进一步研究. 另外我们目前对基因功能复杂性的认识仍然不够, 尤其对外源基因表达的时空性的控制很难准确操纵, 当一些蛋白的表达受抑制时, 为维持正常代谢功能, 其他相关补偿途径可能被激活. RNAi效应分子对基因的抑制率一般也很难达到100%. 因此RNAi虽然具有特异性好, 效率高等优点, 但在临床应用中仍然具有一定的风险, 尚需进一步继续研究.
本研究利用RNAi技术, 采用pGensil-1质粒构建重组质粒载体, 并成功转导入人胰腺癌细胞株PANC-1, 通过RT-PCR、Western blot方法验证了含shRNA的重组质粒载体可有效抑制人胰腺癌细胞中突变型K-ras基因的表达, CCK-8法示可明显抑制细胞的增殖, 而且将重组的pGensil-1-P1质粒注射到荷瘤裸鼠的瘤体内后可以减缓瘤体增长速度, 呈现明显的抑瘤效应. 因此我们可以认为以突变型K-ras基因为靶点, 利用RNAi技术治疗肿瘤可望成为一种有效的基因治疗方法.
胰腺癌是严重危害人类生命健康的恶性肿瘤之一, 其恶性程度极高, 难以早期诊断和治疗, 预后极差. 除早期手术外, 尚无其他有效治疗措施. 随着分子生物学的发展, RNA干扰作为一种新的高效抑制特定基因表达的技术, 成为基因治疗领域的强有力的工具, 因此基于RNA干扰技术的基因治疗方法成为攻克胰腺癌新的希望.
何裕隆, 教授, 中山大学附属第一医院胃肠胰腺外科
K-ras基因在胰腺癌中的点突变率平均在80%左右, 其中大于98%的突变形式是第12位密码子的点突变, 抑制突变的K-ras基因的表达成为胰腺癌基因治疗的热点. 基于RNA干扰技术的基因治疗方法能否抑制胰腺癌细胞的生长成为本研究的重点.
RNA干扰技术以原癌基因或突变的抑癌基因为靶点, 可以恢复肿瘤细胞的正常基因调控, 基因表达降低, 癌细胞生长受抑制, 从而达到治疗的目的. 基于RNA干扰技术的基因治疗方法在前列腺癌、乳腺癌、结肠癌等以及在抵抗病毒感染的试验中被证明是有效的.
本文在体内及体外水平观察以质粒作为载体的短发夹RNA转染到胰腺癌细胞后其突变型K-ras基因mRNA及其蛋白的表达均减少, 对于胰腺癌细胞生长以及对裸鼠移植瘤生长具有明显的抑制的作用.
本文选题是医学目前仍难以攻克的恶性肿瘤治疗的基础研究, RNA干扰技术也是近年来研究的热点. 虽内容上创新性稍嫌不足, 参考文献较旧, 但实验方法、结果和统计分析过程均较为严谨, 可重复性较高, 因此结论可靠.
编辑: 史景红 电编: 何基才
| 1. | Howe JR, Conlon KC. The molecular genetics of pancreatic cancer. Surg Oncol. 1997;6:1-18. [PubMed] [DOI] |
| 2. | Brummelkamp TR, Bernards R, Agami R. Stable suppression of tumorigenicity by virus-mediated RNA interference. Cancer Cell. 2002;2:243-247. [PubMed] [DOI] |
| 3. | Shen YM, Yang XC, Yang C, Shen JK. Enhanced therapeutic effects for human pancreatic cancer by application K-ras and IGF-IR antisense oligodeoxynucleotides. World J Gastroenterol. 2008;14:5176-5185. [PubMed] [DOI] |
| 5. | Aoki Y, Cioca DP, Oidaira H, Kamiya J, Kiyosawa K. RNA interference may be more potent than antisense RNA in human cancer cell lines. Clin Exp Pharmacol Physiol. 2003;30:96-102. [PubMed] [DOI] |
| 6. | Wang S, Chai YB, Liu F, Zhang XY, Jia W, Xie X, Yu WQ, Shang ZC, Jin BQ, Sun BZ. [Effect of specific siRNA targeting against bcr-abl chimeric gene on chronic myelogenous leukemia cells]. Zhonghua Yixue Zazhi. 2005;85:198-202. [PubMed] [DOI] |
| 7. | Wilda M, Fuchs U, Wössmann W, Borkhardt A. Killing of leukemic cells with a BCR/ABL fusion gene by RNA interference (RNAi). Oncogene. 2002;21:5716-5724. [PubMed] [DOI] |
| 8. | Wang YH, Liu S, Zhang G, Zhou CQ, Zhu HX, Zhou XB, Quan LP, Bai JF, Xu NZ. Knockdown of c-Myc expression by RNAi inhibits MCF-7 breast tumor cells growth in vitro and in vivo. Breast Cancer Res. 2005;7:R220-R228. [PubMed] [DOI] |
| 9. | Zhao H, Ardelt B, Ardelt W, Shogen K, Darzynkiewicz Z. The cytotoxic ribonuclease onconase targets RNA interference (siRNA). Cell Cycle. 2008;7:3258-3261. [PubMed] |
| 10. | Cerny WL, Mangold KA, Scarpelli DG. K-ras mutation is an early event in pancreatic duct carcinogenesis in the Syrian golden hamster. Cancer Res. 1992;52:4507-4513. [PubMed] |
| 11. | Chen LM, Le HY, Qin RY, Kumar M, Du ZY, Xia RJ, Deng J. Reversal of the phenotype by K-rasval12 silencing mediated by adenovirus-delivered siRNA in human pancreatic cancer cell line Panc-1. World J Gastroenterol. 2005;11:831-838. [PubMed] |
| 12. | Fleming JB, Shen GL, Holloway SE, Davis M, Brekken RA. Molecular consequences of silencing mutant K-ras in pancreatic cancer cells: justification for K-ras-directed therapy. Mol Cancer Res. 2005;3:413-423. [PubMed] [DOI] |