修回日期: 2008-10-26
接受日期: 2008-10-27
在线出版日期: 2008-12-08
目的: 用纳米磁珠与基质辅助激光解析离子化飞行时间质谱(MALDI-TOF-MS)技术检测脂肪肝患者血清蛋白质组, 筛选候选标志物并建立诊断模型, 初步探讨所建立的诊断模型在脂肪肝早期诊断中的临床意义.
方法: 95例中度和76例轻度脂肪肝患者均经B超证实, 99名健康人血清. 用WCX(弱阳离子交换型)纳米磁珠检测各血清标本获得血清蛋白指纹图谱. 用Biomarker Wizard软件分析所获得的蛋白图谱找出差异蛋白, 再用Biomarker Patterns建立诊断模型. 扩大样本量, 通过盲法分析进一步验证诊断模型的可靠性.
结果: 初始建模时, 建立了由m/z为7626.2、24147.7、6118.2 这3个差异蛋白峰组成的中度脂肪肝诊断模型, 其敏感性为90.2%, 特异性为93.9%. 扩大样本盲法验证的敏感性为90.9%, 特异性为92.0%. 另选取了m/z为7626.2、3286.0、2760.7、2543.1、2746.1这5个差异蛋白峰组成的模型, 能把轻度从中度脂肪肝患者中区分出来; 选取m/z为7626.2、11721.0、24141.7、8529.1、9042.7这5个差异蛋白峰组成的模型, 能将轻度脂肪肝患者从健康对照中区分出来.
结论: 蛋白质组学技术可筛选出有意义的血清生物标志差异蛋白. 由三个差异表达蛋白及其特定组合构成的诊断模型可以区分中度脂肪肝患者与健康人, 由五个特定组合构成的差异表达蛋白的模型能区分轻度、中度脂肪肝患者及区分轻度脂肪肝患者与健康对照.
引文著录: 颜怀军, 陈兆军, 曾强, 陈春, 张腊红, 李宁, 许洋. 应用蛋白质组学技术对脂肪肝患者血清标志物的筛选. 世界华人消化杂志 2008; 16(34): 3904-3909
Revised: October 26, 2008
Accepted: October 27, 2008
Published online: December 8, 2008
AIM: To analyze the serum proteomic pattern of the fatty liver disease (FLD) patients, to build a diagnostic model and to evaluate its clinic significance using magnetic bead and MALDI-TOF-MS.
METHODS: WCX magnetic bead and MALDI-TOF-MS were used to detect the serum proteomic patterns of 95 modest FLD patients, 76 mild FLD patients and 99 healthy persons (HP). Biomarker Wizard software was used to analyze protein peaks for significant difference. The model was then built by Biomarker Patterns Software and was further evaluated in blind test for reliability.
RESULTS: A diagnostic pattern for modest FLD from HP using m/z 7626.2, 24147.7, 6118.2 was established with 90.2% sensitivity and 93.9% specificity. A sensitivity of 90.9% and a specificity of 92.0% in blind test were obtained. One diagnostic pattern using m/z 7626.2, 3286.0, 2760.7, 2543.1, 2746.1 was established to differentiate mild from modest FLD; the other diagnostic pattern using m/z 7626.2, 11721.0, 24141.7, 8529.1, 9042.7 was established to differentiate mild FLD from HP.
CONCLUSION: Proteomic technology can significantly identify novel significant biomarkers in the serum. The diagnostic pattern consisting of three differential protein peaks can discriminate the modest FLD from HP. The diagnostic pattern consisting of five specific differential protein peaks can differentiate mild from modest FLD as well as mild FLD from HP.
- Citation: Yan HJ, Chen ZJ, Zeng Q, Chen C, Zhang LH, Li N, Xu Y. Screening serum biomarkers of fatty liver disease using proteomic technology. Shijie Huaren Xiaohua Zazhi 2008; 16(34): 3904-3909
- URL: https://www.wjgnet.com/1009-3079/full/v16/i34/3904.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i34.3904
脂肪性肝病(fatty liver disease, FLD), 简称脂肪肝, 是遗传-环境-代谢应激相关性疾病, 疾病谱包括单纯性脂肪肝、脂肪性肝炎以及脂肪性肝硬化, 而根据病因则分为酒精性肝病(alcoholic liver disease)和非酒精性脂肪性肝病(nonalcoholic fatty liver disease)两大类. 随着饮食结构的改变, 我国脂肪肝的发病率呈逐年升高趋势. 脂肪肝是最常见的弥漫性肝病, 常缺乏特异的临床表现, 其发病机制至今不明, 极少数可发展成肝硬化. 如果早期诊断、早期治疗, 可以阻止脂肪肝的进一步发展, 甚至使其逆转. 脂肪肝是指由于各种原因引起的肝细胞内脂肪堆积过多的病变. 正常肝内脂肪占肝质量的3%-4%, 如果脂肪含量超过肝质量的5%即为脂肪肝, 严重者脂肪量可达40%-50%, 脂肪肝的脂类主要是甘油三酯. 传统的血液生化检查, 影像学检查, 肝活检等方法可以对大部分的脂肪肝做出诊断, 但是都各有其局限性. 血生化检查对脂肪肝的诊断没有特异性. 影像学检查中的B超作为脂肪肝的首选诊断方法, 但是因脂肪变肝细胞达30%时B超才可发现脂肪肝, 其灵敏度和特异性亦有待提高; 超声引导下肝穿刺活检组织细胞学检查可以确诊脂肪肝, 但是因肝活检有创伤性, 患者难以接受, 应用范围也受限. 脂肪肝的早期诊断目前仍旧没有发现理想的标志物[1-4].
本研究应用纳米磁珠结合基质辅助激光解析离子化飞行时间质谱(MALDI-TOF-MS)技术, 分析脂肪肝患者与正常健康对照的血清在蛋白质组上的差异. 建立了由7626.2, 24147.7, 6118.2质荷比(蛋白质质量和电荷比值, 简称质荷比, m/z)等3个差异蛋白峰组成的脂肪肝诊断模型, 初步探讨蛋白指纹图谱技术在脂肪肝早期诊断中的应用价值. 此诊断模型的敏感性为90.2%, 特异性为93.9%. 扩大样本盲法验证的敏感性为90.9%, 特异性为92.0%; 且可以区分轻、中度脂肪肝患者及区分轻度患者与健康对照. 此诊断模型可以作为另一种辅助脂肪肝诊断的好方法.
本研究共纳入2006-08/2008-05在中国人民解放军南京军区杭州疗养院空勤区和杭州市第二人民医院的体检者并接受腹部超声检查患者的血清样本共计270例. 本研究设计通过我院临床研究伦理委员会的批准, 符合伦理学标准要求. 所有受试对象均为在入选前由专业人员详细告知研究详细内容后自愿加入本研究, 并签署知情同意书. 乙腈、三氟乙酸、SPA、尿素、DTT、CHAPS、Tris-HCL、dH2O等购自Sigma公司. MALDI-TOF-MS(PBSⅡc)为Ciphergen公司产品. 弱阳离子交换型(WCX)纳米磁珠, 结合缓冲液, 洗脱液等为北京赛尔迪生物医药科技有限公司产品[5].
1.2.1 样品收集与预处理: 质谱的标准化质控血清制备定义符合如下标准, 供血者男女各半, 血型为O型; 年龄为18-30岁[5]. 患者外周血采集后立即放入4 ℃冰箱静置. 1-2 h内, 4 ℃ 4000 r/min离心5 min, 分离血清后, 4 ℃ 14000 r/min再离心5 min, 去除所有残留细胞碎片. 在冰上将血清转移到新的离心管中, 放入-80 ℃冰箱分装保存, 限冻融一次. 使用前取出血清样品, 冰上融化. 在标记好的1.5 mL离心管中依次加入20 μL 9 mol/L缓冲液(9 mol/L Urea, 2% CHAPS, 50 mmol/L Tris-HCl, 1% DTT, pH 9.0), 和10 μL血清样品, 并将样品混匀. 稀释好的样品室温静置10 min, 然后再加入360 μL结合缓冲液混匀[5].
1.2.2 纳米磁珠预处理、上样和洗脱: 将WCX纳米磁珠分装到PCR管, 置于磁性处理器上, 吸取液体. 再依次加入100 μL结合缓冲液, 混匀后放置5 min, 然后把PCR管置于磁性处理器上, 吸取液体, 重复上述操作一次. 向每个装有纳米磁珠的PCR管中加入100 μL稀释好的血清样品, 混匀后室温放置15 min. 将PCR管置于磁性处理器上, 吸去未结合样品. 每管加入100 μL结合缓冲液, 混匀后放置5 min, 然后把PCR管置于磁性处理器上, 吸取液体, 重复上述操作一次. 然后, 每管加入10 μL洗脱液混匀, 放置5 min后置于磁性处理器上. 取5 μL上清液移到另一个PCR管中, 加入5 μL SPA(Sinapinic acid)饱和溶液充分混匀, 吸取1 μL点样到Au芯片上, 待干后放入仪器读取[5].
1.2.3 芯片检测、数据采集和参数设置: 采用PBSⅡc质谱仪读取芯片信息, 用加有All-in-one标准蛋白质的NP20芯片校正仪器, 使分子质量的误差范围至0.1%内. 用血清中的内标峰4091.1或6634.0 m/z校正原始数据中的蛋白指纹图谱, 使分子量误差<0.01%, 从而获得的精确的蛋白指纹图谱. 将标准化质控血清中用于定量的标准峰, m/z为4091.1或6634.0, 强度调至40%-50%信号强度的最大值时, 芯片阅读仪参数设置如下: 激光强度175, 检测灵敏度8, 优化范围为m/z为1000-15000, 最高50000, 芯片上的每个点采集90次. 用Ciphergen ProteinChip 3.2.1软件收集数据.
1.2.4 数据处理: 首先随机挑取51份中度脂肪肝患者血清和49份年龄匹配的对照血清用于建立脂肪肝诊断模型. 建模的主要过程包括: (1)图谱标准化. 用血清中m/z为6634.0峰进行了校正, 而后又进行了"减少基线", 以减少不同芯片、仪器状态波动等因素引起的试验误差. (2)用Biomarker Wizard 3.1软件快速计算相同m/z的蛋白在脂肪肝组与对照组间峰值差异的P值. 选择信/噪比(S/N)>5和在所有图谱中出现频率>90%的峰作为有效蛋白峰. 为避免遗漏小的蛋白峰, 将S/N>2和分子质量偏差<0.1%的峰也标记为有效蛋白峰. 然后, 根据方差分析的原理计算总图谱内脂肪肝组与对照组相同m/z蛋白表达差异的P值(以Excel表输出差异蛋白的分子量和相对强度). (3)诊断模型的建立和验证. 用Biomarker Patterns Software 5.0分析软件对脂肪肝组与对照组间相同m/z的差异表达蛋白峰值做线性分类分析, 经过进一步优化试验参数(包括Gini、Testing、Advance、Costs等), 确定最佳分类模型, 即诊断模型. 然后, 扩大样本量, 用此诊断模型盲法分析另外44份脂肪肝中度患者, 26份脂肪肝轻度患者和50名健康人血清中的质谱数据, 并根据盲法分析结果的敏感性和特异性.
1.2.5 B超: 所用仪器为日本Alokassd256型超声诊断仪, 探头频率3.5 MHz. 常规扫查肝、胆、脾、肾. 脂肪肝的患者均按照"中华医学会肝脏病学分会脂肪肝和酒精性肝病学组"在2006年制定的诊断标准进行诊断[1]. B超诊断脂肪肝依据为[1]: (1)肝脏弥漫性肿大, 形态饱满, 表面光滑, 肝边缘膨胀圆钝. (2)肝实质回声增强, 明显高于脾脏及肾皮质回声, 呈云雾状, 肝脏深部回声减弱. 轻度脂肪肝表现为肝脏后半部光点回声稍减弱, 深面肝包膜回声仍可显示. 中度脂肪肝表现为肝深层1/3部分光点回声明显减低, 肝包膜回声不能显示, 提高增益可以显示. (3)肝细胞脂肪变性: 脂肪变以大泡为主, 偶见脂肪性肉芽肿. 轻度: 脂肪变肝细胞达30%-50%者; 中度: 脂肪变肝细胞达50%-75%者. (4)肝内血管不清晰, 彩色多普勒血流显像肝内血管彩色血流不易显示. 轻度病变, 可显示门静脉主干及一级分支中血流, 肝静脉间断显示; 中度病变, 仅模糊隐显门静脉主干内彩色血流, 肝静脉中无彩色显示. (5)正常管道结构回声改变: 轻度, 肝内管道结构回声多无明显改变. 排除标准: 各种类型的肝炎, 如病毒性肝炎(乙肝、丙肝等); 各重要脏器的器质性病变; Wilson病、全胃肠外营养; 自身免疫性疾病﹑糖尿病; 妊娠或哺乳期妇女.
统计学处理 采用Ciphergen ProteinChip软件和Biomarker Wizard软件对质谱检测得到的蛋白指纹图谱进行统计学处理. 脂肪肝组与对照组、轻度与中度脂肪肝组之间蛋白质峰的比较采用Mann-Whitney U检验, P<0.05具有统计学意义. 在此基础上采用Biomarker Patterns软件识别诊断脂肪肝的最佳标志物, 并建立脂肪肝诊断模型.
270例血清样本中, 有95例中度脂肪肝病例, 其中61例三酰甘油(TG)偏高, 34例TG正常; 76例轻度脂肪肝病例中, 43例TG偏高, 33例TG正常; 另有99例健康对照. 脂肪肝及健康对照的血清样本随后被分成两组: 训练组, 健康人49例, 脂肪肝-轻、中度分别为50、51例; 另一组为盲测组, 健康人50例, 脂肪肝-轻、中度分别为26、44例.
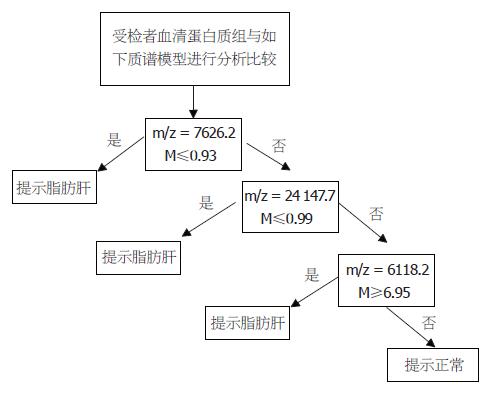
51份中度脂肪肝患者和49份正常对照血清的原始指纹图谱标准化后, 用Biomarker Wizard软件分析, 在m/z为2000-50000范围内共检测到163个蛋白峰, 其中6个在脂肪肝组与对照组的差异有极显著意义(P<0.001, 表1). 对这些血清差异表达蛋白质用Biomarker Patterns软件做进一步分析, 建立由7626.2、24147.7、6118.2 m/z等3个差异蛋白峰组成的诊断模型(建模组, 图1). 用此分类法分析51份脂肪肝样本, 其中46份区分正确, 5份区分错误, 敏感性为90.2%; 分析49份正常健康对照样本, 46份区分正确, 3份区分错误, 特异性为93.9%. 根据差异蛋白及其特定组合, 可以区分脂肪肝和健康人.
| m/z | 脂肪肝组 | 健康对照组 | P |
| 7626.2 | 0.69±0.24 | 7.12±3.75 | 1.8E-08 |
| 2543.1 | 1.73±1.96 | 5.77±3.39 | 4.95E-05 |
| 2746.1 | 15.61±7.45 | 9.20±4.64 | 8.86E-05 |
| 2760.7 | 1.16±1.19 | 3.79±2.22 | 0.00035 |
| 24141.7 | 0.69±0.30 | 1.02±0.54 | 0.00088 |
| 6118.2 | 6.48±3.64 | 4.25±2.70 | 0.00090 |
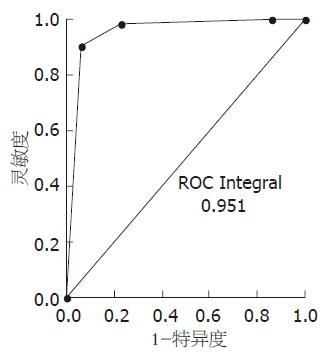
进一步扩大样本量, 用由7626.2、24147.7、6118.2 m/z 3个差异蛋白峰组成的诊断模型盲法分析44份中度脂肪肝和50份正常健康对照样本的蛋白指纹图谱. 44份中度脂肪肝患者样本中40份划分正确, 4份划分错误, 敏感性为90.9%; 50份正常健康对照样本, 46份划分正确, 4份划分错误, 特异性为92.0%. 盲法验证的ROC曲线值为0.951(图2), 进一步的分析验证了所建立模型的准确性.
51份中度脂肪肝与50份轻度脂肪肝蛋白指纹图谱标准化后, 用Biomarker Wizard软件分析, 在m/z为2000-50000范围内共检测到163个蛋白峰, 其中5个蛋白峰的差异有显著意义(P<0.001). 选取了m/z为7626.2、3286.0、2760.7、2543.1、2746.1这5个差异蛋白峰组成的模型, 能把轻度从中度脂肪肝患者中区分出来(表2).
| m/z | 中度脂肪肝 | 轻度脂肪肝 | P |
| 7626.2 | 0.69±0.24 | 5.09±2.03 | 1.19E-06 |
| 3286.0 | 0.54±1.08 | 2.13±2.34 | 0.000192 |
| 2760.7 | 1.16±1.19 | 4.22±2.02 | 0.000258 |
| 2543.1 | 1.73±1.96 | 5.63±3.43 | 0.000718 |
| 2746.1 | 15.61±7.45 | 10.35±5.40 | 0.000917 |
50份轻度脂肪肝与49份正常健康对照蛋白指纹图谱标准化后, 用Biomarker Wizard软件分析, 在m/z为2000-50000范围内共检测到162个蛋白峰, 其中5个蛋白峰在轻度脂肪肝与正常健康对照组的差异有显著意义(P<0.05). 选取m/z为7626.2、11721.0、24141.7、8529.1、9042.7等5个差异蛋白峰组成的模型, 能将轻度脂肪肝患者从健康对照中区分出来(表3).
| m/z | 轻度脂肪肝 | 正常健康对照 | P |
| 7626.2 | 5.09±2.03 | 7.12±3.75 | 0.001 |
| 11721.0 | 1.07±0.59 | 1.29±0.46 | 0.010 |
| 24141.7 | 0.80±0.42 | 1.02±0.54 | 0.020 |
| 8529.1 | 0.65±0.96 | 1.22±1.72 | 0.020 |
| 9042.7 | 0.42±0.82 | 0.61±0.69 | 0.030 |
脂肪肝不是一种独立的疾病, 是由诸多原因造成的后果. 长期酗酒, 营养过剩, 营养不良, 糖尿病、肝炎、甲亢、重度贫血等慢性疾病, 药物性肝损害等等都是导致脂肪肝的原因. 而提高其疾病发生发展逆转率的关键在于提高早期诊断率.
目前临床诊断主要依靠病史, 临床表现, 血液学检测, 影像学诊断等. 在影像学诊断中, B超现已作为脂肪肝的首选诊断方法, 并广泛用于人群脂肪肝发病率的流行病学调查. 近来国外报道B超诊断脂肪肝的阳性预测值为67%. 超声引导下肝穿刺活检组织细胞学检查是确诊脂肪肝, 特别是局灶性脂肪肝的主要方法, 在形态学检查时作必要的特殊染色、免疫组化、组织生化测定及特殊细胞学检查等, 可提高诊断的目的性. 但是因肝活检有创伤性, 患者难以接受.
近年来, 国内外在血清蛋白组方面的研究日益受到关注, 继SELDI-TOF-MS技术后又发展了纳米磁珠结合MALDI-TOF-MS技术[6-15]. 这一技术的出现为筛选高敏感性和特异性的肿瘤及其他疾病的诊断标志物提供了又一个崭新的研究思路和技术平台, 他比SELDI-TOF-MS更灵敏, 因为球形磁珠比芯片表面具有更多的表面积, 另外也方便后续对未知峰的鉴定. 因此近年来被广泛用于各种疾病和肿瘤标志物的筛选和鉴定[16-22]. 在乳腺癌, 大肠癌, 口腔癌等肿瘤标志物的研究中, 利用该技术建立的诊断模型均具有较高的敏感性和特异性[23-25]. 在脂肪肝的蛋白质组学方面的研究中, Younossi et al就于2005年应用SELDI-TOF-MS等实验手段, 对98例肥胖的外科患者进行基因组/蛋白质组分析, 结果显示, 在非酒精性脂肪肝的不同类型中, 有好几个基因差异表达和差异蛋白峰, 但该研究没有建立血清质控标准及脂肪肝诊断模型[26].
在进行血清蛋白质质谱分析时发现血液样本离体后如不及时分离血清, 对实验的稳定性影响很大. 及时分离血清、血清样本的保存和质量的稳定性问题对研究及送检显得尤其重要[5]. 由于既往的样本不完全符合质谱血清学分析的标准, 故对实验分析带来了困惑; 并且大量收集新鲜的血清样本有困难, 研究人员不得不采用反复冻溶几次的样本, 这会影响到实验诊断和医学研究的重复性[5]. 本实验在4 ℃下处理血液标本, 2 h内尽快分离血清及细胞, 血清分装、储存在-80 ℃, 限冻溶1次. 本实验的血清蛋白质质谱分析的重复性(即同一标本同时在WCX磁珠上做8点重复试验, 所有峰值的CV值<10%)与以前我们的报道一致[5].
本研究应用纳米磁珠结合MALDI-TOF-MS技术分析脂肪肝患者与正常人血清在蛋白质水平上的差异, 建立了由7626.2、24147.7、6118.2 m/z 3个差异蛋白峰组成的脂肪肝模型, 其敏感性为90.2%, 特异性为93.9%. 扩大样本盲法验证的敏感性为90.9%, 特异性为92.0%. 这是国内外首次报道用WCX纳米磁珠与MALDI-TOF-MS技术检测脂肪肝的结果. 由于蛋白指纹图谱仪(PBSⅡc)已经国家食品药品监督管理局(SFDA)批准进入国内医院进行蛋白指纹图谱的检测[5], 故差异蛋白峰(蛋白指纹)将来可作为脂肪肝辅助诊断的一种新方法. 本研究进一步选取了m/z为7626.2、3286.0、2760.7、2543.1、2746.1这5个差异蛋白峰组成的模型, 能将轻度脂肪肝从中度脂肪肝患者中区分出来; 选取了m/z为7626.2、11721.0、24141.7、8529.1、9042.7这5个差异蛋白峰组成的模型, 能将轻度脂肪肝患者从健康对照中区分出来. 该模型能区分轻度、中度脂肪肝患者及区分轻度脂肪肝患者与健康对照, 其检查的无创性及其较之B超检查相对更高的敏感性和特异性, 具有脂肪肝早期诊断的临床意义, 不失为诊断脂肪肝的另一种新的辅助方法, 并且有助于阐明脂肪肝的发病机制和进一步鉴定出干预性治疗的潜在靶点.
因此, WCX纳米磁珠结合质谱技术筛选出的生物标志物可用于脂肪肝的早期诊断及随访检测, 对其在脂肪肝生物标志物的蛋白鉴定和治疗监测相关方面的意义有待进一步研究[27-32].
脂肪肝是指各种原因引起的肝细胞脂肪堆积, 是一个常见的临床现象. 脂肪肝的诊断主要依靠病史、临床表现和实验室检查; 特别是B超和CT, 但确切的诊断还是有赖于有创伤性的肝活检. 蛋白指纹图谱技术是近年来的热点技术, 已经在临床疾病的研究中得到广泛的应用并展示出较好的应用前景. 其检查的无创性和相对更高的敏感性和特异性, 不失为诊断脂肪肝的另一种辅助方法.
刘海林, 主任医师, 上海交通大学医学院附属第九人民医院消化科; 曹志成, 院士, 香港伊利莎伯医院临床肿瘤科、肿瘤研究部
蛋白指纹图谱技术出现的同时也提出一种全新的多标志物谱或个性化标志物的诊断模式. 采用该技术筛选脂肪肝患者血清中的特异性标志物, 可以发现一些传统方法不能发现的小分子物质, 对这些小分子物质的鉴定有助于脂肪肝的诊断和对发病机制的探讨. 但目前鉴定低丰度小分子难度较大.
血清蛋白指纹图谱的检测一般采用SELDI技术, 本文采用纳米磁性微球技术捕获血清蛋白, 再采用基质辅助激光解析电离飞行时间质谱仪进行蛋白指纹图谱检测, 首次为读者提供了新的实验依据.
由于蛋白指纹图谱仪(PBSⅡc)已获国家食品药品监督管理局(SFDA)批准进入国内医院进行蛋白指纹图谱的检测, 故差异蛋白峰(蛋白指纹)可作为脂肪肝辅助诊断的一种新方法.
基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS): 是利用激光脉冲辐射使芯池中的分析物解析形成荷电离子, 根据不同m/z, 这些离子在仪器场中飞行的时间长短不一, 由此绘制出一张质谱图案.
本文应用蛋白质组学技术筛选脂肪肝患者血清标志物, 研究结果对临床工作具有一定的参考价值.
编辑: 李军亮 电编: 郭海丽
| 3. | Rector RS, Thyfault JP, Wei Y, Ibdah JA. Non-alcoholic fatty liver disease and the metabolic syndrome: an update. World J Gastroenterol. 2008;14:185-192. [PubMed] [DOI] |
| 4. | Tarantino G. Should nonalcoholic fatty liver disease be regarded as a hepatic illness only? World J Gastroenterol. 2007;13:4669-4672. [PubMed] |
| 6. | Grizzle WE, Semmes OJ, Basler J, Izbicka E, Feng Z, Kagan J, Adam BL, Troyer D, Srivastava S, Thornquist M. The early detection research network surface-enhanced laser desorption and ionization prostate cancer detection study: A study in biomarker validation in genitourinary oncology. Urol Oncol. 2004;22:337-343. [PubMed] [DOI] |
| 7. | Zhu XD, Zhang WH, Li CL, Xu Y, Liang WJ, Tien P. New serum biomarkers for detection of HBV-induced liver cirrhosis using SELDI protein chip technology. World J Gastroenterol. 2004;10:2327-2329. [PubMed] |
| 8. | Ward DG, Cheng Y, N'Kontchou G, Thar TT, Barget N, Wei W, Billingham LJ, Martin A, Beaugrand M, Johnson PJ. Changes in the serum proteome associated with the development of hepatocellular carcinoma in hepatitis C-related cirrhosis. Br J Cancer. 2006;94:287-292. [PubMed] [DOI] |
| 9. | Mathelin C, Cromer A, Wendling C, Tomasetto C, Rio MC. Serum biomarkers for detection of breast cancers: A prospective study. Breast Cancer Res Treat. 2006;96:83-90. [PubMed] [DOI] |
| 10. | Kang X, Xu Y, Wu X, Liang Y, Wang C, Guo J, Wang Y, Chen M, Wu D, Wang Y. Proteomic fingerprints for potential application to early diagnosis of severe acute respiratory syndrome. Clin Chem. 2005;51:56-64. [PubMed] [DOI] |
| 11. | Zhang Z, Bast RC Jr, Yu Y, Li J, Sokoll LJ, Rai AJ, Rosenzweig JM, Cameron B, Wang YY, Meng XY, Berchuck A, Van Haaften-Day C, Hacker NF, de Bruijn HW, van der Zee AG, Jacobs IJ, Fung ET, Chan DW. Three biomarkers identified from serum proteomic analysis for the detection of early stage ovarian cancer. Cancer Res. 2004;64:5882-5890. [PubMed] [DOI] |
| 12. | Petricoin EF, Liotta LA. SELDI-TOF-based serum proteomic pattern diagnostics for early detection of cancer. Curr Opin Biotechnol. 2004;15:24-30. [PubMed] [DOI] |
| 13. | Cho WC. Contribution of oncoproteomics to cancer biomarker discovery. Mol Cancer. 2007;6:25. [PubMed] [DOI] |
| 14. | Cho WC, Cheng CH. Oncoproteomics: current trends and future perspectives. Expert Rev Proteomics. 2007;4:401-410. [PubMed] [DOI] |
| 16. | Villanueva J, Philip J, Entenberg D, Chaparro CA, Tanwar MK, Holland EC, Tempst P. Serum peptide profiling by magnetic particle-assisted, automated sample processing and MALDI-TOF mass spectrometry. Anal Chem. 2004;76:1560-1570. [PubMed] [DOI] |
| 17. | Villanueva J, Philip J, DeNoyer L, Tempst P. Data analysis of assorted serum peptidome profiles. Nat Protoc. 2007;2:588-602. [PubMed] [DOI] |
| 18. | Mengel-Jorgensen J, Sanchez JJ, Borsting C, Kirpekar F, Morling N. MALDI-TOF mass spectrometric detection of multiplex single base extended primers. A study of 17 y-chromosome single-nucleotide polymorphisms. Anal Chem. 2004;76:6039-6045. [PubMed] [DOI] |
| 19. | Lopez MF, Mikulskis A, Kuzdzal S, Bennett DA, Kelly J, Golenko E, DiCesare J, Denoyer E, Patton WF, Ediger R. High-resolution serum proteomic profiling of Alzheimer disease samples reveals disease-specific, carrier-protein-bound mass signatures. Clin Chem. 2005;51:1946-1954. [PubMed] [DOI] |
| 20. | Hortin GL. The MALDI-TOF mass spectrometric view of the plasma proteome and peptidome. Clin Chem. 2006;52:1223-1237. [PubMed] [DOI] |
| 21. | Baumann S, Ceglarek U, Fiedler GM, Lembcke J, Leichtle A, Thiery J. Standardized approach to proteome profiling of human serum based on magnetic bead separation and matrix-assisted laser desorption/ionization time-of-flight mass spectrometry. Clin Chem. 2005;51:973-980. [PubMed] [DOI] |
| 22. | Gold B, Deng H, Bryk R, Vargas D, Eliezer D, Roberts J, Jiang X, Nathan C. Identification of a copper-binding metallothionein in pathogenic mycobacteria. Nat Chem Biol. 2008;4:609-616. [PubMed] [DOI] |
| 23. | de Noo ME, Deelder A, van der Werff M, Ozalp A, Mertens B, Tollenaar R. MALDI-TOF serum protein profiling for the detection of breast cancer. Onkologie. 2006;29:501-506. [PubMed] [DOI] |
| 25. | Cheng AJ, Chen LC, Chien KY, Chen YJ, Chang JT, Wang HM, Liao CT, Chen IH. Oral cancer plasma tumor marker identified with bead-based affinity-fractionated proteomic technology. Clin Chem. 2005;51:2236-2244. [PubMed] [DOI] |
| 26. | Younossi ZM, Baranova A, Ziegler K, Del Giacco L, Schlauch K, Born TL, Elariny H, Gorreta F, VanMeter A, Younoszai A. A genomic and proteomic study of the spectrum of nonalcoholic fatty liver disease. Hepatology. 2005;42:665-674. [PubMed] [DOI] |
| 27. | Nedelkov D, Kiernan UA, Niederkofler EE, Tubbs KA, Nelson RW. Investigating diversity in human plasma proteins. Proc Natl Acad Sci USA. 2005;102:10852-10857. [PubMed] [DOI] |
| 28. | Zhu Y, Valdes R Jr, Jortani SA. Application of bioaffinity mass spectrometry for analysis of ligands. Ther Drug Monit. 2005;27:694-699. [PubMed] [DOI] |
| 29. | Anderson NL, Anderson NG. The human plasma proteome: history, character, and diagnostic prospects. Mol Cell Proteomics. 2002;1:845-867. [PubMed] [DOI] |
| 30. | Woong-Shick A, Sung-Pil P, Su-Mi B, Joon-Mo L, Sung-Eun N, Gye-Hyun N, Young-Lae C, Ho-Sun C, Heung-Jae J, Chong-Kook K. Identification of hemoglobin-alpha and -beta subunits as potential serum biomarkers for the diagnosis and prognosis of ovarian cancer. Cancer Sci. 2005;96:197-201. [PubMed] [DOI] |
| 31. | Villanueva J, Shaffer DR, Philip J, Chaparro CA, Erdjument-Bromage H, Olshen AB, Fleisher M, Lilja H, Brogi E, Boyd J. Differential exoprotease activities confer tumor-specific serum peptidome patterns. J Clin Invest. 2006;116:271-284. [PubMed] [DOI] |
| 32. | Liotta LA, Petricoin EF. Serum peptidome for cancer detection: spinning biologic trash into diagnostic gold. J Clin Invest. 2006;116:26-30. [PubMed] [DOI] |