修回日期: 2008-11-01
接受日期: 2008-11-03
在线出版日期: 2008-12-08
目的: 研究表没食子儿茶素-3-没食子酸酯(EGCG)的抗肝纤维化作用及其机制.
方法: 运用腹腔注射CCl4构建大鼠肝纤维化模型, 观察EGCG对大鼠肝纤维化的影响. 运用HE染色、Massion三色染色检测肝纤维化的变化; 生化检测血清丙氨酸转移酶(ALT)及天冬氨酸转移酶(AST); 同时检测肝组织的羟脯氨酸、还原型谷胱甘肽(GSH) 和硫代巴比妥酸反应底物(TBARS)含量. 免疫组织化学法观察α-平滑肌肌动蛋白(α-SMA)的表达; 分别运用RT-PCR和Western blot法检测转化生长因子β1(TGF-β1)及结缔组织生长因子(CTGF)mRNA和蛋白质表达.
结果: EGCG对CCl4诱导的大鼠肝纤维化程度具有显著的抑制作用. EGCG对肝细胞具有显著的保护作用, 与纤维化模型组比较, EGCG干预组血清ALT、AST水平降低(138.4±45.8 vs 234.6±63.2, 96.4±20.5 vs 186.2±36.6, 均P<0.05). EGCG显著抑制肝组织α-SMA的表达. EGCG通过抑制TBARS的形成和提高GSH含量, 显著改善CCl4诱导的肝纤维化大鼠肝脏的氧化状态. 同时EGCG显著抑制肝组织TGF-β1及CTGF的mRNA和蛋白质的表达(均P<0.05).
结论: EGCG能够显著抑制肝纤维化的进展, 其机制与EGCG改善大鼠肝脏的氧化状态及抑制TGF-β1和CTGF的表达有关.
引文著录: 甄茂川, 王效民, 尹震宇, 汪谦, 刘平果, 吴国洋, 俞可克, 李岗山. EGCG对肝纤维化大鼠TGF-β1和CTGF表达的影响. 世界华人消化杂志 2008; 16(34): 3828-3834
Revised: November 1, 2008
Accepted: November 3, 2008
Published online: December 8, 2008
AIM: To examine the protective effects of epigallocatechin-3-gallate (EGCG) on CCl4-induced hepatic fibrosis.
METHODS: A rat model of CCl4-induced hepatic fibrosis was established to assess the effect of EGCG on the treatment for fibrosis. Liver fibrosis of the rats was evaluated by two histological methods: HE staining and Masson's trichrome staining. Activities of serum ALT and AST were checked with automated biochemistry analyzer. The levels of liver tissue hydroxyproline, glutathione (GSH) and thiobarbituratic acid reactive substances (TBARS) were also determined. The expression of α-SMA in hepatic tissue was detected by immunohistochemistry. The mRNA and protein levels of TGF-β1 and CTGF expression were detected by RT-PCR and Western blot analysis.
RESULTS: Histological and hepatic hydroxyproline examination revealed that EGCG significantly arrested progression of hepatic fibrosis. EGCG caused significant amelioration of liver injury, and reduced activities of serum ALT and AST (138.4 ± 45.8 vs 234.6 ± 63.2, 96.4 ± 20.5 vs 186.2 ± 36.6, both P < 0.05). Redox state was improved in CCl4-induced hepatic fibrosis through treatment with EGCG, by suppressing the TBARS formation and increasing the level of GSH. Moreover, EGCG markedly reduced both mRNA and protein expression of TGF-β1 and CTGF in the liver tissue (P < 0.05).
CONCLUSION: EGCG significantly arrested progression of hepatic fibrosis. The underlying mechanism was associated with changes in the redox state and markedly decreased expression of TGF and CTGF in liver tissue.
- Citation: Zhen MC, Wang XM, Yin ZY, Wang Q, Liu PG, Wu GY, Yu KK, Li GS. Effect of EGCG on expression of TGF-β1 and CTGF in rats with liver fibrosis. Shijie Huaren Xiaohua Zazhi 2008; 16(34): 3828-3834
- URL: https://www.wjgnet.com/1009-3079/full/v16/i34/3828.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i34.3828
表没食子儿茶素-3-没食子酸酯(epigallocatechin-3-gallate, EGCG)是绿茶多酚的主要单体及活性成分. EGCG作为一种强的抗氧化剂在治疗氧化应激相关疾病方面引起众多的关注, 如肿瘤、心血管疾病和纤维化. 最近Chen et al[1]报道, 运用EGCG预处理可以减轻CCl4诱导的急性肝损伤. 体外的研究已证明EGCG能够通过抑制HSC Ⅰ型胶原的合成, 抑制增殖和诱导凋亡而发挥抗肝纤维化的作用[2-3]. EGCG能否成为有效的治疗肝纤维化药物, 尚需进一步研究. 因此, 我们运用CCl4诱导的大鼠肝纤维化模型, 探讨EGCG对CCl4诱导的肝纤维化的抑制作用以及相关机制.
清洁级♂健康SD大鼠, 体质量180-200 g, 由中山大学动物实验中心提供, 动物合格证号: SCXK(粤)2004A084. 动物房室温20-22 ℃, 光照周期12 h. 实验前大鼠适应环境1 wk, 自由饮水, 无不良反应, 进食、饮水和活动正常者纳入实验. 羊抗α-SMA, 购自Santa Cruz Biotechnology公司. 二抗为偶联HRP的抗羊IgGMcAb, 购自武汉博士德公司. EGCG纯度95%, Sigma公司产品, 为粉末状, 临用前溶于生理盐水中, 过滤除菌; 明胶、Triton-X100, Sigma公司产品. CCl4、橄榄油, 广州威佳公司产品. 考马斯亮蓝R-250, 广州鼎国公司产品. Massion三色试剂盒, 广州俪科公司产品. GSH检测试剂盒, Calbiochem公司产品.
1.2.1 分组及方法: 健康♂SD大鼠, 随机分成4组: (1)正常对照组, 大鼠给与ip橄榄油1 mL/kg, 每周2次; (2)EGCG对照组, 大鼠给予ip橄榄油1 mL/kg, 每周2次, 同时每天ip EGCG(25 mg/kg); (3)纤维化模型组, 大鼠给予ip 500 mL/L CCl4橄榄油溶液1 mL/kg, 每周2次. (4)EGCG治疗组, 大鼠给予ip 500 mL/L CCl4橄榄油溶液1 mL/kg, 每周2次, 同时每日给予EGCG(25 mg/kg)ip. 实验期间所有大鼠食用标准饲料. 各组均于7 wk后处死. 处死前禁食24 h. 处死时, 大鼠用水合氯醛麻醉, 迅速从心脏穿刺取血, 分离血清, -80 ℃保存. 平卧状态下剖腹, 去除肝脏筋膜, 取右叶相同的部分置于冰生理盐水中充分洗涤后, 一部分用100 g/L中性甲醛固定, 3 d内石蜡包埋备组织病理检测; 其余肝组织迅速置于液氮中保存.
1.2.2 肝脏组织病理学检测: 肝脏石蜡切片作HE染色, Massion三色染色法及α-SMA免疫组化染色. 由同一位病理学专家光镜下观察肝组织病理学改变, 对肝损伤程度采用Knodell指数进行盲法比较和评分[4], 0级: 无纤维化; 1级: 汇管区纤维化; 2级: 汇管区纤维化扩大; 3级: 桥接样纤维化; 4级: 肝硬化. 免疫组化采用SP法, 操作按说明书进行, 结果运用HIPAS-2000型计算机图像分析系统, 通过显微摄像系统摄取图像并输入图像分析系统进行灰度变换, 使胶原纤维着色区域与背景分开, 自动记录着色面积和总面积. 于100倍镜下测定胶原纤维面积百分比, 计算方法为: 胶原纤维面积/肝组织面积×100%, 取平均值.
1.2.3 肝组织羟脯氨酸含量测定: 采用氯仿-T法测定. 取肝组织500 mg, 加950 mL/L乙醇脱脂0.5 d, 于脱脂器中用丙酮脱脂2 d, 取出置10 ℃烤箱烘干, 研磨成粉. 再精确称取肝粉40 mg, 放入加带塞试管内, 加入6 mol/L盐酸3 mL, 放在125 ℃烤箱水解5 h. 自然冷却后, 移入50 mL容量瓶加6 mol/L氢氧化钠调pH至6.0. 用蒸馏水稀释至50 mL刻度. 过滤后取1.0 mL测定. 各管加1.0氯氨T溶液摇匀, 室温下放置20 min继续加入1.0 mL过氯酸, 5 min后加入1.0 mL 100 mL/L对二甲氨基苯甲醛溶液. 65 ℃水浴保温20 min, 取出后冷却. 20 min后在550 nm波长处比色. 通过运用已知浓度的羟脯氨酸绘制的标准曲线, 来确定肝组织的羟脯氨酸的浓度.
1.2.4 肝组织GSH及TBARS含量的测定: GSH检测试剂盒, Calbiochem公司产品. 脂质过氧化物的主要降解产物是丙二醛(malondialdehyde, MDA), 可与硫代巴比妥酸(thiobarbituric acid, TBA)发生反应, 生成紫红色的物质; 该物质在532 nm处有最大吸收峰. 因此, 可利用于测定样品中脂质过氧化物的含量.
1.2.5 血清学肝功能测定: 取大鼠血液约3 mL, 置干燥玻璃管内, 37 ℃温浴30 min, 4 ℃冰箱静置2 h, 3000 g 10 min, 取血清, -80 ℃保存. 自动生化分析仪检测肝功能指标ALT和AST.
1.2.6 半定量RT-PCR检测: 取大约300 mg肝组织, 加入3 mL TRIzol(Invitrogen)提取总RNA, 在紫外分光仪下测定RNA含量, 根据RNA在A260nm/A280nm≥1.8及10 g/L琼脂糖凝胶电泳28S和18S RNA条带比值≥1.5鉴定RNA纯度和完整性. 取2 μg总RNA为模板, 参照TaKaRa公司的RNA PCR Kit(AMV)Ver 3.0试剂盒说明书进行逆转录聚合酶链反应(RT-PCR). 大鼠CTGF寡核苷酸引物参考Murphy et al[5]序列由上海生工合成, 上游5'-CTAAGACCTGTGGGATGGGC-3', 下游5'-CTCAAAGATGTCATTGTCCCC-3'(383 bp); 大鼠TGF-β1寡核苷酸引物参考Ding et al[6]上游5'-TGAGTGGCTGTCTTTTGACG-3', 下游5'-ACTTCCAACCCAGGTCCTTC-3'(350 bp); 内参照β-actin引物序列如下: 上游5'-TGGGACGATATGGAGAAGAT-3', 下游5'-ATTGCCGATAGTGATGACCT-3'(452 bp). PCR反应条件为: 94 ℃ 2 min; 94 ℃ 30 s、55 ℃ 30 s、72 ℃ 1 min, 30个循环; 72 ℃ 10 min. 取PCR扩增产物10 mL在15 g/L琼脂糖凝胶(含0.5 g/L溴化乙锭)电泳, 用美国Pharmacia Master Image紫外凝胶成像系统进行基因表达水平的半定量分析.
1.2.7 Western blot分析: 将肝组织置于冰冷的裂解液(含150 mmol/L NaCl、50 mmol/L Tris-HCl [pH 7.6]、0.1% SDS、1% NP-40和蛋白酶抑制剂复合物)中摇床放置10 min, 13000 g 10 min收集裂解物总蛋白, 取40 μg组织蛋白行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)并原位电转印至PVDF膜; 膜经封闭液(含20 mmol/L Tris-HCl[pH 7.6]、150 mmol/L NaCl、0.1% Tween-20和5%脱脂奶粉)处理后, 与羊抗TGF-β1、CTGF或β-actin的多克隆抗体分别孵育, 膜经漂洗后再与辣根过氧化物酶耦联的兔抗羊二抗反应, Western blot增强化学发光法(ECL)发光试剂显影, 灰度成像软件(UVP, UK)测定主带的吸光度值以计算β-actin、CTGF和 TGF-β1蛋白表达水平.
统计学处理 实验所得数据用mean±SD表示, 采用完全随机设计的单因素方差分析, 多个样本均数间的两两比较采用Student-Newman-Keuls q检验, 以P<0.05为差异有显著性, 所有操作均以SPSS11.0统计软件完成.
血清AST和ALT是评价肝脏损伤常用的生化指标. 同正常对照组相比, 肝纤维化模型组的血清AST和ALT显著增高; 给予EGCG治疗后血清AST和ALT较模型组显著降低. 而EGCG对照组同正常对照组无明显差别(表1).
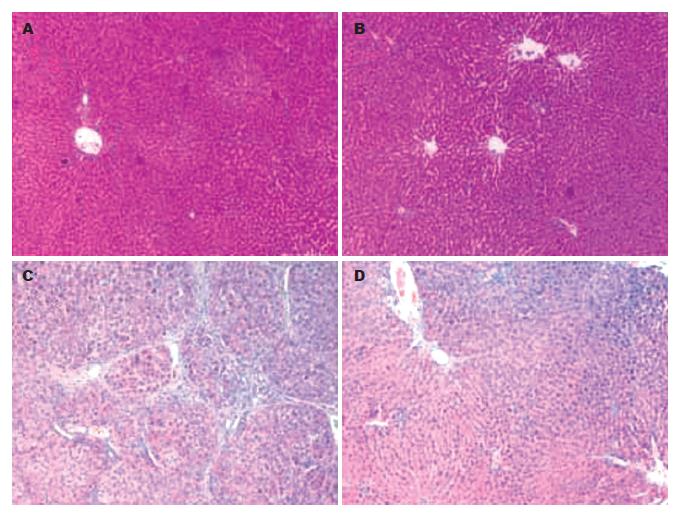
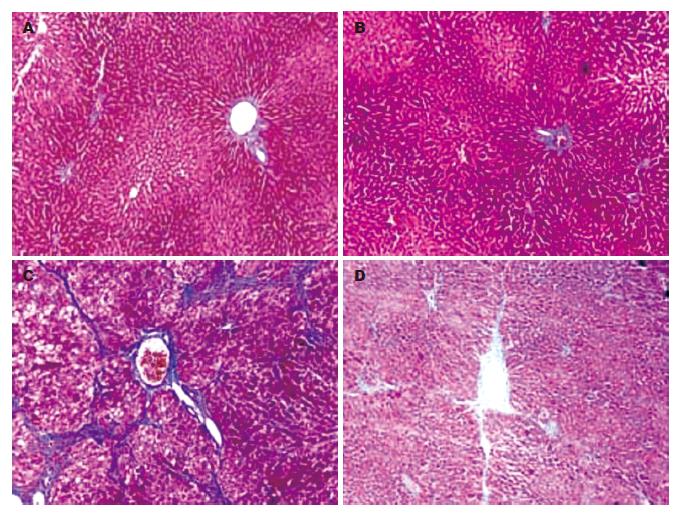
正常对照组和EGCG对照组为正常肝脏表现, 颜色深红, 表面光滑, 边缘锐利, 质地较软. 纤维化模型组肝脏增大, 颜色浅, 边缘钝, 质地硬, 表面有粗颗粒状表现. EGCG治疗组肝脏颜色较红, 略增大, 表面尚光滑, 肝脏表面可见细小颗粒. 运用HE和Massion染色二种组织病理学方法对肝纤维化程度进行分析. 组织病理学分析结果显示正常对照组和EGCG对照组的肝组织肝索结构清晰, 肝细胞以中央静脉为中心呈放射状, 肝组织内无脂肪空泡(图1A-B), 仅汇管区和中央静脉有少许胶原纤维存在(图2A-B). 模型组肝小叶结构破坏, 纤维组织增生明显, 将肝小叶分隔成大小不等的肝细胞团, 肝细胞广泛变性坏死, 汇管区扩大、胶原沉积(图1C, 2C). 同纤维化模型组比较, 治疗组肝细胞的变性坏死程度及肝小叶结构破坏程度降低, 肝脏胶原纤维增生亦明显减轻, 纤维条索疏松变窄(图1D, 2D). 运用Knodell指数对肝纤维化程度进行评分分析, 结果显示, EGCG治疗组同模型组比较有显著差异(表2, P<0.05). 模型组的纤维化面积为20.5%, EGCG治疗组减低至13.2%(表3, P<0.05). 而EGCG对照组和正常对照组之间的组织病理学变化没有明显的差别.
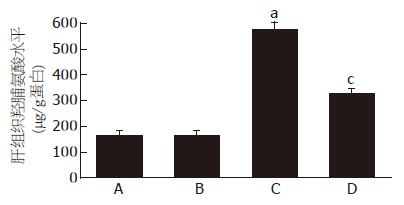
在检测肝脏组织病理学改变的同时, 通过检测肝组织中羟脯氨酸水平, 对纤维化程度进行定量分析. 同正常对照组相比较, 肝脏的羟脯氨酸水平在模型组显著增高(P<0.05); EGCG治疗后羟脯氨酸水平显著下降(P<0.05, 图3).
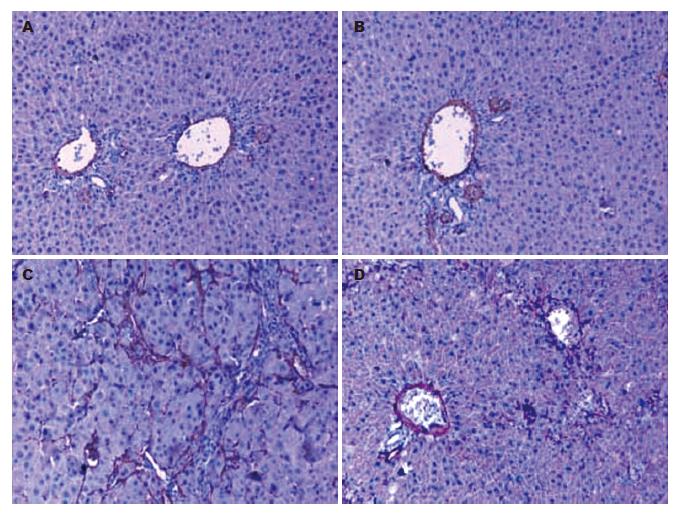
活化的HSC是肝纤维化时基质蛋白的主要来源. 而α-SMA是HSC活化的重要指标. 因此, 我们运用免疫组化法检测α-SMA在肝脏中的表达. 结果显示, 在正常对照组肝脏, α-SMA阳性细胞主要存在于门静脉和肝动脉周围. 给予ip CCl4 7 wk后, α-SMA阳性细胞占据了大部分的纤维组织. 但同时给予EGCG治疗后纤维化区域的α-SMA阳性细胞的数量显著减低(图4).
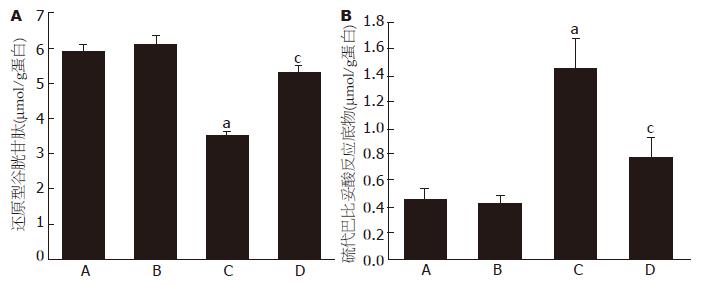
通过检测大鼠肝组织匀浆中的GSH和TBARS浓度, 探讨EGCG治疗对肝组织氧化状态的影响. GSH构成了拮抗自由基的第一道防线. 如图5A所示, 同正常对照组比较(5.9±0.2 μmol/g), 肝纤维化组肝组织GSH含量显著下降(3.5±0.1 μmol/g, P<0.05). 同正常对照组比较, 肝纤维化组TBARS含量增加约3.2倍(图5B); EGCG治疗组肝脏TBARS含量降至(0.78±0.10 μmol/g, P<0.05, 图5B).
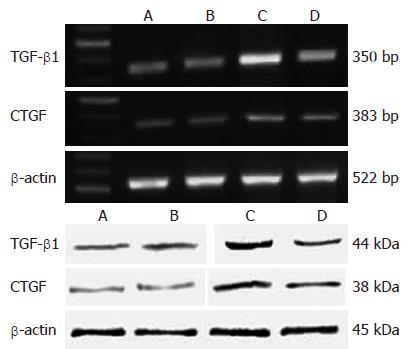
RT-PCR结果分析显示肝纤维化模型组肝脏CTGF和TGF-β1 mRNA的表达显著高于正常对照组, 而EGCG干预组显著下降, 二者之间的差异均有统计学意义(图6, 表3, P<0.05). 运用Western blot法检测肝脏CTGF和TGF-β1蛋白表达, 结果显示肝纤维化模型组肝脏CTGF和TGF-β1蛋白的表达显著高于正常对照组; 而EGCG干预后, CTGF和TGF-β1蛋白的表达均显著下降, 二者之间的差异均有统计学意义(图6, 表3, P<0.05).
氧化应激被认为是CCl4诱导的肝损伤的主要原因. CCl4由肝细胞的细胞色素P450代谢生成三氯甲基自由基. 这些自由基致脂质过氧化, 脂质过氧化产物引起肝细胞损伤和促进纤维组织的生成. 本研究结果显示EGCG干预后血清转氨酶AST和ALT显著下降, 表明EGCG对CCl4引起的大鼠肝脏毒性具有保护作用. 同先前的研究结果相同, 经CCl4处理后, 大鼠肝组织中脂质过氧化标志物TBARS显著增高. 而EGCG能够显著CCl4所致的大鼠TBARS的形成. GSH作为一种抗氧化剂在细胞内和细胞外通过结合多种酶反应步骤扩大其细胞内的功能, 包括活性氧中间产物的解毒作用及减少蛋白质的硫化、硫氢化和二硫化物的形成. 有研究表明GSH通过谷胱甘肽过氧化物酶消除脂质过氧化物的产生. 本实验发现, CCl4处理的大鼠肝脏GSH水平显著下降, 而EGCG干预后肝脏GSH水平显著增高. 我们的研究结果同既往的报道相一致, EGCG能够通过升高GSH水平抑制体外培养的HSCs的氧化反应[7]. 体外研究还表明, EGCG对肝细胞的保护作用主要归结于其抗氧化作用[8-9]. 最近, Chen et al证实运用EGCG预处理可以通过抑制脂质过氧化和减少促炎症反应物NO的产生来减轻CCl4诱导的急性肝损伤[1]. 总之, 这些结果表明EGCG可能通过其抗氧化能力发挥抗CCl4诱导的大鼠肝纤维化作用.
HSCs被认为是细胞外基质(extracellular matrix, ECM)产生的主要来源, 因此其在肝纤维化的发生和发展中发挥着关键作用[10]. 在正常肝脏, HSCs处于静止状态. 肝损伤时, HSCs被激活, 表达α-SMA是HSCs活化的一个重要标志. 我们的研究发现EGCG抑制肝纤维化进展伴随着α-SMA表达阳性细胞数量的下降, 表明EGCG可抑制HSCs的活化. 先前的研究表明氧化应激通过直接或间接旁分泌刺激受损的肝细胞来促进肝纤维化发展和HSC活化. 因此, EGCG可能通过抑制氧化反应依赖的HSCs活化来防止肝纤维化的形成.
TGF-β1是目前已知最强的促肝纤维化细胞因子. 近年研究发现, TGF-β1在体外实验中可特异性诱导成纤维细胞产生CTGF, 并由后者作为下游效应介质作用于结缔组织, 刺激成纤维细胞增殖和细胞外基质合成, 经CTGF介导的TGF-β1信号途径与肝纤维化的关系更具有特异性. 越来越多的体内外研究结果表明CTGF为TGF-β1下游的纤维化活性效应分子; TGF-β1引起的CTGF表达上调在肝纤维化形成的过程中可能发挥着关键作用[11-12]. 肝脏过表达TGF-β1的转基因小鼠导致肝纤维化快速进展, 运用TGF-β1反义寡核苷酸能够显著抑制CCl4诱导的大鼠肝纤维化[13]. 因此, 通过抑制TGF-β1的合成和(或)其信号传导是治疗纤维化的重要策略. CTGF是一种富含半胱氨酸的蛋白质具有广泛的细胞生物学作用. 有研究表明, 在肝纤维化形成过程中, CTGF主要来源于HSC, 具有诱导HSC迁移、增殖、黏附和促进Ⅰ型胶原的表达; 且CTGF mRNA和蛋白表达水平与肝纤维化的程度成正相关, 而与疾病的类型无关; 运用siRNA使CTGF的表达沉默可具有防治肝纤维化的作用, 阻断CTGF的表达或抑制其生物活性可能成为特异而有效的治疗肝纤维化的手段[14]. 我们的结果显示, 同正常大鼠相比, CCl4诱导的肝纤维化大鼠在出现组织学异常的同时伴有TGF-β1和CTGF表达增高, 这进一步支持了二者在肝纤维化发病机制中的作用. 而EGCG治疗能明显抑制TGF-β1、CTGF表达的增高及改善组织形态上的损害. 体外研究结果亦证明EGCG能够通过促进HSC的GSH合成而抑制TGF-β受体的表达而阻断TGF-β信号传导, 最终抑制CTGF的表达[7].
本研究结果证明EGCG干预能显著抑制CCl4诱导的大鼠肝纤维化的进展, 这一效应同EGCG抑制肝脏氧化状态和TGF-β1的表达及其信号传导密切相关.
肝纤维化是一种常见的病症, 是慢性肝病共有的病理改变, 不同病因引起的慢性肝损伤造成以胶原为主的细胞外基质各成分合成增多、降解相对不足, 过分在肝内沉积引起肝纤维化. 肝星状细胞(HSC)被认为是慢性肝损伤时细胞外基质的主要来源, 因此其在肝纤维化的发生发展中发挥着关键作用.
戴朝六, 教授, 中国医科大学第二临床学院(盛京医院)肝胆外科
目前对肝纤维化的治疗尚缺乏理想的药物, 寻找新的有效的抗肝纤维化的药物成为当前国内外研究的热点.
EGCG作为茶多酚的主要单体及活性成分, 以其强大的抗氧化作用在治疗氧化应激相关疾病方面引起众多的关注, 如肿瘤、心血管疾病和纤维化. 最近Chen et al报道, 运用EGCG预处理可以减轻单次剂量CCl4诱导的急性肝损伤. 体外的研究已证明EGCG能够通过抑制肝星状细胞Ⅰ型胶原的合成, 抑制增殖和诱导凋亡而发挥抗肝纤维化的作用.
本课题基于肝纤维化研究的最新进展, 运用CCl4腹腔注射的大鼠肝纤维化模型, 观察EGCG对CCl4诱导的肝纤维化的保护作用及其相关机制.
本文为EGCG能够成为有效治疗肝纤维化的药物提供重要的理论依据.
桥接样纤维化: 主要由桥接坏死发展而来, 桥接样纤维化虽有纤维间隔形成, 但小叶结构大部仍保留.
本研究有一定科学性、创新性和可读性, 较好地反映出我国或国际胃肠病学基础研究的先进水平.
编辑: 李军亮 电编: 何基才
| 1. | Chen JH, Tipoe GL, Liong EC, So HS, Leung KM, Tom WM, Fung PC, Nanji AA. Green tea polyphenols prevent toxin-induced hepatotoxicity in mice by down-regulating inducible nitric oxide-derived prooxidants. Am J Clin Nutr. 2004;80:742-751. [PubMed] |
| 2. | Nakamuta M, Higashi N, Kohjima M, Fukushima M, Ohta S, Kotoh K, Kobayashi N, Enjoji M. Epigallocatechin-3-gallate, a polyphenol component of green tea, suppresses both collagen production and collagenase activity in hepatic stellate cells. Int J Mol Med. 2005;16:677-681. [PubMed] |
| 3. | Higashi N, Kohjima M, Fukushima M, Ohta S, Kotoh K, Enjoji M, Kobayashi N, Nakamuta M. Epigallocatechin-3-gallate, a green-tea polyphenol, suppresses Rho signaling in TWNT-4 human hepatic stellate cells. J Lab Clin Med. 2005;145:316-322. [PubMed] [DOI] |
| 4. | Brunt EM. Grading and staging the histopathological lesions of chronic hepatitis: the Knodell histology activity index and beyond. Hepatology. 2000;31:241-246. [PubMed] [DOI] |
| 5. | Murphy M, Godson C, Cannon S, Kato S, Mackenzie HS, Martin F, Brady HR. Suppression subtractive hybridization identifies high glucose levels as a stimulus for expression of connective tissue growth factor and other genes in human mesangial cells. J Biol Chem. 1999;274:5830-5834. [PubMed] [DOI] |
| 6. | Ding J, Yu J, Wang C, Hu W, Li D, Luo Y, Luo H, Yu H. Ginkgo biloba extract alleviates liver fibrosis induced by CCl in rats. Liver Int. 2005;25:1224-1232. [PubMed] [DOI] |
| 7. | Yumei F, Zhou Y, Zheng S, Chen A. The antifibrogenic effect of (-)-epigallocatechin gallate results from the induction of de novo synthesis of glutathione in passaged rat hepatic stellate cells. Lab Invest. 2006;86:697-709. [PubMed] [DOI] |
| 8. | Kagaya N, Tagawa Y, Nagashima H, Saijo R, Kawase M, Yagi K. Suppression of cytotoxin-induced cell death in isolated hepatocytes by tea catechins. Eur J Pharmacol. 2002;450:231-236. [PubMed] [DOI] |
| 9. | Ramírez-Mares MV, de Mejía EG. Comparative study of the antioxidant effect of ardisin and epigallocatechin gallate in rat hepatocytes exposed to benomyl and 1-nitropyrene. Food Chem Toxicol. 2003;41:1527-1535. [PubMed] [DOI] |
| 10. | Friedman SL. Mechanisms of hepatic fibrogenesis. Gastroenterology. 2008;134:1655-1669. [PubMed] [DOI] |
| 12. | Sun K, Wang Q, Huang XH. PPAR gamma inhibits growth of rat hepatic stellate cells and TGF beta-induced connective tissue growth factor expression. Acta Pharmacol Sin. 2006;27:715-723. [PubMed] [DOI] |
| 13. | Doh KO, Jung HK, Moon IJ, Kang HG, Park JH, Park JG. Prevention of CCl4-induced liver cirrhosis by ribbon antisense to transforming growth factor-beta1. Int J Mol Med. 2008;21:33-39. [PubMed] |
| 14. | Li G, Xie Q, Shi Y, Li D, Zhang M, Jiang S, Zhou H, Lu H, Jin Y. Inhibition of connective tissue growth factor by siRNA prevents liver fibrosis in rats. J Gene Med. 2006;8:889-900. [PubMed] [DOI] |