修回日期: 2008-10-24
接受日期: 2008-10-27
在线出版日期: 2008-11-28
目的: 探讨H pylori感染在胃癌及癌前疾病中的分布状态以及在胃癌的发生及分化中的作用以及免疫组化法检测H pylori感染的价值.
方法: 随机选取辽宁省庄河地区不同胃疾病胃黏膜活检标本327例, 包括慢性浅表性胃炎63例、萎缩性胃炎62例, 胃癌202例, 常规HE染色及免疫组织化学染色, 观察黏膜、黏液H pylori感染密度.
结果: 不同胃疾病H pylori在胃黏膜定植状态为浅表性胃炎、萎缩性胃炎高于胃癌(χ2 = 96.998, 87.542, 均P<0.01), 胃癌组织低于癌周黏膜(χ2 = 5.378, P<0.01), 肠型胃癌高于弥漫型胃癌(χ2 = 19.253, P<0.01). 不同胃疾病H pylori在胃黏液游离状态为H pylori密度评分≤2时, 浅表性胃炎、萎缩性胃炎低于胃癌(χ2 = 6.526, 6.218, 均P<0.01), H pylori密度评分>2时, 浅表性胃炎、萎缩性胃炎高于胃癌(χ2 = 20.252, 46.248, 均P<0.01), 萎缩性胃炎高于浅表性胃炎(χ2 = 4.746, P<0.05), 胃癌与癌周黏膜无统计学差异, 肠型胃癌高于弥漫型胃癌(χ2 = 6.784, P<0.01).
结论: 不同胃疾病H pylori分布, 浅表性胃炎、萎缩性胃炎高于胃癌, 胃癌低于癌周黏膜, 肠型高于弥漫型. 黏液内游离H pylori密度评分胃癌组织与癌周黏膜无差异. 免疫组化染色检测H pylori优于HE.
引文著录: 于秀文, 董楠楠, 宫月华, 徐倩, 袁媛. 幽门螺杆菌在胃癌及其癌前疾病中的原位检测及意义. 世界华人消化杂志 2008; 16(33): 3740-3745
Revised: October 24, 2008
Accepted: October 27, 2008
Published online: November 28, 2008
AIM: To investigate the distribution of H pylori infection in gastric cancer and precancerous diseases and the role of H pylori infection in the incidence and differentiation of gastric cancer, as well as the clinical value of H pylori infection detection using immunohistochemical method.
METHODS: Biopsy specimens of gastric mucosa in various diseases were randomly selected from 327 cases in Zhuanghe region in Liaoning Province, including 63 cases of superficial gastritis, 62 cases of atrophic gastritis and 202 cases of gastric cancer. HE staining and immunohistochemical staining were used to measure the density of H pylori infection in gastric mucosa and mucus.
RESULTS: The H pylori colonization status was higher in superficial gastritis group or in atrophic gastritis than gastric cancer group (χ2 = 96.998, 87.542, both P < 0.01), while the status was lower in gastric cancer group than peri-cancer mucosa (χ2 = 5.378, P < 0.01), higher in the intestinal gastric cancer group than in diffused gastric cancer (χ2 = 19.253, P< 0.01). When H pylori density score was ≤ 2, the H pylori free status in superficial gastritis and atrophic gastritis were lower than that of gastric cancer (χ2 = 6.526, 6.218, both P < 0.01), and when H pylori density score > 2, it was higher in superficial gastritis group or atrophic gastritis group than in gastric cancer group (χ2 = 20.252, 46.248, both P < 0.01), it was higher in atrophic gastritis than in superficial gastritis (χ2 = 4.746, P < 0.05), and it was higher in the intestinal gastric cancer than in diffused gastric cancer (χ2 = 6.784, P < 0.01).
CONCLUSION: The H pylori distribution is higher in superficial gastritis and atrophic gastritis than in gastric cancer, lower in gastric cancer than in peri-cancer mucosa, higher in the intestinal gastric cancer than in diffused one. There is no significant difference in the free H pylori density score between gastric cancer tissue and peri-cancer mucosa. Immunohistochemical detection of H pylori is better than HE staining.
- Citation: Yu XW, Dong NN, Gong YH, Xu Q, Yuan Y. In situ detection of Helicobacter pylori in gastric cancer and precancerous diseases and its significance. Shijie Huaren Xiaohua Zazhi 2008; 16(33): 3740-3745
- URL: https://www.wjgnet.com/1009-3079/full/v16/i33/3740.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i33.3740
幽门螺杆菌(H pylori)是一种能运动的G-人类致病菌, 他可以导致胃炎、胃溃疡以及增加胃癌的发生风险[1]. 1994年世界卫生组织下属的国际癌症研究机构(IARC)已将其列为人类胃癌的Ⅰ类致癌物[2]. 目前, 诊断H pylori感染的方法很多, 如细菌培养、形态学检查、快速尿素酶实验(RUT)及末梢血抗H pylori-IgG检测等[3], 其中形态学检查, 特别是苏木素-伊红(HE)染色, 在常规病理诊断的同时检测H pylori感染, 既评价了组织学改变状况, 又观察了H pylori感染情况[4], 故被学者广泛使用. 但以往利用HE染色在胃癌组织中很少发现H pylori感染[5]. 那么究竟在胃癌发生过程中是否始终伴有H pylori感染? 在胃癌组织中H pylori的分布状况如何? 其与不同组织学分型胃癌关系如何? 目前尚不清楚. 本研究同步利用HE及免疫组织化学方法对不同胃疾病黏膜标本进行H pylori的原位检测, 旨在探讨H pylori感染在胃癌及癌前疾病、胃癌与癌周黏膜、胃癌不同组织学类型的分布状态, 同时探讨免疫组化方法检测H pylori感染的价值.
随机选取辽宁省庄河地区1992-2007年经胃镜取材的胃黏膜标本共327例, 男201例, 女126例, 年龄32-77(平均年龄59.32)岁, 包括慢性浅表性胃炎63例、萎缩性胃炎62例, 胃癌202例. 按胃癌的Lauren's分型[6]: 肠型102例, 弥漫型100例. 所有胃癌标本中有50例带有癌周黏膜(与癌不在同一块黏膜, 无癌组织浸润).
1.2.1 免疫组织化学染色及HE染色: 免疫组织化学染色采用SP法(链酶卵白素-过氧化酶法). 一抗为多克隆兔抗H pylori-IgG(DAKO, Denmark A/S)浓缩型抗体, 工作浓度为1:25, SP试剂盒(福州迈新生物技术有限公司)操作步骤按说明书进行, 用0.01 mol/L柠檬酸缓冲液, pH 6.0±0.1进行微波H pylori抗原修复. 细菌培养的H pylori进行涂片, 阳性染色的涂片作为阳性对照, PBS代替一抗作阴性对照. HE染色即苏木素-伊红染色: 胃黏膜活检组织经950 mL/L乙醇固定, 石蜡包埋, 制成5 μm切片, HE染色, 镜下观察.
1.2.2 结果判定: 免疫组织化学染色及HE染色评分标准相同. H pylori感染的程度依据显微镜下每个视野(×1000)所见的细菌数目进行4级评分[7]: 0分: 0个; 1分: 1-9个; 2分: 10-29个; 3分: 30-99个; 4分≥100个. 分别观察黏膜(胃黏膜小凹上皮表面、腺腔内)、黏液(黏膜表面黏液及远处黏液)H pylori, 每个部位观察2个视野, 取其均数作为该部位H pylori感染的密度值, 对积分进行4级综合判定: (-)为0分; (+)为0分<积分≤1分; (++)为1分<积分≤2分; (+++)为积分>2分.
统计学处理 采用SPSS11.5软件进行χ2和配对χ2检验, 所有统计检验均为双侧概率检验, P<0.05差异有统计学意义.
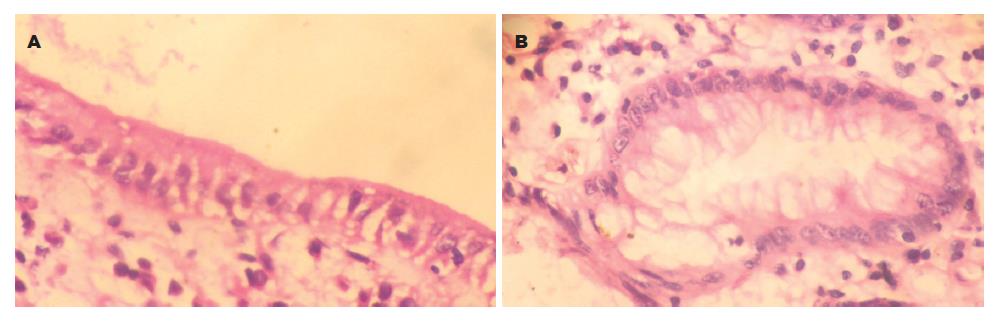
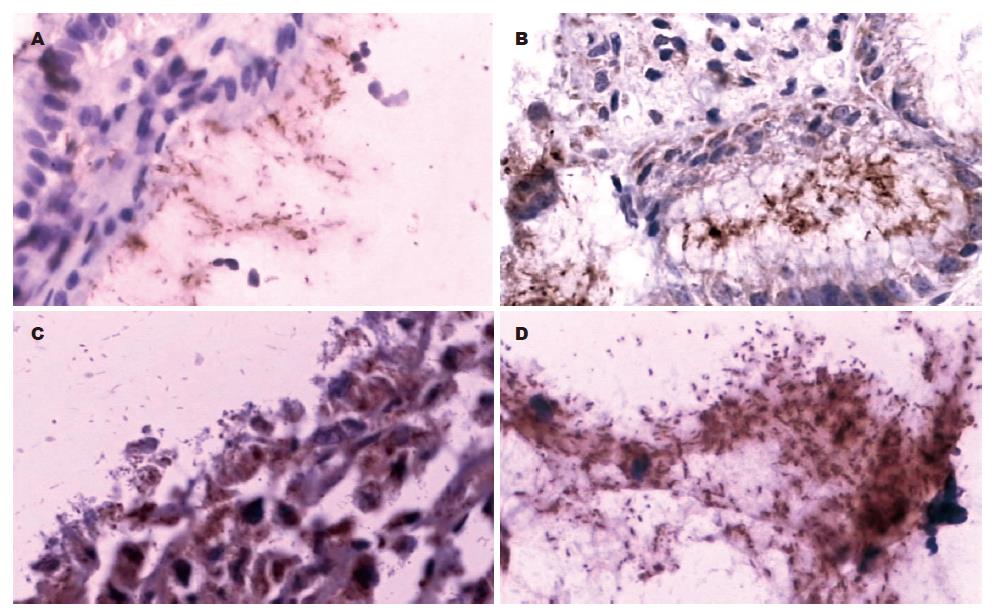
免疫组化阳性的H pylori呈黄色或棕黄色, 而HE染色H pylori呈蓝色或紫蓝色, 单个细菌为短杆状或弯曲状, 可散在、成簇或成片排列. H pylori存在于胃黏膜小凹上皮表面、腺腔内、黏膜表面黏液及远处黏液中. 免疫组化染色与HE染色比较H pylori感染密度评分, 差异具有统计学意义(P<0.01, 表1). 免疫组化染色在胃黏液内发现大量成簇或成片状排列的H pylori, 而HE染色呈阴性(图1-2).
不同胃疾病H pylori在胃黏膜分布为浅表性胃炎、萎缩性胃炎高于胃癌(χ2 = 96.998, χ2 = 87.542, P<0.01); 而不同胃疾病H pylori在胃黏液分布为H pylori密度评分≤2分时, 浅表性胃炎、萎缩性胃炎低于胃癌(χ2 = 6.526, χ2 = 6.218, P<0.01), H pylori密度评分大于2时, 浅表性胃炎、萎缩性胃炎高于胃癌(χ2 = 20.252, χ2 = 46.248, P<0.01), 萎缩性胃炎高于浅表性胃炎(χ2 = 4.746, P<0.05, 表2).
50例相对应的胃癌及癌周组织H pylori在胃黏膜分布为胃癌18.0%(9/50)低于癌周黏膜54.0%(27/50)(χ2 = 5.378, P<0.05), 而在胃黏液分布胃癌与癌周黏液两者无统计学差异(P>0.05, 表3).
肠型、弥漫型胃癌组织H pylori在胃黏膜分布为肠型高于弥漫型(χ2 = 19.253, P<0.01), 而在胃黏液中分布亦为肠型胃癌高于弥漫型(χ2 = 6.784, P<0.01); 同一类型胃癌H pylori的分布为黏液高于黏膜(P<0.01, 表4).
以往研究表明, H pylori感染与慢性浅表性胃炎、慢性萎缩性胃炎、胃及十二指肠溃疡、肠化生和胃癌相关[8-10], 是胃癌发生的始动因素[11]. 然而, 利用常规检测方法, 在慢性萎缩性胃炎、胃癌组织中H pylori检出率较低[12]. 本研究同时利用HE及免疫组织化学方法对不同胃疾病黏膜组织进行H pylori的原位检测, 发现免疫组化方法对H pylori的检出率高于HE, 此方法不仅能检测到定植于胃黏膜的H pylori, 而且还能发现大量隐藏在胃黏液内游离的H pylori, 而HE染色则为阴性. 文献报道, 免疫组织化学方法是一种特殊的检测H pylori感染的方法, 该方法观察结果较稳定[13], 观察者间的一致率高达98%[14]. 本研究免疫组化方法检测结果显示, 不同胃疾病H pylori在胃黏膜分布为浅表性胃炎、萎缩性胃炎高于胃癌(P<0.05), 在胃黏液分布为H pylori密度评分≤2分时, 浅表性胃炎、萎缩性胃炎低于胃癌(P<0.01), H pylori密度评分大于2时, 浅表性胃炎、萎缩性胃炎高于胃癌(P<0.01), 萎缩性胃炎高于浅表性胃炎(P<0.05)结果提示, 单纯检测定植于胃黏膜的H pylori数量不能全面反映患者H pylori感染的状况, 有必要对黏膜和黏液中的H pylori密度进行综合检测. 本研究发现从慢性浅表性胃炎-慢性萎缩性胃炎-胃癌发生过程中, 定植于黏膜的H pylori逐渐减少, 而黏液内H pylori密度仍处于较高水平, 尤其在萎缩性胃炎的黏液中可以检出大量H pylori. Sarosiek et al[15]报道萎缩性胃炎伴有胃酸的降低, 低胃酸影响了H pylori的定植, 但黏液内仍有H pylori的存在, 游离的H pylori可以产生溶解黏液的酶, 使黏膜层变薄, 黏蛋白成分发生变化[16-17], 有利于H pylori通过黏液屏障与胃黏膜上皮细胞发生黏附及定植. 黏附的H pylori可以产生一些毒力因子, 如细胞毒素相关蛋白A(CagA)、空泡细胞毒素(VacA)等, 直接损害胃黏膜或引起炎症反应, 增加DNA损伤的机会, 导致胃黏膜上皮细胞更新加速, 从而引起胃癌的发生[18-19]. 提示, H pylori在癌前疾病及胃癌中是始终存在的, 并处于较高水平. 那么在胃癌及癌周围组织H pylori分布如何呢? 本研究结果显示, 在胃癌及癌周围组织均可检出H pylori, 胃癌及癌周组织H pylori在胃黏膜分布为胃癌低于癌周黏膜(P<0.05), 而在胃黏液内分布胃癌与癌周黏膜两者无统计学差异(P>0.05). 从癌周组织到癌组织定植H pylori数量逐渐降低, 但其却以游离的方式存在于黏液内(76.0%), 与癌周正常组织(86.5%)经配对χ2检验无统计学差异. 说明同一患者体内癌组织及癌周围组织H pylori感染状况是相同的, 通过检测癌周围组织H pylori能够反映患者的感染状况.
目前研究表明, 肠型胃癌和弥漫性胃癌的发生过程不同. 肠型胃癌经由H pylori感染胃炎→腺体萎缩→肠上皮化生→异型增生→胃癌, 而弥漫性胃癌则很少或不经历此过程[20]. 肠型胃癌H pylori检出率高于弥漫型胃癌(94.4% vs 42.1%)[10]. 本研究显示, 在肠型及弥漫型胃癌中均可检出H pylori, 肠型、弥漫型胃癌组织H pylori在胃黏膜分布为肠型高于弥漫型(31.4% vs 7%, P<0.01), 在胃黏液分布亦为肠型胃癌高于弥漫型(91.2% vs 78%, P<0.01). 即随着胃癌分化程度的降低, 定植于黏膜的H pylori以及游离于黏液的H pylori均减少. 文献报道[21]胃上皮细胞所分泌的黏液主要分布在肠型胃癌的腺腔表面而散在分布于弥散型胃癌的基质层, H pylori则恰恰依赖于腺腔内的黏液而存活. 存活的H pylori可以不定期的与胃黏膜相互作用, 并分泌大量的cagA、vacA等毒素[22], CagA通过Ⅳ分泌系统激活某些信号转导途径引起细胞的增殖和分化[23-25], 形成不同类型的胃癌.
本研究采用免疫组化方法原位检测不同胃疾病、胃癌及癌周围黏膜、不同组织学类型胃癌H pylori在黏膜的定植状态及在黏液的游离状态的分布, 为H pylori与胃癌的发生研究提供了实验依据.
H pylori可以导致胃炎、胃溃疡以及增加胃癌的发生风险.目前, 诊断H pylori感染的方法很多, 其中形态学检查, 特别是HE, 在常规病理诊断的同时检测H pylori感染, 既评价了组织学改变状况, 又观察了H pylori感染情况, 故被学者广泛使用.
邹小明, 教授, 哈尔滨医科大学附属第二医院普外二科
Sarosiek et al研究发现萎缩性胃炎伴有胃酸的降低, 低胃酸影响了H pylori的定植, 但胃黏膜远端黏液内仍有H pylori的存在.
本研究发现, 黏膜内定植H pylori密度浅表性胃炎、萎缩性胃炎高于胃癌; 胃癌低于癌周黏膜; 肠型高于弥漫型.黏液内游离H pylori密度胃癌组织与癌周黏膜无差异.免疫组化染色检测H pylori优于HE染色. 单纯检测定植于胃黏膜的H pylori数量不能全面反映患者H pylori感染状况, 有必要对黏膜和黏液中的H pylori密度进行综合检测.
本研究选题科学, 创新性较好, 实用性较强, 统计学处理正确, 具有很好的学术价值.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Suerbaum S, Michetti P. Helicobacter pylori infection. N Engl J Med. 2002;347:1175-1186. [PubMed] [DOI] |
| 2. | Schistosomes, liver flukes and Helicobacter pylori. IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Lyon, 7-14 June 1994. IARC Monogr Eval Carcinog Risks Hum. 1994;61:1-241. [PubMed] |
| 3. | Taj Y, Essa F, Kazmi SU, Abdullah E. Sensitivity and specificity of various diagnostic tests in the detection of Helicobacter pylori. J Coll Physicians Surg Pak. 2003;13:90-93. [PubMed] |
| 4. | Ota H, Hosoda K, Kobayashi M, Genta RM. [Histological diagnosis of Helicobacter pylori using biopsy specimens]. Nippon Rinsho. 2003;61:61-65. [PubMed] |
| 5. | Sipponen P, Kosunen TU, Valle J, Riihelä M, Seppälä K. Helicobacter pylori infection and chronic gastritis in gastric cancer. J Clin Pathol. 1992;45:319-323. [PubMed] [DOI] |
| 6. | Lauren P. The two histological main types of gastric carcinoma: diffuse and so-called intestinal-type carcinoma. An attempt at a histo-clinical classification. Acta Pathol Microbiol Scand. 1965;64:31-49. [PubMed] |
| 7. | Tokunaga Y, Shirahase H, Yamamoto E, Inao R, Hamaguchi S, Kanaji K, Kitaoka A, Yagi T, Tokuka A, Ohsumi K. Modified rapid urease test for Helicobacter pylori detection in relation to an immunohistochemical stain. J Gastroenterol Hepatol. 2000;15:617-621. [PubMed] [DOI] |
| 8. | Matsuhisa T, Miki M, Yamada N, Sharma SK, Shrestha BM. Helicobacter pylori infection, glandular atrophy, intestinal metaplasia and topography of chronic active gastritis in the Nepalese and Japanese population: the age, gender and endoscopic diagnosis matched study. Kathmandu Univ Med J (KUMJ). 2007;5:295-301. [PubMed] |
| 10. | Trajkov D, Stardelova K, Dimitrova M, Mishevski J, Serafimoski V. Helicobacter pylori and gastric carcinoma. Prilozi. 2007;28:39-46. [PubMed] |
| 11. | Wu MS, Hung HW, Wang JT, Tseng CC, Shun CT, Wang HP, Lee WJ, Lin JT. Helicobacter pylori-seronegative gastric carcinoma: a subset of gastric carcinoma with distinct clinicopathologic features. Hepatogastroenterology. 1998;45:2432-2436. [PubMed] |
| 12. | Araújo-Filho I, Brandão-Neto J, Pinheiro LA, Azevedo IM, Freire FH, Medeiros AC. Prevalence of Helicobacter pylori infection in advanced gastric carcinoma. Arq Gastroenterol. 2006;43:288-292. [PubMed] |
| 13. | Marzio L, Angelucci D, Grossi L, Diodoro MG, Di Campli E, Cellini L. Anti-Helicobacter pylori specific antibody immunohistochemistry improves the diagnostic accuracy of Helicobacter pylori in biopsy specimen from patients treated with triple therapy. Am J Gastroenterol. 1998;93:223-226. [PubMed] [DOI] |
| 14. | Rotimi O, Cairns A, Gray S, Moayyedi P, Dixon MF. Histological identification of Helicobacter pylori: comparison of staining methods. J Clin Pathol. 2000;53:756-759. [PubMed] [DOI] |
| 15. | Sarosiek J, Marshall BJ, Peura DA, Hoffman S, Feng T, McCallum RW. Gastroduodenal mucus gel thickness in patients with Helicobacter pylori: a method for assessment of biopsy specimens. Am J Gastroenterol. 1991;86:729-734. [PubMed] |
| 16. | Kang HM, Kim N, Park YS, Hwang JH, Kim JW, Jeong SH, Lee DH, Lee HS, Jung HC, Song IS. Effects of Helicobacter pylori Infection on gastric mucin expression. J Clin Gastroenterol. 2008;42:29-35. [PubMed] |
| 18. | Suriani R, Colozza M, Cardesi E, Mazzucco D, Marino M, Grosso S, Sanseverinati S, Venturini I, Borghi A, Zeneroli ML. CagA and VacA Helicobacter pylori antibodies in gastric cancer. Can J Gastroenterol. 2008;22:255-258. [PubMed] [DOI] |
| 19. | Farinati F, Cardin R, Cassaro M, Bortolami M, Nitti D, Tieppo C, Zaninotto G, Rugge M. Helicobacter pylori, inflammation, oxidative damage and gastric cancer: a morphological, biological and molecular pathway. Eur J Cancer Prev. 2008;17:195-200. [PubMed] [DOI] |
| 20. | Vauhkonen M, Vauhkonen H, Sipponen P. Pathology and molecular biology of gastric cancer. Best Pract Res Clin Gastroenterol. 2006;20:651-674. [PubMed] [DOI] |
| 21. | Endo S, Ohkusa T, Saito Y, Fujiki K, Okayasu I, Sato C. Detection of Helicobacter pylori infection in early stage gastric cancer. A comparison between intestinal- and diffuse-type gastric adenocarcinomas. Cancer. 1995;75:2203-2208. [PubMed] [DOI] |
| 23. | Katoh M, Katoh M. FGF signaling network in the gastrointestinal tract (review). Int J Oncol. 2006;29:163-168. [PubMed] |
| 24. | Franco AT, Israel DA, Washington MK, Krishna U, Fox JG, Rogers AB, Neish AS, Collier-Hyams L, Perez-Perez GI, Hatakeyama M. Activation of beta-catenin by carcinogenic Helicobacter pylori. Proc Natl Acad Sci USA. 2005;102:10646-10651. [PubMed] [DOI] |
| 25. | Snider JL, Allison C, Bellaire BH, Ferrero RL, Cardelli JA. The beta1 integrin activates JNK independent of CagA, and JNK activation is required for Helicobacter pylori CagA+-induced motility of gastric cancer cells. J Biol Chem. 2008;283:13952-13963. [PubMed] [DOI] |