修回日期: 2008-10-23
接受日期: 2008-10-27
在线出版日期: 2008-11-28
目的: 观察小分子三肽化合物酪丝缬肽(tyroservatide, YSV)对人肝癌细胞系SMMC-7721的抑制作用, 并分析YSV对肿瘤细胞血管生成相关基因表达的影响.
方法: 建立人肝癌细胞SMMC-7721的体外培养体系, 采用四甲基偶氮唑蓝(MTT)比色法检测YSV对体外培养的SMMC-7721的增殖抑制作用, 应用功能分类基因芯片分析人肝癌细胞SMMC-7721经药物作用后血管生成相关基因表达的差异变化, 同时应用RT-PCR方法验证相关基因的表达.
结果: YSV能显著抑制人肝癌SMMC-7721的生长, 10 mg/L YSV作用72 h对SMMC-7721的增殖抑制率为42.34%, 与对照组比较有统计学意义(P<0.05). 在113个血管生成相关基因中, YSV组相比对照组, 基因下调0.667倍以上的有7个. RT-PCR在基因水平上证实YSV能显著抑制血管内皮生长因子(VEGF)和白介素8(IL-8)的表达.
结论: YSV在体外能够显著抑制人肝癌细胞SMMC-7721的生长, 并能在基因水平上下调肿瘤细胞血管生成相关因子的表达.
引文著录: 张宁, 王鲁, 赵一鸣, 梁英, 吴伟忠, 樊嘉, 汤钊猷. 酪丝缬肽对人肝癌细胞SMMC-7721血管生成相关基因表达谱的影响. 世界华人消化杂志 2008; 16(33): 3719-3723
Revised: October 23, 2008
Accepted: October 27, 2008
Published online: November 28, 2008
AIM: To observe inhibitory effects of tripeptide compound tyroservatide (YSV) on proliferation of human hepatocarcinoma cell SMMC-7721, and to apply cDNA microarray to analyze its influence on angiogenesis-related gene expression profile of SMMC-7721.
METHODS: A culture system of SMMC-7721 in vitro was established. The inhibitory effects of tyroservatide on growth of SMMC-7721 was detected using 3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) colorimetric assay. Gene expression profile of SMMC-7721 was detected by Oligo angiogenesis microarray analysis. Semi-quantitative reverse transcription-polymerase chain reaction (RT-PCR) was used to verify the results of the specific genes.
RESULTS: YSV significantly inhibited the growth of SMMC-7721; the proliferative inhibition rate was 42.34%, when YSV was used for 72 hours at concentration of 10 mg/L. The difference was significant compared with the control group (P < 0.05). After YSV treatment, 7 genes were down-regulated at least 0.667 fold among a total of 113 angiogenesis genes, compared with control group. YSV significantly inhibited the gene expression of angiogenesis factors such as vascular endothelial growth factor (VEGF) and interleukin-8 (IL-8) confirmed by RT-PCR.
CONCLUSION: YSV could significantly inhibit the growth of human hepatocarcinoma SMMC-7721 in vitro, and down-regulate expression of angiogenesis factors at genetic level.
- Citation: Zhang N, Wang L, Zhao YM, Liang Y, Wu WZ, Fan J, Tang ZY. Microarray analysis of tyroservatide-regulated angiogenesis gene expression profile in human hepatocellular carcinoma cell SMMC-7721. Shijie Huaren Xiaohua Zazhi 2008; 16(33): 3719-3723
- URL: https://www.wjgnet.com/1009-3079/full/v16/i33/3719.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i33.3719
原发性肝癌(主要为肝细胞癌, 以下简称肝癌)是我国最常见的恶性肿瘤之一, 每年新发病例约占全球新发肝癌总病例的55%, 病死率在国内男性中排第二位, 女性中排第三位[1-2]. 外科手术切除是主要的肝癌治疗方法, 但由于术后的高复发率, 使得手术的效果并不能令人满意[3]. 且很多患者明确诊断时已处于肝癌晚期, 具有手术机会的患者只占30%左右, 传统的细胞毒性化疗方法也并未表现出对肝癌的明显有效性[4]. 因此对于多数肝癌患者, 寻找有效、低毒且针对肝癌特异性高的新型药物仍是临床亟待解决的问题. 小分子肽是一类有广泛生物学活性的肽类化合物, 有多肽疫苗、多肽抗生素、抗病毒多肽、心血管活性肽、细胞因子模拟肽和抗肿瘤多肽等. 在抗肿瘤多肽研究方面, 已经发现一个六肽在体内可以显著抑制腺瘤生长(包括肺、胃及大肠腺瘤)[5]. 我们研究的小分子三肽化合物酪丝缬肽(tyroservatide, YSV)由三个氨基酸组成, 化学结构组成为L-酪氨酸-L-丝氨酸-L-缬氨酸, 分子结构为C17H25N3O6, 相对分子质量为367.40 Da. 我们观察YSV对体外培养的人肝癌细胞SMMC-7721生长抑制作用, 并应用基因芯片技术分析YSV对人肝癌细胞血管生成相关基因表达的影响, 为酪丝缬肽抗肿瘤作用机制的研究提供新的思路.
YSV由中国深圳康哲药业有限公司提供, RPMI Medium 1640培养液及小牛血清均购自Gibco公司, MTT购自SIGMA试剂公司. 细胞株为复旦大学附属中山医院肝癌研究培养的人肝癌细胞SMMC-7721.
1.2.1 细胞培养: 人肝癌细胞SMMC-7721采用含100 mL/L FBS的RPMI 1640培养基培养, 950 mL/L湿度, 50 mL/L CO2, 37 ℃. 所用细胞在体外培养均不超过5代, 选生长状态好, 处于对数生长期的细胞进行实验.
1.2.2 MTT测定: SMMC-7721用含100 mL/L FBS的RPMI 1640培养基稀释成1×107/L, 分别接种于96孔细胞培养板中, 2000个/孔, 每组四个复孔, 细胞贴壁24 h后加入相应药物. 实验分组: 药物干预组, 药物均使用含100 mL/L FBS的RPMI 1640培养液稀释, 加入细胞培养板, 使YSV的终浓度分别为0.01、0.1、1.0、10、100 mg/L, 每孔0.2 mL. 阴性对照组, 加入等体积50 mL/L FBS的RPMI 1640培养液. 50 mL/L CO2, 37 ℃条件下, 药物作用24、48、72 h后进行MTT检测, 操作按试剂盒说明书进行, 用酶标仪测定不同作用时间下细胞的吸光度(A490), 计算酪丝缬肽对人肝癌SMMC-7721生长的影响和抑制情况. 抑制率 = (对照组A490-药物组A490)/对照组A490×100% .
1.2.3 基因芯片的制备: (1)样本RNA的抽提: 选取对照组及YSV(10, 100 mg/L作用72 h)的药物干预组细胞, 每份样品约1×106-1×107细胞, 加入1 mL的RNA抽提试剂TRIzol(Invitrogen, Inc. Carlsbad, CA, USA). (2)样本RNA质量检测: 使用Nanodrop测定RNA在分光光度计260、280和230 nm的吸收值, 以计算浓度并评估纯度. 用甲醛电泳试剂进行变性琼脂糖凝胶电泳, 检测RNA纯度及完整性. (3)制备生物素标记的cRNA探针: 采用SuperArray公司的Truelabeling-AMPTM线性RNA扩增试剂盒合成生物素标记的cRNA探针, 包括: 样本RNA进行逆转录反应合成cDNA; 在逆转录反应中加入RNA扩增缓冲液, 生物素标记的UTP和扩增酶类混合液, 合成生物素标记的cRNA探针; 使用Super Array Grade cRNA纯化试剂盒纯化cRNA探针. (4)芯片杂交: 将纯化的cRNA探针在GEAhyb杂交液条件下与所选择的Oligo GEArray系列芯片杂交. (5)化学发光检测: cRNA探针与芯片杂交后, 加入链亲和素耦联的碱性磷酸酶(AP)及化学发光底物反, X射线胶片曝光在胶片上显示检测结果. (6)图像采集与数据分析: X-射线胶片曝光后, 将胶片上的图象用扫描仪扫描并转换为灰度TIFF格式的图片文件保存, 使用配套软件GEArray Expression Analysis Suite对原始数据进行完整的芯片数据分析.
1.2.4 RT-PCR方法检测YSV对肿瘤细胞血管生成相关基因表达的影响: 所选取细胞为YSV 10 mg/L, 作用72 h的药物干预组及阴性对照组, RT-PCR方法检测YSV作用后对肿瘤细胞血管生成相关基因促血管生成因子(vascular endothelial growth factor, VEGF)及IL-8表达的影响. 使用TRIzol(Invitrogen, Inc. Carlsbad, CA, USA)提取肿瘤细胞中的总RNA, 用Reverse Transcription System(Promega, Inc. Madison, WI, USA)扩增相关基因的mRNA, RT-PCR反应条件及引物序列见表1. 应用20 g/L琼脂糖凝胶电泳PCR产物, 100 mV恒压电泳40min, 在紫外灯下观察照相. 以β-actin作为内参照, 以靶基因/β-actin灰度比值作为mRNA的相对表达丰度.
| 基因 | 引物(5'-3') | 退火温度( ℃) | 周期 | 大小(bp) |
| β-actin | Sense: ATGGAAGAAGAAATCGCCGC | 55 | 30 | 287 |
| Antisense: ACACGCAGCTCGTTGTAGAA | ||||
| VEGF | Sense: GCAGAAGGAGGAGGGCAGAATC | 60 | 40 | 149 |
| Antisense: GGCACACAGGATGGCTTGAAG | ||||
| IL-8 | Sense: CAAACCTTTCCACCCCAAAT | 56 | 30 | 197 |
| Antisense: CAAACCTTTCCACCCCAAAT |
统计学处理 应用SPSS11.5统计软件进行分析, MTT实验数据以mean±SD表示, 应用方差分析方法统计各组数据, P<0.05为有统计学意义, 使用芯片配套软件GEArray Expression Analysis Suite对基因芯片数据进行分析.
不同浓度YSV在不同时段对人肝癌细胞SMMC-7721均有一定的抑制作用, 与对照组比较有显著地差异(P<0.05); YSV作用72 h时各浓度对肿瘤细胞的抑制作用最为明显, 尤其在剂量10 mg/L时, 抑制率可以达到42.34%(表2).
使用综合型GEArray表达分析配套软件(GEArray Expression Analysis Suite)将灰度TIFF格式图片的点阵转换为数字数据以分析芯片结果. 三组细胞血管生成相关基因芯片检测结果比较: YSV(10 mg/L, 72 h)组与对照组相比较, 有7个基因下调0.667以上(表3); YSV(100 mg/L, 72 h)组与对照组比较, 有6个基因下调0.667倍以上(表4). 其中VEGF与IL-8下调最为明显, 并进一步通过RT-PCR得到了验证.
| Symbol | YSV | 对照组 | YSV/对照组 |
| CCL11 | 0.0881 | 0.1387 | 0.6350 |
| FGF6 | 0.0061 | 0.0093 | 0.6631 |
| IL8 | 0.0056 | 0.0172 | 0.3263 |
| IL10 | 0.0061 | 0.0100 | 0.6059 |
| NUDT6 | 0.0437 | 0.1177 | 0.3717 |
| VEGF | 0.0188 | 0.1121 | 0.1684 |
| VG5Q | 0.0936 | 0.2055 | 0.4557 |
| Symbol | YSV | 对照组 | YSV/对照组 |
| CCL11 | 0.0680 | 0.1387 | 0.4903 |
| CXCL2 | 0.0901 | 0.1567 | 0.5750 |
| IL8 | 0.0072 | 0.0172 | 0.4201 |
| IL10 | 0.0065 | 0.0101 | 0.6442 |
| NUDT6 | 0.0580 | 0.1177 | 0.4901 |
| VEGF | 0.0275 | 0.1121 | 0.2453 |
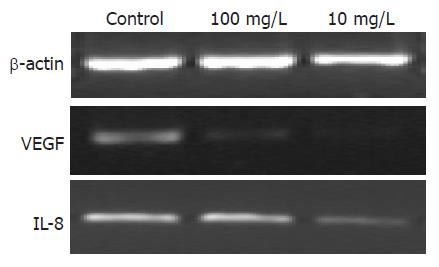
为验证基因芯片的结果, 选取VEGF和IL-8这两个差异显著的促血管生成因子, 应用RT-PCR法进行验证. 与基因芯片结果一致, YSV 10 mg/L, 作用72 h后可以明显地抑制肿瘤细胞VEGF和IL-8 mRNA表达(图1).
肝细胞癌是一种多血管实体肿瘤[6], 其中丰富的血管成为肝癌具有生长快、转移早及浸润广泛的生物学特点的物质基础. 促血管生成因子对新生血管起着积极的正向调节的作用, VEGF被认为是肿瘤组织中最主要的促血管生长因子, 在肝脏由肝硬化向肝癌的转化及刺激肝癌血管生成过程中发挥关键作用[7]. Poon et al[8]发现原发性肝癌患者术前血清中高浓度VEGF和临床病理特征中肿瘤包膜不完整、肝内转移、静脉侵袭、肿瘤分期呈明显正相关. VEGF通过与其在内皮细胞的受体VEGFR结合并相互作用激活多条信号转到通路, 如Akt/PI3K/MAPK通路, 进而诱导内皮细胞增殖、迁徙[9]. Li et al[10]发现肝癌患者血清中VEGF mRNA表达水平与肿瘤组织内微血管密度成明显正相关. 此外由于在新生血管化中的重要作用, VEGF也在一定程度上促进了肿瘤转移及复发[11].
IL-8是CXC趋化因子家族中的一员, 并被证实在多种实体肿瘤中具有强烈的促血管生成的作用[12]. 当肝癌侵犯血管及胆管, IL-8的表达上调, 由肝细胞分泌的IL-8在体外同样可以刺激人脐静脉内皮细胞的增殖[13]. IL-8可以直接提高内皮细胞的生存能力, 促进内皮细胞增生并上调基质金属蛋白酶的表达, 进而调节血管生成[14]. Ren et al[15]研究发现肝癌患者血清中IL-8高水平可以反映出肿瘤组织中新生血管活动旺盛及肿瘤生长迅速. Huang et al[16]发现一种以IL-8为靶向目标的人源中和抗体对于黑色素瘤的生长、转移和血管生长具有潜在的治疗意义.
生物活性多肽近来逐渐受到关注, 已有几十余种多肽类药物进入临床研究, 多集中在多肽疫苗、多肽抗生素、抗病毒多肽、心血管活性肽和抗肿瘤多肽[17]. 相关文献报道酪丝缬肽可抑制肝癌细胞BEL-7402裸鼠移植瘤的生长, 通过抑制肿瘤增殖相关基因的表达, 增强抑制肿瘤生长相关基因的表达发挥抗肿瘤活性[18]. 贾静 et al[19]研究发现YSV通过抑制人肝癌细胞BEL-7402增殖、降低细胞代谢和破坏肿瘤细胞细胞膜的完整性、诱导肿瘤细胞凋亡、坏死来发挥抗肿瘤作用. 另外YSV能够促进PTEN, 并抑制AKT、P21、P27的表达来抑制人肝癌细胞BEL-7402裸鼠移植瘤的生长[20]. 本课题主要针对酪丝缬肽对人肝癌细胞SMMC-7721的抑制作用并探讨对其血管生成相关基因表达的影响. 体外MTT实验结果显示酪丝缬肽能够显著抑制肿瘤细胞的生长, 当用药剂量为10 mg/L, 作用时间72 h时, 抑制率可达42.34%, 与对照组相比具有统计学意义.
在证实YSV对人肝癌细胞SMMC-7721药效的基础上, 我们应用血管生成相关基因芯片筛选YSV对人肝癌细胞SMMC-7721血管生成相关基因表达的影响, 该基因芯片是美国SuperArray公司生产的功能分类基因芯片, 是将微阵列技术与特定生物学通路的最新知识有机结合, 可以大大缩短发现诊治各种疾病的生物学标志物的时间, 已成为生物学通路研究的重要工具. 他与表达谱基因芯片的本质区别就在于剔除了基因芯片上对研究对象毫无意义的基因, 我们可以把功能分类基因芯片的结果比作对基因图谱进行局部"放大"的分子图像. 基因芯片结果显示, 在113个血管生成相关基因中, YSV组(10 mg/L, 72 h)相对于对照组, 下调0.667倍以上的有7个基因, 分别是CCL11、FGF6、IL-8、IL-10、NUDT6、VEGF、VG5Q, 均为促血管生成相关基因, 其中差异最显著的为VEGF与IL-8.
YSV能够在基因水平上抑制肝癌细胞血管生成相关因子的表达, 为进一步探讨YSV抗肿瘤机制提供了新的思路. 如上所述YSV对其他肿瘤细胞的作用机制复杂, 其药效的发挥是多通路、多环节共同作用的结果, 且体外实验无法模拟体内复杂的生物学环境, YSV可能通过抑制血管生成相关基因的表达并结合其他作用机制来产生对SMMC-7721的抑制作用. 鉴于离体实验的局限性, 因此YSV具体的抗血管生成作用还有待于动物模型的证实.
酪丝缬肽(YSV)可以通过诱导细胞凋亡、坏死, 破坏肿瘤细胞膜的完整性来有效的抑制肝癌细胞的增殖活性, 而目前尚无酪丝缬肽抗肿瘤细胞血管生成作用的相关报道.
李涛, 副主任医师, 北京大学人民医院肝胆外科
小分子肽是一类有广泛生物学活性的肽类化合物, 有多肽疫苗、多肽抗生素、抗病毒多肽、心血管活性肽、细胞因子模拟肽和抗肿瘤多肽等. 在抗肿瘤多肽研究方面, 已经发现一个六肽在体内可以显著抑制腺瘤生长(包括肺、胃及大肠腺瘤).
国内学者Jia et al研究发现YSV通过抑制人肝癌细胞BEL-7402增殖、降低细胞代谢和破坏肿瘤细胞细胞膜的完整性、诱导肿瘤细胞凋亡、坏死来发挥抗肿瘤作用.
对于多血管实体肿瘤, 抗血管生成治疗是当前研究的热点, 而肝细胞癌作为一种多血管肿瘤, 其中丰富的血管是使其具有生长快、转移早及浸润广泛的生物学特点的物质基础, 抑制肝癌组织中新生血管的生长对于肝癌的治疗具有特殊的意义, 本研究主要针对酪丝缬肽对人肝癌细胞SMMC-7721的抑制作用并探讨对其血管生成相关基因表达的影响.
本文首次证实了酪丝缬肽能够体外抑制肝癌细胞促血管生成相关基因的表达, 为酪丝缬肽治疗肝癌的临床应用中提供一些有意义的实验基础.
本研究方法合理, 结果可信, 具有一定的创新性和实用性, 学术价值较好.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Tang ZY. Small hepatocellular carcinoma: current status and prospects. Hepatobiliary Pancreat Dis Int. 2002;1:349-353. [PubMed] |
| 2. | Tang ZY. Hepatocellular carcinoma--cause, treatment and metastasis. World J Gastroenterol. 2001;7:445-454. [PubMed] |
| 3. | Poon RT, Fan ST, Lo CM, Ng IO, Liu CL, Lam CM, Wong J. Improving survival results after resection of hepatocellular carcinoma: a prospective study of 377 patients over 10 years. Ann Surg. 2001;234:63-70. [PubMed] [DOI] |
| 4. | Bruix J, Sherman M, Llovet JM, Beaugrand M, Lencioni R, Burroughs AK, Christensen E, Pagliaro L, Colombo M, Rodés J. Clinical management of hepatocellular carcinoma. Conclusions of the Barcelona-2000 EASL conference. European Association for the Study of the Liver. J Hepatol. 2001;35:421-430. [PubMed] [DOI] |
| 5. | Fujisawa N, Sakao Y, Hayashi S, Hadden WA 3rd, Harmon CL, Miller EJ. alpha-Chemokine growth factors for adenocarcinomas; a synthetic peptide inhibitor for alpha-chemokines inhibits the growth of adenocarcinoma cell lines. J Cancer Res Clin Oncol. 2000;126:19-26. [PubMed] [DOI] |
| 6. | Poon RT, Ng IO, Lau C, Yu WC, Yang ZF, Fan ST, Wong J. Tumor microvessel density as a predictor of recurrence after resection of hepatocellular carcinoma: a prospective study. J Clin Oncol. 2002;20:1775-1785. [PubMed] [DOI] |
| 7. | Zhang ZL, Liu ZS, Sun Q. Expression of angiopoietins, Tie2 and vascular endothelial growth factor in angiogenesis and progression of hepatocellular carcinoma. World J Gastroenterol. 2006;12:4241-4245. [PubMed] |
| 8. | Poon RT, Ng IO, Lau C, Zhu LX, Yu WC, Lo CM, Fan ST, Wong J. Serum vascular endothelial growth factor predicts venous invasion in hepatocellular carcinoma: a prospective study. Ann Surg. 2001;233:227-235. [PubMed] [DOI] |
| 9. | Vogel C, Bauer A, Wiesnet M, Preissner KT, Schaper W, Marti HH, Fischer S. Flt-1, but not Flk-1 mediates hyperpermeability through activation of the PI3-K/Akt pathway. J Cell Physiol. 2007;212:236-243. [PubMed] [DOI] |
| 10. | Li XM, Tang ZY, Qin LX, Zhou J, Sun HC. Serum vascular endothelial growth factor is a predictor of invasion and metastasis in hepatocellular carcinoma. J Exp Clin Cancer Res. 1999;18:511-517. [PubMed] |
| 11. | Niu Q, Tang ZY, Ma ZC, Qin LX, Zhang LH. Serum vascular endothelial growth factor is a potential biomarker of metastatic recurrence after curative resection of hepatocellular carcinoma. World J Gastroenterol. 2000;6:565-568. [PubMed] |
| 12. | Lin Y, Huang R, Chen L, Li S, Shi Q, Jordan C, Huang RP. Identification of interleukin-8 as estrogen receptor-regulated factor involved in breast cancer invasion and angiogenesis by protein arrays. Int J Cancer. 2004;109:507-515. [PubMed] [DOI] |
| 13. | Akiba J, Yano H, Ogasawara S, Higaki K, Kojiro M. Expression and function of interleukin-8 in human hepatocellular carcinoma. Int J Oncol. 2001;18:257-264. [PubMed] |
| 14. | Li A, Dubey S, Varney ML, Dave BJ, Singh RK. IL-8 directly enhanced endothelial cell survival, proliferation, and matrix metalloproteinases production and regulated angiogenesis. J Immunol. 2003;170:3369-3376. [PubMed] |
| 15. | Ren Y, Poon RT, Tsui HT, Chen WH, Li Z, Lau C, Yu WC, Fan ST. Interleukin-8 serum levels in patients with hepatocellular carcinoma: correlations with clinicopathological features and prognosis. Clin Cancer Res. 2003;9:5996-6001. [PubMed] |
| 16. | Huang S, Mills L, Mian B, Tellez C, McCarty M, Yang XD, Gudas JM, Bar-Eli M. Fully humanized neutralizing antibodies to interleukin-8 (ABX-IL8) inhibit angiogenesis, tumor growth, and metastasis of human melanoma. Am J Pathol. 2002;161:125-134. [PubMed] |
| 17. | Janin YL. Peptides with anticancer use or potential. Amino Acids. 2003;25:1-40. [PubMed] |
| 18. | 王 松, 陆 融, 朱 智彤, 赵 茜, 卢 奕, 贾 静, 傅 正, 周 春雷, 赵 岚, 李 会强. 三肽化合物酪丝缬肽对人肝癌裸鼠移植瘤基因表达谱的影响. 肿瘤. 2006;26:699-704. |
| 19. | 贾 静, 朱 智彤, 陆 融, 赵 茜, 李 国力, 金 孟珏, 李 会强, 姚 智. 三肽化合物酪丝缬肽对人肝癌细胞BEL-7402增殖抑制作用的实验研究. 中国药理学通报. 2005;21:1433-1437. |
| 20. | Zhu Z, Jia J, Lu R, Lu Y, Fu Z, Zhao L, Wang L, Jin M, Zhao L, Gao W. Expression of PTEN, p27, p21 and AKT mRNA and protein in human BEL-7402 hepatocarcinoma cells in transplanted tumors of nude mice treated with the tripeptide tyroservatide (YSV). Int J Cancer. 2006;118:1539-1544. [PubMed] [DOI] |