修回日期: 2008-10-12
接受日期: 2008-10-14
在线出版日期: 2008-11-28
目的: 探讨restin基因转染对胃癌细胞BGC- 803裸鼠移植瘤生长抑制作用及对肿瘤血管生成的影响.
方法: 将重组质粒pEGFP-restin转染BGC-803细胞, 以绿色荧光蛋白示踪其对胃癌细胞BGC-803生长的影响; RT-PCR鉴定目的基因的表达; 通过裸鼠移植瘤实验比较restin对裸鼠移植瘤的生长抑制作用, 免疫组织化学染色方法观察微血管密度(MVD)和血管内皮生长因子(VEGF)的表达.
结果: 重组质粒经RT-PCR扩增后在600 bp处稳定表达; 将pEGFP-restin重组质粒转染胃癌细胞BGC-803, 荧光显微镜下见转染组细胞发出绿色荧光, 肿瘤细胞形态不一; 裸鼠移植瘤实验显示, 与对照组(空载体组和未转染组)比较, 转染组胃癌细胞生长速度缓慢, 肿瘤体积小(P<0.01); 空载体组与转染组的抑瘤率分别为3.60%、29.02%; 免疫组化显示, 转染组肿瘤微血管密度减少(4.25±0.29 vs 9.79±0.94, 10.34±1.22, 均P<0.05), 转染组VEGF表达降低(12.24±3.45 vs 44.52±9.70, 39.76±6.38, 均P<0.05).
结论: restin基因转染可抑制裸鼠移植瘤生长, 影响肿瘤新生血管形成可能是其抗肿瘤作用之一.
引文著录: 张建永, 李锦毅, 李红玉, 戴聪, 马春雷, 王向党. restin基因转染对裸鼠胃癌移植瘤生长的影响. 世界华人消化杂志 2008; 16(33): 3713-3718
Revised: October 12, 2008
Accepted: October 14, 2008
Published online: November 28, 2008
AIM: To investigate the inhibitory effect of restin transfection on the growth of human gastric cancer BGC-803 tumor xenograft in nude mouse model with the localized expression of restin and to explore its effect on angiogenesis.
METHODS: Gastric cancer BGC-803 cell line was transfected with recombinant pEGFP-restin through LipofectamineTM2000 mediation. The effect on BGC-803 growth was observed by enhanced green fluorescent proteins assay. The expression of restin gene was detected using restriction endonuclease analysis and RT-PCR; cell cycle was observed using flow cytometry (FCM). Through in vitro study, growth inhibition of the restin on the cancer was observed in nude mice. Microvessel density (MVD) and expression of vascular endothelial growth factor (VEGF) were assessed by immunohistochemistry.
RESULTS: The results of identification by restriction endonuclease analysis and RT-PCR demonstrated that restin gene was stably expressed in BGC-803 cells transfected with pEGFP-restin and that significant expression of EGFP was observed in these cells with irregularity. Slower growth speed and smaller volume were found in pEGFP-restin thansfecting cell group than in control group (P < 0.01). The inhibition rates of tumor in empty vector and pEGFP-restin thansfecting cell group were 3.60% and 29.02%, respectively. The MVD was lower in pEGFP-restin thansfecting cell group than in control group (4.25 ± 0.29 vs 9.79 ± 0.94, 10.34 ± 1.22, both P < 0.05); the expression of VEGF was down-regulated compared with control group (12.24 ± 3.45 vs 44.52 ± 9.70, 39.76 ± 6.38, both P < 0.05).
CONCLUSION: Restin transfection could inhibit BGC-803 cell growth in nude mice, which may be related to inhibition of angiogenesis in gastric cancer.
- Citation: Zhang JY, Li JY, Li HY, Dai C, Ma CL, Wang XD. Effect of restin gene transfection on human gastric carcinoma xenograft growth in nude mice. Shijie Huaren Xiaohua Zazhi 2008; 16(33): 3713-3718
- URL: https://www.wjgnet.com/1009-3079/full/v16/i33/3713.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i33.3713
1972年, Folkman[1]提出"抗肿瘤新生血管形成"的设想, 通过抑制或破坏肿瘤新生血管形成及生长, 切断肿瘤赖以生存的基础, 达到控制肿瘤生长和转移的目的, 这一设想已被越来越多的研究所证实. 人胶原XV的C末端非胶原结构域(NC10 domain of α1 chain of collagen type XV), 由180个氨基酸组成. 1999年, Ramchandran et al[2]首先克隆并表达了人胶原XV的C末端非胶原结构域, 并将其命名为restin. 序列分析表明, restin与内皮抑素(endostatin)同源, 可靶向抑制血管内皮细胞的迁移和生长. 此前, 我们前期成功构建了pEGFP-restin重组质粒, 并在细胞中稳定表达[3], 为下一步工作奠定了基础. 本研究通过绿色荧光蛋白, 并观察restin基因对胃癌裸鼠移植瘤生长的影响, 观察其对胃肿瘤血管的抑制作用, 初步探讨restin基因在肿瘤治疗中的作用及可能机制.
Balb/c-nu裸鼠由中国科学院肿瘤医院基础所提供. pEGFP-C1质粒由中国人民解放军军事医学科学院庞博博士惠赠, pEGFP-restin质粒由中国人民解放军武警总医院中心实验室构建, 人胃癌BGC-803细胞系由北京肿瘤医院基础所提供. 限制性内切酶BamHⅠ和EcoRⅠ、DNA-Marker购自天佑达生物工程科技有限公司, 脂质体Lipofectamine购于美国Invitrogen公司, DNA凝胶纯化试剂盒、TRIzol-RNA提取试剂盒、Wizard Plus SV Minipreps试剂盒均购自北京全式金生物技术有限公司, Reverse Transcription System试剂盒购自Promega公司. 兔抗人VEGF多克隆抗体、鼠抗人CD34 mAb及即用型免疫组化二步法试剂盒均购自北京百奥泰斯生物科技有限公司.
1.2.1 质粒扩增和细胞转染: 将pEGFP-restin质粒用热击法转化感受态细胞, 在含有氨苄青霉素的LB培养基中培养, 筛选阳性克隆扩大培养, 提取并纯化质粒DNA, 将获得的重组质粒DNA, 紫外分光光度计测定其纯度, 用BamHⅠ和EcoRⅠ酶切鉴定, pEGFP-C1和pEGFP-restin经酶切电泳后分别出现4.7 kb、4.7 kb和600 bp的条带. 选取对数生长期的BGC-803细胞培养, 待细胞融合率达90%-95%时, 按LipofectamineTM2000试剂盒说明书, 将重组质粒DNA转染BGC-803细胞, 以转染pEGFP-C1为空载体对照组, 并设未转染对照组, 转染48 h后, 待其细胞融合率达80%时, 加入1 g/L G418进行筛选, 使转染后的BGC-803细胞选择性生长, 2 wk后未转染组细胞相继死亡, 转染组和空载体组均出现肉眼可见的细胞克隆, 随机挑选抗性克隆, 待扩增后备用. 转染后24, 48, 72 h荧光显微镜观察细胞表达绿色荧光蛋白(EGFP)情况, 判断细胞转染效率及转染后生长状态.
1.2.2 RT-PCR检测restin的表达: 分别收集未转染组、空载体组及转染restin组细胞进行RT-PCR检测, 按照TRIzol试剂盒说明书提取总RNA, 设计restin基因的上游引物: 5'-ggatccatttcaagtgccaatcatgagaagcct-3', 下游引物: 5'-gaattcttacttcctagcgtctgtcatgaaact-3', 反应体系50 μL, 反应条件为: 94 ℃变性30 s, 60 ℃退火30 s, 72 ℃延伸60 s, 循环30次; 72 ℃延伸5 min, 琼脂糖凝胶电泳分析.
1.2.3 裸鼠移植瘤实验: 24只SPF级裸鼠, 随机分为未转染组、空载体(pEGFP-C1)组和转染(pEGFP-restin)组, 每组8只, 按3×106/只在裸鼠右侧腋窝皮下分别注射三组细胞, 观察肿瘤出现时间, 成瘤后每隔2 d测量肿瘤的长径(a)和短径(b), 取平均值绘制肿瘤生长曲线, 瘤体积V = (a×b2)/2(mm3), 连续14 d观察, 26 d处死裸鼠, 剥离肿瘤称质量. 抑瘤率(%) = (未转染组平均瘤质量-各组平均瘤质量)/未转染组平均瘤质量×100%.
1.2.4 免疫组化检测肿瘤微血管密度(MVD)及VEGF的表达: 26 d处死裸鼠后, 将肿瘤组织以甲醛固定, 制成石蜡切片, 常规HE染色光镜下观察, 并进行免疫组化, 采用即用型二步法, 步骤按试剂盒说明进行. 主要步骤: 载玻片防脱片处理, 6 μm厚连续切片, 二甲苯脱蜡, 梯度乙醇脱水, 微波修复20 min, 30 mL/L的H2O2室温孵育5-10 min, 以消除内源性过氧化物酶的活性, PBS洗三次, 分别滴加50 μL的一抗(CD34, 1:200; VEGF, 1:500); 4 ℃过夜, PBS漂洗3次, 每张切片滴加50 μL过氧化氢酶-免疫球蛋白聚合物, 37 ℃孵育15 min, PBS洗3次, 每张切片滴100 μL DAB, 显微镜下控制染色15 min. 蒸馏水洗, 苏木精复染、脱水、透明、封片. 显微镜下读片、摄影, 每张切片用0.01 mol/L PBS代替一抗作空白对照, 用非免疫血清代替一抗作阴性对照. 参照Weidner[4]和Maeda的方法, 即在低倍镜下(×40)选择微血管密集区(hot spots), 再在高倍镜(×200)下观察, 以3个热点区域CD34着色的平均血管数为MVD. VEGF免疫组化结果判定. 观察棕黄或棕褐色颗粒的分布情况, 有棕黄或棕褐色颗粒且强度高于背景的非特异性着色为阳性细胞; 细胞内无棕黄或棕褐色颗粒为阴性细胞.
统计学处理 采用SPSS16.0统计软件, 实验数据用mean±SD表示, 计量资料采用单因素方差分析和t检验, P<0.05为差异有统计学意义.
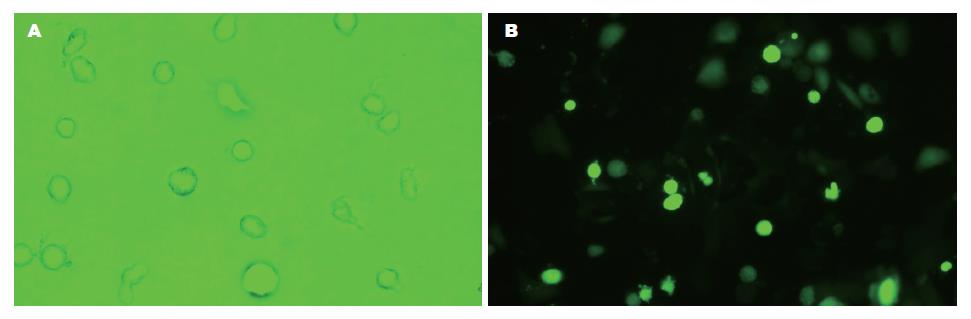
重组质粒扩增后, 酶切鉴定正确后转染BGC-803细胞. 荧光显微镜下显示, 转染重组质粒和空载体的细胞均有绿色荧光蛋白表达, 48 h呈现明亮的绿色荧光, 转染组约70%-80%的细胞发出绿色荧光. 肿瘤细胞形态大小不一, 部分肿瘤细胞缩小变圆, 并未影响生长速度. 表明带有restin的重组质粒在胃癌细胞中分子水平上表达(图1).
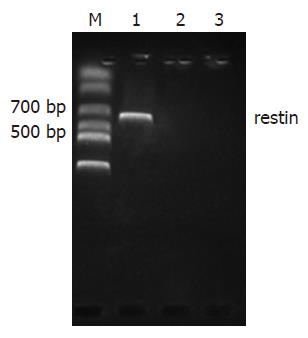
胃癌细胞BGC-803经质脂体法进行重组质粒转染后, 提取三组细胞总RNA, 逆转录合成cDNA, 经RT-PCR扩增后, 5%琼脂糖电泳显示, 转染组可见清晰的约600 bp的restin目的基因条带(图2), 空载体组和未转染组未见特异条带出现.
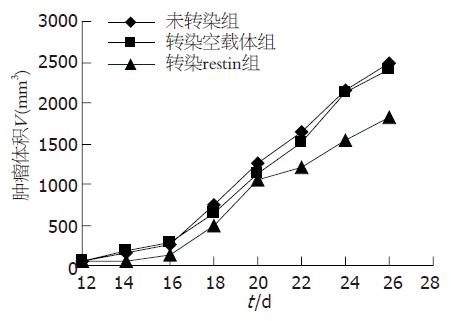
荷瘤后12 d至14 d裸鼠皮下全部成瘤, 接种26 d后, 未转染组、空载体组、转染组裸鼠移植瘤体积分别为2480.80±302.52 mm3、2413.98±272.00 mm3、1817.88±359.31 mm3(图3), 转染组肿瘤体积小于未转染组和空载体组(均P<0.01), 未转染组与空载体组间差异无统计学意义; 三组瘤质量分别为2.24±0.35 g、2.16±0.31 g、1.59±0.39 g, 转染restin组瘤重小于未转染组和空载体组(均P<0.01), 未转染组与空载体组间差异无统计学意义; 转染空载体组与转染restin组的抑瘤率分别为3.60%、29.02%.
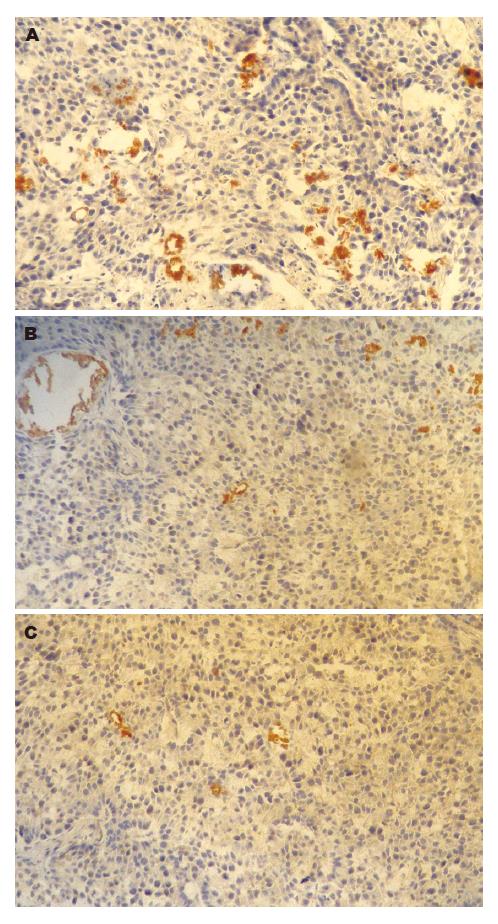
光学显微镜下观察, 可见CD34在血管内皮细胞膜和细胞质染色, 为弥漫阳性, 呈现杂乱无章的微血管网, 并出现管腔结构(图4), 转染组MVD值低于未转染组和空载体组(4.25±0.29 vs 9.79±0.94、10.34±1.22, P<0.05); 未转染组与空载体组间的差异无统计学意义(P>0.05). VEGF阳性染色为棕黄色, 定位于肿瘤细胞质内(图5), 转染restin后, 裸鼠移植瘤组织中的VEGF表达较未转染组和空载体组均降低(12.24±3.45 vs 44.52±9.70、39.76±6.38, P<0.05), 未转染组和转染空载体组间的差异无统计学意义(P>0.05).
肿瘤生长和转移具有明确的血管依赖性[5], 如果没有新生血管的形成, 肿瘤细胞只能靠周围组织的弥散获得氧气和养料, 其生长将受到明显限制, 一旦在瘤灶内及周围形成新生血管, 肿瘤细胞就可经新生血管运输获得充足的营养物质而迅速生长; 并通过血液循环把肿瘤细胞运输到他处, 抗肿瘤血管生成能抑制结肠癌[6]、肺癌[7]、鼻咽癌[8]等恶性肿瘤. 有研究表明, 肿瘤细胞自身产生的VEGF是重要的促血管生长因子, 可通过与其受体VEGFR1、VEGFR2结合, 胞内信号传导, 诱导血管内皮细胞增殖和促进内皮细胞迁移, 增加微血管通透性, 加速血浆蛋白外渗, 最终导致新的基质及新生管腔形成. 因此应用转基因方法将血管生成抑制因子转入靶细胞, 可以在肿瘤组织周围创造抑制血管生成的微环境[9], 使肿瘤病灶局部形成较高的药物浓度, 有效抑制肿瘤生长[10-11].
1999年, Ramchandran et al首先发现了restin是一种血管发生抑制因子, restin位于胶原XV的羧端非胶原结构域, 分子质量为20 kDa, 广泛分布于各种组织基底膜, 在结构序列上与内皮抑素有61%的同源性, 研究发现, restin在体外可抑制血管内皮细胞的迁移, 特别是抑制因VEGF刺激引发的血管内皮细胞增长[12], 对肿瘤的发生、发展及转移具有重要影响[2,12]. 在小鼠移植瘤实验中, restin基因可使肝癌移植瘤体积缩小, 并抑制肝癌转移灶的生长[13]; 人源restin片段能有效地抑制鸡胚新生血管的形成[14].
绿色荧光蛋白(green fluorescent protein, GFP)是一种能在细胞和分子生物学与临床检测中较理想的报告基因, 具有荧光标记的细胞在体内易于追踪, 可观察其在体内的生长情况, 与目的基因构建成重组体还能检测目的基因的高效转染和表达. GFP性能稳定, 具有能在活体内连续检测的特性[15]. 我们通过绿色荧光蛋白, 示踪重组质粒pEGFP-restin在胃癌细胞中的分子表达情况, 发现转染后70%-80%的细胞发出绿色荧光, 提示restin在胃癌细胞中稳定表达. 并观察到转染restin基因的BGC-803细胞肿瘤细胞形态不一, 部分肿瘤细胞缩小变圆, 但并未影响其生长速度.
本实验将重组质粒pEGFP-restin(由武警总医院中心实验室构建)扩增纯化后, 转染BGC-803细胞, 经RT-PCR扩增, 得到600 bp片段, 与预期相符, 表明重组质粒能够在BGC-803细胞mRNA水平上表达相应的基因.
在实验中, 我们建立了裸鼠胃癌移植瘤动物模型, 观察转染重组质粒对裸鼠胃癌移植瘤生长抑制作用, 对其可能机制进行了初步探讨. 裸鼠体内成瘤实验结果表明, 空载体组与转染组的抑瘤率分别为3.60%、29.02%, 随着restin基因表达的充分, 转染组肿瘤生长较对照组减缓, 裸鼠移植瘤生长受到一定程度抑制, 这一结果与Ramchandran et al报道的结果相符. 有研究表明, restin在体外可抑制血管内皮细胞的增殖[2], 这种抑制作用是否与其抑制肿瘤新生血管生成有关. 我们又进一步进行了研究.
接下来我们采用免疫组化方法, 观察了restin基因对胃癌组织MVD和VEGF的影响, 目前研究发现CD34抗体是最敏感的内皮细胞标志物[16]. 本实验采用CD34染色方法检测肿瘤组织的MVD, 光镜下可清晰显示肿瘤细胞间质中的微血管, 有的呈现管腔结构. 研究结果发现, 基因转染组肿瘤新生血管数少于未转染组和空载体组(P<0.05), restin对肿瘤新生血管生成有一定抑制作用. VEGF检测结果显示, 在未转染组和空载体组VEGF表达较高. 转染组VEGF表达降低, 肿瘤组织中VEGF阳性细胞数均高于转染组. 表明restin转染抑制了肿瘤组织中VEGF的表达, 这种抑制肿瘤血管作用可能与降低肿瘤组织中VEGF表达相关.
我们的研究结果显示, restin基因与肿瘤血管生长抑制相关, 影响肿瘤新生血管形成可能是其抗肿瘤作用之一.
血管生成是目前肿瘤治疗研究的热点, 抑制肿瘤血管生成从理论上可抑制肿瘤的生长和转移, 但是临床实验表明, 肿瘤患者血管抑制剂应用与动物实验理想效果相差较远, 如果能将基因靶向治疗技术应用于临床, 就可在肿瘤部分保持药物的较高浓度, 增强治疗效果.
汪思应, 教授, 安徽医科大学实验动物中心; 王晓艳, 副教授, 中南大学湘雅三医院消化内科
restin基因与内皮抑素同源, 有研究表明其可抑制肿瘤血管细胞生成, 但其抗肿瘤的具体机制及作用方式不甚清楚, 如能深入研究restin基因对胃癌的作用, 将会为胃癌的基因治疗提供新的途径和方法.
自1972年Folkman提出"肿瘤血管生成疗法"以来, 这一理论得到了相关实验的证实而逐渐被认可, 为肿瘤的治疗提供了新的思路和途径.
目前应用肿瘤血管生成的基因治疗有很多优点, 无毒副作用, 无耐药性, 浓度高等. 因此对肿瘤血管抑制因子的研究将成为治疗的新热点, 随着进一步的深入研究, 有望成为肿瘤治疗有效的途径.
本研究设计基本合理, 方法成熟, 结果可靠, 具有一定的临床意义.
编辑: 李军亮 电编: 何基才
| 1. | Folkman J. Anti-angiogenesis: new concept for therapy of solid tumors. Ann Surg. 1972;175:409-416. [PubMed] [DOI] |
| 2. | Ramchandran R, Dhanabal M, Volk R, Waterman MJ, Segal M, Lu H, Knebelmann B, Sukhatme VP. Antiangiogenic activity of restin, NC10 domain of human collagen XV: comparison to endostatin. Biochem Biophys Res Commun. 1999;255:735-739. [PubMed] [DOI] |
| 4. | Weidner N. Current pathologic methods for measuring intratumoral microvessel density within breast carcinoma and other solid tumors. Breast Cancer Res Treat. 1995;36:169-180. [PubMed] [DOI] |
| 5. | Staton CA, Stribbling SM, Tazzyman S, Hughes R, Brown NJ, Lewis CE. Current methods for assaying angiogenesis in vitro and in vivo. Int J Exp Pathol. 2004;85:233-248. [PubMed] [DOI] |
| 6. | Dkhissi F, Lu H, Soria C, Opolon P, Griscelli F, Liu H, Khattar P, Mishal Z, Perricaudet M, Li H. Endostatin exhibits a direct antitumor effect in addition to its antiangiogenic activity in colon cancer cells. Hum Gene Ther. 2003;14:997-1008. [PubMed] [DOI] |
| 7. | Kurdow R, Boehle AS, Ruhnke M, Mendoza R, Boenicke L, Sipos B, Schniewind B, Dohrmann P, Kalthoff H. Retroviral endostatin gene transfer inhibits growth of human lung cancer in a murine orthotopic xenotransplant model. Langenbecks Arch Surg. 2003;388:401-405. [PubMed] [DOI] |
| 8. | Yue T, Zhang P, Liu P, Deng QL, Ji QM, Li XY, Zhu ZY. [Effect of transfection of hEndostatin gene on CNE2 cell xenograft growth in nude mice]. Ai Zheng. 2003;22:148-151. [PubMed] |
| 9. | Sako A, Kitayama J, Koyama H, Ueno H, Uchida H, Hamada H, Nagawa H. Transduction of soluble Flt-1 gene to peritoneal mesothelial cells can effectively suppress peritoneal metastasis of gastric cancer. Cancer Res. 2004;64:3624-3628. [PubMed] [DOI] |
| 10. | Liu H, Peng CH, Liu YB, Wu YL, Zhao ZM, Wang Y, Han BS. Inhibitory effect of adeno-associated virus-mediated gene transfer of human endostatin on hepatocellular carcinoma. World J Gastroenterol. 2005;11:3331-3334. [PubMed] |
| 11. | Li L, Wu PH, Huang JL, Liu RY, Zeng YX, Huang WL. [Inhibitive effects of recombinant adenovirus-mediated human endostatin on the growth of human hepatocellular carcinoma xenograft in nude mice]. Zhonghua Ganzangbing Zazhi. 2003;11:542-545. [PubMed] |
| 12. | Sasaki T, Larsson H, Tisi D, Claesson-Welsh L, Hohenester E, Timpl R. Endostatins derived from collagens XV and XVIII differ in structural and binding properties, tissue distribution and anti-angiogenic activity. J Mol Biol. 2000;301:1179-1190. [PubMed] [DOI] |
| 13. | Xu R, Xin L, Zhang JM, Li ZP, Gan RB. [Restin expressed in vivo suppresses the growth of tumors in nude mice]. Shengwu Huaxue Yu Shengwu Wuli Xuebao (Shanghai). 2002;34:571-575. [PubMed] |
| 14. | 张 革, 柯 细松, 冯 涛, 周 兰, 曾 昭淳. 血管发生抑制因子restin的克隆表达及其抗血管活性的初步研究. 中国肿瘤生物治疗杂志. 2002;9:194-197. |
| 15. | Malecaze F, Couderc B, de Neuville S, Serres B, Mallet J, Douin-Echinard V, Manenti S, Revah F, Darbon JM. Adenovirus-mediated suicide gene transduction: feasibility in lens epithelium and in prevention of posterior capsule opacification in rabbits. Hum Gene Ther. 1999;10:2365-2372. [PubMed] [DOI] |
| 16. | Martin L, Green B, Renshaw C, Lowe D, Rudland P, Leinster SJ, Winstanley J. Examining the technique of angiogenesis assessment in invasive breast cancer. Br J Cancer. 1997;76:1046-1054. [PubMed] |