修回日期: 2008-10-22
接受日期: 2008-10-27
在线出版日期: 2008-11-18
目的: 探讨来自心脏停搏供体大鼠肝移植供肝热缺血再灌注损伤对移植物的影响.
方法: 实验分为4组: 对照组(C)和移植组, 移植组根据供肝获取前经历供体心脏停搏时间的不同分为3组: 热缺血0 min(W0组)、热缺血15 min(W15组)和热缺血30 min(W30组), 其后用建立大鼠动脉化原位肝移植模型, 每组均为24只大鼠, 分别测定术后3、7、14和30 d移植肝组织学、肝功能和细胞增殖核抗原Ki-67蛋白的变化, 每个时间点各取6只大鼠处死.
结果: 随着供肝热缺血时间的延长, 移植肝损伤加重, 并且恢复过程也延长. 移植组和对照组术后第3、7、14和30天血清ALT、AST均无显著性改变. 肝移植术后早期肝细胞Ki-67表达水平随供肝热缺血时间的延长而增高, 术后14 d恢复正常. 各组的肝细胞Ki-67表达均与血清ALT、AST无关.
结论: 肝移植过程中供肝热缺血主要损伤肝细胞, 并随着供肝热缺血时间的延长移植肝细胞损伤加重, 肝细胞功能恢复早于其形态学恢复.
引文著录: 张宝良, 刘彤. 心脏停搏供体大鼠供肝热缺血对原位肝移植物的影响. 世界华人消化杂志 2008; 16(32): 3681-3686
Revised: October 22, 2008
Accepted: October 27, 2008
Published online: November 18, 2008
AIM: To investigate the effect on graft of warm ischemia reperfusion injury following orthotopic liver transplantation from non-heart beating donors in rats.
METHODS: The rats were divided into four groups (n = 24/group) including the control group and 3 liver transplantation groups in which cardiac arrest time was respectively 0, 15, 30 min (W0, W15, W30). The model of orthotopic liver transplantation with arterial reconstruction was established. Six rats in each group each time were sacrificed on 3, 7, 14 and 30 days after surgery, respectively. Histological features, hepatic function and Ki-67 were detected.
RESULTS: Histological studies showed that longer warm ischemia time increased the liver restoration time as well as aggravated liver parenchyma injury. Serum levels of alanine transaminase (ALT) and aspartate transaminase (AST) in all groups showed no marked difference on 3, 7, 14 and 30 days after surgery. The proportion of Ki67-labeled hepatocytes increased with the warm ischemia time of the graft and returned to normal on day 14 postoperatively. In all the groups, the proportion of Ki67-labeled hepatocytes showed no significant correlation with ALT and AST.
CONCLUSION: The main site of warm ischemia of the graft is the hepatocyte. The injury of hepatocyte aggravates with warm ischemia time of the graft. Restoration of the function is faster than restoration of the morphology.
- Citation: Zhang BL, Liu T. Influence of warm ischemia reperfusion of the donor liver from non-heart-beating donors on the graft in rat orthotopic liver transplantation. Shijie Huaren Xiaohua Zazhi 2008; 16(32): 3681-3686
- URL: https://www.wjgnet.com/1009-3079/full/v16/i32/3681.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i32.3681
目前, 我国的临床肝移植中, 供肝主要来源于无心跳供体. 国外也利用无心跳供体来缓解供肝来源的短缺与等待肝移植的患者剧增之间的矛盾. 但是, 无心跳供体必然会使供肝遭受热缺血, 加重移植肝的损伤, 从而增加肝移植术后发生移植原发性肝无功能的机会[1]. 因此, 本实验利用来自心脏停搏供体的大鼠动脉化肝移植模型进行供肝热缺血损伤研究, 为今后进行相关临床与基础研究提供依据.
选用♂近交系Lewis大鼠, 体质量150- 170 g, 购于北京维通利华实验动物技术有限公司. 所有动物均在清洁、温暖(20℃-25℃)、通风环境下, 普通饲料喂养, 体质量增至180-220 g行原位肝移植术.
1.2.1 分组: 实验分为4组: 肝移植组和对照组(C组), 肝移植组根据供肝获取前经历供体心脏停搏时间的不同分为3组: 热缺血0 min(W0组)、热缺血15 min(W15组)和热缺血30 min(W30组).
1.2.2 手术方法: 供体、受体术前禁食12 h, 不禁水. 供体40 g/L水合氯醛溶液7.5 mL/kg腹腔内注射麻醉, 于双人双目显微镜下行清洁手术. W0组: 供肝基本分离完毕后, 自腹主动脉插管灌注4℃乳酸钠林格氏液, 直至肝脏颜色呈土黄色, 切取肝脏及腹主动脉袖套, 保存于4℃乳酸钠林格氏液中. W15组和W30组供体手术: 供体麻醉满意后, 经阴茎背静脉注入肝素钠生理盐水2 mL(含肝素钠500 U), 约5 min后开胸用血管钳夹闭心脏基底部致心脏停搏, 热缺血时间自夹闭心脏基底部起至冷灌注前测算, 热缺血各组利用心脏停搏期间游离供肝[2-3].
大鼠动脉化原位肝移植操作步骤参照Engemann法[3], 其简要过程如下: 受体游离肝脏步骤同供体手术, 以8-0无损伤缝线行肝上下腔静脉端端吻合, 双套管法吻合门静脉及肝下下腔静脉, 供体腹主动脉袖套与受体左肾静脉水平以下腹主动脉行端侧吻合. 将胆道支撑管远端插入受体胆总管, 结扎、固定、大网膜包裹. 3组的无肝期、肝下下腔静脉阻断时间、腹主动脉吻合时间、无肝期结束至肝动脉开放时间和冷缺血时间均无显著性差别. C组只向胆总管内插入胆道支撑管.
1.2.3 标本获取及检测指标: 各组大鼠分别于术后(POD)第3、7、14、30天乙醚麻醉下行无菌手术, 获取肝组织及血清, 每个时间点各取6只大鼠. 血清行肝脏相关的酶学(ALT、AST)分析, 肝组织标本行病理切片常规HE染色检查和免疫组化检测肝细胞增殖核抗原Ki-67的表达. 兔抗大鼠Ki-67多克隆抗体和兔二步法检测试剂盒分别购自LAB VISION和北京中杉金桥生物技术有限公司. 以PBS代替第一抗体作为阴性对照, 取乳癌组织作为阳性对照. Ki-67阳性反应主要定位于细胞核, 呈棕色颗粒状, 高倍镜下每张切片选择10个有代表性的视野, 每个视野记数100个细胞, 共记数1000个细胞, 计算其阳性细胞比例, 作为Ki-67的标记指数.
统计学处理 本实验采用SPSS13.0统计软件包进行数据分析处理. 所有结果, 当P<0.05时认为具有统计学意义.
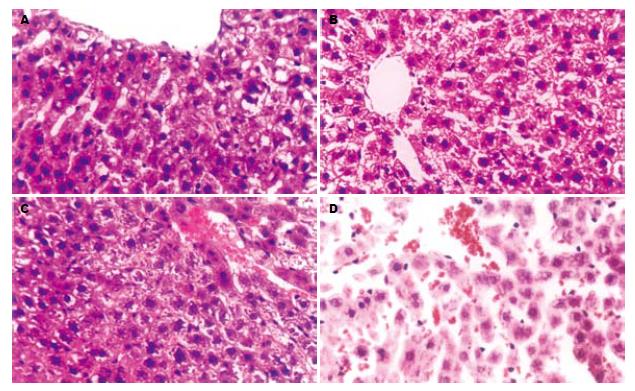
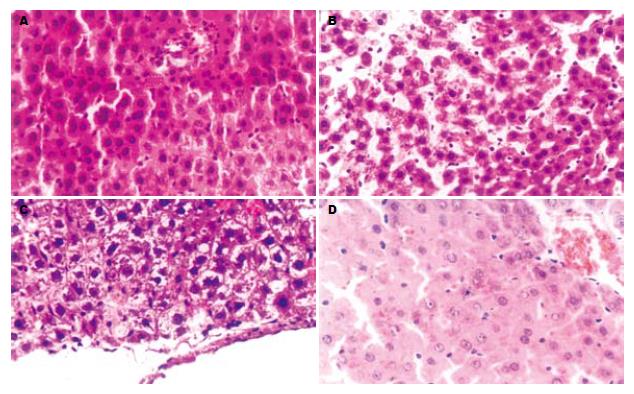
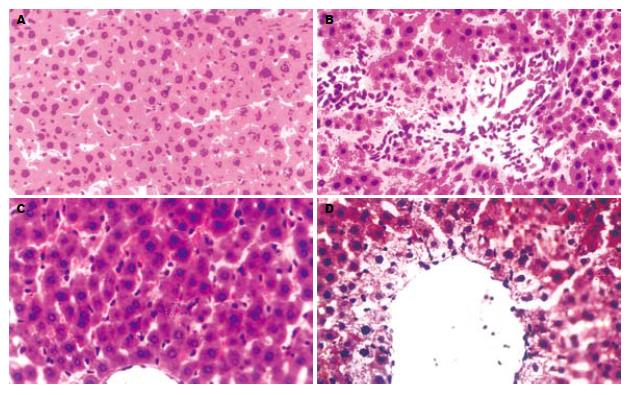
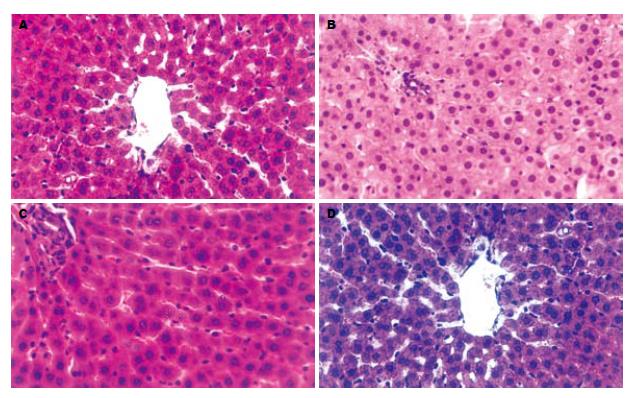
术后第3天, W0组(图1A): 区域性肝细胞水肿, W15组(图1B)及W30(图1C)组均出现弥漫性肝细胞水肿, 三组均出现胞质疏松化和气球样变, 细胞核肿胀, 肝细胞索结构不清, 均见核分裂及较多双核细胞, 上述改变, 均随热缺血时间的延长而加重. 术后第7天, W0组(图2A)及W15组(图2B)肝细胞水肿均较第3天减轻, 双核细胞较第3天减少, W30组(图2C)肝细胞水肿与术后第3天相似, 可见中性粒细胞浸润. 术后第14天, W0组(图3A)肝结构基本恢复正常, W15组(图3B)及W30组(图3C)肝细胞水肿明显减轻, 可见胆管细胞增生. 术后第30天, W0组(图4A)肝结构基本正常, W15组(图4B)及W30组(图4C)肝细胞水肿较轻, 可见胆管细胞增生及中性粒细胞浸润. 对照组各时间点肝脏结构均基本正常(图1D、图2D、图3D、图4D).
大鼠肝移植术后第3、7、14、30天血清ALT、AST结果显示: 热缺血各组和对照组相比ALT和AST均无显著性差别; 并且热缺血各组及对照组随着术后时间的延长ALT和AST均无显著性变化(表1-2).
| 分组 | W0 | W15 | W30 | C | F | P |
| POD3 | 71.2±18.8 | 82.8±8.1 | 85.2±28.9 | 70.7±6.1 | 1.078 | 0.381 |
| POD7 | 71.0±7.5 | 69.8±13.5 | 66.8±12.3 | 73.2±19.1 | 0.222 | 0.880 |
| POD14 | 80.0±10.2 | 77.5±7.4 | 74.7±12.4 | 84.2±23.2 | 0.457 | 0.715 |
| POD30 | 75.8±8.5 | 85.5±17.9 | 73.7±15.4 | 76.5±13.7 | 0.802 | 0.507 |
| F | 0.756 | 1.835 | 1.001 | 0.732 | ||
| P | 0.532 | 0.173 | 0.413 | 0.545 |
| 分组 | W0 | W15 | W30 | C | F | P |
| POD3 | 85.5±14.3 | 100.5±18.5 | 105.3±37.2 | 86.3±20.4 | 1.062 | 0.402 |
| POD7 | 97.3±13.8 | 87.3±15.4 | 82.8±10.6 | 87.3±12.0 | 1.322 | 0.295 |
| POD14 | 109.3±20.6 | 90.0±25.3 | 101.5±21.4 | 92.7±29.9 | 0.770 | 0.524 |
| POD30 | 99.7±29.2 | 108.2±44.9 | 82.5±9.6 | 76.5±13.8 | 1.651 | 0.210 |
| F | 1.380 | 0.688 | 1.713 | 0.663 | ||
| P | 0.278 | 0.570 | 0.196 | 0.585 |
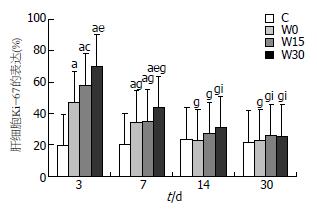
在大鼠肝移植术后第3天, C组与热缺血各组差异明显, 随着供肝热缺血时间的增加, 肝细胞增生显著. W0与W15和W30组差别显著, W15和W30组差别显著. 术后第7天, C组与热缺血各组差异显著, W0与W15差异消失, W0与W30、W15与W30差别显著. 在术后14 d、30 d, 热缺血各组与C组无明显差异.
热缺血各组肝细胞增生状况随着术后时间的延长有逐渐下降的趋势, 并在术后14 d其差异消失, 与C组无明显差别. W0组术后第3天显著高于7、14和30 d, 术后7 d与14 d、7 d与30 d、14 d与30 d差异消失. W15和W30组术后3 d显著高于7 d、14 d和30 d, 术后7 d与14 d、7 d与30 d差异显著, 14 d与30 d差异消失; C组在术后各时间点之间均无明显差别(图5).
术后3 d和7 d, 移植组的肝细胞Ki-67表达与热缺血时间具有显著正相关性, 而术后14 d和30 d不具有相关性(POD3: rs = 0.826, P = 0.000; POD7: rs = 0.682, P = 0.002; POD14: rs = 0.367, P = 0.134; POD30: rs = 0.184, P = 0.466). 经统计学分析, 各组的肝细胞Ki-67表达均与血清ALT、AST无关.
无心跳供体分为4类: (1)到达医院时已经死亡; (2)不成功的复苏; (3)等待心脏停搏(通常为有计划的生命支持撤离后); (4)脑死亡时心脏停搏. 第1和2类称为不可控的无心跳供体, 第3类称为可控的无心跳供体, 其肝移植术后效果与来自于脑死亡供体相比术后长期效果一致[4-5]. 而不可控的无心跳供体代表了最大的潜在器官供体来源, 因此界定一个肝移植物可用的最大热缺血时间具有重要的临床实用价值.
来自于无心跳供体的器官其基本问题在于长时间的热缺血. 热缺血能快速引起肝脏内ATP含量降低, 进一步造成细胞内酸中毒、细胞水肿. 同时再灌注时, 大量氧自由基产生和大量炎性介质释放, 进一步加重肝窦内皮细胞损伤和肝细胞损伤, 并且损害肝脏的微循环, 增加肝移植术后发生原发性无功能的机会[6].
肝移植术后的病理学检查成为判断肝移植术后并发症的金标准. 本组实验结果显示, 肝脏移植术后第3天随着供肝热缺血时间的延长, 移植肝细胞水肿及胞质疏松化、气球样变明显加重, 并以小叶中央明显.
Ikeda et al[7]发现移植肝损伤随着热缺血时间的延长而加重, 而肝窦内皮细胞未见明显改变. 同时发现热缺血造成Kupffer细胞数量下降、吞噬能力降低. 心脏停搏供体的肝脏移植物, 主要表现为肝细胞损伤, 非实质细胞的损伤与无心脏停搏供体相似[8]. 随着供体心搏骤停的时间延长, 肝移植术后早期肝细胞的凋亡数量增加, TNF-α上升, 术后晚期肝细胞坏死增加[9]. 本实验也证实随着供肝热缺血时间的延长, 肝细胞损伤加重这一结论.
由于肝脏移植术后肝细胞受损, 导致其开始增殖进行恢复. 本实验采用细胞增殖核抗原Ki-67来反映细胞增殖活性, 探讨肝组织再生的可能性. 本实验结果显示, 在移植术后第3天, 随着供肝热缺血时间的增加, 肝细胞增生显著, 并且增生程度与热缺血时间具有显著相关性. 并且随着术后时间的延长, 肝细胞增生逐渐恢复正常, 且随热缺血时间延长, 其恢复过程也延长.
血清ALT、AST存在于正常的肝细胞中, 当肝细胞损伤时逸出细胞外, 测定血清中的这些酶可反映出肝细胞损伤的程度. 本实验发现, 肝移植组术后第3天血清ALT、AST恢复正常, 显示肝移植术后功能与形态的不一致性. 血清ALT、AST等活性一般在肝移植术后几小时内增高, 术后24 h达到高峰, 其后迅速下降[10]. He et al[11]在大鼠肝移植研究中, 同样也发现热缺血30 min以内, ALT、AST在术后3 d基本降至正常, 这与本实验结果较为一致, 说明热缺血在30 min以内, 肝细胞损伤不严重, 复流后能很快恢复其功能. 而从病理形态学上看, 其形态学恢复正常需要较长时间, 热缺血时间的增加明显延长其恢复过程. 肝移植术后肝细胞的功能恢复明显早于其形态学恢复, 说明了肝脏本身所蕴藏的巨大储备潜能.
大鼠供肝热缺血时限多数报道为30 min[11-12]. 本实验的结果证实, 来自于心脏停搏时间30 min以内的供肝适合进行肝移植术后的长期研究, 同时也提示长时间热缺血的边缘供肝在临床上具有一定的可用性. 此外, 采用应用自由基清除剂依达拉奉可减轻来自无心跳供体的移植肝的热缺血再灌注损伤[13], 中药苦参碱可以通过减轻再灌注后内毒素血症, 抑制库氏细胞激活及炎症性细胞因子释放, 清除氧自由基, 促进NO合成等途径, 减轻肝细胞及肝窦内皮细胞的损伤, 并且可以促进抑制凋亡基因的表达来抑制冷保存再灌注导致的肝细胞凋亡[14-15], 这必将会进一步促进无心跳供体的临床应用.
目前, 国内外均利用来自无心跳供体的供肝缓解供肝来源短缺与等待肝移植患者剧增之间的矛盾, 但其移植术后原发性移植肝无功能的机会较高. 因此, 本文利用心脏停搏供体的大鼠肝移植进行供肝热缺血损伤研究.
邱双健, 副教授, 复旦大学附属中山医院肝癌研究所、肝肿瘤外科
供肝热缺血损伤一直是肝移植领域的研究难点, 其中如何减轻供肝热缺血损伤正成为研究热点. 采用药物和其他方法减轻来自无心跳供体的移植肝的热缺血再灌注损伤正日益受到人们的关注.
本文对来自心脏停搏供肝的临床肝移植应用有一定的指导作用, 并对供肝热缺血损伤研究提供理论依据.
该研究利用来自心脏停搏供体的大鼠动脉化肝移植模型进行供肝热缺血损伤研究, 认为热缺血30 min内来自于心脏停搏的供肝肝移植术后是安全的, 该研究的发现具有一定的临床应用价值.
编辑: 李军亮 电编:何基才
| 1. | Abt PL, Desai NM, Crawford MD, Forman LM, Markmann JW, Olthoff KM, Markmann JF. Survival following liver transplantation from non-heart-beating donors. Ann Surg. 2004;239:87-92. [PubMed] [DOI] |
| 2. | Kamada N, Calne RY. A surgical experience with five hundred thirty liver transplants in the rat. Surgery. 1983;93:64-69. [PubMed] |
| 3. | Engemann R, Ulrichs K, Thiede A, Müller-Ruchholtz W, Hamelmann H. Value of a physiological liver transplant model in rats. Induction of specific graft tolerance in a fully allogeneic strain combination. Transplantation. 1982;33:566-568. [PubMed] |
| 4. | Kootstra G, Daemen JH, Oomen AP. Categories of non-heart-beating donors. Transplant Proc. 1995;27:2893-2894. [PubMed] |
| 5. | Manzarbeitia CY, Ortiz JA, Jeon H, Rothstein KD, Martinez O, Araya VR, Munoz SJ, Reich DJ. Long-term outcome of controlled, non-heart-beating donor liver transplantation. Transplantation. 2004;78:211-215. [PubMed] [DOI] |
| 6. | Serracino-Inglott F, Habib NA, Mathie RT. Hepatic ischemia-reperfusion injury. Am J Surg. 2001;181:160-166. [PubMed] [DOI] |
| 7. | Ikeda T, Yanaga K, Kishikawa K, Kakizoe S, Shimada M, Sugimachi K. Ischemic injury in liver transplantation: difference in injury sites between warm and cold ischemia in rats. Hepatology. 1992;16:454-461. [PubMed] [DOI] |
| 8. | Tsutsumi R, Azuma T, Miyamoto S, Hou Z, Ohkubo H, Yuzawa H, Kamohara Y, Okudaira S, Mizoe A, Fujioka H. Main injury site of liver grafts from non-heart-beating donors in pigs. Transplant Proc. 2000;32:2348. [PubMed] [DOI] |
| 10. | Biasi F, Bosco M, Chiappino I, Chiarpotto E, Lanfranco G, Ottobrelli A, Massano G, Donadio PP, Vaj M, Andorno E. Oxidative damage in human liver transplantation. Free Radic Biol Med. 1995;19:311-317. [PubMed] [DOI] |
| 11. | He XS, Ma Y, Wu LW, Ju WQ, Wu JL, Hu RD, Chen GH, Huang JF. Safe time to warm ischemia and posttransplant survival of liver graft from non-heart-beating donors. World J Gastroenterol. 2004;10:3157-3160. [PubMed] |
| 13. | Nakamura A, Akamatsu Y, Miyagi S, Fukumori T, Sekiguchi S, Satomi S. A free radical scavenger, edaravone, prevents ischemia-reperfusion injury in liver grafts from non-heart-beating donors. Transplant Proc. 2008;40:2171-2174. [PubMed] [DOI] |