修回日期: 2008-10-20
接受日期: 2008-10-27
在线出版日期: 2008-11-18
目的: 探讨三叶因子3(trefoil factor 3, TFF3)和CD147在不同胃黏膜病变中的表达与间质微血管(microvessel density, MVD)值的关系.
方法: 利用组织芯片技术制作302例的组织芯片, 同时采用S-P免疫组化方法检测TFF3、CD147和CD34表达.
结果: 萎缩性胃炎、不典型增生和胃癌各组TFF3表达均高于浅表性胃炎和正常组(48.3%, 51.9%, 41.7% vs 13.3%; 48.3%, 51.9%, 41.7% vs 3.6%, 均P<0.01); 胃癌CD147表达和MVD高于正常胃黏膜、浅表性胃炎、萎缩性胃炎和不典型增生(78.9% vs 14.3%, 43.3%, 51.2%, 59.3%; 31.86±9.92 vs 26.10±6.82, 24.74±5.49, 20.77±6.87, 14.95±6.28, 均P<0.05), 浅表性胃炎CD147表达和MVD与正常胃黏膜之间差异显著(43.3% vs 14.3%; 20.77±6.87 vs 14.95±6.28, 均P<0.05). TFF3、CD147表达和MVD与胃癌淋巴结转移和TNM分期有关(P<0.05), TFF3表达与胃癌组织学类型有关(P<0.05), CD147表达与胃癌分化程度和胃癌浸润深度有关(P<0.01), MVD与胃癌浸润深度有关(P<0.05). TFF3、CD147阳性表达的MVD高于阴性的(35.47±9.41 vs 29.27±9.50; 33.33±9.62 vs 26.40±9.17, P<0.01). TFF3和CD147表达与MVD呈显著正相关(r = 0.323, r = 0.279). TFF3(+)/CD147(+)者在深度浸润(T3-4)、临床分期TNMⅢ-Ⅳ、淋巴结转移的比率和MVD最高, 且明显高于TFF3(-)/CD147(-)者(P<0.05).
结论: TFF3、CD147和CD34在胃黏膜癌变和癌变后的恶性演进过程中起重要作用, 可作为胃癌的早期诊断和预测胃癌发生转移的重要指标.
引文著录: 唐忠辉, 陈华生, 邹宗楷, 蔡韶滨, 苏海燕, 沈洪武, 吴文乔, 林莉, 王元亨. TFF3和CD147在不同胃黏膜病变中的表达及其与血管生成的关系. 世界华人消化杂志 2008; 16(32): 3631-3636
Revised: October 20, 2008
Accepted: October 27, 2008
Published online: November 18, 2008
AIM: To investigate expression of trefoil factor 3 (TFF3) and CD147 in gastric mucosa, and their correlation with microvessel density (MVD) in carcinogenesis of gastric mucosa.
METHODS: Three hundred and two sample tissues were prepared using tissue microarray. At the same time, S-P immunohistochemical methods were applied to detect expression of TFF3, CD147 and CD34.
RESULTS: TFF3 expression was significantly higher in atrophic gastritis, atypical hyperplasia and gastric cancinoma than in normal controls or in superficial gastritis (48.3%, 51.9%, 41.7% vs 13.3%; 48.3%, 51.9%, 41.7% vs 3.6%, all P < 0.01). CD147 expression and MVD were higher in gastric cancinoma than in normal controls, superficial gastritis, atrophic gastritis or in atypical hyperplasia (78.9% vs 14.3%, 43.3%, 51.2%, 59.3%; 31.86 ± 9.92 vs 26.10 ± 6.82, 24.74 ± 5.49, 20.77 ± 6.87, 14.95 ± 6.28, all P < 0.05). There was significant difference in CD147 expression and MVD between superficial gastritis and normal controls (43.3% vs 14.3%; 20.77 ± 6.87 vs 14.95 ± 6.28, all P < 0.05). TFF3 and CD147 expression and MVD were correlated with lymph node metastasis and TNM staging (all P < 0.05). TFF3 expression was correlated with histological type (P< 0.05), CD147 expression was correlated with tumor differentiation (P < 0.01). CD147 expression and MVD were correlated to depth of invasion (P < 0.05). MVD with positive expressions of TFF3, survivin and CD147 was higher than that with negative expression (35.47 ± 9.41 vs 29.27 ± 9.50; 33.33 ± 9.62 vs 26.40 ± 9.17, all P < 0.01). The expression of TFF and CD147 and MVD were positively correlated(r = 0.323, r = 0.279). Rate of the deeper tumor invasion (T3-4), TNM categories (TNMⅢ-Ⅳ), lymph node metastasis and MVD reached the highest in TFF3(+)/CD147(+) and were markedly higher in TFF3(+)/CD147(+) than TFF3(-)/CD147(-) (P < 0.05).
CONCLUSION: TFF3, CD147 and CD34 may play important roles in carcinogenesis and gastric carcinoma development of gastric mucosa. They can be used as important markers for early diagnosis and reflecting metastasis in gastric cancinoma.
- Citation: Tang ZH, Chen HS, Zou ZK, Cai SB, Su HY, Shen HW, Wu WQ, Lin L, Wang YH. Trefoil factor 3 and CD147 expression in carcinogenesis of gastric mucosa and their correlation with angiogenesis. Shijie Huaren Xiaohua Zazhi 2008; 16(32): 3631-3636
- URL: https://www.wjgnet.com/1009-3079/full/v16/i32/3631.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i32.3631
胃癌是我国最常见的恶性肿瘤之一, 目前早期胃癌的发现仍比较困难, 早期胃癌的预后较好, 5年生存率可达90%以上, 因而提高早期胃癌的检出率非常重要. 本实验采用组织芯片技术构建含30例正常胃黏膜和272例患者(包括浅表性胃炎30例、萎缩性胃炎30例、不典型增生30例及胃癌182例)的组织芯片, 用免疫组化SP法检测三叶因子3(trefoil factor 3, TFF3)、CD147和间质微血管密(microvessel density, MVD)在组织芯片中的表达, 旨在探讨TFF3和CD147在不同胃黏膜病变中的表达与MVD值的关系及对胃黏膜保护作用和胃癌发生发展、浸润转移、血管生成的影响, 为胃癌早期诊断及预后判断提供客观指标.
选取漳州市医院病理科2001-01/2002-12随访资料完整的原发性胃癌手术切除标本的蜡块182例. 温习全部病例的临床资料, 按新编常见恶性肿瘤诊治规范[1]进行组织分型、区域淋巴结转移分站及TNM分期. 另胃镜活检选取正常胃黏膜、浅表性胃炎、萎缩性胃炎及中、重度不典型增生的蜡块各30例, 所有患者术前未经过任何抗癌治疗. 实验用兔抗人TFF3多克隆抗体(工作浓度为1:100)、兔抗人CD147多克隆抗体(即用型)和鼠抗人CD34 mAb(即用型)及SP免疫组化试剂盒及DAB显示试剂盒均购自北京中杉金桥生物技术有限公司.
1.2.1 分组情况: 胃癌组(n = 182)、浅表性胃炎组(n = 30)、萎缩性胃炎组(n = 30)、不典型增生组(n = 30). 正常胃黏膜为正常组. 胃癌根据患者的性别、年龄、组织学类型、分化程度、浸润深度、淋巴结是否转移和TNM分期进行分组.
1.2.2 组织芯片制作: (1)HE染色切片形态学观察, 确定目标组织, 如胃癌等组织. (2)选择目标组织并分别在组织切片和相应石蜡组织上标记. (3)依次制作组织芯片制孔器、取材针和受体蜡块[2], 制成7×6点列阵的组织芯片受体模块; 用已制作取材针从已定位的石蜡上取目标组织到组织芯片受体蜡块的相应孔内, 构建含有30例正常胃黏膜和272例患者(包括浅表性胃炎30例、萎缩性胃炎30例、不典型增生30例及胃癌182例)的不同胃黏膜病变的组织阵列蜡块8块. (4)将组织阵列蜡块行连续切片, 切片厚度为4 µm, 与常规组织制片基本相似.
1.2.3 免疫组化: 采用SP方法对组织芯片切片进行免疫组化染色, DAB显色, 苏木精复染, 封片, 具体操作按照SP试剂盒说明书进行. 以PBS缓冲液代替一抗作为阴性对照, 用已知阳性组织切片作阳性对照.
1.2.4 染色结果判断: 采用双盲法, 由两位病理医师独立观察, 若计数相差10%以上重新计数. TFF3以细胞胞质内出现淡黄色至棕黄色颗粒为阳性细胞. CD147以细胞胞膜及胞质内出现淡黄色至棕黄色颗粒为阳性细胞. 采用半定量积分法: 根据阳性细胞数和着色深度计分, 每例均随机观察计数5个高倍视野(×400), 确定其每个视野的阳性率, 取平均数, 按下列计分: 阳性细胞≤5%为0分, 6%-25%为1分, 26%-50%为2分, 51%-75%为3分, >75%为4分; 阳性细胞表达的着色深度: 基本不着色为0分, 黄色为1分, 棕黄色为2分, 棕褐色为3分. 将两项积分相乘: 0分为阴性(-), 1-4分为弱阳性(+), 5-8分为中度阳性(++), 9-12分为强阳性(+++). MVD计数: CD34以细胞膜出现棕黄色颗粒为阳性, 每一个染成棕黄色的、可与周围血管、肿瘤细胞和其他结缔组织区分开来的内皮细胞或内皮细胞簇, 不论管腔和红细胞出现与否, 均作为1个单一的, 可作为1个微血管. 但肌层较厚及管腔面积大于8个红细胞直径的血管不计数. 在低倍镜下观察整张切片的血管分布情况后, 选择癌灶周围间质血管密集区, 在400×视野内计数上述5个不同区域的微血管数, 取其平均值为MVD.
统计学处理 MVD用mean±SD表示. 所有统计数据应用SPSS10.0软件包处理. 采用χ2检验、Independent-Samples t检验、One-way ANOVA过程和Spearman等级相关性检验判断各组之间TFF3、CD147表达和MVD的差异, 取P<0.05为差异有显著性.
构建含30例正常胃黏膜和272例患者(包括浅表性胃炎30例、萎缩性胃炎30例、不典型增生30例及胃癌182例)的组织芯片, 蜡块组织阵列的排列整齐, 常规切片组织形态良好. 在302例组织芯片中有13例发生皱折和掉片现象, 其中胃癌7例、正常胃组织2例、萎缩性胃炎1例、不典型增生3例.
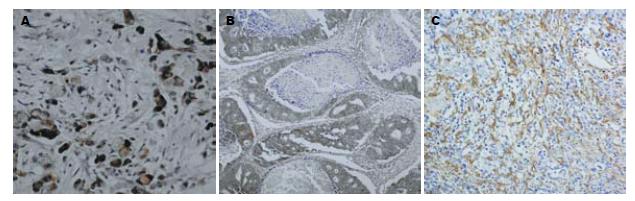
在胃癌组织中, TFF3阳性染色主要定位于癌细胞胞质(图1A), 其阳性表达率为41.7%; CD147主要定位于癌细胞胞膜及胞质(图1B), 其阳性表达率为78.9%. CD34主要表达于细胞膜, 微血管染色呈棕黄色, 分布不均呈异质性(图1C).
从表1中可见, TFF3、CD147表达和MVD值随着浅表性胃炎→萎缩性胃炎→不典型增生而逐渐升高, 但胃癌TFF3表达反而低于萎缩性胃炎、不典型增生, 萎缩性胃炎、不典型增生和胃癌间差异不显著, 三组均显著高于浅表性胃炎和正常胃黏膜(P = 0.003, P = 0.000, P<0.01); 胃癌CD147表达和MVD依次高于正常胃黏膜、浅表性胃炎、萎缩性胃炎和不典型增生(P = 0.000, P= 0.000, P<0.01); 浅表性胃炎组CD147表达和MVD明显高于正常胃黏膜(P = 0.015, P = 0.001, P<0.05).
| 分组 | n | TFF3表达 | CD147表达 | CD34表达 | |||
| 阳性n(%) | P值 | 阳性n(%) | P值 | MVD(mean±SD) | P值 | ||
| 正常组 | 28 | 1(3.6) | 4(14.3) | 14.95±6.28 | |||
| 浅表性胃炎组 | 30 | 4(13.3) | 13(43.3) | 20.77±6.87 | |||
| 萎缩性胃炎组 | 29 | 14(48.3) | 15(51.2) | 24.74±5.49 | |||
| 不典型增生组 | 27 | 14(51.9) | 16(59.3) | 26.10±6.82 | |||
| 胃癌组 | 175 | 102(41.7) | 0.000 | 138(78.9) | 0.000 | 31.86±9.92 | 0.000 |
TFF3、CD147表达和MVD与胃癌淋巴结转移和TNM分期有关(P<0.05, 表2), 与性别、年龄无关; TFF3表达与胃癌组织学类型有关(P<0.05, 表2), CD147表达与胃癌分化程度有关(P<0.01, 表2), CD147表达和MVD与胃癌浸润深度有关(P<0.05, 表2).
| 项目 | n | TFF3表达 | CD147表达 | CD34表达 | ||||||
| 阳性n (%) | P值 | 阳性n (%) | P值 | MVD(mean±SD) | P值 | |||||
| 性别 | 0.863 | 0.627 | 0.800 | |||||||
| 男 | 133 | 55(41.4) | 106(79.7) | 31.75±10.20 | ||||||
| 女 | 42 | 18(42.9) | 32(72.6) | 32.20±9.10 | ||||||
| 年龄 | 0.518 | 0.486 | 0.861 | |||||||
| <60 | 67 | 30(44.8) | 51(76.1) | 31.69±9.12 | ||||||
| ≥60 | 109 | 43(39.8) | 87(80.6) | 31.97±10.43 | ||||||
| 组织学类型 | 0.040 | 0.189 | 0.090 | |||||||
| 乳头状腺癌 | 20 | 8(40.0) | 12(60.0) | 31.99±11.20 | ||||||
| 管状腺癌 | 92 | 32(34.8) | 72(78.3) | 30.25±9.80 | ||||||
| 低分化腺癌 | 28 | 11(39.3) | 24(85.7) | 32.91±10.35 | ||||||
| 印戒细胞癌 | 9 | 4(44.4) | 8(88.9) | 38.51±9.09 | ||||||
| 黏液腺癌 | 26 | 18(69.2) | 22(84.6) | 34.01±8.16 | ||||||
| 分化程度 | 0.131 | 0.004 | 0.082 | |||||||
| 高分化 | 30 | 9(30.0) | 17(56.7) | 29.98±10.55 | ||||||
| 中分化 | 73 | 28(38.4) | 60(82.2) | 31.31±9.42 | ||||||
| 低未分化 | 72 | 36(50.0) | 61(84.7) | 33.62±9.94 | ||||||
| 浸润深度 | 0.779 | 0.029 | 0.000 | |||||||
| T1 | 14 | 4(28.6) | 8(57.1) | 23.49±5.58 | ||||||
| T2 | 23 | 10(43.5) | 16(69.6) | 27.50±6.91 | ||||||
| T3 | 94 | 40(42.5) | 74(78.7) | 31.13±9.10 | ||||||
| T4 | 44 | 19(43.2) | 40(90.9) | 38.36±10.40 | ||||||
| 淋巴结转移 | 0.037 | 0.019 | 0.000 | |||||||
| 无 | 26 | 6(23.1) | 16(61.5) | 25.00±7.66 | ||||||
| 有 | 149 | 66(44.5) | 122(81.9) | 33.06±9.80 | ||||||
| TNM分期 | 0.008 | 0.001 | 0.000 | |||||||
| Ⅰ期 | 14 | 4(28.6) | 8(57.1) | 23.49±5.58 | ||||||
| Ⅱ期 | 67 | 22(32.8) | 46(68.7) | 25.72±7.09 | ||||||
| Ⅲ期 | 72 | 31(43.1) | 62(86.1) | 35.84±8.23 | ||||||
| Ⅳ期 | 22 | 16(72.7) | 22(100.0) | 42.86±7.85 | ||||||
TFF3、CD147阳性表达的MVD高于阴性表达的MVD(P<0.01, 表3). TFF3与MVD的之间关系(r = 0.323, P = 0.000), CD147表达与MVD的之间关系(r = 0.279, P = 0.000).
| 项目 | n | MVD(mean±SD) | F | P值 | t | u | P值 |
| TFF3表达 | |||||||
| 阴性 | 102 | 29.27±9.50 | |||||
| 阳性 | 73 | 35.47±9.41 | 0.018 | 0.894 | 4.274 | 174 | 0.000 |
| CD147表达 | |||||||
| 阴性 | 37 | 26.40±9.17 | |||||
| 阳性 | 138 | 33.33±9.62 | 0.035 | 0.851 | -3.920 | 173 | 0.000 |
在175例胃癌中TFF3与CD147表达的之间不存在明显相关性(r = 0.069, P = 0.364). 表4中可见, TFF3(+)/CD147(+)者在深度浸润(T3+T4)、临床分期(TNMⅢ+TNMⅣ)、淋巴结转移的比率和MVD最高, 且明显高于TFF3(-)/CD147(-)者(P<0.05).
| TFF3表达 | CD147表达 | n | MVD(mean±SD) | T3+T4 | TNMⅢ+TNMⅣ | 淋巴结转移 |
| + | + | 60 | 36.65±8.94 | 50(83.3) | 43(71.7) | 56(93.3) |
| + | - | 13 | 30.05±10.0 | 19(69.2) | 4(30.8) | 11(84.6) |
| - | + | 78 | 30.76±9.41 | 64(82.1) | 41(52.6) | 66(84.6) |
| - | - | 24 | 24.43±8.23 | 15(63.5) | 6(25.0) | 16(66.8) |
| F = 11.324, P = 0.000 | P = 0.123 | P = 0.000 | P = 0.022 |
近年来的大量研究已证实胃癌的发生、发展和预后是多基因改变的结果, 其演变过程包括: 正常胃组织→浅表性胃炎→萎缩性胃炎→不典型增生→胃癌.
TFF3也称肠三叶因子(intestinal trefoil factor, ITF)为三叶肽家族一员, 是一种新肽, 主要是由杯状细胞分泌的特异分布于肠黏膜表面的多肽物质, 对胃黏膜有保护作用[3], 在胃肠黏膜发生炎症、溃疡等病变时, 其表达上调, 诱导细胞迁移, 参与黏膜保护及受损黏膜的修复过程. 然而, 其在肿瘤中的作用日益受到重视, 通过抑制细胞黏附、促进细胞侵袭、抑制凋亡及新生血管形成等, 在肿瘤中发挥作用. Yamachika et al[4]研究认为TFF3有抑制细胞黏附, 促进癌细胞侵袭, 阻断细胞凋亡的作用. 在胃黏膜发生肠化、不典型增生到胃癌的发生过程中表达逐步增高[5], 研究发现TFF3在胃癌中的表达与性别、淋巴结转移有关[4,6]. 本研究结果显示, TFF3表达随着浅表性胃炎、萎缩性胃炎、不典型增生而逐渐升高, 胃癌TFF3表达反而低于萎缩性胃炎、不典型增生, 三组之间差异不显著, 却显著高于正常胃组织和浅表性胃炎. 提示TFF3高表达参与了胃黏膜肠上皮化生、不典型增生和恶性转化的过程, 其可能是胃黏膜癌变的早期分子事件. 本研究显示, TFF3表达与胃癌组织学类型、淋巴结转移和TNM分期有关, 却与性别、分化程度和浸润深度无关, 说明TFF3在胃黏膜癌变和癌变后的恶性演进过程中起重要作用, 可作为胃癌早期发现的一个有用的标志物.
CD147最初被命名为细胞外基质金属蛋白酶刺激物(EMMPRIN), 属于免疫球蛋白超家族(IgSF)的成员之一[7], 广泛存在于细胞表面的糖蛋白. 他是一种新的细胞表面黏附分子, 介导细胞与细胞、细胞与间质的黏附作用[8]. CD147参与人体的多种生理活动, 如胚胎着床、子宫复旧及伤口愈合[9]等, 在多种肿瘤细胞和组织中高表达, 通过诱导基质金属蛋白酶(MMP)的分泌促进了肿瘤的浸润、转移[10-11]. 本研究结果显示, CD147表达随着炎症、肠上皮化生、癌变逐渐上调, 正常胃黏膜与浅表性胃炎、不典型增生与胃癌各组之间差异显著, 浅表性胃炎、萎缩性胃炎和不典型增生三者之间差异不显著. 提示CD147可能在胃黏膜炎症和肠化生中扮演了某种角色, CD147在胃黏膜癌变过程中已被激活. 关于CD147与胃黏膜防御、修复和肠化等过程的关系及其作用机制, 目前尚无定论, 需进一步研究明确. 本研究还发现, CD147表达与胃癌分化程度、浸润深度、淋巴结转移和TNM分期有关, 说明CD147与胃癌的侵袭、转移有关, 有助于判断胃癌的病理分级.
肿瘤血管新生在恶性肿瘤的生长及转移中起重要作用, MVD是判定血管生成的一个良好指标. 实验性肿瘤模型和人类癌前病变血管生成研究发现: 在肿瘤发生的早期即显示血管表型, 随着早期癌向浸润癌的进展MVD显著增加, 至浸润癌期微血管密度最高、肿瘤体积增大更明显、转移的概率也增多. 本研究结果表明MVD在正常的胃黏膜、浅表性胃炎、萎缩性胃炎、不典型增生、胃癌组织均有表达, 表达呈依次增高, 正常胃黏膜与浅表性胃炎、浅表性胃炎与萎缩性胃炎、不典型增生与胃癌各组之间差异显著, 萎缩性胃炎与不典型增生之间差异不显著. 提示随着胃黏膜炎症和肠上皮化生的发生, 微血管生成也增加, 可有利于病变的修复. 但微血管密度越高, 已癌变细胞进入血循环及淋巴循环的机会越多, 淋巴结及邻近脏器转移机率也越大, 其预后可能越差. 肿瘤在生长过程中确有异常血管形成. 这些异常血管的形成, 又为肿瘤的生长提供了适合的基础, 促进了肿瘤的生长. 此理论与本研究结果相符, 即在胃癌组织中MVD与肿瘤的浸润深度、淋巴结转移及TNM分期有关.
肿瘤的发生发展是一复杂的过程: 肿瘤细胞的无限增殖、细胞凋亡及新生血管形成等. 其过程涉及相关基因的激活、失活、突变等; 细胞间的黏附、信号传递、酶解、渗透与移动等; 肿瘤细胞进出血管和对靶组织的侵袭等. 已研究证明[6,12-13]TFF3和CD147参与肿瘤血管形成过程. 本实验研究发现, TFF3和CD147阳性组中的MVD高于阴性组, TFF3和CD147表达与MVD呈正相关. 说明TFF3和CD147极有可能共同参与了肿瘤血管的生成来促进肿瘤的生长及转移.
现代分子生物学研究表明, 人类基因组约由10万左右的不同基因组成, 这些基因的选择性表达决定了机体整个生命过程, 基因表达的变化处于控制生物学调节机制的中心位置. 因此, 研究胃癌不同发展阶段的基因表达变化, 不仅有助于阐明胃癌的发病机制, 而且还能为进一步开展胃癌的基因诊断和基因治疗提供重要的理论依据.
田晓峰, 教授, 大连医科大学附属第二医院
随着分子生物学技术的发展, TFF3和CD147对肿瘤的发生、增殖、浸润和转移的作用逐渐被人们所重视, 有关TFF3和CD147与血管形成在肿瘤发生、发展和转移过程中的相互联系、信号转导及表达调控机制将会成为当今肿瘤研究中的新热点之一.
相关研究表明, TFF3影响了上皮细胞钙黏素的表达和定位, 以及诱导连环素的酪氨酸磷酸化, 从而降低细胞间的紧密连接、促进上皮细胞移行. 通过抑制细胞黏附、促进细胞侵袭、抑制凋亡, 在胃肿瘤中发挥作用. CD147不仅参与细胞与细胞或细胞与基质的黏附, 而且作为细胞外基质金属蛋白酶刺激物, CD147还具有刺激肿瘤细胞周围间质成纤维细胞分泌MMPs的能力, 从而促进肿瘤细胞的浸润转移.
本课题采用组织芯片技术对TFF3、CD147和CD34在胃不同病变中的表达进行了分析, 结果提示TFF3、CD147和CD34在胃黏膜癌变和癌变后的恶性演进过程中起重要作用, 可作为胃癌的早期诊断和预测胃癌发生转移的重要指标.
本文采用组织微列阵技术对TFF3和CD147在胃不同病变中的表达进行了分析, 总体试验设计合理规范, 全文书写层次清楚, 逻辑性较好.
编辑: 史景红 电编:何基才
| 4. | Yamachika T, Werther JL, Bodian C, Babyatsky M, Tatematsu M, Yamamura Y, Chen A, Itzkowitz S. Intestinal trefoil factor: a marker of poor prognosis in gastric carcinoma. Clin Cancer Res. 2002;8:1092-1099. [PubMed] |
| 5. | Leung WK, Yu J, Chan FK, To KF, Chan MW, Ebert MP, Ng EK, Chung SC, Malfertheiner P, Sung JJ. Expression of trefoil peptides (TFF1, TFF2, and TFF3) in gastric carcinomas, intestinal metaplasia, and non-neoplastic gastric tissues. J Pathol. 2002;197:582-588. [PubMed] [DOI] |
| 7. | Biswas C, Zhang Y, DeCastro R, Guo H, Nakamura T, Kataoka H, Nabeshima K. The human tumor cell-derived collagenase stimulatory factor (renamed EMMPRIN) is a member of the immunoglobulin superfamily. Cancer Res. 1995;55:434-439. [PubMed] |
| 8. | Suzuki S, Sato M, Senoo H, Ishikawa K. Direct cell-cell interaction enhances pro-MMP-2 production and activation in co-culture of laryngeal cancer cells and fibroblasts: involvement of EMMPRIN and MT1-MMP. Exp Cell Res. 2004;293:259-266. [PubMed] [DOI] |
| 9. | Guo H, Li R, Zucker S, Toole BP. EMMPRIN (CD147), an inducer of matrix metalloproteinase synthesis, also binds interstitial collagenase to the tumor cell surface. Cancer Res. 2000;60:888-891. [PubMed] |
| 10. | Sun J, Hemler ME. Regulation of MMP-1 and MMP-2 production through CD147/extracellular matrix metalloproteinase inducer interactions. Cancer Res. 2001;61:2276-2281. [PubMed] |
| 11. | Guo H, Zucker S, Gordon MK, Toole BP, Biswas C. Stimulation of matrix metalloproteinase production by recombinant extracellular matrix metalloproteinase inducer from transfected Chinese hamster ovary cells. J Biol Chem. 1997;272:24-27. [PubMed] [DOI] |
| 12. | Dhar DK, Wang TC, Tabara H, Tonomoto Y, Maruyama R, Tachibana M, Kubota H, Nagasue N. Expression of trefoil factor family members correlates with patient prognosis and neoangiogenesis. Clin Cancer Res. 2005;11:6472-6478. [PubMed] [DOI] |
| 13. | Caudroy S, Polette M, Nawrocki-Raby B, Cao J, Toole BP, Zucker S, Birembaut P. EMMPRIN-mediated MMP regulation in tumor and endothelial cells. Clin Exp Metastasis. 2002;19:697-702. [PubMed] [DOI] |