修回日期: 2008-10-16
接受日期: 2008-10-21
在线出版日期: 2008-11-18
目的: 观察辣椒素敏感传入神经及内源性一氧化氮(NO)在电刺激PVN减轻大鼠GI-R损伤中的作用.
方法: 将SD大鼠随机分为6组: GI-R组, 假电刺激PVN组, 电刺激PVN组, 溶剂组, 辣椒素预处理组及L-NAME组. 采用夹闭大鼠腹腔动脉30 min去除动脉夹再灌注1 h的GI-R损伤模型. 采用核团内电刺激PVN以兴奋其内神经元及大剂量辣椒素预处理使辣椒素敏感传入神经失去功能等方法, 研究辣椒素敏感传入神经在PVN对GI-R损伤调控中的作用.
结果: 用大剂量辣椒素消除辣椒素敏感传入神经作用后, 可以部分阻断电刺激PVN引起的保护效应, 损伤较电刺激组加重54.85%, 与对照组比较差异显著(P<0.05); 给予NO合酶阻断剂L-NAME后, 能够阻断电刺激PVN的保护效应, 损伤较电刺激组加重72.98%, 与对照组比较差异显著(P<0.05).
结论: 辣椒素敏感传入神经及内源性NO参与了电刺激PVN对GI-R损伤的保护效应.
引文著录: 张咏梅, 张建福, 闫长栋. 辣椒素敏感传入神经在电刺激室旁核减轻大鼠胃缺血-再灌注损伤中的作用. 世界华人消化杂志 2008; 16(32): 3616-3620
Revised: October 16, 2008
Accepted: October 21, 2008
Published online: November 18, 2008
AIM: To elucidate the role of capsaicin-sensitive afferent fibers in mediating the effect of electrical stimulation (ES) of paraventricular nucleus (PVN) against rat gastric ischemia-reperfusion (GI-R) injury.
METHODS: GI-R injury was induced in rats by clamping the celiac artery for 30 min and then reperfusing for 1 h. The methods of nuclear electric stimulation to excite the PVN and pretreatment with a high dose of capsaicin to ablate the capsaicin-sensitive afferent fibers were used to explore the role of capsaicin-sensitive afferent fibers in the regulation of PVN on GI-R injury.
RESULTS: Pretreament with a high dose of capsaicin to ablate afferent fibers partly abolished the protective effect of PVN against GI-R injury and the injury was increased by 54.85% as compared with that in the PVN stimulation group (P < 0.01); Pretreament with L-nitro-L-arginine methyl ester (L-NAME) significantly abolished the protective effect of PVN against GI-R injury and the injury was increased by 72.98% as compared with that in the PVN stimulation group (P < 0.01).
CONCLUSION: Capsaicin-sensitive afferent fibers and endogenous NO are involved in the protective effect of PVN stimulation against GI-R injury.
- Citation: Zhang YM, Zhang JF, Yan CD. Capsaicin-sensitive afferent fibers mediate the protective effect of electrical stimulation of paraventricular nucleus against gastric ischemia-reperfusion injury in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(32): 3616-3620
- URL: https://www.wjgnet.com/1009-3079/full/v16/i32/3616.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i32.3616
下丘脑室旁核(paraventricular nucleus, PVN)不仅参与对胃的各种生理机能, 如胃酸分泌、胃运动及胃电活动的调节, 并且参与了胃黏膜损伤的调控[1]. 我们以前的研究表明电刺激下丘脑室旁核(paraventricular nucleus, PVN)通过迷走和交感神经的介导, 可明显减轻大鼠胃缺血-再灌注(gastric ischemia-reperfusion, GI-R)损伤[2-3]. 但是, 刺激PVN对GI-R的损伤的调控, 是通过什么传入神经, 尚不清楚. 胃肠道的传入神经元有许多属于辣椒素敏感的传入神经元, 大剂量辣椒素可选择性地使其失去功能, 从而可独立研究传入神经在胃功能活动中的作用[4-5]. 目前研究认为辣椒素敏感的传入神经对胃黏膜有保护作用, 并且是通过非肾上腺素能、非胆碱能递质介导的, 许多资料表明, 降钙素基因相关肽(CGRP)通过CGRP1受体, 速激肽通过NK2受体, 共同作为传入神经的递质, 参与对胃黏膜的保护作用, 一氧化氮(NO)是他们共同的第二信使[6-7]. 因此, 本研究通过建立GI-R模型, 以大剂量辣椒素使传入神经失去功能并应用NO合成抑制剂L-NAME, 观察辣椒素敏感传入神经及内源性NO在电刺激PVN对GI-R损伤保护效应中的作用.
辣椒素和L-NAME购自美国Sigma公司, 药品和试剂均临用前新鲜配制. 成年健康的SD大鼠(220-240 g), ♂, 由徐州医学院实验动物中心(使用许可号: SYXK[su] 2002-0038)提供. 实验前禁食24 h、自由饮水.
1.2.1 分组: 将SD大鼠随机分为6组: (1)GI-R组(n = 10). (2)假电刺激PVN后进行GI-R组(假电刺激PVN组, n = 8). (3)以0.4 mA电刺激PVN后进行GI-R组(电刺激PVN组, n = 8). (4)大鼠注射溶剂(100 mL/L乙醇、10%吐温80和80%生理盐水)后, 再以0.4 mA电刺激PVN, 然后行GI-R组(溶剂组). (5)药物处理组: 用大剂量辣椒素sc使传入神经"失去功能"(denervation)后, 再以0.4 mA电刺激PVN, 然后行GI-R组(辣椒素预处理组); 股静脉注射L-NAME(3 mg/kg)10 min后, 再以0.4 mA电刺激PVN, 然后行GI-R组(L-NAME组).
1.2.2 辣椒素敏感传入神经"失功能"法: 12.5 g/L辣椒素溶于100 mL/L乙醇、100 mL/L吐温80和800 mL/L生理盐水中, 分3 d sc, 剂量分别为25、50、50 mg/(kg·d), 每天1次, 总剂量为125 mg/kg. 另一组大鼠注射等容积的溶剂作为对照(溶剂组). 2 wk后以0.1 mL/L辣椒素溶液滴入每只大鼠眼内. 在检验去神经成功(对照组大鼠均出现显著的前肢擦抹眼部的反应, 而"去神经"组大鼠则无此反应[8])后, 进行核团埋藏电极.
1.2.3 核团埋藏电极: 大鼠在麻醉下(100 g/L水合氯醛400 mg/kg ip)固定于立体定位仪上, 按照Paxinos和Watson脑图谱[9]及我们以前的方法[3]将外径0.4 mm、内芯尖端裸露0.5 mm的同心圆刺激电极插入右侧PVN(坐标: AP 1.5 mm, R 0.4 mm, H 7.7-7.8 mm, 门齿瓣低于耳间连线3.3 mm), 用502胶及自凝牙托粉固定. 刺激PVN的参数为单相方波, 波宽0.2 ms, 强度0.4 mA, 频率50 Hz, 持续1 min. 刺激脉冲由刺激器产生并通过隔离器恒流恒压输出, 每间隔10 min刺激1次, 共5次, 假电刺激组只插电极不进行电刺激. 刺激完毕立即行胃缺血-再灌注.
1.2.4 GI-R动物模型的制备: 按Wada et al[10]法进行. 实验大鼠水合氯醛麻醉后, 仔细分离腹腔动脉与周围组织, 用小动脉夹夹闭腹腔动脉30 min后去除动脉夹恢复血流再灌注60 min. 实验结束后取胃计数胃黏膜损伤指数.
1.2.5 胃黏膜损伤指数测定: 参照Guth et al[11]法加以改进. 以腺胃区局限于胃上皮的点状糜烂、溃疡、出血灶的长度累积计分: 正常为0分; 损伤小于1 mm计1分; 1-2 mm计2分; 2-3 mm计3分; 余类推. 损伤宽度超过1 mm时, 分数加倍. 每组大鼠损伤分数的平均值为损伤指数.
统计学处理 采用SPSS13.0软件包对结果进行分析, 应用方差分析, 数据以mean±SD表示, P<0.05有统计学意义.
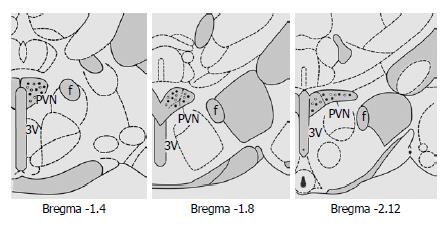
根据Paxinos和Watson脑图谱[9], 对实验中PVN的刺激部位进行了组织学鉴定, 组织学图片见图1.
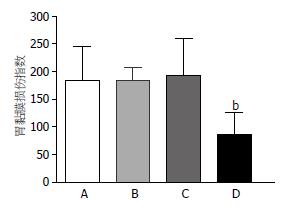
我们重复GI-R动物模型. GI-R 1 h可引起胃黏膜明显损伤, 其胃黏膜损伤指数为184.7±60.9, 假电刺激PVN组胃黏膜损伤与单纯GI-R组无明显差异, 其胃黏膜损伤指数为: 183.3±24.6; sc溶剂2 wk后进行GI-R组亦与单纯GI-R组无明显差异, 其胃黏膜损伤溃疡指数为: 192.4±68.3; 0.4 mA电刺激PVN后进行GI-R组, 其胃黏膜损伤指数为: 85.4±39.8, 较GI-R组明显减轻(P<0.01). 因此, 提示电刺激PVN可明显减轻胃黏膜损伤, 而手术操作和溶剂对胃黏膜损伤无明显影响(图2).
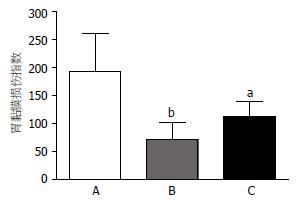
在成功重复了GI-R动物模型基础上, 我们观察辣椒素预处理对电刺激室旁核减轻大鼠胃缺血-再灌注损伤中的作用. 以sc溶剂2 wk后进行GI-R组作为对照, sc溶剂2 wk后行电刺激PVN+GI-R组, 其胃黏膜损伤指数为72.3±29.8, 与溶剂对照组比较具有显著差别(P<0.01), 辣椒素预处理组胃黏膜损伤指数为112.0±28.6, 说明部分翻转了电刺激PVN对胃黏膜的保护作用, 损伤较电刺激组加重54.9%, 统计学上无显著差异, 与对照组比较差异显著(P<0.05, 图3).
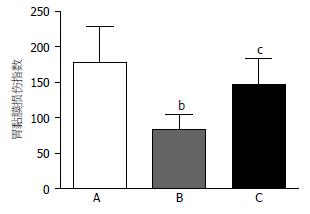
以iv溶剂10 min后进行GI-R组为对照组, 其胃黏膜损伤指数为178.2±50.1; iv溶剂10 min后, 0.4 mA电刺激PVN+GI-R组损伤明显减轻, 其胃黏膜损伤指数84.0±20.0; 腹腔给予L-NAME 12.5 mg/kg阻断内源性NO释放后, 再用0.4 mA的电流刺激PVN+GI-R, 可完全消除电刺激PVN的保护作用, 损伤较电刺激组加重73.0%, 其胃黏膜损伤指数为147.7±35.9, 与电刺激组相比具有显著性差异(P<0.05, 图4).
我们前期的研究已经发现电刺激PVN后, 通过迷走和交感神经的介导, 能够明显减轻GI-R损伤[2-3]. 但在此过程中传入神经的作用尚难确定. 研究发现: 传入神经对辣椒素敏感, 辣椒素是一种兴奋性毒素, 小剂量时对传入神经元有强烈的刺激作用, 大剂量时可引起传入神经元长期失功能, 即产生"去神经"作用, 因此辣椒素可作为研究传入神经的工具药.
辣椒素敏感传入神经能增强胃黏膜对外来损伤因子的抵抗力, 近几年研究显示胃内灌注适量的辣椒素对胃黏膜具有保护作用, 并能促进溃疡愈合[12]. 小剂量辣椒素(1-10 mg/kg)可预防或明显减轻由盐酸、乙醇、酸化阿司匹林和出血性休克等引起的大鼠胃黏膜损伤, 而用神经毒剂量的辣椒素预处理后, 则加重各种损伤因子如浸水应激、盐酸、牛磺胆酸盐、血小板活性因子、内皮素-1、醋酸、乙酰水杨酸、消盐痛和酒精引起的胃黏膜损伤的形成[13-15], 一些对胃黏膜具有保护性的物质如: 胃泌素17、抗溃疡药ecabat、抗酸药hydrotalcit、质子泵抑制剂lansoprazole、前列腺素E2等, 他们对胃黏膜的保护作用可被辣椒素预处理减弱或消除[15-19]. GI-R损伤的发生与胃黏膜内氧自由基生成过多、内皮素水平升高、胃微循环障碍、白细胞浸润、一氧化氮释放、胃酸分泌增多、前列腺素合成减少等有关[2-3,20], 辣椒素敏感的传入神经参与Ghrelin、leptin、胆囊收缩素(cholecystokinin)等脑肠肽以及缺血预处理对GI-R损伤的保护作用[21-23].
本研究发现辣椒素预处理后, 电刺激PVN组GI-R损伤较溶剂对照组加重54.85%, 说明辣椒素敏感传入神经可能部分参与了电刺激PVN对GI-R损伤的保护作用, 但还有其他保护机制. 由于辣椒素敏感的传入神经对胃黏膜的保护作用是由CGRP等非肾上腺素、非胆碱能递质所介导的, NO是他们共同的第二信使, 对多种损伤因子所致的胃黏膜损伤具有保护作用. Masuda et al[24]的研究表明应用NO合酶抑制剂L-NNA抑制内源性NO的形成, 可明显增加酒精所至胃黏膜损伤, NO供体L-Arg能完全抑制L-NNA的作用, 使黏膜损伤减轻. Andrews et al和Naito et al报道给予外源性NO及刺激内源性NO的合成均能减轻GI-R损伤, 应用NO合酶抑制剂明显增加GI-R损伤[25-26]. 为此, 我们进一步观察了NO在电刺激PVN减轻GI-R损伤中的作用, 发现给予L-NAME阻断内源性NO后能完全取消电刺激PVN对GI-R损伤的保护作用, 其胃黏膜损伤指数较未给药电刺激PVN组加重72.98%, 本结果也支持NO作为一种保护因子, 参与PVN对GI-R调控作用, 其可能机制为电刺激PVN后, 通过外周神经影响内源性NO的释放, 从而参与PVN对GI-R损伤的保护作用.
总之, 辣椒素敏感传入神经及内源性NO参与了电刺激PVN对GI-R损伤的保护效应, 这将为临床治疗胃黏膜损伤提供理论依据.
下丘脑室旁核是调节内脏活动的一个关键核团, 参与了对胃的各种生理机能如胃酸分泌、胃运动及胃电活动的调节. 室旁核内神经元兴奋后可以通过神经传导或神经-内分泌通路, 影响胃黏膜的攻击因子和防御因子, 从而参与多种胃黏膜损伤的调控; 而胃内的伤害性刺激也可以引起室旁核等核团的激活, 表现为c-fos的大量表达.
梅林, 教授, 北京大学医学部生理学与病理生理学系神经调节和消化内分泌研究室
如何减轻各种伤害性刺激所致胃黏膜损伤是多年来消化生理研究的热点, 其中脑肠轴(brain-gut axis)的作用已引起人们的广泛关注. 辣椒素敏感传入神经元参与了多种保护因子对胃黏膜损伤保护作用.
本研究首次报道辣椒素敏感传入神经及内源性NO参与了电刺激室旁核对胃缺血-再灌注损伤的保护效应, 初步探讨了可能参与室旁核对胃黏膜损伤调控的传入神经通路.
研究表明胃内灌注辣椒素对多种伤害性刺激引起的大鼠胃黏膜损伤及人胃黏膜具有明显的保护作用. 因此, 辣椒素对胃肠黏膜损伤的治疗具有潜在的应用价值.
本文实验对照的设计尚合理可靠, 统计学处理方法使用恰当, 为临床研究提供了一定的依据.
编辑: 李军亮 电编:吴鹏朕
| 1. | 张 咏梅, 张 建福, 魏 尔清. 下丘脑室旁核对胃的调控. 国际麻醉学与复苏杂志. 2006;27:373-376. |
| 2. | Zhang JF, Zhang YM, Yan CD, Zhou XP. Neuroregulative mechanism of hypothalamic paraventricular nucleus on gastric ischemia-reperfusion injury in rats. Life Sci. 2002;71:1501-1510. [PubMed] [DOI] |
| 3. | Zhang YM, Wei EQ, Li L, Qiao WL, Wang L, Zhang JF. Extracellular signal-regulated kinase pathways may mediate the protective effect of electrical stimulation of the paraventricular nucleus against ischaemia-reperfusion injury of the gastric mucosa. Clin Exp Pharmacol Physiol. 2007;34:742-752. [PubMed] [DOI] |
| 4. | Kwiecień S, Brzozowski T, Konturek PC, Pawlik MW, Pawlik WW, Kwiecień N, Konturek SJ. The role of reactive oxygen species and capsaicin-sensitive sensory nerves in the pathomechanisms of gastric ulcers induced by stress. J Physiol Pharmacol. 2003;54:423-437. [PubMed] |
| 5. | Evangelista S. Role of sensory neurons in restitution and healing of gastric ulcers. Curr Pharm Des. 2006;12:2977-2984. [PubMed] [DOI] |
| 6. | Brzozowski T, Konturek PC, Konturek SJ, Brzozowska I, Pawlik T. Role of prostaglandins in gastroprotection and gastric adaptation. J Physiol Pharmacol. 2005;56 Suppl 5:33-55. [PubMed] |
| 7. | Szolcsányi J, Barthó L. Capsaicin-sensitive afferents and their role in gastroprotection: an update. J Physiol Paris. 2001;95:181-188. [PubMed] [DOI] |
| 8. | Holzer P. Neural emergency system in the stomach. Gastroenterology. 1998;114:823-839. [PubMed] [DOI] |
| 9. | Paxinos G, Watson C. The rat brain in sterotaxic coordinates. 3nd ed. Orlando FLA, USA: Academic Press 1996; F23-F26. |
| 10. | Wada K, Kamisaki Y, Kitano M, Kishimoto Y, Nakamoto K, Itoh T. A new gastric ulcer model induced by ischemia-reperfusion in the rat: role of leukocytes on ulceration in rat stomach. Life Sci. 1996;59:PL295-PL301. [PubMed] [DOI] |
| 11. | Guth PH, Aures D, Paulsen G. Topical aspirin plus HCl gastric lesions in the rat. Cytoprotective effect of prostaglandin, cimetidine, and probanthine. Gastroenterology. 1979;76:88-93. [PubMed] |
| 12. | Satyanarayana MN. Capsaicin and gastric ulcers. Crit Rev Food Sci Nutr. 2006;46:275-328. [PubMed] [DOI] |
| 14. | Sobue M, Joh T, Oshima T, Suzuki H, Seno K, Kasugai K, Nomura T, Ohara H, Yokoyama Y, Itoh M. Contribution of capsaicin-sensitive afferent nerves to rapid recovery from ethanol-induced gastric epithelial damage in rats. J Gastroenterol Hepatol. 2003;18:1188-1195. [PubMed] [DOI] |
| 15. | Fukushima K, Aoi Y, Kato S, Takeuchi K. Gastro-protective action of lafutidine mediated by capsaicin-sensitive afferent neurons without interaction with TRPV1 and involvement of endogenous prostaglandins. World J Gastroenterol. 2006;12:3031-3037. [PubMed] |
| 16. | Stroff T, Plate S, Respondek M, Müller KM, Peskar BM. Protection by gastrin in the rat stomach involves afferent neurons, calcitonin gene-related peptide, and nitric oxide. Gastroenterology. 1995;109:89-97. [PubMed] [DOI] |
| 17. | Kinoshita M, Kume E, Tamaki H. Roles of prostaglandins, nitric oxide and the capsaicin-sensitive sensory nerves in gastroprotection produced by ecabet sodium. J Pharmacol Exp Ther. 1995;275:494-501. [PubMed] |
| 18. | Murakami I, Satoh H, Asano S, Maeda R. Role of capsaicin-sensitive sensory neurons and nitric oxide in the protective effect of lansoprazole, a proton pump inhibitor, on the gastric mucosa in rats. Jpn J Pharmacol. 1996;72:137-147. [PubMed] [DOI] |
| 19. | Vongthavaravat V, Mesiya S, Saymeh L, Xia Y, Ward A, Harty RF. Transforming growth factor alpha-mediated gastroprotection against stress ulceration in the rat: involvement of capsaicin-sensitive sensory neurons. Life Sci. 2003;72:1803-1811. [PubMed] [DOI] |
| 21. | Konturek PC, Brzozowski T, Walter B, Burnat G, Hess T, Hahn EG, Konturek SJ. Ghrelin-induced gastroprotection against ischemia-reperfusion injury involves an activation of sensory afferent nerves and hyperemia mediated by nitric oxide. Eur J Pharmacol. 2006;536:171-181. [PubMed] [DOI] |
| 22. | Brzozowski T, Konturek PC, Pajdo R, Kwiecień S, Ptak A, Sliwowski Z, Drozdowicz D, Pawlik M, Konturek SJ, Hahn EG. Brain-gut axis in gastroprotection by leptin and cholecystokinin against ischemia-reperfusion induced gastric lesions. J Physiol Pharmacol. 2001;52:583-602. [PubMed] |
| 23. | Pajdo R, Brzozowski T, Konturek PC, Kwiecien S, Konturek SJ, Sliwowski Z, Pawlik M, Ptak A, Drozdowicz D, Hahn EG. Ischemic preconditioning, the most effective gastroprotective intervention: involvement of prostaglandins, nitric oxide, adenosine and sensory nerves. Eur J Pharmacol. 2001;427:263-276. [PubMed] [DOI] |
| 24. | Masuda E, Kawano S, Nagano K, Tsuji S, Takei Y, Tsujii M, Oshita M, Michida T, Kobayashi I, Nakama A. Endogenous nitric oxide modulates ethanol-induced gastric mucosal injury in rats. Gastroenterology. 1995;108:58-64. [PubMed] [DOI] |
| 25. | Andrews FJ, Malcontenti-Wilson C, O'Brien PE. Protection against gastric ischemia-reperfusion injury by nitric oxide generators. Dig Dis Sci. 1994;39:366-373. [PubMed] [DOI] |
| 26. | Naito Y, Yoshikawa T, Matsuyama K, Yagi N, Arai M, Nakamura Y, Kaneko T, Yoshida N, Kondo M. Neutrophils, lipid peroxidation, and nitric oxide in gastric reperfusion injury in rats. Free Radic Biol Med. 1998;24:494-502. [PubMed] [DOI] |