修回日期: 2008-10-17
接受日期: 2008-10-21
在线出版日期: 2008-11-08
目的: 探讨乙型肝炎患者外周血DCs HBV DNA载量与DCs功能的关系.
方法: 采集20例慢性乙型肝炎患者和10例健康人的抗凝外周静脉血, 分离外周血单个核细胞(PBMCs), IL-4和GM-CSF的作用下培养使DCs增殖、成熟, 以流式细胞技术分别检测DCs表面HLA-DR、CD-1α、CD80及CD86的表达; ELISA检测DCs培养上清液IL-12的水平, 实时荧光定量PCR法检测DCs HBV DNA的载量, 同种异体混合淋巴细胞反应检测DCs刺激同种异体T细胞增殖能力.
结果: 慢性乙型肝炎患者外周血DCs内亦可检测到HBV DNA, 患者DCs表面HLA-DR、CD-1α、CD80及CD86的表达水平、DCs分泌IL-12水平及DCs刺激同种异体T细胞增殖能力均显著低于健康对照组, 其中DCs HBV DNA阳性组较DCs HBV DNA阴性组下降更为明显(39.17±6.02 vs 60.11±7.92, 46.03±5.52 vs 58.77±4.12, 20.95±6.32 vs 35.24±7.41, 25.16±6.05 vs 45.30±8.01, 19.67±7.32 vs 30.74±8.39, 0.32±0.08 vs 0.59±0.11, 均P<0.01或0.05); HLA-DR、CD-1α、CD80及CD86的表达、IL-12水平及DCs刺激同种异体T细胞增殖能力与DCs HBV DNA载量呈显著负相关(r = -0.713, -0.713, -0.623, -0.702, -0.525, -0.841, 均P<0.001).
结论: 慢性乙型肝炎患者外周血DCs可被HBV DNA感染, 患者DCs HBV DNA载量与DCs功能有密切关系, 病毒载量低者DCs功能好, 病毒载量高者DCs功能差.
引文著录: 彭建平, 孙克伟, 伍玉南, 何芳. 慢性乙型肝炎患者外周血树突状细胞HBV DNA载量与其功能的关系. 世界华人消化杂志 2008; 16(31): 3556-3560
Revised: October 17, 2008
Accepted: October 21, 2008
Published online: November 8, 2008
AIM: To investigate the HBV DNA load in monocyte-derived dendritic cells (DCs) from patients with chronic hepatitis B, and to explore the reason for decrease of DC function.
METHODS: Twenty patients with chronic hepatitis B and 10 healthy controls were included in this study. We incubated and induced DC subsets differentiated from peripheral blood mononuclear cells (PBMCs). The expression levels of HLA-DR, CD-1α, CD80 and CD86 were detected by flow cytometry, and the levels of interleukin-12 (IL-12) in supernatants were measured by enzyme-linked immunosorbent assay (ELISA). The stimulatory ability of DCs for proliferation of allogeneic T cells was evaluated with mixed lymphocyte reaction (MLR). HBV DNA load in DCs was detected by fluorescent quantitative real-time PCR.
RESULTS: HBV DNA was detected in the DCs of 13 patients. The expression levels of HLA-DR, CD-1α, CD80, CD86, IL-12, and the stimulatory ability of DCs for allogeneic T cell proliferation were much lower in patients than those in healthy controls (P < 0.01 or 0.05); moreover, the above indicator levels were lower in patients with DC HBV DNA positive than those in patients with DC HBV DNA negative (correspondingly: 39.17 ± 6.02 vs 60.11 ± 7.92; 46.03 ± 5.52 vs 58.77 ± 4.12, 20.95 ± 6.32 vs35.24 ± 7.41, 25.16 ± 6.05 vs 45.30 ± 8.01, 19.67 ± 7.32 vs 30.74 ± 8.39, 0.32 ± 0.08 vs 0.59 ± 0.11; P < 0.01 or 0.05 ). The expression levels of HLA-DR, CD-1α, CD80 and CD86 on DCs, as well as the secretion of IL-12 and the stimulatory ability of DCs for allogeneic T cell proliferation, were significantly correlated with DC HBV load (r = -0.713, -0.713, -0.623, -0.702, -0.525, -0.841; P < 0.001).
CONCLUSION: The monocyte-derived DCs can be infected by HBV DNA. There is a significantly negative correlation between DC function and HBV DNA load, and the function of DCs is good when the load of HBV DNA is lower.
- Citation: Peng JP, Sun KW, Wu YN, He F. Relationship between HBV DNA load in monocyte-derived dendritic cells and dendritic cell function in patients with chronic hepatitis B. Shijie Huaren Xiaohua Zazhi 2008; 16(31): 3556-3560
- URL: https://www.wjgnet.com/1009-3079/full/v16/i31/3556.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i31.3556
病毒性肝炎是我国最常见的疾病之一, 慢性乙型肝炎患者病情迁延不愈的主要原因是由于HBV形成的特异性的免疫耐受所导致的病毒持续感染. 树突状细胞(dendritic cells, DCs)是迄今所知作用最强的抗原递呈细胞(antigen presenting cell, APC)[1]. 在慢性乙型肝炎患者中DCs的功能是低下的[2], DCs功能的异常可能导致抗原提呈功能失调, 引起体液和细胞免疫紊乱, 最终导致患者病情迁延不愈[3]. DCs HBV DNA载量反映了HBV在DCs内复制的活跃程度. 目前关于乙型肝炎患者DCs内HBV载量与DCs功能的关系, 国内外报道少见. 本研究对乙型肝炎患者DCs内HBV DNA的存在状况进行研究, 力求探讨慢性乙型肝炎患者DCs的功能下降的可能原因.
20例慢性乙型肝炎患者为2008-04/08湖南中医药大学第一附属医院门诊及住院病例, 均为血清HBV DNA阳性患者, 其中男14例, 女6例, 年龄25-46(平均34.9)岁. 诊断参照2000年西安全国病毒性肝炎会议的标准[4], 均排除了甲、丙、丁和戊型肝炎等病毒重叠感染以及其他原因(酒精、药物等)引起的肝脏损害. 另取10例健康人作为正常对照. 淋巴细胞分离液购于天津灏洋公司; IL-4和GM-CSF购于美国Peprotech公司; RPMI 1640购于美国Gibco公司; 胎牛血清(fetal calf serum, FCS)购于美国Hyclone公司, 荧光标记鼠抗人HLA-DR-PE, CD-1α-FITC, CD80-FITC, CD86-PE购于美国eBioscience公司; 人IL-12 ELISA试剂盒购于深圳晶美生物工程有限公司; HBV DNA PCR荧光检测试剂盒购于上海科华生物技术有限公司; 丝裂霉素C购于美国Sigma公司.
1.2.1 DCs的培养: 按照Romani et al分离培养DCs的方法稍作修改[5]. 无菌条件下抽取各组外周血20 mL, 肝素抗凝, 用淋巴细胞分离液分离外周血单个核细胞(peripheral blood mononuclear cells, PBMCs), PBS洗涤2次, RPMI 1640洗涤1次. 用含100 mL/L FCS RPMI 1640液调整外周血PBMCs浓度为3×109/L, 移植入6孔培养板, 每孔3 mL. 50 mL/L CO2 37℃条件下培养2 h, 吸弃培养上清液, 37℃预热RPMI 1640液轻轻洗涤培养板2次, 祛除非贴壁细胞, 即获贴壁的单个核细胞. 往祛除非贴壁细胞的6孔培养板孔内各加3 mL 100 mL/L FCS RPMI 1640培养液, 其中含有GM-CSF 100 μg/L, IL-4 500 kU/L, 在50 mL/L CO2 37℃条件下培养, 隔天换液1次, 吸弃原液1.5 mL, 加同体系培养液1.5 mL. 收集第7天悬浮细胞即为DCs. 台盼蓝染色测定细胞活力>95%, 计数DCs获得量.
1.2.2 FACS检测DCs细胞表面分子的表达: 在DCs培养的第7天收集细胞, 用PBS洗细胞2次, 稀释成5×108/L, 加入鼠抗人鼠抗人HLA-DR-PE, CD-1α-FITC, CD80-FITC, CD86-PE 20 μL, 轻轻混匀, 4℃温育45 min, 再用PBS洗2次, 流式细胞仪检测HLA-DR、CD-1α、CD86、CD80的表达.
1.2.3 ELISA检测DCs培养上清液IL-12的水平: 按试剂盒说明书操作.
1.2.4 同种异体混合淋巴细胞反应: 取其他健康人外周血, 经淋巴细胞分离液分离后获得单个核细胞, 注入T细胞尼龙毛柱, 37℃孵育1 h后, 冲洗出非黏附细胞为同种异型效应T细胞. 取同时培养7 d的DCs用50 mg/L的丝裂霉素C 37℃处理45 min后, PBS洗涤3次, 悬浮于完全1640培养基中, 以1×104/孔加人96孔培养板, 分别用患者和正常人的PBMCs作对照组, 每组各3个复孔, 每孔加人同种T细胞2×105, 终体积200 μL/孔, 在37℃、50 mL/L CO2条件下培养96 h. 培养结束后, 沉淀细胞加人MTT液(5 g/L)20 μL/孔, 上述相同条件下继续培养4-6 h, 每孔加人酸化异丙醇100 μL, 振荡10 min, 在波长550 nm处测A值.
1.2.5 HBV DNA的检测: 采用实时荧光定量PCR法检测, 仪器为杭州博日Line-Gene型全自动定量PCR仪, 试剂为上海科华配套试剂, 检测灵敏度为5×105 copies/L. DCs培养的第7天, 用含100 mL/L FCS RPMI 1640液调整DCs浓度为5×108/L, 每个标本取细胞悬液3 mL, PBS洗涤3次, 提取DCs内DNA, 按试剂盒说明书操作. 同时将最后一次洗涤液保留进行HBV DNA的检测, 检测方法同上.
统计学处理 对检测的HBV DNA拷贝数取常用对数. 对DCs功能的相关指标与HBV DNA的常用对数值用相关分析法进行处理, 并对相关系数进行显著性检验, 两组数据间的相关关系用直线相关分析方法, P<0.05为有显著性差异.
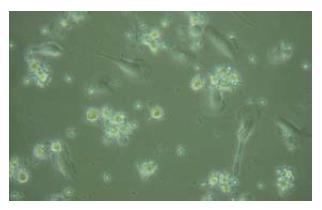
PBMCs培养2 h后见圆形扁平贴壁细胞, 培养24 h后可见贴壁单个核细胞聚集成大小不等葡萄串状, 黏附于培养板底, 尤以边缘为著. 第3天可见这部分细胞体积增大, 第4天可见部分细胞悬浮于细胞培养液, 第5天可见这部分细胞数目增多, 部分细胞出现许多毛刺. 第7天培养液中飘浮着大量有明显树突状的大个细胞或细胞团(图1).
将DCs洗涤液进行HBV DNA的检测, 所有标本均未检出HBV DNA, 排除了血清污染对实验结果的影响. 血清HBV DNA阳性患者20例, 13例DCs内可检测到HBV DNA, 7例DCs内未检出HBV DNA, DCs内HBV DNA检出率为65.0%. 20例患者血清HBV DNA拷贝数的平均数为6.36±0.33log10值, 13例DCs HBV DNA阳性者DCs HBV DNA拷贝数的平均数为6.07±0.21log10值, 而7例DCs HBV DNA阴性者及10例正常对照者DCs HBV DNA水平<106 copies/L.
DCs HBV DNA阳性组及阴性组HLA-DR、CD80、CD86和CD-1α的表达率普遍降低, 分别与正常人组比较P<0.01, 尤以DCs HBV DNA阳性组下降更为明显, 与DCs HBV DNA阴性组比较P<0.01, 有统计学意义(表1).
在同种异体混合淋巴细胞反应中, DCs表现出比自体PBMCs具有更强的刺激T淋巴细胞增殖的能力. DCs HBV DNA阳性组、DCs HBV DNA阴性组及正常对照组刺激T细胞增殖的A值分别为0.32±0.08、0.59±0.11、0.71±0.09, 三组之间两两比较均有显著性差异(P<0.05), 可见HBV DNA阳性组DCs刺激T细胞增殖的能力低于HBV DNA阴
性组.
13例DCs HBV DNA阳性者IL-12水平均值为19.67±7.32 ng/L, 7例DCs HBV DNA阴性者IL-12水平均值为30.74±8.39 ng/L, 而正常人组为79.58±6.68 ng/L, 慢性乙型肝炎较正常人组IL-12水平明显下降, P<0.01, 尤以DCs HBV DNA阳性组下降更为明显, 与DCs HBV DNA阴性组比较P<0.01, 有统计学意义.
DCs表面分子的表达、DCs分泌IL-12水平及DCs刺激同种异体T细胞增殖能力与DCs HBV DNA载量呈显著负相关(CD80: r = -0.623, t = 3.839,P<0.01; CD86: r = -0.702, t = 3.541, P<0.01; HLA-DR: r = -0.713, t = 7.487, P<0.001; CD-1α: r = -0.713, t = 7.487, P<0.001; IL-12: r = -0.525, t = 4.110, P<0.001; DCs刺激同种异体T细胞增殖能力: r = -0.841, t = 7.103, P<0.001).
DCs是人体内功能最强的专职性APC, 是机体免疫功能的始动者, 能显著活化初始T淋巴细胞, 还与单核细胞、内皮细胞及活化的B淋巴细胞一起参与再次免疫应答. 其功能缺陷将导致抗原无法被有效地递呈给CD4+Th和CD8+CTL, 从而产生异常的细胞和体液免疫应答. 目前不少研究结果表明, 慢性乙型肝炎患者DCs的功能存在缺陷, 认为这是导致HBV持续感染的重要因素之一[6-7].
近年来, 国内外的大量研究表明, 慢性乙型肝炎患者外周血DCs数量减少, 表型不成熟、功能下调, 并且临床往往表现出外周血高滴度的HBV DNA载量, 而且针对HBV的特异性CTL应答很弱, 甚至检测不到[8].
HBV DNA是体内HBV复制增殖最直接的指标, 无外源性抗病毒措施干预时, 血清HBV DNA载量的高低可以反映机体免疫系统和HBV之间的作用结果, 而且不同HBV DNA载量组间肝组织炎症程度亦存在明显的差异[9-10], 因此HBV DNA载量可以作为重要参数来评价机体免疫系统对HBV的免疫应答状态. 而DCs内HBV DNA载量反映的是DCs内HBV复制水平的高低, DCs的生物学功能可能受HBV直接影响[11].
曾有报道将HBV导入正常人的DCs后发现其表型和功能明显降低. Munz et al[11]发现, 慢性乙型肝炎患者外周血DCs中可检测到HBV DNA基因片段, 这说明DCs可被HBV感染, DCs的生物学功能可能受HBV直接影响. 而Arima则运用原位杂交PCR和RT-PCR的方法, 从慢性乙型肝炎患者外周血来源的DCs内检测到了HBV DNA和HBV RNA, 并发现其同种异体混合淋巴细胞反应水平下降, 表明DCs可能作为HBV的肝外贮存场所并与HBV的复制有关[12]. 研究还发现, 慢性乙型肝炎患者DCs的表型以及抗原提呈能力与体内HBV载量密切相关, 表型以及抗原递呈能力良好者病毒载量低, 而表型以及抗原递呈能力差者则病毒载量高[13].
Beckebaum et al[14]将HBV颗粒与正常人外周血单个核细胞来源的DCs共培养后, PCR及透射电镜检测发现: DCs内存在HBV, 说明体外培养的DCs亦能被HBV感染, 其机制可能为DCs表达唾液酸糖蛋白受体(asialoglycoprotein receptor, ASGPR), ASGPR介导细胞的内摄作用, 导致HBV进入DCs内[15]. 本研究将DCs洗涤液进行HBV DNA的检测, 所有标本均未检出HBV DNA, 排除了HBV体外感染DCs的可能, 本研究在DCs内检测到的HBV DNA为患者DCs本身所含有的.
本研究的结果显示, 20例慢性乙型肝炎血清HBV DNA阳性患者, DCs内HBV DNA检出率为65.0%, 说明DCs亦能受到HBV感染. 慢性乙型肝炎DCs HBV DNA阳性及DCs HBV DNA阴性患者DCs表面HLA-DR、CD80、CD86和CD-1α的表达均较正常人组明显低下, 且DCs HBV DNA阳性组较DCs HBV DNA阴性组下降更为明显. 并且HLA-DR、CD80、CD86和CD-1α等的表达与DCs内HBV DNA载量均呈显著的负相关关系, 而这些分子与DCs的成熟度和功能发挥有密切的关系. 提示慢性乙型肝炎患者DCs HBV DNA载量与DCs表面分子表达水平有密切关系, 病毒载量低者表面分子表达水平高, 病毒载量高者表面分子表达水平低.
IL-12是迄今为止所发现的DCs细胞释放的最有效的CTL和NK细胞活性刺激因子, 在机体抗病毒和抗肿瘤的一系列免疫病理条件下均能发挥关键作用. Chouaib et al[16-17]报道在MLR反应阶段, 内源性IL-12的产生对细胞的增殖和CTL分化起重要的作用. 因此, IL-12产生的缺失可能是慢性乙型肝炎患者DCs刺激T细胞增殖能力降低的最重要的原因. 从我们的实验中发现DCs HBV DNA阳性及DCs HBV DNA阴性患者DCs分泌IL-12水平较正常对照组均明显下降, DCs HBV DNA阳性组较DCs HBV DNA阴性组亦有明显下降, 并且DCs分泌IL-12水平与DCs内HBV DNA水平均呈显著负相关, DCs HBV DNA载量越高, 则DCs分泌IL-12水平越低. 说明DCs内HBV DNA载量能影响DCs分泌IL-12水平, 从而进一步影响DCs功能.
总之, 慢性乙型肝炎患者外周血DCs内亦可检测到HBV DNA, 说明DCs亦能受到HBV的感染. 而且DCs的表型、刺激同种异体T细胞增殖能力及分泌IL-12能力与DCs内HBV载量呈显著负相关关系, 在一定程度上反映了DCs的功能状态对机体清除HBV的影响. 因此, 寻求恢复或提高患者DCs的功能, 可能将是治疗慢性乙型肝炎的一种新的方法.
DCs是人体内功能最强的专职性APC, 是机体免疫功能的始动者, 其功能缺陷将导致抗原无法被有效的递呈给CD4+Th和CD8+CTL, 从而产生异常的细胞和体液免疫应答. Beekebaum和Arima均已证实DCs内有HBV的感染. HBV对DCs的感染, 可以诱导DCs的凋亡, 从而导致DCs分泌细胞因子和刺激T细胞增殖的能力受到抑制, DCs作为体内免疫反应的始动子、调节子和效应子, 一旦受损会影响到机体免疫的各个环节. 所以, 研究DCs内HBV DNA载量与DCs功能的关系是慢性HBV感染机制研究的一个重要方面.
朱传武, 副主任医师, 江苏省苏州市第五人民医院传染科
慢性乙型肝炎患者PBMCs通过体外诱导培养产生的DCs存在HBV, 这一现象对DCs和免疫系统功能尤其在慢性乙型肝炎病变过程的影响值得重视. DCs内存在HBV对各种免疫细胞的分化、功能及他们与DCs间的相互作用关系产生影响有待于进一步的研究并加以证实.
Munz et al发现, 慢性乙型肝炎患者外周血DCs中可检测到HBV DNA基因片段. 而Arima则运用原位杂交PCR和RT-PCR的方法, 从慢性乙型肝炎患者外周血来源的DCs内检测到了HBV DNA和HBV RNA, 并发现其同种异体混合淋巴细胞反应水平下降. Beekebaum et al研究表明, 正常人单个核细胞来源的DCs在受到HBV感染后, 表现出抗原提呈功能下降, 同时伴随Thl反应受损.
目前关于乙型肝炎患者DCs内HBV载量与DCs功能的关系, 国内外报道少见. 本研究对乙型肝炎患者DCs内HBV DNA的存在状况进行研究, 力求探讨慢性乙型肝炎患者DCs的功能下降的可能原因.
寻求恢复或提高患者DCs的功能, 可能将是治疗慢性乙型肝炎的一种新的方法, 国内已开展了DCs疫苗治疗慢性乙型肝炎的研究. 研究慢性乙型肝炎患者外周血DCs HBV DNA载量与其功能关系或许能为DCs疫苗治疗慢性乙型肝炎提供一定的基础.
本文探讨了慢性乙型肝炎患者外周血DCs HBV DNA载量与DCs功能的关系, 新颖性较强, 研究内容可信, 具有一定的研究价值.
编辑: 李军亮 电编:郭海丽
| 1. | Banchereau J, Steinman RM. Dendritic cells and the control of immunity. Nature. 1998;392:245-252. [PubMed] [DOI] |
| 2. | Akbar SM, Horiike N, Onji M, Hino O. Dendritic cells and chronic hepatitis virus carriers. Intervirology. 2001;44:199-208. [PubMed] [DOI] |
| 3. | Arima S, Akbar SM, Michitaka K, Horiike N, Nuriya H, Kohara M, Onji M. Impaired function of antigen-presenting dendritic cells in patients with chronic hepatitis B: localization of HBV DNA and HBV RNA in blood DC by in situ hybridization. Int J Mol Med. 2003;11:169-174. [PubMed] |
| 5. | Romani N, Reider D, Heuer M, Ebner S, Kampgen E, Eibl B, Niederwieser D, Schuler G. Generation of mature dendritic cells from human blood. An improved method with special regard to clinical applicability. J Immunol Methods. 1996;196:137-151. [PubMed] [DOI] |
| 6. | Tavakoli S, Mederacke I, Herzog-Hauff S, Glebe D, Grun S, Strand D, Urban S, Gehring A, Galle PR, Bocher WO. Peripheral blood dendritic cells are phenotypically and functionally intact in chronic hepatitis B virus (HBV) infection. Clin Exp Immunol. 2008;151:61-70. [PubMed] |
| 7. | Wang K, Fan X, Fan Y, Wang B, Han L, Hou Y. Study on the function of circulating plasmacytoid dendritic cells in the immunoactive phase of patients with chronic genotype B and C HBV infection. J Viral Hepat. 2007;14:276-282. [PubMed] [DOI] |
| 8. | Takaki A, Tatsukawa M, Koike K, Shiratori Y. [Mechanism of immune surveillance against HBV infection]. Nippon Rinsho. 2004;62 Suppl 8:62-65. [PubMed] |
| 9. | Beckebaum S, Cicinnati VR, Gerken G. DNA-based immunotherapy: potential for treatment of chronic viral hepatitis? Rev Med Virol. 2002;12:297-319. [PubMed] [DOI] |
| 10. | Gao B, Chen HS, Zhao GM, Zhu L, Ji Y, Fei R, Dai CY, Xu J, Zhu LM, Wei L. [Relationship between the quantities of peripheral dendritic cells and of serum HBV DNA and the inflammatory reaction levels in the liver]. Zhonghua Ganzangbing Zazhi. 2005;13:414-416. [PubMed] |
| 11. | Munz C, Steinman RM, Fujii S. Dendritic cell maturation by innate lymphocytes: coordinated stimulation of innate and adaptive immunity. J Exp Med. 2005;202:203-207. [PubMed] [DOI] |
| 12. | Arima S, Akbar SM, Michitaka K, Horiike N, Nuriya H, Kohara M, Onji M. Impaired function of antigen-presenting dendritic cells in patients with chronic hepatitis B: localization of HBV DNA and HBV RNA in blood DC by in situ hybridization. Int J Mol Med. 2003;11:169-174. [PubMed] |
| 14. | Beckebaum S, Cicinnati VR, Zhang X, Ferencik S, Frilling A, Grosse-Wilde H, Broelsch CE, Gerken G. Hepatitis B virus-induced defect of monocyte-derived dendritic cells leads to impaired T helper type 1 response in vitro: mechanisms for viral immune escape. Immunology. 2003;109:487-495. [PubMed] [DOI] |
| 15. | Valladeau J, Duvert-Frances V, Pin JJ, Kleijmeer MJ, Ait-Yahia S, Ravel O, Vincent C, Vega F Jr, Helms A, Gorman D, Zurawski SM, Zurawski G, Ford J, Saeland S. Immature human dendritic cells express asialoglycoprotein receptor isoforms for efficient receptor-mediated endocytosis. J Immunol. 2001;167:5767-5774. [PubMed] |
| 16. | Chouaib S, Chehimi J, Bani L, Genetet N, Tursz T, Gay F, Trinchieri G, Mami-Chouaib F. Interleukin 12 induces the differentiation of major histocompatibility complex class I-primed cytotoxic T-lymphocyte precursors into allospecific cytotoxic effectors. Proc Natl Acad Sci U S A. 1994;91:12659-12663. [PubMed] [DOI] |