修回日期: 2008-10-11
接受日期: 2008-10-14
在线出版日期: 2008-11-08
目的: 研究瘦素(leptin)在肝缺血/再灌注(H-I/R)后肠道内的表达变化, 并探讨leptin在H-I/R介导的肠道损伤中的作用.
方法: 建立大鼠70% H-I/R模型, 大鼠随机分成5组, 每组9只, 依次为假手术(Sham)组、肝缺血60 min/再灌注60 min (I60'R60')组、I60'R150'组、I60'R240'组和I60'R360'组. 采用酶比色法检测损伤后血清二胺氧化酶活性, 采用HE染色和免疫组织化学法分别检测损伤后十二指肠的病理改变和leptin蛋白表达, 并采用逆转录-PCR法观察损伤后十二指肠leptin mRNA表达的变化.
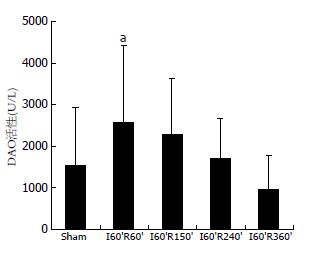
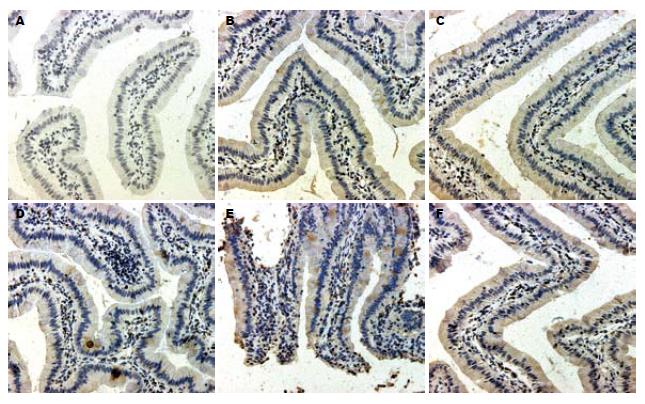
结果: 与损伤后Sham组比较, 四个再灌注组血清二胺氧化酶活性无显著差异, 但I60'R60'组显著高于I60'R360'组(P = 0.0077). 病理学观察提示H-I/R早期的十二指肠损伤较重而后期逐步减轻. 与损伤后Sham组十二指肠leptin蛋白表达相比, I60'R240'、I60'R360'组显著升高(0.126503±0.005873, 0.129458±0.003755 vs 0.079269±0.001995, 均P<0.01), 再灌注组之间按I60'R360'、I60'R240'、I60'R60'、I60'R150'组的顺序依次递减. 与损伤后Sham组十二指肠leptin mRNA表达相比, I60'R150'组显著降低(0.944±0.033 vs 1.022±0.011, P = 0.049).
结论: Leptin在H-I/R后肠道内发生的表达变化与肠道损伤密切相关, 提示leptin可能作为一种保护因子对抗H-I/R介导的肠道损伤.
引文著录: 林季, 颜光涛, 薛辉, 郝秀华, 张凯, 王录焕. Leptin在大鼠肝缺血/再灌注介导的肠道损伤中的作用. 世界华人消化杂志 2008; 16(31): 3485-3491
Revised: October 11, 2008
Accepted: October 14, 2008
Published online: November 8, 2008
AIM: To explore the changes of leptin in intestinal tract following hepatic ischemia/reperfusion (H-I/R), to investigate the association between these changes and H-I/R-induced intestinal injury, and to find out the role of leptin in H-I/R-induced intestinal injury.
METHODS: A 70% H-I/R model of rats was established, forming 5 groups including sham-operation and injury ones based on different reperfusion time. Enzyme-colorimetry was used to detect serum diamine oxidase activity after injury, hematoxylin-eosin staining and immunohistochemistry were applied to investigate pathological variations and leptin protein expressions in duodenum after injury, respectively, while reverse transcriptase-PCR was used to detect leptin mRNA expressions in duodenum after injury.
RESULTS: Compared with sham-operation group after injury, the four reperfusion groups showed no significant difference in serum diamine oxidase activity, but serum diamine oxidase level was significantly higher in 60 min ischemia/60 min reperfusion (I60'R60') group than in I60'R360' group (P = 0.0077). Pathological investigation suggested that duodenal impairments at the early phase of H-I/R were more serious, while the impairments at the later phase lessened gradually. Compared with leptin protein expression in duodenum of sham-operation group after injury, that of I60'R240' and I60'R360' groups increased significantly (0.126503 ± 0.005873, 0.129458 ± 0.003755 vs 0.079269 ± 0.001995, both P < 0.01), and the levels of reperfusion groups decreased in such order as I60'R360', I60'R240', I60'R60' and I60'R150' groups. Compared with leptin mRNA expression in duodenum of sham-operation group after injury, that of I60'R150' group decreased significantly (0.944 ± 0.033 vs 1.022 ± 0.011, P = 0.049), and it was significantly lower than the level of I60'R360' group.
CONCLUSION: The expression changes of leptin in intestinal tract after H-I/R are closely associated with intestinal injury, suggesting that leptin may be a protective factor of resisting H-I/R-induced intestinal injury.
- Citation: Lin J, Yan GT, Xue H, Hao XH, Zhang K, Wang LH. Role of leptin in hepatic ischemia/reperfusion-induced intestinal injury of rats. Shijie Huaren Xiaohua Zazhi 2008; 16(31): 3485-3491
- URL: https://www.wjgnet.com/1009-3079/full/v16/i31/3485.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i31.3485
肝缺血/再灌注(H-I/R)常发生于肝移植、肝切除、腹腔挤压伤复苏时, 引起损伤的主要原因是活性氧生成、Ca2+超载和白细胞活化, 是导致临床相关疾病患者不良预后的重要原因[1-3]. 瘦素(leptin)是一种由ob基因表达, 含167个氨基酸, 分子质量为16 kDa的活性因子, 主要作用是抑制摄食、促进能量消耗[4-5]. 近年的研究证实leptin参与能量代谢、神经-内分泌、血管新生和生殖的调控[6-8], 能够加速糖和脂肪的氧化以代偿细胞损伤, 并能够增强免疫系统功能[9-10]. 由于肝、肠道是营养吸收、能量代谢的重要器官, leptin又是与创伤修复密切相关的代谢因子, 而且尚未见leptin与H-I/R介导的肠道损伤相关联的报道, 我们设想leptin在H-I/R后肠道内的表达发生一定的变化, 这些变化与肠道结构破坏、功能受损存在一定的联系. 我们通过建立大鼠70% H-I/R模型, 采用酶比色法检测损伤后血清二胺氧化酶(DAO)活性, 采用HE染色和免疫组织化学法分别检测损伤后十二指肠的病理改变和leptin蛋白表达, 并采用逆转录-PCR法观察损伤后十二指肠leptin mRNA表达的变化, 探讨leptin在H-I/R介导的肠道损伤中的作用.
免疫用清洁级♂新西兰白兔3只, 体质量1250 g; 实验用清洁级♂SD大鼠45只, 体质量250 g, 均由中国人民解放军总医院实验动物中心提供(许可证编号D98010). 重组鼠leptin购自Pepro Tech®公司; 福氏完全及不完全佐剂购自Gibco BRL®公司; AMV酶、Oligo(dT)15购自Promega®公司; 琼脂糖购自Sigma®公司. DAO检测试剂由中国人民解放军总医院第一附属医院黎君友老师馈赠; 磷酸盐缓冲液、生物素化羊抗兔IgG、辣根过氧化物酶标记的链亲合素、二氨基联苯胺四盐酸(DAB)染色试剂盒购自北京中杉金桥®公司; TRIzol试剂、RNA酶抑制剂、Taq酶、dNTPs购自北京鼎国®公司; leptin、β-actin引物由北京赛百盛®公司合成; 其他试剂均为国产分析纯级.
1.2.1 leptin抗血清的制备: 将leptin抗原120 μg与3 mL福氏完全佐剂充分混匀后, 以背部皮内多点注射法免疫新西兰白兔, 每只白兔注射1 mL. 首次免疫后2 wk进行加强免疫, 采用福氏不完全佐剂. 之后每隔4 wk进行1次加强免疫, 共计4次. 末次免疫后1 wk于清醒状态下分离白兔右侧颈内动脉并插管持续放血, 收集血样按4℃、3000 g 15 min, 冻存血清于-80℃备用.
1.2.2 大鼠70% H-I/R模型的建立: 大鼠随机分成5组, 每组9只, 依次为假手术(Sham)组、肝缺血60 min/再灌注60 min(I60'R60')组、I60'R150'组、I60'R240'组和I60'R360'组. 实验前12 h禁食、不限水, 实验时以1%戊巴比妥钠(60 mg/kg, ip)麻醉大鼠, 无菌条件下开腹, 取右侧肋缘下斜切口, 充分显露第一肝门. 以微血管夹夹闭肝蒂左分叉, 60 min后取出血管夹进行再灌注, 腹腔内注射1 mL生理盐水后关腹[11]. Sham组开腹后仅钝性分离肝蒂左分叉, 但不夹闭阻断肝叶供血.
1.2.3 血清及十二指肠样品的制备: 损伤后于相应时间点、相同麻醉条件下对各组大鼠行心脏抽血, 血样置37℃水浴20 min后, 按4℃、3000 g离心20 min, 保存血清于-20℃. 抽血后迅速取出十二指肠并均分为2份, 一份置液氮速冻后存于-80℃, 另一份采用常规石蜡包埋法经梯度酒精脱水、二甲苯透明后, 制作成石蜡块. 采用Leica® RM2135切片机连续切片, 厚度4 μm, 分别用于HE染色和免疫组织化学检测.
1.2.4 血清DAO活性的检测: 血清DAO活性测量的标准点为75、150、300、600、1200、2400、4800、9600 U/L, 设立空白对照管、标准管和样品管. 各取40 μL蒸馏水、标准品和血清样品加入含0.2 mol/L pH7.2磷酸缓冲液240 μL、40 mg/L辣根过氧化物酶8 μL、5 g/L邻联茴香胺8 μL、1.75 g/L二盐酸尸胺8 μL的混合液, 室温避光混匀2 min, 置37℃避光水浴30 min后, 于436 nm处以空白对照管调零后测量各管的吸光度. 以标准管的DAO活性由低至高为横坐标, 以其对应的调零后吸光度为纵坐标, 作出标准曲线. 将各血清样品的调零后吸光度代入标准曲线, 即可计算出相应样品的DAO活性.
1.2.5 十二指肠损伤的观察: 十二指肠标本的石蜡切片经二甲苯脱蜡、梯度酒精处理至水洗, 以Gill改良苏木素溶液染色、盐酸酒精分化、稀氨水返蓝、伊红溶液染色, 再经梯度酒精处理、二甲苯透明后, 用中性树脂封片. 采用Leica® DC300F型图像采集系统观察并拍摄HE染色结果.
1.2.6 十二指肠leptin蛋白表达的检测: 采用链霉卵白素-过氧化物酶连结三步法检测十二指肠标本的leptin蛋白表达. 石蜡切片经二甲苯脱蜡、梯度酒精处理至水洗, 依次经内源性过氧化物酶清除、抗原修复、正常血清封闭、抗体结合、DAB染色、蒸馏水洗涤, 再经Gill改良苏木素溶液染色、盐酸酒精分化、稀氨水返蓝、梯度酒精处理、二甲苯透明后, 用中性树脂封片. 所用一抗为1:50自制leptin抗血清, 二抗为1:200生物素化羊抗兔IgG, 显色时加入1:200辣根过氧化物酶标记链霉卵白素, 三种试剂均以磷酸盐缓冲液稀释. 采用Leica® DC300F型图像采集系统拍摄免疫组织化学染色结果, 每组切片随机挑选9个视野进行拍摄, 采用Image Pro Plus® 6.0软件定量分析每个视野图像中特异性阳性染色的累积光密度与特异性组织区域面积像素的比值.
1.2.7 逆转录-PCR: 采用TRIzol试剂提取十二指肠总RNA, 操作步骤按说明书进行. 提取总RNA后, 以三蒸水为空白对照, 测量样品260 nm处的紫外吸光值并计算出总RNA浓度, 随后进行逆转录. 以β-actin mRNA表达作为cDNA合成及PCR反应的内源性参照, leptin和β-actin的引物序列及反应条件如表1. 于15 g/L琼脂糖电泳检测PCR产物, 并用Gel-Pro®凝胶成像仪拍摄和分析电泳图像.
| 引物名 | 核酸序列及PCR反应条件 | 产物大小(bp) | GenBank |
| leptin | 上游引物: 5'-ACCTGGAGAACCTGCGAGAC-3' | 336 | NM_013076 |
| 下游引物: 5'-AGGAGTAGGAGAAACGGACA-3' | |||
| 变性: 94℃ 30 s, 退火: 55.6℃ 30 s, 延伸: 72℃ 30 s, 循环: 35 | |||
| β-actin | 上游引物: 5'-AGAGGGAAATCGTGCGTGAC-3' | 445 | NM_031144 |
| 下游引物: 5'-TGGAAGGTGGACAGTGAGGC-3' | |||
| 变性: 94℃ 30 s, 退火: 55.7℃ 30 s, 延伸: 72℃ 30 s, 循环: 35 |
统计学处理 采用统计软件Stata 7.0进行数据处理, 使用单因素方差分析F检验和t检验分别进行多样本组间和两样本间比较. 测量结果以mean±SD表示, 以P<0.05为差异有显著性.
与损伤后Sham组血清DAO活性相比, 4个再灌注组与之均无显著差异. 再灌注组之间两两相比, I60'R60'组显著高于I60'R360'组(P = 0.0077), I60'R150'组趋向于显著高于I60'R360'组(P = 0.0858), 其他组之间无显著差异(图1).
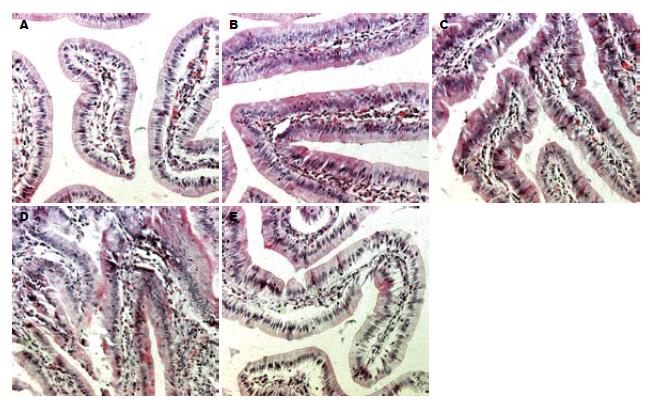
与Sham组相比, I60'R60'组十二指肠黏膜上皮层柱状细胞活动性增加、排列不规则、嗜酸性染、胞质减少, 刷状缘局灶性萎缩、缺失, 杯状细胞数增加, 黏膜固有层充血. I60'R150'组十二指肠黏膜上皮层柱状细胞活动性增加、排列极不规则、广泛水肿、坏死, 刷状缘广泛萎缩、崩解, 杯状细胞数增加、坏死, 黏膜固有层充血减轻. I60'R240'组十二指肠黏膜上皮层柱状细胞活动性增加、排列紊乱、弥漫性水肿、坏死, 刷状缘弥漫性萎缩、崩解, 杯状细胞数增加、广泛坏死, 黏膜固有层充血减轻. I60'R360'组十二指肠黏膜上皮层柱状细胞活动性减低、排列趋于规则、无明显水肿、尚有局灶性坏死, 刷状缘趋于完整、仅局限性缺失, 杯状细胞数减少、无明显坏死, 黏膜固有层无充血(图2).
与损伤后Sham组十二指肠leptin蛋白表达(0.079269±0.001995)相比, I60'R60'组(0.089756±0.014883)、I60'R150'组(0.074811±0.010886) 与之无显著差异, I60'R240'组(0.126503±0.005873)、I60'R360'组(0.129458±0.003755)显著升高(均P<0.01). 再灌注组之间两两相比均有显著差异(均P<0.01), 按I60'R360'、I60'R240'、I60'R60'、I60'R150'组的顺序依次递减(图3).
与损伤后Sham组十二指肠leptin mRNA表达(1.022±0.011)相比, I60'R150'组显著降低(0.944±0.033, P = 0.049), I60'R60'(0.990±0.001)、I60'R240'(0.968±0.041)、I60'R360'组(1.041±0.017)与之均无显著差异. 再灌注组之间两两相比, I60'R360'组显著高于I60'R150'组(P = 0.014), 并趋向于显著高于I60'R240'组(P = 0.065), 其他组之间均无显著差异(图4).
H-I/R造成的损伤机制主要是自由基释放、中性粒细胞聚集、内皮素/NO失衡、核因子-κB活化、前炎症细胞因子和黏附分子释放、肝细胞凋亡等[12-17], 目前研究发现leptin与内皮素、NO、核因子-κB、多种炎症细胞因子、氧源性自由基、中性粒细胞聚集及细胞凋亡都存在联系[18-23], 而且我们前期的工作也初步证实leptin在急性炎症反应中发挥一定的保护效应[4,6,24-26], 我们考虑leptin与H-I/R介导的内环境紊乱(尤其是肠道损伤)可能存在某些联系. 但目前国内外尚无这方面的报道, 若能揭示leptin在H-I/R介导的肠道损伤中的作用, 对于相关外科手术、创伤等疾病的诊治将具有积极的意义. 我们采用的70% H-I/R模型而非100% H-I/R模型, 避免了因全肝血流阻断后肠道淤血引起的细菌移位和内毒素释放对观察指标的潜在影响[27]. 同时, 自制的leptin抗血清具有良好的效价和特异性, 已应用于前期的相关研究[28-29].
DAO是一种含有脱氨的丁二胺和组胺的细胞质酶, 发挥控制肠黏膜增殖的作用, 外周血DAO活性的变化能反映创伤后肠黏膜屏障功能受损和修复情况, 是判断肠黏膜屏障功能的敏感指标[30-31]. 我们的结果发现, 损伤后再灌注组血清DAO活性与Sham组均无显著差异, 这符合70% H-I/R模型仅夹闭部分门脉血流而不会造成显著肠道淤血、坏死的实验条件; 同时, H-I/R早期I60'R60'组血清DAO活性显著高于损伤后期的I60'R360'组, 以及I60'R150'组趋向高于I60'R360'组, 则说明H-I/R早期的十二指肠黏膜受损情况比损伤后期要严重得多. 十二指肠HE染色的结果提示, H-I/R早期的肠道损伤较重而后期逐步减轻, 也说明H-I/R后期机体对肠道损伤存在有效的抗损伤、促修复机制.
既然leptin是联系能量代谢、免疫调控和神经-内分泌三大功能系统的枢纽, 我们考虑leptin在H-I/R后受损肠道内的表达水平会发生某些变化, 这些变化可能与改善肠道的内环境紊乱有关. 从蛋白水平的结果来看, 损伤后十二指肠leptin蛋白表达在H-I/R早期无显著变化, 至损伤后期显著升高, 提示H-I/R后期受损的肠道黏膜屏障逐步恢复时伴随着leptin蛋白表达的升高. 从基因水平的结果来看, 十二指肠leptin mRNA表达于H-I/R早期即有下降的趋势, 于I60'R150'组显著降低, 损伤后期又逐步恢复, 虽然与Sham组无显著差异, 但是I60'R360'组显著高于I60'R150'组而且趋向高于I60'R240'组, 提示H-I/R早期高代谢造成的能量储备不足和肠道严重受损抑制了十二指肠leptin mRNA表达, 损伤后期能量储备的逐步升高和肠道损伤逐步修复则反馈诱导十二指肠leptin mRNA表达回升至Sham组水平, 同时他也促进了十二指肠leptin蛋白的表达.
总之, 结合血清DAO活性、十二指肠HE染色结果、leptin蛋白表达和基因表达的结果, 我们发现leptin表达水平的增高与肠道损伤的修复存在密切联系, leptin对H-I/R后肠道结构受损和屏障功能改善很可能发挥了抗损伤因子的重要角色. 充分利用以leptin为核心的代谢、免疫及神经-内分泌网络进行内源性和外源性的干预, 将有助于开拓早期诊治H-I/R介导的肠道损伤和消化系统脏器创伤的新方法.
感谢廖杰、于力方、李宁老师与钟苑、周国垠、吕效兴同志对本研究的部分操作给予的支持.
研究表明, 瘦素 (leptin)参与能量代谢、神经-内分泌、血管新生、生殖、免疫应答等的调节, 这提示瘦素是与创伤修复密切相关的代谢因子. 探讨瘦素在肝缺血/再灌注后肠道内的表达变化及其与肠道损伤的联系, 为利用以瘦素为核心的调控网络进行损伤后干预提供了理论依据.
张国梁, 主任医师, 天津市第一中心医院消化内科; 张占卿, 主任医师, 上海市(复旦大学)公共卫生中心
肝、肠道是营养吸收、能量代谢的重要器官, 国内外尚未见leptin与肝缺血/再灌注介导的肠道损伤相关联的报道. 同时, 由于leptin可能参与创伤后内环境紊乱的恢复过程, 研究leptin在肝缺血/再灌注介导的肠道损伤中的变化, 成为证明leptin是否对肠道损伤发挥保护效应的一个主要环节.
目前认为肝缺血/再灌注的损伤机制包括自由基释放、中性粒细胞聚集、内皮素/NO失衡、核因子-κB活化、前炎症细胞因子和黏附分子释放、肝细胞凋亡等, 而leptin与这些因素都有关联, 提示他参与调节肝缺血/再灌注介导的脏器损伤. 前期研究也证实leptin在损伤后发挥迟缓而持续的保护效应.
本研究发现leptin在肝缺血/再灌注后的肠道内发生显著的表达变化, 这些表达变化与肠道损伤紧密相关, leptin表达水平的增高与肠道损伤的修复存在密切联系, 提示leptin对肝缺血/再灌注后的肠道结构受损和屏障功能改善很可能扮演了抗损伤因子的重要角色.
探讨leptin在肝缺血/再灌注介导的肠道损伤中的作用, 为充分利用以leptin为核心的代谢、免疫及神经-内分泌网络进行内源性和外源性的干预, 开拓早期诊治肝缺血/再灌注介导的肠道损伤和消化系统脏器创伤的新方法有积极的意义.
本研究选题新颖, 设计合理, 统计处理正确, 语言表达规范, 科学性、创新性和可读性均能较好地反映我国胃肠病基础研究的先进水平.
编辑: 李军亮 电编:何基才
| 1. | Caldwell CC, Tschoep J, Lentsch AB. Lymphocyte function during hepatic ischemia/reperfusion injury. J Leukoc Biol. 2007;82:457-464. [PubMed] [DOI] |
| 2. | Wang ZZ, Zhao WJ, Zhang XS, Tian XF, Wang YZ, Zhang F, Yuan JC, Han GZ, Liu KX, Yao JH. Protection of Veratrum nigrum L. var. ussuriense Nakai alkaloids against ischemia-reperfusion injury of the rat liver. World J Gastroenterol. 2007;13:564-571. [PubMed] |
| 3. | Jiang N, Zhang ZM, Liu L, Zhang C, Zhang YL, Zhang ZC. Effects of Ca2+ channel blockers on store-operated Ca2+ channel currents of Kupffer cells after hepatic ischemia/reperfusion injury in rats. World J Gastroenterol. 2006;12:4694-4698. [PubMed] |
| 4. | Lin J, Yan GT, Xue H, Hao XH, Zhang K, Wang LH. Leptin protects vital organ functions after sepsis through recovering tissue myeloperoxidase activity: an anti-inflammatory role resonating with indomethacin. Peptides. 2007;28:1553-1560. [PubMed] [DOI] |
| 5. | Dong F, Ren J. Fitness or fatness--the debate continues for the role of leptin in obesity-associated heart dysfunction. Curr Diabetes Rev. 2007;3:159-164. [PubMed] [DOI] |
| 6. | Lin J, Yan GT, Hao XH, Wang LH, Zhang K, Xue H. Effect of intestinal ischemia-reperfusion injury on protein levels of leptin and orexin-A in peripheral blood and central secretory tissues. World J Gastroenterol. 2005;11:1000-1004. [PubMed] |
| 7. | Frühbeck G. Intracellular signalling pathways activated by leptin. Biochem J. 2006;393:7-20. [PubMed] [DOI] |
| 8. | Buyukberber M, Koruk M, Savas MC, Gulsen MT, Pehlivan Y, Deveci R, Sevinc A, Gergerlioglu S. Leptin levels in the differential diagnosis between benign and malignant ascites. World J Gastroenterol. 2007;13:398-402. [PubMed] |
| 9. | Niu L, Wang X, Li J, Huang Y, Yang Z, Chen F, Ni H, Jin Y, Lu X, Cao Q. Leptin stimulates alpha1(I) collagen expression in human hepatic stellate cells via the phosphatidylinositol 3-kinase/Akt signalling pathway. Liver Int. 2007;27:1265-1272. [PubMed] |
| 10. | Thomas T. Leptin and fragility fracture: evidence for a protective effect in humans. Am J Med. 2004;117:966-968. [PubMed] [DOI] |
| 11. | Bátkai S, Osei-Hyiaman D, Pan H, El-Assal O, Rajesh M, Mukhopadhyay P, Hong F, Harvey-White J, Jafri A, Haskó G. Cannabinoid-2 receptor mediates protection against hepatic ischemia/reperfusion injury. FASEB J. 2007;21:1788-1800. [PubMed] [DOI] |
| 12. | Lee WY, Lee JS, Lee SM. Protective effects of combined ischemic preconditioning and ascorbic acid on mitochondrial injury in hepatic ischemia/reperfusion. J Surg Res. 2007;142:45-52. [PubMed] [DOI] |
| 13. | Katsumi H, Nishikawa M, Yamashita F, Hashida M. Prevention of hepatic ischemia/reperfusion injury by prolonged delivery of nitric oxide to the circulating blood in mice. Transplantation. 2008;85:264-269. [PubMed] |
| 14. | Matsui N, Kasajima K, Hada M, Nagata T, Senga N, Yasui Y, Fukuishi N, Akagi M. Inhibiton of NF-kappaB activation during ischemia reduces hepatic ischemia/reperfusion injury in rats. J Toxicol Sci. 2005;30:103-110. [PubMed] [DOI] |
| 15. | Akahori T, Sho M, Hamada K, Suzaki Y, Kuzumoto Y, Nomi T, Nakamura S, Enomoto K, Kanehiro H, Nakajima Y. Importance of peroxisome proliferator-activated receptor-gamma in hepatic ischemia/reperfusion injury in mice. J Hepatol. 2007;47:784-792. [PubMed] [DOI] |
| 16. | Kubes P. The role of adhesion molecules and nitric oxide in intestinal and hepatic ischemia/reperfusion. Hepatogastroenterology. 1999;46 Suppl 2:1458-1463. [PubMed] |
| 17. | Hatano E. Tumor necrosis factor signaling in hepatocyte apoptosis. J Gastroenterol Hepatol. 2007;22 Suppl 1:S43-S44. [PubMed] [DOI] |
| 18. | Chao HH, Hong HJ, Liu JC, Lin JW, Chen YL, Chiu WT, Wu CH, Shyu KG, Cheng TH. Leptin stimulates endothelin-1 expression via extracellular signal-regulated kinase by epidermal growth factor receptor transactivation in rat aortic smooth muscle cells. Eur J Pharmacol. 2007;573:49-54. [PubMed] [DOI] |
| 19. | Mattace Raso G, Esposito E, Iacono A, Pacilio M, Coppola A, Bianco G, Diano S, Di Carlo R, Meli R. Leptin induces nitric oxide synthase type II in C6 glioma cells. Role for nuclear factor-kappaB in hormone effect. Neurosci Lett. 2006;396:121-126. [PubMed] [DOI] |
| 20. | Tang CH, Lu DY, Yang RS, Tsai HY, Kao MC, Fu WM, Chen YF. Leptin-induced IL-6 production is mediated by leptin receptor, insulin receptor substrate-1, phosphatidylinositol 3-kinase, Akt, NF-kappaB, and p300 pathway in microglia. J Immunol. 2007;179:1292-1302. [PubMed] |
| 21. | Rolland YM, Perry HM 3rd, Patrick P, Banks WA, Morley JE. Leptin and adiponectin levels in middle-aged postmenopausal women: associations with lifestyle habits, hormones, and inflammatory markers--a cross-sectional study. Metabolism. 2006;55:1630-1636. [PubMed] [DOI] |
| 22. | Marciniak A, Borkowska E, Kedra A, Rychlik M, Beltowski J. Time-dependent transition from H(2)O(2)-extracellular signal-regulated kinase- to O(2)-nitric oxide-dependent mechanisms in the stimulatory effect of leptin on renal Na+/K+/- ATPase in the rat. Clin Exp Pharmacol Physiol. 2006;33:1216-1224. [PubMed] [DOI] |
| 23. | Montecucco F, Bianchi G, Gnerre P, Bertolotto M, Dallegri F, Ottonello L. Induction of neutrophil chemotaxis by leptin: crucial role for p38 and Src kinases. Ann N Y Acad Sci. 2006;1069:463-471. [PubMed] [DOI] |
| 24. | Lin J, Yan GT, Wang LH, Hao XH, Zhang K, Xue H. Leptin fluctuates in intestinal ischemia-reperfusion injury as inflammatory cytokine. Peptides. 2004;25:2187-2193. [PubMed] [DOI] |
| 25. | Lin J, Yan GT, Wang LH, Xue H, Hao XH, Zhang K. [Effect of long tubular bone fracture on serum levels of leptin, acute phase proteins and biochemical markers for organ functions]. Zhongguo Weizhongbing Jijiu Yixue. 2006;18:19-23. [PubMed] |
| 26. | Lin J, Yan GT, Gao XN, Liao J, Wang LH, Hao XH. [Distribution of leptin expression and its effect on the recovery of sepsis-induced internal disorders]. Sichuan Daxue Xuebao Yixueban. 2008;39:360-363, 417. [PubMed] |
| 27. | Hiranuma S, Ito K, Noda Y, Ozasa H, Koike Y, Horikawa S. Amelioration of hepatic ischemia/reperfusion injury in the remnant liver after partial hepatectomy in rats. J Gastroenterol Hepatol. 2007;22:2167-2172. [PubMed] [DOI] |
| 28. | Yan GT, Hao XH, Xue H, Lu YP. Establishment of a highly sensitive leptin radioimmunoassay and detection of increased leptin levels in hyperlipidemia and pregnancy. J Immunoassay Immunochem. 2002;23:317-326. [PubMed] [DOI] |
| 29. | Shi Y, Yan GT, Lin J. Intestinal ischemia-reperfusion injury made leptin decreased. Regul Pept. 2006;133:27-31. [PubMed] [DOI] |
| 30. | Rajtar S, Irman-Florjanc T. Amitriptyline affects histamine-N-methyltransferase and diamine oxidase activity in rats and guinea pigs. Eur J Pharmacol. 2007;574:201-208. [PubMed] [DOI] |
| 31. | García-Martin E, Mendoza JL, Martínez C, Taxonera C, Urcelay E, Ladero JM, de la Concha EG, Díaz-Rubio M, Agúndez JA. Severity of ulcerative colitis is associated with a polymorphism at diamine oxidase gene but not at histamine N-methyltransferase gene. World J Gastroenterol. 2006;12:615-620. [PubMed] |