修回日期: 2008-10-05
接受日期: 2008-10-07
在线出版日期: 2008-10-28
目的: 研究SNCG在胃癌中的表达及意义, 探讨SNCG与MMP-2, MMP-9在胃癌中表达的相关性.
方法: 采用免疫组化法检测60例胃癌及20例胃正常黏膜石蜡标本中SNCG蛋白和MMP-2、MMP-9的表达.
结果: 在胃癌组织中SNCG, MMP-2及MMP-9的表达阳性率均高于周围正常组织(65%, 75%, 68.3% vs 0%, 25%, 20%, 均P<0.05), 他们的表达均与肿瘤浸润深度、淋巴结转移及肿瘤临床分期相关(P<0.05). SNCG的表达与MMP-2和MMP-9的表达呈正相关(r = 0.383, 0.552, 均P<0.01), MMP-2的表达和MMP-9的表达呈正相关(r = 0.352, P<0.01).
结论: SNCG和MMP-2、MMP-9异常表达可能共同参与胃癌的发生、发展过程, SNCG和MMP-2、MMP-9可作为胃癌病理学特点的参考指标.
引文著录: 陈进, 郭子健, 王卫理, 金琳芳. SNCG在胃癌中的表达及其与MMP-2, MMP-9的相关性. 世界华人消化杂志 2008; 16(30): 3400-3405
Revised: October 5, 2008
Accepted: October 7, 2008
Published online: October 28, 2008
AIM: To study the expression and significance of synuclein g (SNCG) in gastric cancer, and to explore the relationship between SNCG and MMP-2, and MMP-9 in gastric carcinoma.
METHODS: Expression levels of SNCG protein, MMP-2, MMP-9 in sixty gastric cancer samples were detected using immuno-histochemical analysis and 20 paraffin wax samples of normal gastric mucosa were also detected and compared.
RESULTS: The positive rates of SNCG, MMP-2 and MMP-9 were higher in gastric carcinoma than in neighboring normal tissues (65%, 75%, 68.3% vs 0%, 25%, 20%, all P < 0.05). Their expression was positively correlated with depth of tumor infiltration, lymphatic metastasis, as well as the clinical staging of tumor (all P < 0.05). Expression of SNCG was also positively correlated with that of MMP-2 and MMP-9 (r = 0.383, 0.552, both P < 0.01). In addition, expression of MMP-2 was positively correlated with MMP-9 (r = 0.352, P < 0.01).
CONCLUSION: The aberrant expression of SNCG, MMP-2 and MMP-9 are likely to jointly participate in the process of genesis and development of gastric carcinoma, therefore the detection of SNCG, MMP-2 and MMP-9, which reflect the pathological characteristics of gastric cancer, could be regarded as a reference index.
- Citation: Chen J, Guo ZJ, Wang WL, Jin LF. Expression of synuclein g in gastric carcinoma and its relationship with MMP-2 and MMP-9. Shijie Huaren Xiaohua Zazhi 2008; 16(30): 3400-3405
- URL: https://www.wjgnet.com/1009-3079/full/v16/i30/3400.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i30.3400
随着对肿瘤研究的不断深入, 人们逐步认识到DNA甲基化与肿瘤的发生密切相关. DNA高甲基化可导致基因转录沉寂, 使重要基因如抑癌基因、DNA修复基因等丧失功能, 以致正常细胞的生长分化调控失常以及DNA损伤不能被及时修复而引起肿瘤的发生. 然而DNA低甲基化这种表观遗传学改变在肿瘤发病中的作用则研究较少. Synuclein γ(SNCG), 又称为乳腺特异基因BCSG1[1], 已在乳腺癌中被证实具有促进乳腺癌浸润和转移的作用[2]. 研究显示SNCG基因的表达主要与第一个外显子的低甲基化状态密切相关[3], SNCG去甲基化是导致乳腺癌恶化的关键性因素. 目前有关SNCG在胃癌中的研究国内外报道很少. 我们对SNCG在胃癌组织的表达进行了研究, 探讨了其表达与临床病理的关系, 并分析了胃癌组织SNCG, MMP-2, MMP-9表达的相关性及其意义, 初步探讨了SNCG可能的作用机制, 为以后更深入的研究打下基础.
收集2007-01/2008-01我院病理科石蜡包埋组织标本80例, 其中胃癌60例, 癌旁正常胃黏膜20例. 20例正常对照均取自距胃癌切缘5 cm以外正常胃黏膜组织. 60例胃癌患者中, 男48例, 女12例; 年龄36-75(平均58.6)岁. 病理类型: 高分化及中分化腺癌36例, 低分化腺癌、印戒及黏液细胞癌24例. 无淋巴转移者17例, 有淋巴转移者43例. TNM分期: Ⅰ期及Ⅱ期共19例, Ⅲ期及Ⅳ期共41例. 所有患者在术前均未接受放疗和化疗处理. 所有的胃癌病例临床病理资料完整, 每例标本都选择包括肿瘤中心和肿瘤边缘的石蜡块1-2个, 制成连续切片, 片厚3-4 μm. SNCG鼠抗人mAb、MMP-2兔抗人多克隆抗体、MMP-9兔抗人多克隆抗体均为即用型, 购自北京中杉金桥生物技术有限公司.
每个病例的切片均分为3部分, 分别检测SNCG蛋白和MMP-2、MMP-9的表达. 免疫组化采用EnVision二步法. 细胞质出现SNCG染色棕黄色细颗粒为SNCG阳性细胞, 少数病例可见胞核着色. 表达结果采用半定量法分析计数, 按阳性细胞占肿瘤细胞的百分率记分. 通过400倍高倍镜下观察至少5个视野, 取其平均值来确定. SNCG的染色结果分为: 阴性(-), 染色细胞数<5%; 弱阳性(+), 染色细胞数5%-25%; 阳性(++), 染色细胞数26%-50%, 强阳性(+++), 染色细胞数>50%. MMP-2、MMP-9阳性染色位于细胞质和/或细胞膜呈棕黄色, 显色强时为棕褐色. 光镜下用高倍镜视野对每例组织切片癌组织区域连续计数500个癌细胞, 计算阳性细胞所占的比例. 其中无细胞染色为阴性(-), 阳性细胞所占比例<10%为阳性(+), 阳性细胞数占10%-50%为阳性(++), 阳性细胞数>50%为强阳性(+++). 为便于统计描述, 对样本进行分类, 0到1+为弱染, 定为阴性, 2+到3+为强染, 定为阳性表达.
统计学处理 数据库建立和数据分析采用SPSS11.0软件, 采用χ2检验及Spearman相关分析.
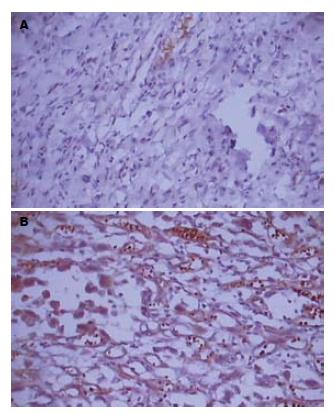
SNCG在正常胃黏膜中呈阴性表达, 少部分为弱阳性, 染色较浅(图1). SNCG在胃癌组织中的表达呈细胞质分布, 阳性信号为棕黄色颗粒(图1). 在正常胃黏膜中SNCG无阳性表达, 在胃癌组织中SNCG阳性表达39例, 表达阳性率为65%(39/60), 显著高于正常胃黏膜的表达(P<0.05, 表1).
| 胃癌 | 正常胃黏膜 | P | |||||||
| - | + | ++ | +++ | - | + | ++ | +++ | ||
| SNCG | 13 | 8 | 13 | 26 | 16 | 4 | 0 | 0 | 0.0000 |
| MMP-2 | 9 | 6 | 21 | 24 | 8 | 7 | 3 | 2 | 0.0001 |
| MMP-9 | 13 | 6 | 29 | 12 | 11 | 5 | 3 | 1 | 0.0002 |
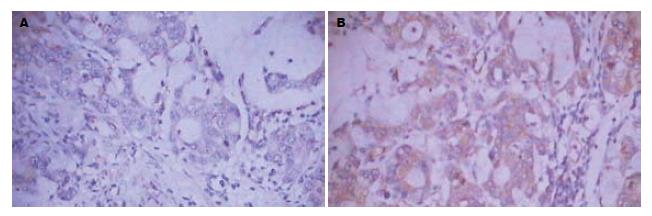
MMP-2在正常胃黏膜中大多为阴性表达, 少部分为阳性(图2). MMP-2在胃癌组织中的表达呈细胞质分布, 阳性信号为棕黄色颗粒(图2). 在正常胃黏膜中MMP-2阳性表达5例, 表达阳性率为25%(5/20), 在胃癌组织中MMP-2阳性表达45例, 表达阳性率为75%(45/60), 显著高于正常胃黏膜的表达(P<0.05, 表1).
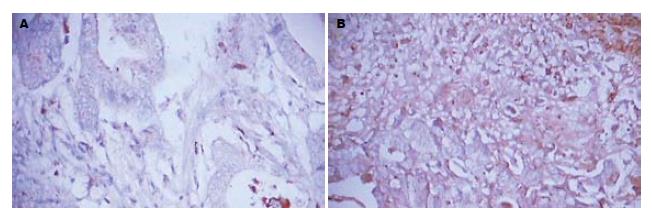
MMP-9在正常胃黏膜中大多为阴性表达, 少部分为阳性(图3). MMP-9在胃癌组织中的表达呈细胞质分布, 阳性信号为棕黄色颗粒(图3). 在正常胃黏膜中MMP-9阳性表达4例, 表达阳性率为20%(4/20), 在胃癌组织中MMP-9阳性表达41例, 表达阳性率为68.3%(41/60), 显著高于正常胃黏膜的表达(P<0.05, 表1).
胃癌组织中SNCG, MMP-2, MMP-9的表达与胃癌浸润深度、淋巴结转移及TNM分期均显著相关(均P<0.05). 但与患者的年龄、性别及胃癌分化程度无显著相关(均P>0.05), 在T1+T2、T3+T4阳性表达率分别为16.7%(1/6)和70.4%(38/54), 16.7%(1/6)和81.5%(44/54), 16.7%(1/6)和74.1%(40/54), 浸润越深, 表达越强, 在Ⅰ+Ⅱ期、Ⅲ+Ⅳ期阳性表达率分别为15.8%(3/19)和87.8%(36/41), 52.6%(10/19)和85.4%(35/41), 47.4%(9/19)和78.0%(32/41), 分期越晚, 表达越强. SNCG在无淋巴结转移及有淋巴结转移的阳性表达率分别为17.6%(3/17)和83.7%(36/43), 52.9%(9/17)和83.7%(36/43), 35.3%(6/17)和81.4%(35/43), 淋巴结转移越多, 表达越强(表2).
| 临床病理特征 | n | SNCG | P | MMP-2 | P | MMP-9 | P | |||
| 阴性 | 阳性 | 阴性 | 阳性 | 阴性 | 阳性 | |||||
| 年龄 | ||||||||||
| <50岁 | 6 | 2 | 4 | 0.7182 | 3 | 3 | 0.3203 | 1 | 5 | 0.7114 |
| ≥50岁 | 54 | 19 | 35 | 12 | 42 | 18 | 36 | |||
| 性别 | ||||||||||
| 男 | 48 | 15 | 33 | 0.3790 | 11 | 37 | 0.7094 | 14 | 34 | 0.6272 |
| 女 | 12 | 6 | 6 | 4 | 8 | 5 | 7 | |||
| 浸润深度 | ||||||||||
| T1和T2 | 6 | 5 | 1 | 0.0304 | 5 | 1 | 0.0029 | 5 | 1 | 0.0162 |
| T3和T4 | 54 | 16 | 38 | 10 | 44 | 14 | 40 | |||
| 淋巴结转移 | ||||||||||
| 有 | 43 | 7 | 36 | 0.0000 | 7 | 36 | 0.0315 | 8 | 35 | 0.0005 |
| 无 | 17 | 14 | 3 | 8 | 9 | 11 | 6 | |||
| TNM分期 | ||||||||||
| Ⅰ, Ⅱ | 19 | 16 | 3 | 0.0000 | 9 | 10 | 0.0162 | 10 | 9 | 0.0175 |
| Ⅲ, Ⅳ | 41 | 5 | 36 | 6 | 35 | 9 | 32 | |||
| 分化程度 | ||||||||||
| 高分化, 中分化 | 36 | 11 | 25 | 0.3767 | 7 | 29 | 0.2235 | 10 | 26 | 0.4277 |
| 低分化, | 24 | 10 | 14 | 8 | 16 | 9 | 15 | |||
| 印戒, 黏液 | ||||||||||
胃癌组织中34例SNCG与MMP-2同时阳性表达, 10例SNCG与MMP-2同时阴性表达, SNCG与MMP-2表达呈正相关(P<0.05). 34例SNCG与MMP-9同时阳性表达, 14例SNCG与MMP-9同时阴性表达, SNCG与MMP-2表达呈正相关(P<0.05). 35例MMP-2与MMP-9同时阳性表达, 9例MMP-2与MMP-9同时阴性表达, SNCG与MMP-2表达呈正相关(P<0.05, 表3).
| SNCG | r | P | MMP-9 | r | P | |||
| - | + | - | + | |||||
| MMP-2 | ||||||||
| - | 10 | 5 | 0.383 | 0.0025 | 9 | 6 | 0.352 | 0.0059 |
| + | 11 | 34 | 10 | 35 | ||||
| MMP-9 | ||||||||
| - | 14 | 5 | 0.552 | 0.0000 | ||||
| + | 7 | 34 | ||||||
目前, 对于胃癌发展和演进过程中的癌症相关基因的研究已获得了一定的进展, 但其确切的病因学、发病机制以及浸润和转移的机制仍未完全明了. 肿瘤从开始形成到浸润和转移, 经历了3个重要阶段: 细胞粘连、局部蛋白酶解及细胞动力增加和迁移. 有许多证据表明在癌细胞侵袭转移过程中, 涉及许多特殊基因及其表达产物, 其中包括促进肿瘤细胞转移发生的转移基因和抑制转移发生的转移抑制基因. SNCG, 又称为乳腺特异基因BCSG1或persyn, 属于Synuclein家庭成员. 近年来的研究发现, SNCG的表达与乳腺癌细胞的生长、浸润、转移和预后有关, 该基因在乳腺癌中过度表达, 导致肿瘤易转移和预后较差. 国内有学者研究证实SNCG在多种肿瘤组织中呈广谱表达[4]. MMPs是一类高度保守的依赖于锌离子的内切蛋白水解酶家族, 可降解基底膜和细胞外基质的大多数蛋白质, 与多种肿瘤的侵袭和转移有关[5-7]. 但SNCG及MMPs与胃癌的发生、发展及侵袭、转移的关系研究不多. 本研究我们采用免疫组化法对60例胃癌组织中SNCG及MMP-2、MMP-9表达情况进行检测, 以探讨他们在胃癌发生、发展及侵袭、转移中的作用.
Synucleins是一类在种属中具有高度保守性的小分子神经蛋白家族, 目前有三个成员α、β和γ Synuclein[8-10]. 目前研究表明SNCG在多种肿瘤组织如肝癌、食管癌、胃癌、肺癌及乳腺癌中呈广谱表达, 存在较高的异常表达率, 但在癌旁非肿瘤组织中少见表达. 我们的研究也显示胃癌组织中SNCG的阳性表达率明显高于正常胃黏膜, 此结果提示SNCG表达的上调与胃癌的恶性演进有关. 有作者报道在多种肿瘤细胞中发现SNCG的第1个外显子出现低甲基化, 且SNCG第1个外显子的低甲基化和SNCG mRNA的表达密切相关, 这提示SNCG基因表达的上调与低甲基化有关[3-4,11]. 也有作者认为SNCG表达的上调与转录因子AP-1和SP-1的激活作用有关[12]. 有关SNCG在人类肿瘤中表达与肿瘤侵袭转移的关系, 国内外许多作者做了大量的研究. Jiaet al[2]通过体外培养乳腺癌细胞及裸鼠成瘤实验证实SNCG促进乳腺癌细胞的生长和分化, 增加乳腺癌细胞的活动性, 促进乳腺癌的浸润和转移. Zhao et al[13]用免疫组化在肝癌组织检测SNCG的表达, 阳性率为65.7%(46/70), Ⅲ/Ⅳ期(44/50, 88%)明显高于Ⅰ/Ⅱ期(2/20, 10%)(P<0.0001), 有远处转移的(15/15, 100%)明显高于无转移的(31/55, 56.4%)(P<0.002). 此外, 在部分肿瘤患者的血清和尿液中检测到了SNCG的存在. Liu et al[4]研究发现SNCG蛋白在Ⅱ-Ⅳ期的肝癌、食管癌、前列腺癌、子宫颈癌、乳腺癌及肺癌中表达率为100%, 在Ⅱ-Ⅳ期的胃癌及结肠癌中表达率分别为81.2%及78.5%, 而在0-Ⅰ期的上述癌中表达率≤20%. 他们同时研究证实SNCG蛋白表达与前列腺癌、乳腺癌及肺癌的淋巴结转移有关, 因缺乏足够的病例, 研究未证实SNCG蛋白表达与肝癌、食管癌、胃癌、子宫颈癌、结肠癌的淋巴结转移有统计学关系, 但发现SNCG蛋白表达与多种恶性肿瘤的远处转移有关. 我们观察了SNCG的表达与胃癌临床病理特征的关系, 发现SNCG的表达与胃癌的浸润深度、淋巴结转移及TNM分期有关, 即浸润越深、有淋巴结转移及TNM分期晚者SNCG表达越高, 这提示SNCG在胃癌演进中起着重要的促进作用, 这与SNCG在其他肿瘤演进中的表现是吻合的. 大量研究证明SNCG在肿瘤浸润转移的各个环节起着重要的作用: SNCG能和MAPs(微管相关蛋白)作用调节细胞骨架的结构和装配动态, 增强细胞的运动性; SNCG能明显抑制肿瘤生长抑制因子OM, 从而促进肿瘤细胞的增殖[2]. 有研究发现当视网膜母细胞瘤细胞系中SNCG过表达时, 明显促进MMP-2和MMP-9的表达, 引起更多转移表型的形成[14].
MMP-2和MMP-9是基质金属蛋白酶(MMP)家族的重要成员. 有关MMP-2和MMP-9在人类肿瘤中表达与肿瘤侵袭转移的关系, 国内外许多作者做了大量的研究. 陈洪雷 et al[15]研究发现, 随着肺癌原发肿瘤的增长、淋巴结浸润和远处转移的出现, MMP-2、MMP-9的表达率逐步增高, 差异有显著性. 同时肺癌的临床分期与上述指标的表达呈正相关, 说明他们的表达与肺癌的进展程度相关. MMP-2和MMP-9能降解细胞外基质和基底膜, 促进肿瘤间质血管的新生, 与肿瘤的浸润及转移有关. Davies et al[16]发现MMP-2和MMP-9的水平随膀胱的分级增高而升高, 侵袭性肿瘤明显高于表浅性肿瘤. 有学者研究发现食管癌组织中MMP-2和MMP-9表达率明显高于正常组织, 而且MMP-2和MMP-9在淋巴结转移组阳性表达率明显高于无淋巴结转移组[17-18]. 吕增发 et al[19]在研究中发现肝癌中MMP-2、MMP-9的表达比周围组织高, 而且其活性增高与肝癌细胞对门静脉和包膜浸润以及发生肝内转移、肿瘤复发密切相关. 有作者发现胃癌中MMP-2、MMP-9表达增强. Mönig et al[20]观察114例胃癌患者, 其中93例癌组织MMP-2表达阳性, 并且MMP-2表达与胃癌进展及其淋巴结转移正相关. 而且随着浸润程度由黏膜层到浆膜外的加深, MMP-2的阳性表达逐渐增加. 潘留兰 et al[21]应用免疫组化SP法检测87 例胃癌组织、癌旁组织及正常胃组织中MMP-2的表达情况, 发现MMP-2在正常胃组织表达率为阴性, 在癌旁组织中有低表达, 为18.4%, 在胃癌组织中表达率明显增高, 为85.1%, 且表达率的高低与淋巴结转移、分化程度、浸润程度呈密切相关性(P<0.05). 王璐 et al[22]研究发现随着癌组织浸润深度的增加, 胃癌细胞内MMP-9的含量逐渐增高, 淋巴转移阳性组MMP-9表达率高于阴性组. 本研究发现正常胃黏膜中MMP-2和MMP-9的阳性表达率明显低于胃癌组织, 且胃癌中浸润越深、有淋巴结转移及TNM分期晚者MMP-2和MMP-9的阳性表达越高, 这与其他作者的发现是一致的, 提示基质金属蛋白酶MMP-2, MMP-9也参与了胃癌的侵袭转移过程.
Jia et al[2]发现当乳腺癌细胞中SNCG过表达时, 明显促进MMP-2和MMP-9的表达, 引起更多转移表型的形成. Surguchevaet al[14]在视网膜母细胞瘤的研究中发现转染SNCG的细胞的基质金属蛋白酶MMP-2、MMP-9表达增强, 从而通过降解及重塑细胞外基质, 以利于肿瘤细胞的迁移穿过细胞基质、基底膜、血管及淋巴管而向远处侵袭. SNCG可能通过激活MAPK信号通路磷酸化激活AP-1, 而导致MMP-2、MMP-9基因转录活性的增强. 本研究发现SNCG的表达与MMP-2和MMP-9的表达呈正相关, 这提示SNCG对MMP-2和MMP-9可能有上调作用. MMP是一类与肿瘤侵袭转移密切相关的蛋白水解酶, 我们推测其机制可能是SNCG通过上调MMP-2和MMP-9的表达从而促进胃癌的浸润和转移. 本研究同时发现MMP-2的表达和MMP-9的表达呈正相关, 这提示MMP-2和MMP-9在胃癌浸润和转移过程中可能有协同作用, 共同参与了胃癌的恶性演进.
总之, 本研究得出如下结论: SNCG、MMP-2和MMP-9在胃癌中显著高表达, 他们在胃癌的浸润转移中起重要作用, SNCG和MMP-2、MMP-9异常表达可能协同参与胃癌的发生、发展过程, 检测SNCG和MMP-2、MMP-9可作为反映胃癌病理学特点的参考指标.
SNCG又称为乳腺特异基因BCSG1, 已被证实在乳腺癌中具有促进癌浸润和转移的作用. 但有关SNCG在胃癌中的研究国内外报道很少. 本研究对SNCG在胃癌组织的表达进行了研究, 探讨了其表达与临床病理的关系, 并分析了胃癌组织SNCG, MMP-2, MMP-9表达的相关性及其意义, 初步探讨了SNCG可能的作用机制, 为以后更深入的研究打下基础.
戴冬秋, 教授, 中国医科大学附属第一医院肿瘤外科; 邹小明, 教授, 哈尔滨医科大学附属第二医院普外二科.
研究显示SNCG基因的表达主要与第一个外显子的低甲基化状态密切相关, SNCG去甲基化是导致乳腺癌恶化的关键性因素. 目前DNA低甲基化这种表观遗传学改变在肿瘤发病中的作用成为研究的热点.
Jia et al发现当乳腺癌细胞中SNCG过表达时, 明显促进MMP-2和MMP-9的表达, 引起更多转移表型的形成.
本文对SNCG在胃癌组织的表达进行了研究, 探讨了其表达与临床病理的关系, 首次分析了胃癌组织SNCG, MMP-2, MMP-9表达的相关性及其意义, 初步探讨了SNCG可能的作用机制, 为以后更深入的研究打下基础.
本研究对照设计合理, 文献引用恰当, 有一定的科学性和创新性, 但实验方法有待改进.
编辑: 李军亮 电编:何基才
| 1. | Ji H, Liu YE, Jia T, Wang M, Liu J, Xiao G, Joseph BK, Rosen C, Shi YE. Identification of a breast cancer-specific gene, BCSG1, by direct differential cDNA sequencing. Cancer Res. 1997;57:759-764. [PubMed] [DOI] |
| 2. | Jia T, Liu YE, Liu J, Shi YE. Stimulation of breast cancer invasion and metastasis by synuclein gamma. Cancer Res. 1999;59:742-747. [PubMed] [DOI] |
| 3. | Gupta A, Godwin AK, Vanderveer L, Lu A, Liu J. Hypomethylation of the synuclein gamma gene CpG island promotes its aberrant expression in breast carcinoma and ovarian carcinoma. Cancer Res. 2003;63:664-673. [PubMed] [DOI] |
| 4. | Liu H, Liu W, Wu Y, Zhou Y, Xue R, Luo C, Wang L, Zhao W, Jiang JD, Liu J. Loss of epigenetic control of synuclein- gamma gene as a molecular indicator of metastasis in a wide range of human cancers. Cancer Res. 2005;65:7635-7643. [PubMed] [DOI] |
| 5. | Westermarck J, Kähäri VM. Regulation of matrix metalloproteinase expression in tumor invasion. FASEB J. 1999;13:781-792. [PubMed] |
| 6. | Itoh Y, Nagase H. Matrix metalloproteinases in cancer. Essays Biochem. 2002;38:21-36. [PubMed] |
| 7. | Curran S, Murray GI. Matrix metalloproteinases: molecular aspects of their roles in tumour invasion and metastasis. Eur J Cancer. 2000;36:1621-1630. [PubMed] [DOI] |
| 8. | Lavedan C, Leroy E, Dehejia A, Buchholtz S, Dutra A, Nussbaum RL, Polymeropoulos MH. Identification, localization and characterization of the human gamma-synuclein gene. Hum Genet. 1998;103:106-112. [PubMed] [DOI] |
| 9. | Lavedan C. The synuclein family. Genome Res. 1998;8:871-880. [PubMed] |
| 10. | Clayton DF, George JM. The synucleins: a family of proteins involved in synaptic function, plasticity, neurodegeneration and disease. Trends Neurosci. 1998;21:249-254. [PubMed] [DOI] |
| 11. | Yanagawa N, Tamura G, Honda T, Endoh M, Nishizuka S, Motoyama T. Demethylation of the synuclein gamma gene CpG island in primary gastric cancers and gastric cancer cell lines. Clin Cancer Res. 2004;10:2447-2451. [PubMed] [DOI] |
| 12. | Lu A, Zhang F, Gupta A, Liu J. Blockade of AP1 transactivation abrogates the abnormal expression of breast cancer- specific gene 1 in breast cancer cells. J Biol Chem. 2002;277:31364-31372. [PubMed] [DOI] |
| 13. | Zhao W, Liu H, Liu W, Wu Y, Chen W, Jiang B, Zhou Y, Xue R, Luo C, Wang L. Abnormal activation of the synuclein-gamma gene in hepatocellular carcinomas by epigenetic alteration. Int J Oncol. 2006;28:1081-1088. [PubMed] |
| 14. | Surgucheva IG, Sivak JM, Fini ME, Palazzo RE, Surguchov AP. Effect of gamma-synuclein overexpression on matrix metalloproteinases in retinoblastoma Y79 cells. Arch Biochem Biophys. 2003;410:167-176. [PubMed] [DOI] |
| 16. | Davies B, Waxman J, Wasan H, Abel P, Williams G, Krausz T, Neal D, Thomas D, Hanby A, Balkwill F. Levels of matrix metalloproteases in bladder cancer correlate with tumor grade and invasion. Cancer Res. 1993;53:5365-5369. [PubMed] |
| 20. | Mönig SP, Baldus SE, Hennecken JK, Spiecker DB, Grass G, Schneider PM, Thiele J, Dienes HP, Hölscher AH. Expression of MMP-2 is associated with progression and lymph node metastasis of gastric carcinoma. Histopathology. 2001;39:597-602. [PubMed] [DOI] |
| 22. | 王 璐, 李 玉林, 张 丽红, 高 旭兰, 吴 珊, 寇 伯君, 朱 桂彬, 李 岩. MMP-9在胃癌组织中的表达及对血管新生和肿瘤进 展的影响. 临床与实验病理学杂志. 2002;18:163-166. |