修回日期: 2008-09-24
接受日期: 2008-10-07
在线出版日期: 2008-10-28
目的: 探讨清肝活血方及其拆方对酒精性肝病(alcoholic liver disease, ALD)大鼠肝组织CD14、TLR4表达的影响.
方法: ♂Wistar大鼠100只随机分成空白组、CCl4组各10只, 余80只为造模组, 采用复合因素复制ALD模型6 wk. CCl4组予微量CCl4腹腔注射, 每周2次. 造模4 wk后将模型组随机分成4组, 清肝活血方及其拆方组各15只, 余为模型组. 予等效剂量清肝活血方及拆方ig 2 wk. 检测血清ALT, AST水平; 留取肝脏标本进行HE染色. RT-PCR检测肝组织CD14 mRNA、TLR4 mRNA表达, 免疫组织化学染色检测肝组织CD14表达, Western blot检测肝组织TLR4蛋白表达.
结果: 与模型组比较, 清肝活血方及其拆方均可明显改善ALD大鼠肝脏脂肪变及肝脏炎症程度(0.67±0.50, 2.15±1.28, 1.38±1.06 vs 4.56±0.73, 均P<0.01). 清肝活血方能显著降低模型大鼠血清ALT水平(725.65±111.02 vs 884.68±177.54, P<0.05), 清肝方和活血方无明显作用; 清肝方、活血方、清肝活血方均可明显降低ALD大鼠血清AST水平(2383.81±888.18, 2158.93±922.85, 2001.90±519.27 vs 3210.98±640.63, P<0.01或0.05), 组间比较无显著差异. 清肝方及清肝活血方能显著降低模型大鼠CD14 mRNA表达(1.46±0.52, 1.10±0.40 vs 2.67±0.66, 均P<0.01), 活血方作用不明显, 清肝活血方优于活血方. 清肝方、活血方、清肝活血方均能显著降低模型大鼠肝组织TLR4 mRNA表达(1.91±0.03, 2.11±0.03, 1.53±0.01 vs 2.37±0.03, 均P<0.01), 组间比较无显著差异. 清肝活血方显著降低模型大鼠肝组织CD14表达(13 392.28±9287.54 vs 32 288.89±15 631.03, P<0.01). 清肝方、活血方、清肝活血方均能显著降低模型大鼠肝组织TLR4表达(1.06±0.10, 1.19±0.05, 0.98±0.12 vs 1.40±0.11, 均P<0.01).
结论: 清肝活血方及其拆方发挥对ALD的防治作用, 其作用机制可能与降低CD14、TLR4基因和蛋白的表达有关.
引文著录: 吴涛, 柳涛, 郑培永, 邢练军, 季光. 清肝活血方及其拆方对酒精性肝病大鼠CD14、TLR4表达的影响. 世界华人消化杂志 2008; 16(30): 3372-3380
Revised: September 24, 2008
Accepted: October 7, 2008
Published online: October 28, 2008
AIM: To study the effect of Qingganhuoxue Recipe (QGHXR) (liver-clearing blood-activating) and its separated recipes on the expression of CD14 and TLR4 in rats with ALD.
METHODS: One hundred male Wistar rats were randomly divided into three groups, that is, experimental group (n = 80) which were established with compound factors, the control group (n = 10) treated with normal saline, and CCl4 group (n= 10) which were intraperitoneally and continuously injected with CCl4 twice a week. Four weeks later, the experimental group was randomly divided into 4 groups: QGHXR group (n = 15), Qinggan (liver-clearing) recipe group (QGR, n = 15), Huoxue (blood -activating) recipe group (HXR, n = 15) and model group (n = 50). All rats were given suitable drugs for two weeks. The serum levels of ALT and AST were detected. Pathological changes in liver tissues were observed using HE staining. The gene expression of CD14 and TLR4 in the liver were measured using RT-PCR, the protein expression of CD14 using immunohistochemical staining, and the expression of TLR4 using Western blot.
RESULTS: Compared with the model group, QGHXR and its separated recipes improved the degree of liver steatosis and inflammation significantly (0.67 ± 0.50, 2.15 ± 1.28, 1.38 ± 1.06 vs 4.56 ± 0.73, all P < 0.01). QGHXR degraded blood level of ALT markedly (725.65 ± 111.02 vs 884.68 ± 177.54 P < 0.05), but QGR and HXR showed no remarkable effect. QGR, HXR and QGHXR reduced the serum level of AST significantly (2383.81 ± 888.18, 2158.93 ± 922.85, 2001.90 ± 519.27 vs 3210.98 ± 640.63, P < 0.01 or 0.05), and there was not significant difference among these groups. QGR and QGHXR down-regulated the expression of CD14 mRNA significantly (1.46 ± 0.52, 1.10 ± 0.40 vs 2.67 ± 0.66, both P < 0.01), but HXR showed no obvious effect. QGR, HXR and QGHXR decreased the expression of TLR4 mRNA significantly (1.91 ± 0.03, 2.11 ± 0.03, 1.53 ± 0.01 vs 2.37 ± 0.03, all P < 0.01), and no significant difference was observed among groups. QGHXR decreased the expression of CD14 in the liver in model group rats (13 392.28 ± 9287.54 vs 32 288.89 ± 15 631.03, P<0.01), but QGR and HXR showed no obvious effect. QGR, HXR and QGHXR decreased the expression of TLR4 significantly (1.06 ± 0.10, 1.19 ± 0.05, 0.98 ± 0.12 vs 1.40 ± 0.11, all P < 0.01).
CONCLUSION: QGHXR and its separated recipes may provide protection against ALD in rats through down-regulating the expression of CD14 and TLR4.
- Citation: Wu T, Liu T, Zheng PY, Xing LJ, Ji G. Effect of Qinggan Huoxue recipe and its separated recipes on the expression of CD14 and TLR4 in rats with alcoholic liver disease. Shijie Huaren Xiaohua Zazhi 2008; 16(30): 3372-3380
- URL: https://www.wjgnet.com/1009-3079/full/v16/i30/3372.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i30.3372
在酒精性肝病(alcoholic liver disease, ALD)的发病机制中, 脂多糖(lipopolysaccharide, LPS)-库普弗细胞(Kupffer cell, KC)的作用机制受到重视, 损伤信号通过白细胞分化抗原14(cluster of differentiation antigen, CD14)和跨膜受体Toll样受体4(Toll-like receptor 4, TLR4)的传递, 引起细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)磷酸化、核因子-κB(nuclear factor-κB, NF-κB)活化, 促进各种细胞因子如肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)的转录与释放, 放大炎症效应, 导致肝损伤的过程, 成为该领域研究的热点之一. 前期研究证实清肝活血方对ALD具有良好的治疗效果[1]; 体外研究发现, 清肝活血方及其拆方通过调控KC表面CD14、TLR4受体, 降低TNF-α的表达, 有效抑制酒精引起的肝脏损害[2]. 本文进一步从体内实验证实清肝活血方及其拆方对ALD的防治作用及其对CD14、TLR4表达的影响.
♂Wistar大鼠100只, SPF级, 体质量180±10 g, 购自上海斯莱克实验动物有限责任公司, 饲养于上海中医药大学附属龙华医院实验中心动物房. 清肝活血方(柴胡9 g, 黄芩9 g, 丹参15 g, 鳖甲9 g, 葛根15 g)及其拆方清肝方(柴胡9 g、黄芩9 g)、活血方(丹参15 g、鳖甲9 g、葛根15 g), 根据《中药药理学研究方法学》[大鼠剂量 = 人剂量×35(人转换因子)/6(大鼠转换因子)]计算出人鼠等效剂量分别为4.75、1.5、3.25 g/kg, 按传统工艺制备成水煎剂, 减压浓缩至0.475、0.15、0.325 g/mL, 备用. CCl4分析纯、橄榄油化学纯 (国药集团化学试剂有限公司); 吡唑(Fluca公司); 戊巴比妥钠(上海西唐生物有限公司); HE染液(上海虹桥乐翔医用试剂有限公司); TRIzol Reagent, AMV RT/PCR Kit和DNA Marker(上海申能博彩生物科技有限公司); DEPC和琼脂糖(Sigma); 氯仿、异丙醇(上海试剂一厂); CD14多克隆兔抗体、SABC试剂盒、DAB显色试剂盒(武汉博士德公司); 引物由上海生工生物有限公司合成, CD14上游序列TCGGCTTGTTGCTGTTGCCTTTGAC 79 bp, CD14下游序列TTCTGCGAGCCAGGTATCCGTTGTT 560 bp; TLR4上游序列GGATTTTACGAATTCCACCTGTTAT 2091 bp, 下游序列CGATACAATTCGACCTGCTGCCTCA 2591 bp; β-actin上游序列TGTGATGGTGGGTATGGGTCAGAAG 207 bp, 下游序列 TCACGGTTGGCCTTAGGGTTCAGAG 431 bp. TLR4兔多克隆抗体(Santa Cruz公司); 二抗HRP-GAMG(Bio-Rad公司). DY89-1型电动玻璃匀浆机为宁波新芝科器研究所产品; 低温离心机为Eppendorf公司; PCR仪(BIO-RAD); RNA/DNA calculator(Pharmacia); 凝胶成像系统(上海四星生物技术有限公司); 电热恒温水槽(上海精宏实验设备有限公司); UV-2102C型紫外可见分光光度计(Unico公司); MK3型酶标仪(Thermo Labsystems).
1.2.1 造模和给药: 造模组以60度二锅头酒、玉米油、吡唑(10 mL:2 mL:25 mg)混合物ig, 灌胃量为10 mL/(kg·d), 分早晚2次灌服. 第2周开始ip CCl4橄榄油溶液(CCl4:橄榄油 = 1:3), 每周2次, 每次注射0.3 mL/kg体质量, 造模共6 wk[3]. 空白组和CCl4组以等量生理盐水ig, CCl4组仅以等量CCl4橄榄油溶液ip, 空白组以等量生理盐水ip. 在造模的第1、2、3、4和5周各取2只模型大鼠做病理分析. 造模4 wk后, 模型大鼠随机分成4组, 即清肝活血方组、清肝方组、活血方组各15只, 剩余的为模型组. 各中药组分别按人鼠等效剂量清肝活血方、清肝方、活血方灌胃给药, 灌胃量为10 mL/(kg·d), 共2 wk. 模型组、空白组和CCl4组加灌等量生理盐水. 造模6 wk后处死大鼠, 以20 g/L戊巴比妥钠ip麻醉(2 mL/kg), 腹主动脉采血, 4℃静置2 h, 3000 r/min, 15 min, 离心分离血清和血浆, -80℃备用. 摘取肝脏称重后, 于肝右叶切取1.0 cm×1.0 cm×0.2 cm大小肝组织2块, 40 g/L中性甲醛溶液固定. 剩余肝组织液氮中速冻后-80℃冰箱保存.
1.2.2 观察项目和方法: (1)病理改变: 石蜡切片, HE染色, 光镜下观察肝脂肪变性和炎症程度. 肝细胞脂肪变性程度判断标准参照Diehl法[4], 炎症活动度计分标准参考1981年Knodell et al[5]提出的慢性肝炎组织学活动指数, 并结合王泰龄et al[6]提出的慢性肝炎炎症活动度计分方案. (2)生化指标: 血清ALT、AST检测采用均采用7170S automatic analyzer全自动分析仪检测. (3)RT-PCR测定肝组织CD14 mRNA、TLR4 mRNA表达: 取肝组织100 mg按照TRIzol Reagent液说明书提取总RNA, 然后用紫外分光光度计定量, 检测260 nm、280 nm A值, 确认两者比值在1.8-2.0之间, 按照试剂盒说明书进行cDNA的逆转录. 总RNA经RT反应后进行PCR扩增, 采用AMV 20 μL体系, 第一链cDNA1 μL、10×PCR Buffer 2 μL, dNTP 1 μL, 目的基因正负链各0.22 μL, β-actin正负链各0.1 μL, Taq酶0.2 μL, DEPC H2O 14.2 μL. 反应条件为: 95℃预变性5 min, 95℃ 30 s, 60℃ 40 s, 72℃ 1 min, 26次循环, 72℃延伸10 min. PCR产物加样于20 g/L琼脂糖凝胶, 上样量12 μL, 6×DNA loading Buffer 2 μL, 电压150 V, 电泳35 min, 紫外灯下观察, 凝胶分析系统拍照. 用密度扫描仪对特异性条带进行密度扫描, 测得其灰度值, 与相应的β-actin灰度之比表示CD14 mRNA、TLR4 mRNA的相对表达量. (4)免疫组织化学染色方法检测肝组织CD14表达: 石蜡切片常规脱蜡至水. 30 mL/L H2O2室温孵育5-10 min, 以消除内源性过氧化物酶的活性, 蒸馏水冲洗, PBS浸泡5 min. 蒸馏水洗1 min×3次, 进行抗原的修复: 热修复抗原法. 50 g/L BSA封闭液室温孵育30 min. 倾去血清, 勿洗, 滴加适当比例稀释的一抗(1:100), 4℃过夜. PBS冲洗, 5 min×3次. 同时以PBS液代替一抗进行阴性对照. 滴加生物素化山羊抗小鼠IgG工作液, 37℃孵育30 min. PBS洗, 2 min×3次. 滴加试剂SABC, 20-37℃ 30 min, PBS洗, 5 min×4次. DAB显色, 镜下观察控制时间. 蒸馏水充分冲洗, 苏木素轻度复染(60-90 s), 脱水, 透明, 封片. 阳性结果判定: CD14阳性表现均为细胞质着色呈棕黄色[7]. 采用Image pro6.0图像分析系统测定200倍镜下CD14阳性面积. 每组选取切片6张, 每张选取细胞分布均匀的3个视野进行分析. (5)Western blot方法测定肝组织TLR4蛋白含量: 提取抗原蛋白后采用紫外分光光度计进行蛋白质定量. 最后稀释为4 g/L, 加载样缓冲液后, 终浓度为2 g/L, 上样量为30-80 μg/泳道. 配分离胶和积层胶; 上样前样品处理: 样品100℃、3 min、冷却, 900 g、离心30 s. 通电电压: 积层胶电泳电压50 V左右, 分离胶电泳电压90-110 V. 考马斯亮蓝染色: 1 h, 1号脱色1 h, 2号脱色2 h. 电转印: 将滤纸硝酸纤维素膜(NcM)切成与凝胶尺寸大小, 置于DM中浸透5 min, 电转液平衡15 min. 转移: 用二张大滤纸贴于两张多孔垫料, 将NcM、胶夹于中间, 在NcM与大滤纸之间垫小滤纸. NcM朝正极, 20 V恒压转移12 h. 杂交: 取下NcM杂交, 凝胶染色看效果. 取下NcM, 做好标记, dH2O冲洗, 室温滤纸干或放入膜固定液15 min. NcM用PBS冲洗二遍, 呈5%-6%脱脂奶粉的pH7.2的PBS中封闭, 室温6-8 h或室温1-2 h, 4℃过夜. 将封闭的膜用PBS冲洗1遍, 洗15 min×1, 5 min×2. 加入一抗1:1000, 室温, 反应1 h. PBS洗15 min×1, 15 min×4. 加入二抗1:5000, 室温, 反应1 h. PBS洗15 min×1, 5 min×4. 混合等体积Bottle1&2与NcM共孵育1 min. 放射自显影: 曝光3 min至10 min. 显影后清水漂洗, 再定影. 凝胶图像分析: 用凝胶图像处理系统分析目标. 测得其灰度值, 与相应的β-actin灰度之比表示其蛋白含量.
统计学处理 各组计量资料以mean±SD表示, 采用方差分析进行组间比较, 数据均采用SPSS12.0软件分析, P<0.05为差异显著.
实验过程中共死亡大鼠31只, 其中由于灌胃不慎致死3只, 被同笼大鼠吃掉10只, 酒精中毒致死18只. 模型组死亡16只, 清肝方组2只, 活血方组7只, 清肝活血方组6只. 尸体解剖观察可见胃穿孔、胃出血、肠坏死等. 空白组、CCl4组大鼠无死亡, 毛发有光泽, 体质量增加, 体态活泼, 食量及二便正常, 无嗜睡、无精神萎靡现象. 模型组大鼠每天灌酒后出现暂时性兴奋, 很快出现醉酒状态并开始酣睡, 皮毛疏松无光泽, 精神不振, 而且饮食逐渐减少, 体质量增长缓慢, 大便溏泻, 小便黄. 各中药组大鼠上述症状有不同程度的减轻, 醉酒状和精神不振状态有所减轻, 食量增加, 体质量增长明显, 并能明显改善大便溏泻, 小便黄的情况.
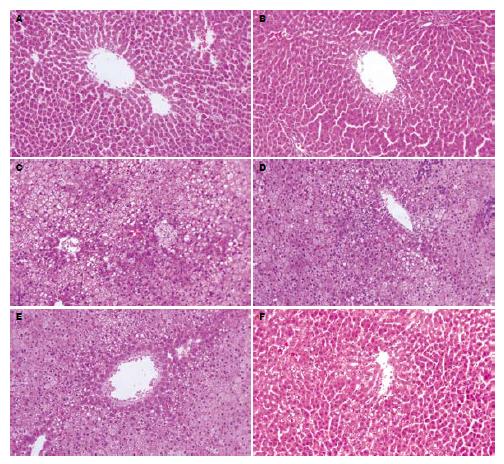
空白组大鼠肝小叶结构清晰, 肝细胞索排列整齐, 呈放射状, 肝窦正常, 胞核结构清晰(图1A). CCl4组镜下表现与空白组基本相同(图1B). 造模第6周肝细胞脂变更加明显, 肝细胞肿大, 胞质疏松化, 肝细胞内出现大量小脂滴空泡, 核被挤向边缘, 同时伴有炎性细胞浸润(P<0.01, 图1C). 清肝活血方及其拆方均可明显改善ALD大鼠肝脏脂肪变及肝脏炎症程度(P<0.01, 图1D-F), 清肝活血方>活血方>清肝方, 清肝活血方优于清肝方(P<0.05, 表1).
模型大鼠表现为血清ALT、AST显著升高(P<0.01、P<0.05); CCl4组ALT无明显改变, AST明显升高(P<0.05); 清肝活血方能显著降低模型大鼠血清ALT水平(P<0.01), 清肝方和活血方无明显作用; 清肝方、活血方、清肝活血方均可明显降低ALD大鼠血清AST水平(P<0.05, P<0.01, P<0.01), 组间比较无显著差异(表1).
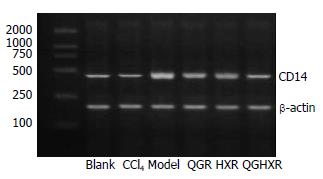
RT-PCR检测显示: 空白组肝组织CD14 mRNA表达较低; 模型大鼠CD14 mRNA表达显著增强(P<0.01); CCl4组无明显改变; 清肝方及清肝活血方能显著降低模型大鼠CD14 mRNA表达(P<0.01), 活血方作用不明显, 清肝活血方优于活血方(P<0.05, 图2, 表2).
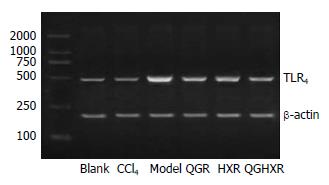
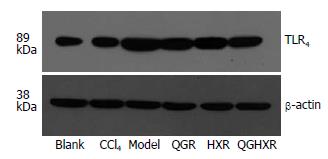
空白组肝组织TLR4 mRNA表达较低; 模型大鼠TLR4 mRNA表达显著增强(P<0.01); CCl4组无明显改变; 清肝方、活血方、清肝活血方均能显著降低模型大鼠肝组织TLR4 mRNA表达(P<0.01), 组间比较无显著差异(图3, 表2).
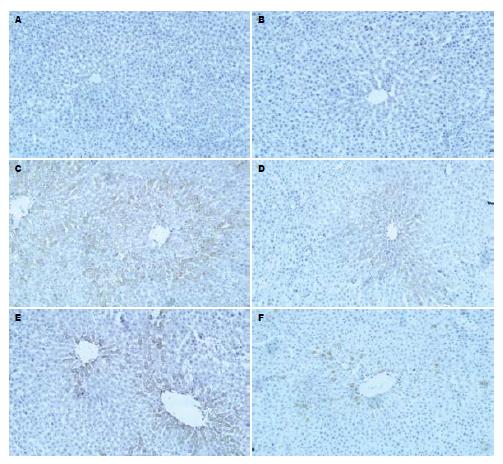
免疫组化染色检测显示: 空白组肝组织中仅有少量细胞质呈阳性, 阳性表达主要位于肝窦内或中央静脉周围的非实质细胞; 模型大鼠肝脏可见明显的CD14阳性染色区域(P<0.01); CCl4组无明显改变; 清肝活血方显著降低模型大鼠肝组织CD14表达(P<0.01), 清肝方、活血方作用不明显(图4, 表3).
中医学虽无ALD之称, 但根据其病因、病理及临床特征, 可将其归属于"伤酒"、"酒病"、"胁痛"、"酒癖"、"酒疸"、"积聚"、"酒臌"、"酒劳"等病证之中. 中医认为酒为水谷之精气, 其气剽悍而有大毒; 酒为湿热之品, 味甘、苦辛、性温、有毒, 入心、肝、肺、胃经. 古人认为长期大量饮酒造成酒毒主要是湿热、瘀血两邪内蕴不解而伤人. 课题组在古籍和文献研究的基础上, 首倡从"瘀热"论治ALD. 应用临床流行病学的研究方法, 对745例ALD患者进行中医证候病理要素调查, 初步总结ALD患者的辨证分型规律, 提出"湿热瘀血为患"是ALD的基本病机, "清肝活血"是治疗ALD的基本法则. 方中首用柴胡、黄芩清肝利湿, 共为君药. 柴胡味苦微寒, 入肝胆二经, 疏肝解郁, 和解退热. 黄芩, 性味苦寒, 入肺、脾、胆、大小肠经, 清热燥湿, 泻火解毒, 止血安胎. 两者合奏清热疏肝, 利湿解毒之功效. 臣药选用丹参、鳖甲. 丹参苦微寒, 入心、肝经, 凉血消肿, 清热去烦, 养血和血, 去瘀生新. 鳖甲味咸, 性微寒, 归肝肾经, 滋阴潜阳, 软坚散结, 退热除蒸. 两药共用可活血化瘀, 软坚散结. 配以葛根为佐, 性平味甘辛, 解肌退热、生津止渴、升发清阳. 全方清肝、活血并用, 切中ALD病机特点.
ALD发病机制复杂, 至今仍未完全阐明, 主要考虑为: 酒精及其代谢产物对肝脏的损伤, 其机制涉及乙醇的代谢产物-乙醛的毒性, 还原型辅酶Ⅰ/辅酶Ⅰ的比值增高所致的代谢紊乱, 缺氧、自由基的损害, 以及炎症介质损伤、细胞凋亡、内毒素、遗传多态性、与病毒的叠加作用等多个方面[7-8]. LPS-KC信号传导途径在ALD发病机制中起着重要的作用. 酒精可导致肠道黏膜对大分子(包括LPS)的通透性增加, 同时肝脏对LPS的清除减少, 使血液中的LPS增高. LPS不仅可直接损伤肝细胞, 更重要的是可与脂多糖结合蛋白(lipolysaccharide binding protein, LBP)结合, 形成LBP-LPS复合体, 并与KC表面的膜受体CD14相互作用, 激活该细胞并介导信号传导, 通过TLR4将信号传导至细胞内, 激活IκB(inhibitory kappa B)发生磷酸化, NF-κB激活并移位进入细胞核, 结合免疫炎症相关靶基因上特异的κB结合位点, 启动该基因的转录; 或通过激活MAPK、ERK, 导致转录因子AP-1(activating protein-1)家族的成员Jun和Fos的活化; 进而可释放大量的氧自由基、细胞因子和炎症介质, 如TNF, IL-6, IL-10, IL-12, 干扰素(interferon-β, IFN-β), 转化生长因子(trans-forming growth factor, TGF-β), 血小板源生长因子(platelet derived growth factor, PDGF)等, 而且细胞黏附分子和细胞因子受体表达也增加, 引起肝细胞进一步坏死、凋亡、炎症和肝纤维化形成[9-13]. 课题组前期对LPS-KC级联反应信号蛋白的干预细胞学研究证实"清肝"方药和"活血"方药在KC膜受体CD14、TLR4、ERK1/2磷酸化和效应因子NF-κB、TNF-α和AP-1等环节具有不同的作用靶点, 呈现协同或拮抗作用[2,14-17]. 该研究是在既有工作基础上, 在"瘀热"病机理论指导下, 以现代分子生物学技术为手段, 从体内实验角度, 研究乙醇介导的LPS-KC信号传导途径中相关蛋白变化的规律, 探讨清肝活血方及其拆方保护肝细胞的作用机制和途径, 为ALD"瘀热"病机理论的发展提供现代科学证据, 进一步指导中医药防治ALD的临床实践, 提高临床疗效.
正常情况下KC中CD14的表达极低, 但随着LPS浓度的增加, KC中CD14 mRNA的表达亦随之增加, 两者有一定的剂量依赖关系; 同时CD14的蛋白合成亦随之而增强[18-20]. Yin et al[21]实验研究证明, 在用酒精灌胃野生小鼠和CD14基因敲除小鼠两类动物中前者的NF-κB, TGF, TNF明显增长, 这说明了在早期酒精性肝损害的发展中作为内毒素受体的CD14分子占了很重要的作用. Zima et al[22]已经显示, CD14在小鼠酒精性肝损伤中是必要的, 且在人类CD14的增长水平与ALD的严重程度是相关联的. 在CD14敲除鼠中对LPS的敏感性和TNF, IL-6的产生至少<10倍未敲除CD14鼠[23]. 本实验研究结果亦表明: 模型大鼠CD14 mRNA表达明显增加, 模型大鼠肝脏可见明显的CD14阳性染色区域. 清肝活血方及清肝方显著降低模型大鼠CD14 mRNA表达, 活血方对CD14 mRNA无明显作用, 清肝活血方优于活血方. 清肝活血方显著降低模型大鼠CD14表达, 清肝方、活血方对CD14蛋白表达无明显作用. 提示清肝方能降低CD14基因表达, 但是在蛋白水平上无明显作用; 活血方对CD14基因和蛋白表达的调控无明显作用; 清肝、活血并用起协同作用, 降低CD14基因和蛋白的表达. 目前研究显示应用CD14 mAb后能抑制TNF-α等细胞因子的表达[24], 在无CD14分子表达的低内毒素反应的细胞中, 转染CD14 cDNA能够使其对内毒素的敏感性增加100-1000倍[25]. 因此, 提示清肝活血方通过调控CD14基因和蛋白的表达, 降低内毒素信号传导的效率, 减少炎症因子的产生和对肝细胞的损伤.
CD14分子在单独情况下不足以传导LPS信号, 还需要TLR4的参与. LPS与TLR4结合后诱导其发生同源或异源受体二聚化, 使其胞内空间结构改变, 可募集下游信号分子. 在CD14分子存在下, LPS直接与TLR4-MD-2复合物紧密结合, 使得TLR4激活, 并向细胞内传递信号[10-11]. 研究发现, TLR4缺失小鼠的KC受到LPS刺激后, 炎性因子分泌减少, ALT升高不明显[26]. Uesugiet al[27]发现TLR4基因突变的C3H/HeJ小鼠经4 wk胃内酒精灌注后, 肝组织损伤程度、转氨酶水平、TNF-α mRNA表达水平均较野生型对照组明显减轻. 本研究结果亦显示了TLR4在LPS信号转导中的重要作用. 空白组仅有少量TLR4基因及蛋白表达, 而模型大鼠肝组织TLR4基因和蛋白表达量均明显增高. 清肝活血方及其拆方均能显著降低模型大鼠肝组织TLR4基因和蛋白表达. 在降低TLR4蛋白表达方面, 清肝活血方>清肝方>活血方, 清肝活血方优于活血方. 提示清肝活血方及其拆方均可降低TLR4的基因和蛋白表达, 降低信号的进一步传递.
ALD的发病机制较复杂, 防治ALD的药物绝不能仅仅着眼于发病环节的某一点上, 中药复方多靶点的药理特点在ALD治疗上存在巨大的优势并已经在临床治疗上显示出良好的疗效. 因此该研究从LPS-KC信号传导途径探讨中药复方及其拆方对ALD防治作用的机制, 更深层次、更本质地揭示不同治法中药作用机制的强度和位点. 但仍有以下不足之处: 一是复合因素造模每日灌胃次数较多, 在较长的造模周期中可能对大鼠食管黏膜造成损伤, 造成动物死亡. 如何完善模型的稳定性是值得各位从事ALD研究的科研工作者思考的问题. 二是鉴于ALD形成机制相当复杂, 我们远未了解透彻, 未来的治疗方向, 除了深化研究ALD发生、发展的每一环节, 从分子生物学方面发现新的治疗手段外, 对多种因素如何共同作用于ALD的不同阶段、不同水平也是值得探索的课题. 此外, 如何筛选临床重复性好、疗效高的方药, 并进行药理药化研究, 在此基础上提取其有效成分, 开发研制临床应用简便、高效速效的新剂型, 也是今后研究的方向之一.
由于饮食结构、生活习惯的改变, 酒精性肝病(ALD)的发病率迅速增加, 已成为危害我国人民健康的常见疾病. 在ALD的发病机制中, 内毒素-库普弗细胞(KC)的作用机制受到重视, 损伤信号导致肝损伤的过程, 成为该领域的热点问题.
唐文富, 副主任医师, 四川大学华西医院中西医结合科; 陈国凤, 主任医师, 中国人民解放军第302医院感染七科.
KC膜受体CD14和跨膜受体TLR4在内毒素-KC信号传导途径中具有重要的意义, 大部分实验研究显示了两者在酒精性肝损伤的发生发展中占有重要的作用.
由于内毒素-KC信号传导途径在酒精性肝损伤中起着重要的作用, 许多临床和实验研究报道了不同中药复方对ALD该途径中相关信号分子的干预作用. 但存在ALD动物模型不稳定性的问题, 在以后的研究中应尽量完善.
前期研究证实清肝活血方对ALD具有良好的治疗效果. 体外研究发现, 清肝活血方及其拆方通过调控KC表面CD14、TLR4受体, 降低TNF-α的表达, 有效抑制酒精引起的肝脏损害. 本实验从体内实验证实清肝活血方及其拆方对ALD的防治作用及其对CD14、TLR4表达的影响.
本文结果提示在ALD大鼠模型中CD14、TLR4基因和蛋白的表达明显升高, 清肝方、活血方、清肝活血方对CD14、TLR4表达呈现不同程度的调节作用. 提示清肝活血方及其拆方可能对内毒素-KC信号传导途径存在调节作用, 这为我们对该信号途径和中药的应用提供了新的内容.
本文系统研究了清肝活血方及拆方对酒精性肝病大鼠的影响, 以丰富的图像及统计数据表明清肝活血方及拆方可以有效降低酒精性肝病模型鼠CD14、TLR4表达. 文章设计合理、研究方法先进、结果表达信息充足有意义, 是一篇精彩的论著.
编辑: 李军亮 电编:何基才
| 4. | Diehl AM, Goodman Z, Ishak KG. Alcohollike liver disease in nonalcoholics. A clinical and histologic comparison with alcohol-induced liver injury. Gastroenterology. 1988;95:1056-1062. [PubMed] |
| 5. | Knodell RG, Ishak KG, Black WC, Chen TS, Craig R, Kaplowitz N, Kiernan TW, Wollman J. Formulation and application of a numerical scoring system for assessing histological activity in asymptomatic chronic active hepatitis. Hepatology. 1981;1:431-435. [PubMed] [DOI] |
| 7. | Arteel GE. Oxidants and antioxidants in alcohol-induced liver disease. Gastroenterology. 2003;124:778-790. [PubMed] [DOI] |
| 8. | Reuben A. Alcohol and the liver. Curr Opin Gastroenterol. 2008;24:328-338. [PubMed] [DOI] |
| 10. | Ryan KM, Ernst MK, Rice NR, Vousden KH. Role of NF-kappaB in p53-mediated programmed cell death. Nature. 2000;404:892-897. [PubMed] [DOI] |
| 11. | Wheeler MD. Endotoxin and Kupffer cell activation in alcoholic liver disease. Alcohol Res Health. 2003;27:300-306. [PubMed] [DOI] |
| 12. | Mathurin P, Deng QG, Keshavarzian A, Choudhary S, Holmes EW, Tsukamoto H. Exacerbation of alcoholic liver injury by enteral endotoxin in rats. Hepatology. 2000;32:1008-1017. [PubMed] [DOI] |
| 13. | Kono H, Enomoto N, Connor HD, Wheeler MD, Bradford BU, Rivera CA, Kadiiska MB, Mason RP, Thurman RG. Medium- chain triglycerides inhibit free radical formation and TNF-alpha production in rats given enteral ethanol. Am J Physiol Gastrointest Liver Physiol. 2000;278:G467-G476. [PubMed] [DOI] |
| 14. | 季 光, 曹 承楼, 张 广业, 张 玮, 邢 练军, 王 奕, 王 雨秾, 王 育群. 清肝活血方对酒精性肝病大鼠肝组织Ⅰ型胶原表达 的影响. 中国中西医结合消化杂志. 2002;10:24-26. |
| 17. | 王 淼, 龙 爱华, 刘 成海, 季 光. 清肝活血方及其拆方对脂多糖介导库普弗细胞活化ERK表达调控的研究. 中西医结合 肝病杂志. 2007;17:277-280. |
| 18. | Andonegui G, Goyert SM, Kubes P. Lipopolysaccharide-induced leukocyte-endothelial cell interactions: a role for CD14 versus toll-like receptor 4 within microvessels. J Immunol. 2002;169:2111-2119. [PubMed] [DOI] |
| 19. | Uesugi T, Froh M, Arteel GE, Bradford BU, Wheeler MD, Gäbele E, Isayama F, Thurman RG. Role of lipopolysaccharide- binding protein in early alcohol-induced liver injury in mice. J Immunol. 2002;168:2963-2969. [PubMed] [DOI] |
| 21. | Yin M, Bradford BU, Wheeler MD, Uesugi T, Froh M, Goyert SM, Thurman RG. Reduced early alcohol-induced liver injury in CD14-deficient mice. J Immunol. 2001;166:4737-4742. [PubMed] |
| 22. | Zima T, Kalousová M. Oxidative stress and signal transduction pathways in alcoholic liver disease. Alcohol Clin Exp Res. 2005;29:110S-115S. [PubMed] [DOI] |
| 23. | Haziot A, Ferrero E, Köntgen F, Hijiya N, Yamamoto S, Silver J, Stewart CL, Goyert SM. Resistance to endotoxin shock and reduced dissemination of gram-negative bacteria in CD14-deficient mice. Immunity. 1996;4:407-414. [PubMed] [DOI] |
| 24. | Verbon A, Dekkers PE, ten Hove T, Hack CE, Pribble JP, Turner T, Souza S, Axtelle T, Hoek FJ, van Deventer SJ. IC14, an anti-CD14 antibody, inhibits endotoxin-mediated symptoms and inflammatory responses in humans. J Immunol. 2001;166:3599-3605. [PubMed] |
| 25. | Lee JD, Kato K, Tobias PS, Kirkland TN, Ulevitch RJ. Transfection of CD14 into 70Z/3 cells dramatically enhances the sensitivity to complexes of lipopolysaccharide (LPS) and LPS binding protein. J Exp Med. 1992;175:1697-1705. [PubMed] [DOI] |
| 26. | Seki E, Tsutsui H, Nakano H, Tsuji N, Hoshino K, Adachi O, Adachi K, Futatsugi S, Kuida K, Takeuchi O. Lipopolysaccharide-induced IL-18 secretion from murine Kupffer cells independently of myeloid differentiation factor 88 that is critically involved in induction of production of IL-12 and IL-1beta. J Immunol. 2001;166:2651-2657. [PubMed] |
| 27. | Uesugi T, Froh M, Arteel GE, Bradford BU, Thurman RG. Toll-like receptor 4 is involved in the mechanism of early alcohol-induced liver injury in mice. Hepatology. 2001;34:101-108. [PubMed] [DOI] |