修回日期: 2008-01-10
接受日期: 2008-01-15
在线出版日期: 2008-01-28
目的: 本实验探讨血管内皮生长因子165(VEGF165)对体外培养的胃癌细胞株BGC-823凋亡的影响和机制.
方法: 将BGC-823细胞分为对照组、感染复数(MOI = 20)病毒Ad-GFP的Ad-GFP组, 重组腺病毒Ad-VEGF165转染的Ad-VEGF165组, 应用流式细胞仪检测细胞凋亡的百分率, RT-PCR方法检测凋亡抑制基因Bcl-2 mRNA的表达, 免疫细胞化学方法检测Bcl-2蛋白的表达情况.
结果: 流式细胞仪测定显示Ad-VEGF165组的细胞凋亡率明显低于Ad-GFP组和对照组(4.6%±0.31% vs 8.37%±1.06%, 7.73%±0.86%, P<0.01); RT-PCR和细胞免疫化学结果显示VEGF165转染BGC-823细胞后促进了细胞Bcl-2 mRNA和蛋白的表达, Ad-VEGF165组Bcl-2 mRNA和蛋白均高于对照组和Ad-GFP组(Bcl-2 mRNA: 0.761±0.05 vs 0.363±0.12, 0.356±0.08; Bcl-2蛋白: 1.010±0.08 vs 0.865±0.07, 0.901±0.05; P<0.01).
结论: VEGF165通过上调凋亡抑制基因Bcl-2及其蛋白的表达, 来抑制血浆饥饿诱导的胃癌细胞的凋亡.
引文著录: 欧希龙, 关云艳, 颜芳, 孙为豪, 杨柳, 陈国胜. 血管内皮生长因子165基因对人胃癌细胞凋亡的影响及机制. 世界华人消化杂志 2008; 16(3): 307-310
Revised: January 10, 2008
Accepted: January 15, 2008
Published online: January 28, 2008
AIM: To investigate the effect of vascular endothelial growth factor 165 (VEGF165) on apoptosis of human gastic adenocarcinoma cell line (BGC-823) in vitro and its underlying mechanism.
METHODS: BGC-823 cells were divided into control group, Ad-GFP group and Ad-VEGF165 group and cultured with GFP (MOI = 20) and Ad-VEGF165. Apoptotic cells were detected by FCM assay. Expression of Bcl-2 mRNA and Bcl-2 protein was determined by RT-PCR and immunocytochemistry, respectively.
RESULTS: FCM showed that the apoptosis rate of BGC-823 cells was significantly lower in the Ad-VEGF165 group than in the Ad-GFP and control groups(4.6% ± 0.31% vs 8.37% ± 1.06%, 7.73% ± 0.86%, P < 0.01). PCR and immunocytochemistry displayed that VEGF165-transfected BGC-823 increased the expression of Bcl-2 mRNA and Bcl-2 protein, which was higher in the Ad-VEGF165 group than in the control and Ad-GFP groups (Bcl-2 mRNA: 0.761 ± 0.05 vs 0.363 ± 0.12, 0.356 ± 0.08; Bcl-2 protein: 1.010 ± 0.08 vs 0.865 ± 0.07, 0.901 ± 0.05; P < 0.01).
CONCLUSION: VEGF165 can inhibit cell apoptosis induced by serum starvation by up-regulating the expression of Bcl-2.
- Citation: Ou XL, Guan YY, Yan F, Sun WH, Yang L, Chen GS. Effect of vascular endothelial growth factor 165 on apoptosis of human gastric carcinoma cells in vitro and its mechanism. Shijie Huaren Xiaohua Zazhi 2008; 16(3): 307-310
- URL: https://www.wjgnet.com/1009-3079/full/v16/i3/307.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i3.307
尽管血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)的发现距今已有很多年, 但人们对他的功能并未了解透彻. 最初人们仅仅把他看作是促血管形成因子, 认为具有促血管生成和增加血管通透性的功能. 后来逐渐认识到他还有其他功能, 如在多种肿瘤细胞上发现了他的受体, 该受体可介导VEGF对这些细胞产生促生存及增加其耐药性的作用等[1]. 为了进一步明确其体外作用, 我们将腺病毒重组体Ad-VEGF165转染至体外培养的胃癌细胞株BGC-823, 观察其对凋亡的影响, 并探讨可能存在的机制.
人胃腺癌细胞株BGC-823购自中科院, 复制缺陷型腺病毒重组体及对照病毒由南京医科大学第一附属医院构建[2]并赠送, RPMI 1640低糖培养基、胎牛血清均购自美国Gibcobrl公司, Annexin V-FITC/PI试剂盒为澳大利亚Bender Medsystems公司产品, RT-PCR试剂盒购自日本TaKaRa公司, 焦碳酸二乙酯(DEPC)水、溴化乙锭(EB)、TRIzol试剂均购自Sigma公司, DNA小分子量marker为北京天为时代公司生产, 引物由南京英俊生物工程技术服务有限公司合成, Bcl-2鼠抗人单克隆抗体购自北京中杉金桥生物技术公司, 免疫组化S-P试剂盒(SP-9000)为福州迈新公司产品, DAB显色试剂盒购自美国Vector Laboratories公司.
1.2.1 流式细胞仪检测细胞凋亡: 取对数生长期的BGC-823细胞, 消化后计数并调整培养液用量, 使细胞悬液终浓度为2.0×108/L, 分别取3 mL接种于四个培养瓶(50 mL)中, 待生长至70%融合后, 阴性对照组和对照组均用无血清培养基培养, 实验组分别用Ad-GFP、Ad-VEGF165 转染(感染复数与前期实验相同取MOI = 20), 8 h后继续用无血清培养基培养, 36 h后收集1.0×106个细胞, 离心后用PBS冲洗两次. 然后先后加入Annexin V-FITC和PI, 1 h内上机检测细胞的凋亡率, 实验重复3次.
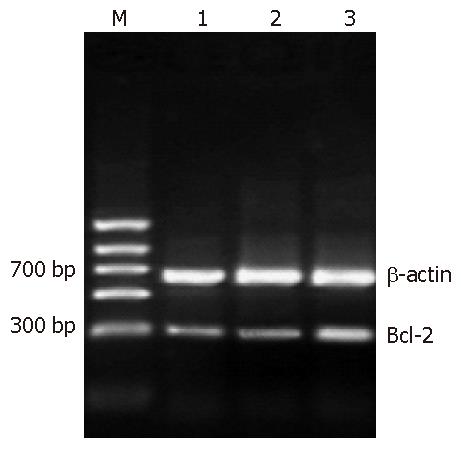
1.2.2 RT-PCR方法检测Bcl-2 mRNA的表达: 实验分为对照组、Ad-GFP组和Ad-VEGF165组, 按前述方法培养及感染细胞后加入1 mL TRIzol reagent提取总RNA, 然后进行逆转录(体系为20 µL), 反应混合物于42 ℃温育30 min后, 升温至99 ℃加热5 min使逆转录酶灭活, 并使DNA、RNA杂合分子变性解离, 立即降至5 ℃冷却5 min. 再行半定量PCR, 引物已在GenBank中核实. Bcl-2上游引物: 5'-GTGGAGGAGCTCTTCAGGGA-3', 下游引物: 5'-AGGCACCCAGGGTGATGCAA-3', 扩增片段长度304 bp; β-actin内参的扩增长度为661 bp, 其上游引物: 5'-TGACGGGGTCACCCACACTGTGCCCATCTA-3', 下游引物: 5'-CTAGAAGCATTTGCGGTGGACGATGCAGGG-3'. 反应体系如下: cDNA 3 µL, 5×PCR Buffer 5 µL, MgCl2 1 µL, Bcl-2、β-actin上下游引物各0.5 µL, Taq(DNA聚合酶)0.25 µL, 灭菌蒸馏水13.75 µL. 反应条件: 98 ℃预变性30 s, 98 ℃变性10 s, 54 ℃复性10 s, 72 ℃延伸30 s, 30个循环后再于72 ℃延伸8 min. PCR产物立即进行电泳, 用ImageMaster VDS扫描分析仪扫描凝胶图谱, 采用Total Lab2.0分析系统(Nonlinear Dynamics Ltd.)对PCR产物进行半定量分析, 测量区带密度, 计算样品的目的区带与内参区带的密度比, 实验重复3次.
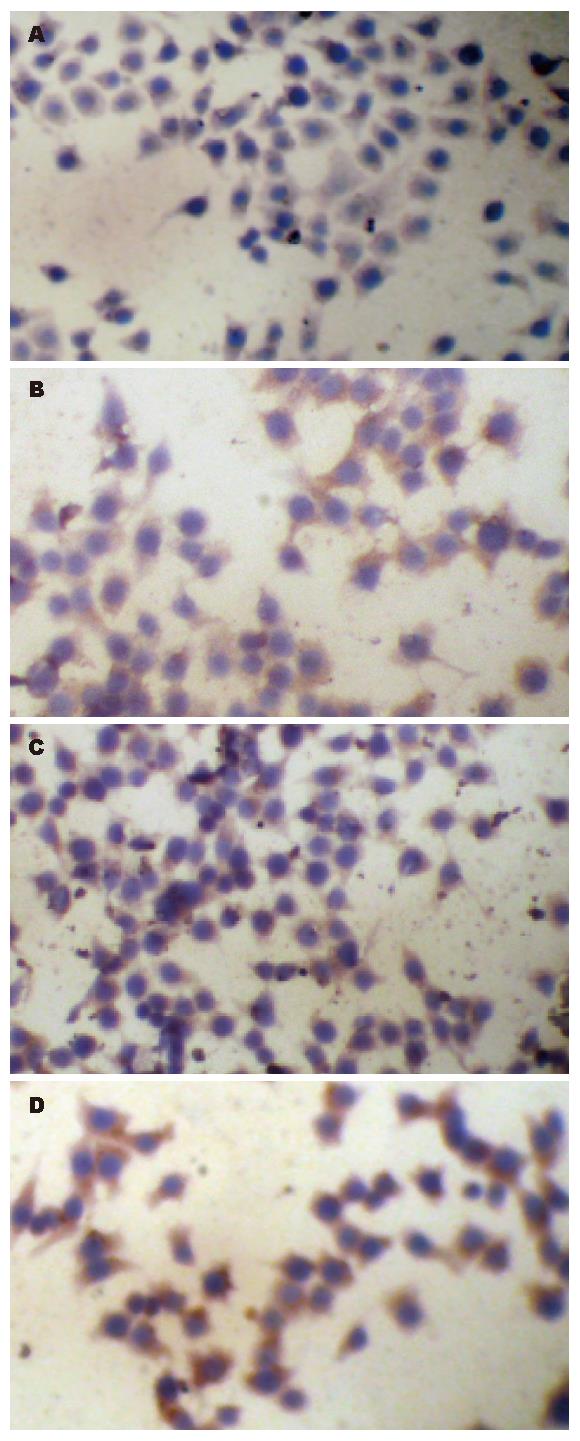
1.2.3 免疫细胞化学检测细胞Bcl-2蛋白的表达: 用底部有小玻片的6孔板接种细胞, 使细胞悬液终浓度为1.0×108/L, 每孔2 mL细胞悬液, 置孵育箱中培养. 感染复数和感染时间同前. 取出小玻片后固定, 然后以3% H2O2消除内源性过氧化物酶的活性, 以微波进行抗原修复, 滴加正常山羊血清工作液后加入一抗(1:100), 4 ℃过夜后分别滴生物素标记的二抗工作液和辣根酶标记链酶卵白素工作液, 最后以DAB显色、苏木素复染. PBS替代一抗作阴性对照.
1.2.4 判断标准: 胞质和/或胞膜见黄色或棕黄色颗粒为阳性. 然后采用计算机图像分析软件Image-Proplus 4.5对阳性表达进行原位定量检测, 每张玻片随机选取5个视野, 自动选取阳性部位并计算平均吸光度值(A), 计算5个视野的平均值作为该片的代表值.
统计学处理 实验结果中计量资料以mean±SD表示, 均数间比较采用t检验. 所有数据均采用SAS8.2统计软件进行分析, P<0.05表示有显著性差异.
血浆饥饿诱导的细胞凋亡率(%)在Ad-VEGF165组和对照组的比较(4.60±0.31 vs 7.73±0.86)以及在Ad-VEGF165组和Ad-GFP组的比较(4.60±0.31 vs 8.37±1.06)均有显著性差异(P<0.01), 而对照组与Ad-GFP组相比, 两组细胞凋亡率的差异无统计学意义, 提示VEGF165具有抑制血浆饥饿所诱导BGC-823细胞凋亡的作用, 而GFP对 BGC-823细胞的凋亡没有影响.
对照组与Ad-GFP组相比(0.363±0.12 vs 0.356±0.08), 两组细胞中Bcl-2 mRNA表达的差异无统计学意义, 而对照组与Ad-VEGF165组相比(0.363±0.12 vs 0.761±0.05)以及Ad-GFP组与Ad-VEGF165组相比(0.356±0.08 vs 0.761±0.05), 有显著性差异(P<0.01), 提示VEGF165转染入体外培养的BGC-823细胞后促进了该细胞Bcl-2 mRNA的表达, 而GFP对BGC-823细胞Bcl-2 mRNA的表达没有影响(图1).
阴性对照无阳性染色. 细胞质和细胞膜染成棕黄色的细胞为Bcl-2阳性细胞(图2). 在对照组和Ad-GFP组中, 可见大部分细胞的胞质、胞膜上有阳性着色, 但染色强度中等, 此两组间A值比较(0.865±0.07 vs 0.901±0.05), 差异无统计学意义. Ad-VEGF165组中阳性细胞接近100%, 染色强度强, 其A值为1.010±0.08, 与前两组比较有统计学意义(P<0.05), 说明Ad-VEGF165转染BGC-823细胞后上调了该细胞的Bcl-2蛋白的表达.
VEGF促进肿瘤生长和转移的作用已得到公认, 但以往认为这一作用是通过VEGF与血管内皮细胞上的受体结合, 促进血管的增殖、增加其通透性以及抑制内皮细胞凋亡而实现的[3]. 有实验显示内皮细胞中高表达的VEGF可诱导和促进Bcl-2和survivin等凋亡抑制基因的高表达, 从而抑制了内皮细胞的凋亡[4-6]. 而近年来在有些肿瘤细胞如肺癌[7]、前列腺癌[8]、膀胱癌[9]、乳腺癌[10]及结肠癌[11]等细胞上发现有其受体的表达, 并证实VEGF可通过这些受体发挥生物学效应. Krause et al[12]将VEGF反义寡核苷酸VEGF857转染至体外培养的移行细胞癌的癌细胞中, 结果降低了细胞增殖活性, 促进了凋亡, 这一功能是抑制了VEGF的表达所致, 也说明VEGF对肿瘤细胞有直接的作用. 但也有实验显示将反义VEGF-RNA转染体外培养的肝癌细胞对细胞的增殖和凋亡没有影响, 而在裸鼠体内则抑制了肿瘤的生长及促进了细胞的凋亡[13]. 我们在前期实验中已将腺病毒重组体Ad-VEGF165进行扩增、纯化后转染胃癌细胞株BGC-823, 并证实其对胃癌细胞的促增殖作用. 而目前已知, 肿瘤的发生除与细胞无限增殖有关外, 还与细胞凋亡减少有关, 细胞凋亡能力的下降是肿瘤具有无限生长能力的另一重要原因. 我们以适当的感染复数转染BGC-823细胞, 并利用血浆饥饿方法诱导细胞凋亡, 然后应用流式细胞仪检测凋亡细胞百分率的变化情况. 结果显示Ad-VEGF165组细胞的凋亡率明显低于Ad-GFP组及对照组, 而后两组之间比较无统计学意义, 说明VEGF165能够抑制血浆饥饿所诱导的BGC-823细胞的凋亡.
为了进一步研究VEGF165抑制凋亡的机制, 我们也检测了基因转染后Bcl-2表达的变化情况. Bcl-2基因家族是对细胞凋亡起调控作用的主要因子, Bcl-2是家族中最主要的成员, 一直被认为是细胞凋亡重要的抑制基因[14]. 在凋亡信号转导的过程中, 通常认为Bcl-2的作用在Caspase-3的上游, 通过抑制Caspase-3的激活而发挥作用[15]. Xu et al[16]检测了慢性活动性胃炎、胃溃疡、中度不典型增生、重度不典型增生、早期胃癌及进展期胃癌患者的细胞凋亡指数及Bcl-2蛋白的表达情况, 结果显示当胃黏膜发生不典型增生时Bcl-2的表达就明显增加, 在胃癌早期阶段达到高峰, 而在进展期该蛋白表达又有下降, 因而认为Bcl-2在胃癌的发生及早期的发展过程中发挥了重要作用. 我们的研究证实, Ad-VEGF165转染BGC-823细胞后可上调Bcl-2 mRNA和Bcl-2蛋白的表达, 因而认为VEGF165可通过上调Bcl-2的表达而抑制胃癌细胞的凋亡.
血管内皮细胞生长因子(VEGF)在肿瘤的发生、发展中扮演着重要的角色, 以往的研究主要是集中在其对肿瘤血管生成上, 随着研究的深入, 人们发现在多种肿瘤细胞上都有VEGF受体的表达, 推测VEGF在促进肿瘤血管生成的同时, 还可能直接作用于肿瘤细胞, 从而促进肿瘤的生长和抑制凋亡.
冯志杰, 教授, 河北医科大学第二医院; 胡和平, 教授, 第二军医大学附属东方肝胆医院消化科.
本文以复制缺陷性腺病毒作为载体构建Ad-VEGF, 体外转染人胃癌细胞株BGC-823, 研究其对BGC-823凋亡的影响以及可能的机制, 这对于未来肿瘤的治疗可能是一个新的研究方向.
VEGF165通过上调凋亡抑制基因Bcl-2及其蛋白的表达, 来抑制血浆饥饿诱导的胃癌细胞的凋亡, 为未来肿瘤治疗提供了一个新的研究方向.
本研究设计合理, 方法先进, 具有一定的科学性.
编辑: 李军亮 电编: 何基才
| 1. | Byrne AM, Bouchier-Hayes DJ, Harmey JH. Angiogenic and cell survival functions of vascular endothelial growth factor (VEGF). J Cell Mol Med. 2005;9:777-794. [PubMed] [DOI] |
| 2. | 周 磊, 张 馥敏, 杨 志健, 陆 丽, 丁 兆丰, 丁 必森, 哈 团柱, 李 传富, 高 翔, 马 文珠. 人血管生成素-1和血管内皮生长因子165基因克隆及复制缺陷型腺病毒载体构建. 中华心血管病杂志. 2003;31:699. |
| 3. | Carmeliet P, Jain RK. Angiogenesis in cancer and other diseases. Nature. 2000;407:249-257. [PubMed] [DOI] |
| 4. | Pidgeon GP, Barr MP, Harmey JH, Foley DA, Bouchier-Hayes DJ. Vascular endothelial growth factor (VEGF) upregulates BCL-2 and inhibits apoptosis in human and murine mammary adenocarcinoma cells. Br J Cancer. 2001;85:273-278. [PubMed] [DOI] |
| 5. | Katoh O, Takahashi T, Oguri T, Kuramoto K, Mihara K, Kobayashi M, Hirata S, Watanabe H. Vascular endothelial growth factor inhibits apoptotic death in hematopoietic cells after exposure to chemotherapeutic drugs by inducing MCL1 acting as an antiapoptotic factor. Cancer Res. 1998;58:5565-5569. [PubMed] |
| 7. | Zhang G, Zhao M, Xu M, Yang Y, Wang M, Yang C. [Correlation of angiogenesis with expression of vascular endothelial growth factor and its receptors in lung carcinoma]. Zhonghua Jie He He Hu Xi Za Zhi. 2002;25:89-93. [PubMed] |
| 8. | Jackson MW, Roberts JS, Heckford SE, Ricciardelli C, Stahl J, Choong C, Horsfall DJ, Tilley WD. A potential autocrine role for vascular endothelial growth factor in prostate cancer. Cancer Res. 2002;62:854-859. [PubMed] |
| 9. | Wu W, Shu X, Hovsepyan H, Mosteller RD, Broek D. VEGF receptor expression and signaling in human bladder tumors. Oncogene. 2003;22:3361-3370. [PubMed] [DOI] |
| 10. | Millanta F, Silvestri G, Vaselli C, Citi S, Pisani G, Lorenzi D, Poli A. The role of vascular endothelial growth factor and its receptor Flk-1/KDR in promoting tumour angiogenesis in feline and canine mammary carcinomas: a preliminary study of autocrine and paracrine loops. Res Vet Sci. 2006;81:350-357. [PubMed] [DOI] |
| 11. | Stewart M, Turley H, Cook N, Pezzella F, Pillai G, Ogilvie D, Cartlidge S, Paterson D, Copley C, Kendrew J. The angiogenic receptor KDR is widely distributed in human tissues and tumours and relocates intracellularly on phosphorylation. An immunohistochemical study. Histopathology. 2003;43:33-39. [PubMed] [DOI] |
| 12. | Krause S, Förster Y, Kraemer K, Fuessel S, Kotzsch M, Schmidt U, Wirth MP, Meye A, Schwenzer B. Vascular endothelial growth factor antisense pretreatment of bladder cancer cells significantly enhances the cytotoxicity of mitomycin C, gemcitabine and Cisplatin. J Urol. 2005;174:328-331. [PubMed] [DOI] |
| 13. | Hao JH, Yu M, Li HK, Shi YR, Li Q, Hao XS. Inhibitory effect of antisense vascular endothelial growth factor RNA on the profile of hepatocellular carcinoma cell line in vitro and in vivo. World J Gastroenterol. 2006;12:1140-1143. [PubMed] [DOI] |
| 14. | Rossé T, Olivier R, Monney L, Rager M, Conus S, Fellay I, Jansen B, Borner C. Bcl-2 prolongs cell survival after Bax-induced release of cytochrome c. Nature. 1998;391:496-499. [PubMed] [DOI] |
| 15. | Shi LG, Zhang GP, Jin HM. Inhibition of microvascular endothelial cell apoptosis by angiopoietin-1 and the involvement of cytochrome C. Chin Med J (Engl). 2006;119:725-730. [PubMed] |
| 16. | Xu AG, Li SG, Liu JH, Gan AH. Function of apoptosis and expression of the proteins Bcl-2, p53 and C-myc in the development of gastric cancer. World J Gastroenterol. 2001;7:403-406. [PubMed] [DOI] |