修回日期: 2008-09-11
接受日期: 2008-09-17
在线出版日期: 2008-10-18
目的: 观察庆大霉素联合碳酸氢钠片预防伊利替康(irinotecan)所致腹泻的疗效.
方法: 收集2006-07/2008-50我科98例接受含伊利替康方案化疗的晚期癌症患者病例资料, 比较腹泻及其他不良反应的差异, 其中预防组(A组, n = 52), 化疗前1 d开始口服碳酸氢钠和庆大霉素(碳酸氢钠片每次2 g, 每天3次; 庆大霉素每次8万U, 每天2次), 连用4 d; 对照组(B组, n = 46), 采用常规方法处理腹泻. 预防组与对照组在化疗期间均常规用托烷司琼等止吐, 于每周期化疗过程中及化疗后监测不良反应发生情况及程度.
结果: A组较B组显著提高了患者的大便pH值(t = 15.295, P<0.05), 腹泻发生率有显著降低(13.70% vs 34.83%, P<0.001), 且减少合并用药(洛哌丁胺: χ2 = 23.844, P<0.001; 思密达: χ2 = 25.054, P<0.001; 生长抑素: χ2 = 8.561, P = 0.003; 静脉补液: χ2 = 8.007; P = 0.005); 同时, 骨髓抑制、恶心呕吐、肝功能异常也有所降低(χ2 = 80.335, 60.339, 5.155, P<0.01或0.05), 而食欲减退、便秘、肾功能异常无明显差异.
结论: 口服庆大霉素联合碳酸氢钠片能有效预防伊立替康所致腹泻, 值得推广.
引文著录: 梅齐, 曹喆, 陈元. 庆大霉素联合碳酸氢钠片预防伊立替康所致腹泻52例. 世界华人消化杂志 2008; 16(29): 3354-3358
Revised: September 11, 2008
Accepted: September 17, 2008
Published online: October 18, 2008
AIM: To observe the therapeutic effects of gentamycin combined with sodium bicarbonate for irinotecan-induced diarrhea.
METHODS: A total of 98 patients with stage Ⅳ cancers were allotted into prevention group (n = 52 patients) and control group (n = 46 patients) from July 2006 to May 2008 in our hospital. All patients received the chemotherapy including irinotecan. The prevention group received gentamycin combined with sodium bicarbonate before the use of irinotecan for 4 d, while the control group received routine treatment. Tropisetron was conventionally used to prevent the vomiting in both groups. All adverse effects were evaluated using NCI-CTC standard.
RESULTS: The use of gentamycin combined with sodium bicarbonate resulted in significantly higher stool pH value (t = 15.295, P < 0.05), significantly reduced the incidence of irinotecan-induced diarrhea (13.70% vs 34.83%, P < 0.001) and medications (Loperamide: χ2 = 23.844, P < 0.001; Smecta: χ2 = 25.054, P < 0.001; Somafostatin: χ2 = 8.561, P = 0.003; Fluid replacement: χ2 = 8.007; P = 0.005). At the same time, bone marrow suppression, nausea and vomiting and liver function were also improved in the prevention group (χ2 = 80.335, 60.339, 5.155, P <0.01 or 0.05). However, there were no significant differences in appetite, constipation, renal function between the two groups.
CONCLUSION: Gentamycin combined with sodium bicarbonate proves to be useful for preventing the diarrhea induced by irinotecan and is recommended for wide use.
- Citation: Mei Q, Cao Z, Chen Y. Gentamycin combined with sodium bicarbonate for prevention of irinotecan-induced diarrhea: An analysis of 52 cases. Shijie Huaren Xiaohua Zazhi 2008; 16(29): 3354-3358
- URL: https://www.wjgnet.com/1009-3079/full/v16/i29/3354.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i29.3354
伊利替康(irinotecan, CPT-11, 开普拓)是半合成喜树碱衍生物, 能特异性抑制DNA拓补异构酶Ⅰ, 1998年获得FDA批准, 用于转移性结直肠癌的治疗[1]. 目前, 伊利替康联合5-FU/LV为晚期结直肠癌的一线标准方案, 并且与其他药物联合治疗肺癌、食管癌、胃癌等, 应用较为广泛[2]. 但是迟发性腹泻是伊利替康最常见的剂量限制性毒性之一, 有报道本品每周给药引起3-4度腹泻发生率高达44.4%, 严重者可致患者死亡. 国外有学者指出口服抗生素及碳酸氢盐可减轻伊利替康所致腹泻[3-4], 但国内少有这方面的研究及报道. 我科自2006年以来便尝试应用庆大霉素联合碳酸氢钠片预防伊立替康所致腹泻, 目前已取得了较好的临床反响. 本文收集我科2006-07/2008-05 98例接受含伊利替康方案化疗的晚期癌症患者病例资料, 比较腹泻等不良反应的差异.
收集2006-07/2008-05 98例我科住院病例符合以下条件者: (1)组织学或细胞学诊断为肺癌、食管癌或结直肠癌; (2)根据International Union Against Cancer Classification (UICC)分期为Ⅳ期, 不能手术者; (3)年龄≤75岁; (4)ECOG评分≤2; (5)骨髓造血功能: WBC>0.004/L, PLT>0.1/L, Hb>9×10-6 g/L; 肝功能: 胆红素<15 mg/L, 转氨酶<正常上限值的两倍; 肾功能: 肌酐<15 mg/L; (6)预期生存时间至少2 mo; (7)化疗方案中含有伊利替康; (8)患者同意签署知情同意书. 其中, A组52例患者, 共197个周期化疗; B组46例患者, 共178个周期化疗. 结肠癌49例, 直肠癌33例, 食管癌9例, 肺癌7例, 这些病例按1:1分配到A、B两个组; 男性60例, 女性38例(男女比1.58:1); 年龄在25-70(平均年龄45.4±9.2)岁.
1.2.1 治疗方案: 52例患者共计197周期化疗在使用伊利替康治疗前用庆大霉素联合碳酸氢钠片预防腹泻(A组), 46例患者共计178周期化疗不做预处理(B组). A组于化疗前1天开始po碳酸氢钠和庆大霉素(碳酸氢钠片每次2 g, 3次/d; 庆大霉素每次8×102 U, 2次/d), 连用4 d; B组不用碳酸氢钠和庆大霉素. 一旦出现首次稀便或大便次数增多, 患者开始饮用大量含电解质的饮料, 并给予高剂量洛哌丁胺(首次服药4 mg, 然后每2 h服药2 mg), 持续到最后1次稀便结束后12 h, 不超过48 h. 必要时, 使用思密达、生长抑素等其他药物, 以及静脉补充液体和电解质. 所有患者化疗前均常规给予5-HT3受体阻滞剂等预防呕吐, 伊利替康用药前1 h肌肉注射阿托品0.5 mg预防急性胆碱能综合征. 下次化疗前当WBC<0.003/L和/或腹泻分级超过Ⅰ度(NCI-CTC V3.0)则推迟伊利替康使用时间. 病情稳定或好转的患者至少维持两周期原方案治疗, 病情明显进展者更换化疗方案. 如果化疗延迟超过6 wk则退出观察.
1.2.2 测定大便pH值: 收集患者使用伊利替康后第1-5天自然排泄的大便. 每个大便标本取5 mL加入25 mL蒸馏水混匀, 在20℃下静置30 min以上. 溶液重新悬浮后, 用pH计(上海精密仪器仪表有限公司生产的PHS-3C, 精度为0.01)测定pH值.
1.2.3 不良反应评价标准: 按NCI-CTC, Version 3.0评价所有发生的不良反应.
统计学处理 使用SPSS13.0软件包, 计数资料显著性检验采用卡方检验, 计量资料显著性检验采用t检验, P<0.05表示有统计学意义.
A组的总腹泻发生率、1-2级腹泻发生率及3-4级腹泻发生率均显著低于对照组(表1). 结果表明口服庆大霉素和碳酸氢钠能减少腹泻发生率, 并且能降低腹泻的严重程度.
| 腹泻分级 | A组 | B组 | χ2 | P | ||||
| 发生腹泻周期数 | 总周期数 | 腹泻发生率(%) | 发生腹泻周期数 | 总周期数 | 腹泻发生率(%) | |||
| 1-2级 | 15 | 197 | 7.61 | 38 | 178 | 21.35 | 14.534 | <0.001 |
| 3-4级 | 12 | 197 | 6.09 | 24 | 178 | 13.48 | 5.887 | 0.015 |
| 合计 | 27 | 197 | 13.70 | 62 | 178 | 34.83 | 23.056 | <0.001 |
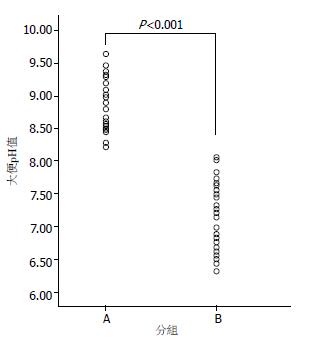
比较两组患者使用伊利替康第1-5天自然排泄的大便样本pH, A组40个大便样本来自15个患者, B组38个大便标本来自14个患者. A组大便pH值范围是8.21-9.64, 平均值为8.77±0.44, B组大便pH值范围是6.32-8.05, 平均值为7.21±0.46. 成组t检验显示t = 15.295, P<0.05, 说明两组pH值有显著性差异, 结果表明口服庆大霉素和碳酸氢钠片能有效提高肠腔pH值(图1).
在整个观察周期中, A组和B组在洛哌丁胺化疗周期数、思密达周期数、生长抑素周期数及需要静脉补液周期数存在显著性差异(P<0.05, 表2). 结果表明, 口服庆大霉素和碳酸氢钠片能减少以上辅助性药物在观察期间的使用次数及总量.
| 合并用药 | A组 | B组 | χ2 | P | ||||
| 使用周期数 | 总周期数 | 用药比例(%) | 使用周期数 | 总周期数 | 用药比例(%) | |||
| 洛哌丁胺 | 24 | 197 | 12.18 | 59 | 178 | 33.15 | 23.844 | <0.001 |
| 思密达 | 15 | 197 | 7.61 | 48 | 178 | 26.97 | 25.054 | <0.001 |
| 生长抑素 | 11 | 197 | 5.58 | 26 | 178 | 14.60 | 8.561 | 0.003 |
| 静脉补液 | 13 | 197 | 6.60 | 28 | 178 | 15.73 | 8.007 | 0.005 |
治疗期间还监测了患者血液毒性、肝肾功能以及恶心呕吐等不良反应发生情况. 研究发现, 其他主要不良反应依次是食欲减退, 骨髓抑制, 恶心呕吐等. 结果表明, 口服庆大霉素和碳酸氢钠片能减轻骨髓抑制、恶心呕吐等其他不良反应(表3).
| 不良反应 | A组 | B组 | χ2 | P | ||||
| 发生周期数 | 总周期数 | 发生率(%) | 发生周期数 | 总周期数 | 发生率(%) | |||
| 骨髓抑制 | 64 | 197 | 32.74 | 140 | 178 | 78.65 | 80.335 | <0.001 |
| 食欲减退 | 120 | 197 | 60.91 | 113 | 178 | 63.48 | 0.262 | 0.608 |
| 恶心呕吐 | 56 | 197 | 28.43 | 122 | 178 | 68.54 | 60.339 | <0.001 |
| 肝功能异常 | 12 | 197 | 6.09 | 23 | 178 | 12.92 | 5.155 | 0.023 |
| 肾功能异常 | 2 | 197 | 1.02 | 1 | 178 | 0.56 | 0.242 | 0.623 |
| 便秘 | 30 | 197 | 15.23 | 27 | 178 | 15.17 | 2.6018 | 0.987 |
伊立替康是一种半合成可溶性喜树碱衍生物, 是拓扑异构酶Ⅰ的特异性抑制剂. 伊立替康在大多数组织中经羧酸酯酶的作用产生活性代谢产物7-乙基-10羟基-喜树碱(SN-38), 两者与拓补异构酶I-DNA复合物结合, 阻止DNA链重组, 引起DNA双链断裂, 造成细胞死亡, 为细胞周期特异性药物, 主要作用于S期[5-6].
CPT-11引起的腹泻包括早期腹泻和迟发性腹泻, 早期腹泻多在用药后24 h内出现, 为乙酰胆碱综合征表现之一, 给予阿托品可缓解; 迟发性腹泻, 为剂量限制性毒性, 在用药24 h后出现[7]. 临床试验证明, 在所有使用伊立替康的患者中, 单药治疗3 wk方案中发生迟发性腹泻的中位时间为滴注伊立替康后第5天[8]. 在联合治疗每周方案中通常出现第1次稀便的中位时间为滴注伊立替康后第11天[9]. 在Saltz et al[10]的研究中, 伊立替康联合5-FU/LV治疗转移性结直肠癌患者, 迟发性腹泻发生率为85%(1-4级), 其中3级为15%, 4级为8%. 在Douillard et al[11]的研究中, 伊立替康联合5-FU/LV治疗转移性结直肠癌患者中迟发性腹泻发生率为72%(1-4级), 其中3级为10%, 4级为4%.
CPT-11活性物质SN-38在肠道内的浓度及其与肠道上皮接触的时间是导致延迟性腹泻的关键[12]. SN-38引起肠上皮细胞坏死、凋亡, 导致小肠吸收水、电解质障碍及小肠液过度分泌. SN-38还引起肠上皮细胞释放血栓素A2(TXA2), 加上CPT-11治疗后肠道上皮细胞的环氧化酶(COX-2)表达增加, 前列腺素E2(PGE2)水平增高. 而TXA2、PGE2能诱导肠上皮细胞氯离子分泌增加, 钠离子吸收下降, 造成腹泻. 肠道菌群在CPT-11所致延迟性腹泻的发生过程中起到重要作用[13]. 肠道细菌的β-葡萄糖醛酸酶可将SN-38-G重新转变成SN-38, 而SN-38对肠道黏膜产生直接损害, 从而造成腹泻. 另一方面, 给药后胆汁中CPT-11的浓度很高. CPT-11通过胆汁分泌进入十二指肠, 然后通过肠道排泄, 而小肠中的羧酸酯酶(CE)活性很高, 可直接将排入肠道的CPT-11原型转变成SN-38, 造成腹泻.
国外有研究报道, 口服抗菌素能抑制肠道细菌生长, 减少细菌所产生的β-葡萄糖醛酸酶, 使肠腔内的SN-38G不能转化为SN-38, 从而减少对肠上皮细胞的损伤[14-15]. 临床已有用抗生素疗法用于本品引起的腹泻. 有报道结直肠癌患者口服新霉素以降低肠道β-葡萄糖醛酸酶活性, 取得较好效果[16]. 给予碳酸氢盐升高肠道pH值, 可降低肠道内SN-38内酯型浓度, 减轻药物引起的细胞损伤和腹泻. 如使用碳酸氢钠提高肠腔pH值, 碱性环境下SN-38转变为羧酸盐形式, 其活性较低[17]. 同时, 药代动力学研究显示口服碱性液体不降低SN-38的血药浓度或曲线下面积(AUC).
国内有关于预防伊立替康所致腹泻的报道较为有限, 经验较少. 参考国外资料, 综合考虑: 新霉素毒性大, 主要不良反应为胃肠道反应, 有食欲不振、恶心及大便次数增多等, 并且在国内多数医院已经没有口服制剂供应; 而庆大霉素胃肠道毒性小, 小剂量口服产生的肾毒性、耳毒性及神经毒性也较小, 并且临床已有用庆大霉素治疗腹泻的经验. 所以我科采用庆大霉素联合碳酸氢钠片预防伊立替康所致腹泻. 在病例资料分析中我们观察到, 预防组腹泻发生率显著低于对照组(P<0.001), 而大便pH值明显高于对照组(P<0.05), 不但减少了化疗期间患者的合并用药次数, 而且其他不良反应发生率也有所降低.
总之, 庆大霉素联合碳酸氢钠预防伊利替康所致腹泻有较好疗效, 与传统方法相比减少了腹泻发生率, 提高了患者对伊利替康化疗的耐受性, 效价合理, 给药方便, 经济适用, 可以考虑作为预防伊利替康化疗所致迟发性腹泻的常规治疗方法, 值得推广.
伊利替康是半合成喜树碱衍生物, 用于转移性结直肠癌的治疗, 并且与其他药物联合治疗肺癌、食管癌、胃癌等, 应用较为广泛. 但是迟发性腹泻是伊利替康最常见的剂量限制性毒性之一, 严重者可致患者死亡. 国外有学者指出po抗生素及碳酸氢盐可减轻伊利替康所致腹泻, 但国内少有这方面的研究及报道.
陈耀凯, 副教授, 中国人民解放军第三军医大学西南医院全军感染病研究所; 张绪清, 副教授, 中国人民解放军第三军医大学附属西南医院全军感染病研究所
CPT-11引起的腹泻包括早期腹泻和迟发性腹泻, 早期腹泻多在用药后24 h内出现; 迟发性腹泻, 为剂量限制性毒性, 在用药24 h后出现. 国外有报道伊立替康联合5-FU/LV治疗转移性结直肠癌患者, 迟发性腹泻发生率为85%(1-4级), 其中3级为15%, 4级为8%, 严重者可致患者死亡.
本文采用庆大霉素联合碳酸氢钠片预防伊立替康所致腹泻, 在病例资料分析中观察到, 预防组腹泻发生率显著低于对照组, 其他不良反应发生率也有所降低.
庆大霉素联合碳酸氢钠预防伊利替康所致腹泻有较好疗效, 与传统方法相比减少了腹泻发生率, 提高了患者对伊利替康化疗的耐受性, 效价合理, 给药方便, 经济适用, 可以考虑作为预防伊利替康化疗所致迟发性腹泻的常规治疗方法, 值得推广.
本研究设计较为合理, 临床资料较完整, 研究结论对临床有参考价值.
编辑: 李军亮 电编:何基才
| 1. | Sabharwal A, Kerr D. Chemotherapy for colorectal cancer in the metastatic and adjuvant setting: past, present and future. Expert Rev Anticancer Ther. 2007;7:477-487. [PubMed] [DOI] |
| 3. | Tsavaris N, Kosmas C, Skopelitis H, Papadoniou N, Polyzos A, Zografos G, Adoniou E, Gryniatsos J, Felekouras E, Zacharakis M. Sequential administration of 5-fluorouracil (5FU)/leucovorin (LV) followed by irinotecan (CPT-11) at relapse versus CPT-11 followed by 5-FU/LV in advanced colorectal carcinoma. A phase III randomized study. Chemotherapy. 2007;53:282-291. [PubMed] [DOI] |
| 4. | Takasuna K, Hagiwara T, Watanabe K, Onose S, Yoshida S, Kumazawa E, Nagai E, Kamataki T. Optimal antidiarrhea treatment for antitumor agent irinotecan hydrochloride (CPT-11)-induced delayed diarrhea. Cancer Chemother Pharmacol. 2006;58:494-503. [PubMed] [DOI] |
| 5. | Hahn KK, Wolff JJ, Kolesar JM. Pharmacogenetics and irinotecan therapy. Am J Health Syst Pharm. 2006;63:2211-2217. [PubMed] [DOI] |
| 6. | Lagadec P, Griessinger E, Nawrot MP, Fenouille N, Colosetti P, Imbert V, Mari M, Hofman P, Czerucka D, Rousseau D. Pharmacological targeting of NF-kappaB potentiates the effect of the topoisomerase inhibitor CPT-11 on colon cancer cells. Br J Cancer. 2008;98:335-344. [PubMed] [DOI] |
| 7. | Kweekel D, Guchelaar HJ, Gelderblom H. Clinical and pharmacogenetic factors associated with irinotecan toxicity. Cancer Treat Rev. 2008; Jun 14. [Epub ahead of print]. [PubMed] |
| 8. | Maeda Y, Ohune T, Nakamura M, Yamasaki M, Kiribayashi Y, Murakami T. Prevention of irinotecan-induced diarrhoea by oral carbonaceous adsorbent (Kremezin) in cancer patients. Oncol Rep. 2004;12:581-585. [PubMed] |
| 9. | Yang X, Hu Z, Chan SY, Chan E, Goh BC, Duan W, Zhou S. Novel agents that potentially inhibit irinotecan-induced diarrhea. Curr Med Chem. 2005;12:1343-1358. [PubMed] [DOI] |
| 10. | Saltz LB. Understanding and managing chemotherapy-induced diarrhea. J Support Oncol. 2003;1:35-46; discussion 38-41, 45-46. [PubMed] |
| 11. | Douillard JY, Sobrero A, Carnaghi C, Comella P, Díaz-Rubio E, Santoro A, Van Cutsem E. Metastatic colorectal cancer: integrating irinotecan into combination and sequential chemotherapy. Ann Oncol. 2003;14 Suppl 2:ii7-ii12. [PubMed] [DOI] |
| 12. | Ikegami T, Ha L, Arimori K, Latham P, Kobayashi K, Ceryak S, Matsuzaki Y, Bouscarel B. Intestinal alkalization as a possible preventive mechanism in irinotecan (CPT-11)-induced diarrhea. Cancer Res. 2002;62:179-187. [PubMed] |
| 13. | de Jong FA, Kehrer DF, Mathijssen RH, Creemers GJ, de Bruijn P, van Schaik RH, Planting AS, van der Gaast A, Eskens FA, Janssen JT. Prophylaxis of irinotecan-induced diarrhea with neomycin and potential role for UGT1A1*28 genotype screening: a double-blind, randomized, placebo-controlled study. Oncologist. 2006;11:944-954. [PubMed] [DOI] |
| 14. | Schmittel A, Jahnke K, Thiel E, Keilholz U. Neomycin as secondary prophylaxis for irinotecan-induced diarrhea. Ann Oncol. 2004;15:1296. [PubMed] [DOI] |
| 15. | Alimonti A, Satta F, Pavese I, Burattini E, Zoffoli V, Vecchione A. Prevention of irinotecan plus 5-fluorouracil/leucovorin-induced diarrhoea by oral administration of neomycin plus bacitracin in first-line treatment of advanced colorectal cancer. Ann Oncol. 2003;14:805-806. [PubMed] [DOI] |
| 16. | Kehrer DF, Sparreboom A, Verweij J, de Bruijn P, Nierop CA, van de Schraaf J, Ruijgrok EJ, de Jonge MJ. Modulation of irinotecan-induced diarrhea by cotreatment with neomycin in cancer patients. Clin Cancer Res. 2001;7:1136-1141. [PubMed] |
| 17. | Takeda Y, Kobayashi K, Akiyama Y, Soma T, Handa S, Kudoh S, Kudo K. Prevention of irinotecan (CPT-11)-induced diarrhea by oral alkalization combined with control of defecation in cancer patients. Int J Cancer. 2001;92:269-275. [PubMed] [DOI] |