修回日期: 2008-09-06
接受日期: 2008-09-08
在线出版日期: 2008-10-18
目的: 探讨并比较自身免疫性肝炎(AIH)、原发性胆汁性肝硬化(PBC)及其重叠综合征(AIH-PBC OS)的临床、生化、影象学以及组织学特征.
方法: 收集在我院自身免疫性肝病住院患者28例, 其中I型AIH 13例、PBC 6例和AIH-PBC OS 9例, 回顾性分析患者临床资料.
结果: AIH-PBC OS患者血清谷草转氨酶(AST)和γ-球蛋白(GLO)水平(分别为和)均明显高于AIH和PBC患者(132.67±35.05 vs 81.15±39.26, 55.17±24.38; 44.33±8.92 vs 34.23±9.89, 33.17±6.79, 均P<0.05), 而碱性磷酸酶(ALP)和γ-谷氨酰转肽酶(GGT)水平明显高于AIH患者(218.11±107.79 vs 106.85±91.57; 280.33±133.51 vs 82.07±36.67, 均P<0.05), 低于PBC患者(245.83±88.60, 315.67±160.01, 均P<0.05). AIH-PBC OS和PBC患者的IgM水平均明显高于AIH患者(793.00±528.57 vs 127.33±30.14; 538.50±349.43 vs 127.33±30.14, 均P<0.05), 而AIH-PBC OS患者的IgG水平明显高于PBC患者(2036.00±457.03 vs 1121.25±313.8, P<0.05). AIH-PBC OS患者界面性肝炎和破坏性胆管炎的发生率分别为88.9%和66.7%. 腹部BUS提示三者常伴有脾大和腹腔淋巴结肿大.
结论: AIH和PBC是典型的分别选择性损伤肝细胞及肝内小胆管的自身免疫性肝病, AIH-PBC OS同时具有AIH和PBC的临床病理学特征, 与PBC相比, AIH-PBC OS更倾向于AIH.
引文著录: 张会爱, 王邦茂, 章明放, 常毅湘, 弓艳霞. 自身免疫性肝病临床病理特征分析28例. 世界华人消化杂志 2008; 16(29): 3338-3342
Revised: September 6, 2008
Accepted: September 8, 2008
Published online: October 18, 2008
AIM: To investigate and compare the clinical, biological, imaging and histological features of patients with autoimmune hepatitis (AIH), primary biliary cirrhosis (PBC) or AIH-PBC overlap syndrome (AIH-PBC OS).
METHODS: The clinical data and liver biopsy specimens from 13 patients with type I AIH, 6 patients with PBC and 9 patients with AIH-PBC OS in General Hospital of Tianjin Medical University were retrospectively analyzed.
RESULTS: Patients with AIH-PBC OS had markedly higher serum aspartate aminotransferase (AST) and γ globulin (GLO) levels than patients with AIH or PBC (132.67 ± 35.05 vs 81.15 ± 39.26, 55.17 ± 24.38; 44.33 ± 8.92 vs 34.23 ± 9.89, 33.17 ± 6.79, all P < 0.05); serum alkalinephosphatase (ALP) and gamma-glutamyl-transpeptidase (GGT) levels were significantly higher in patients with AIH-PBC OS than with AIH (218.11 ± 107.79 vs 106.85 ± 91.57; 280.33 ± 133.51 vs 82.07 ± 36.67, both P < 0.05), but lower than that in patients with PBC (245.83 ± 88.60, 315.67 ± 160.01, both P < 0.05). IgM levels in patients with PBC or AIH-PBC OS were significantly higher than in patients with AIH (793.00 ± 528.57 vs 127.33 ± 30.14; 538.50 ± 349.43vs 127.33 ± 30.14, both P < 0.05) while patients with AIH-PBC OS had significantly higher IgG levels than patients with PBC (2036.00 ± 457.03 vs 1121.25 ± 313.8, P < 0.05). Histological analysis showed interface hepatitis in 88.9% and destructive cholangitis in 66.7% of AIH-PBC OS patients. Abdominal ultrasound showed that they were all often associated with hypersplenotrophy and celiac lymphadenectasis.
CONCLUSION: AIH and PBC are representative autoimmune liver diseases in which hepatocytes and intrahepatic bile ducts, respectively, are selectively damaged by autoimmune mechanisms. AIH-PBC OS with clinicopathological features of both AIH and PBC shows closer clinically and histologically features to AIH than to PBC.
- Citation: Zhang HA, Wang BM, Zhang MF, Chang YX, Gong YX. Clinicopathological features of autoimmune hepatic diseases: an analysis of 28 cases. Shijie Huaren Xiaohua Zazhi 2008; 16(29): 3338-3342
- URL: https://www.wjgnet.com/1009-3079/full/v16/i29/3338.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i29.3338
自身免疫性肝病包括自身免疫性肝炎(autoimmune hepatitis, AIH), 原发性胆汁性肝硬化(primary biliary cirrhosis, PBC), 原发性硬化性胆管炎(primary sclerosing cholangitis, PSC)及重叠综合征(overlapsynodrome, OS), PSC发病率低. 本文主要探讨AIH、PBC及AIH-PBC OS的临床、生化指标、病理学特征等, 着重研究其病理学特征.
收集在我院自身免疫性肝病住院患者28例, 其中I型AIH13例, PBC6例和AIH-PBC OS 9例, 参照1999年国际AIH小组(IAIHG)修正的AIH临床评分标准[1], 以及2000年美国肝病学会(AASLD)关于PBC的临床指导建议[2], 并依据Chazouillerse et al[3]提出AIH-PBC OS应至少有两项标准分别符合AIH和PBC的诊断标准予以诊断.
采集患者以下临床资料: (1)临床特征: 患者性别、年龄、临床症状、合并疾病. (2)生化指标: 包括总蛋白(TP)、白蛋白(ALB)、球蛋白(GLO)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TB)、直接胆红素(DB)、碱性磷酸酶(ALP)、γ-谷氨酰转肽酶(γ-GT)、凝血酶原时间(PT)、肝炎病毒标志物、胆固醇(CH)、甘油三酯(TC). (3)免疫学指标: 包括抗核抗体(ANA)、抗平滑肌抗体(SMA)、抗肝肾微粒体1型抗体(LKM-1)、抗可溶性肝抗原/肝-胰抗原SLA-LP、抗线粒体抗体(AMA)、抗线粒体抗体-M2(AMA-M2)亚型等, 免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)等. (4)影象学检查主要为上腹部B超(BUS). (5)肝穿组织病理学.
统计学处理 计量资料以mean±SD描述, 采用SPSS11.5软件进行组间资料的单因素方差分析及SNK法进行两两比较, 并对分类变量资料进行χ2检验, P<0.05具有统计学意义.
自身免疫性肝病患者28例, 患者多以乏力、纳差、黄疸、腹胀、消化道出血、皮肤瘙痒、周围性水肿或查体发现肝功能异常等入院, 包括: I型AIH 13例, 其中女12例、男1例, 2例合并甲亢, 2例合并糖尿病, 1例合并原发性甲减、桥本甲状腺炎, 1例合并系统性硬化及干燥综合征; PBC 6例, 均为女性, 3例合并糖尿病, 1例合并类风湿性关节炎, 3例合并高脂血症; AIH-PBC OS患者9例, 其中女8例、男1例, 3例合并糖尿病, 1例合并甲亢, 3例合并高脂血症.
所有患者肝炎病毒标志物及DNA定量检查结果均提示目前无病毒感染, 血液生化、免疫学指标及统计学分析结果(表1-2). AIH-PBC OS患者AST和GLO水平明显高于AIH或PBC患者, ALP和GGT水平明显高于AIH患者, 而低于PBC患者. PBC患者的TBIL水平明显高于AIH患者. AIH-PBC OS和PBC患者的IgM水平明显高于AIH患者, 而AIH-PBC OS患者的IgG水平明显高于PBC患者, AIH/PBC OS患者的ANA滴度显著高于AIH和PBC患者, 上述结果均有统计学意义(P均<0.05).
| 项目 | AIH (n = 13) | PBC (n = 6) | AIH-PBC OS (n = 9) | P值 |
| TBIL(μmol/L) | 13.32±8.73 | 60.78±27.67a | 27.01±13.94 | 0.036 |
| ALP(U/L) | 106.85±91.57 | 245.83±88.60a | 218.11±107.79a | 0.009 |
| GGT(U/L) | 82.07±36.67 | 315.67±160.01a | 280.33±133.51a | 0.025 |
| ALT(U/L) | 64.54±48.00 | 62.05±32.07 | 111.00±52.14 | >0.05 |
| AST(U/L) | 81.15±39.26 | 55.17±24.38c | 132.67±35.05a | 0.025 |
| GLO(g/L) | 34.23±9.89 | 33.17±6.79c | 44.33±8.92a | 0.029 |
| PT(s) | 14.44±2.03 | 13.27±2.38 | 12.60±1.44 | >0.05 |
| IgM(g/L) | 127.33±30.14 | 538.50±349.43a | 793.00±528.57a | 0.026 |
| IgA(g/L) | 373.33±216.20 | 323.50±174.94 | 302.60±190.95 | >0.05 |
| IgG(g/L) | 1600.00±562.14 | 1121.25±313.80c | 2036.00±457.03 | 0.043 |
| ANA滴度 | AIH (n = 13) | PBC (n = 6) | AIH/PBC OS (n = 9) |
| 1:800 | 0 | 0 | 7/9(77.8) |
| 1:400 | 7/13(53.8) | 3/6(50) | 2/9(22.2) |
| 1:200 | 3/13(23.1) | 2/6(33.3) | 0 |
| 1:100 | 3/13(23.1) | 1/6(16.7) | 0 |
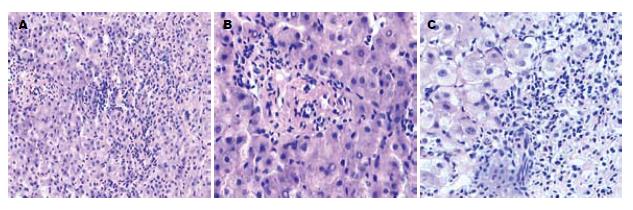
典型病理表现为界面性肝炎、淋巴细胞破坏性胆管炎和肝细胞花环样排列等(图1). AIH、PBC及AIH-PBC OS患者汇管区慢性炎细胞浸润发生率分别为92.31%、83.33%和100%, 界面性肝炎分别为69.2%、16.7%和88.9%, 花环样排列分别为38.5%、0和66.7%, 破坏性胆管炎分别为0、83.3%和66.7%, 小胆管增生分别为0、66.7%和44.4%(表3). AIH和AIH-PBC OS纤维化评分F3及其以上的分别为38.5%和44.5%, Scheuer分级显示PBC患者Grade1和Grade4的发生率分别为50%和66.7%. AIH-PBC OS患者Grade 1和Grade 4的发生率分别为100%和44.4%(表4).
| 病理改变 | AIH(n = 13) | PBC(n = 6) | AIH/PBC OS(n = 9) |
| 界面性肝炎 | 9/13(69.2) | 1/6(16.7) | 8/9(88.9) |
| 花环样排列 | 5/13(38.5) | 0 | 6/9(66.7) |
| 汇管区炎细胞浸润 | 12/13(92.31) | 5/6(83.33) | 9/9(100) |
| 破坏性胆管炎 | 0 | 5/6(83.3) | 6/9(66.7) |
| 小胆管增生 | 0 | 4/6(66.7) | 4/9(44.4) |
| 纤维化评分 | AIH(n = 13) | PBC(n = 6) | AIH/PBC OS(n = 9) |
| Fibrosis | |||
| F0 | 5/13(38.5) | - | 2/9(22.2) |
| F1 | 2/13(15.4) | - | 2/9(22.2) |
| F2 | 1/13(7.6) | - | 1/9(11.1) |
| F3 | 3/13(23.1) | - | 0 |
| F4 | 2/13(15.4) | - | 4/9(44.5) |
| Scheuer分级 | |||
| Grade1 | - | 3/6(50) | 9/9(100) |
| Grade2 | - | 2/6(33.3) | 2/9(22.2) |
| Grade3 | - | 2/6(33.3) | 5/9(55.6) |
| Grade4 | - | 4/6(66.7) | 4/9(44.4) |
OS脾大的发生率分别为61.5%、33.3%和22.2%, 胆囊结石的发生率分别为0、33.3%和22.2%, 三者均有1例出现腹腔淋巴结肿大.
AIH和PBC是两种不同的自身免疫性肝病[4-7], 他们都有自己特征性的临床、免疫以及组织学表现, 这两种特征可能同时或先后发生在同一个患者, 从而产生重叠综合征, 本研究进一步证实了三者的特征.
临床特征、血清生化及免疫学改变: (1)三者均以女性多见, 常合并多种其他自身免疫性疾病, 如系统性硬化、干燥综合症、甲亢、桥本甲状腺炎、类风湿性关节炎等. 三者临床表现无明显差别. (2)血清中出现一种或多种自身抗体, AIH、PBC和AIH-PBC OS均常出现ANA, 但AIH-PBC OS患者ANA滴度均明显高于AIH 或PBC患者, 表明AIH-PBC OS患者出现ANA, 且滴度较高,甚至高于AIH患者, PBC患者虽然也常出现ANA, 但滴度较低. (3)AIH患者血清ALT、AST升高为主, ALP、GGT正常或轻度升高, TBIL也可升高. 血清IgG浓度升高[8-9]. PBC患者主要为ALP和GGT明显升高, 而ALT和AST轻度升高, 血清IgM升高亦为其特点之一[10]. AIH和PBC血清生化特征分别提示肝细胞炎症和胆汁淤积改变. AIH-PBC OS患者AST和ALP同时升高, AMA、ANA和(或)SMA阳性, 血清IgG和IgM同时升高, 同时, AIH-PBC OS患者具有AIH和PBC的生化以及免疫学特征. 其AST和GLO水平明显高于AIH, ANA滴度也高于AIH, 而ALP和GGT水平却低于PBC患者, 表明与PBC相比, AIH-PBC OS更倾向于AIH[11-15].
组织学特征: (1)可发生界面性肝炎及肝细胞花环样排列, AIH、AIH-PBC OS较PBC常见. (2)可发生淋巴细胞破坏性胆管炎及胆管增生, AIH-PBC OS、PBC较AIH常见, 其中在PBC中最常见. (3)PBC偶可出现界面性肝炎. (4)AIH无1例出现胆管改变. (5)三者均有明显的汇管区炎细胞浸润, AIH主要为淋巴细胞、浆细胞浸润, AIH-PBC OS、PBC除了淋巴细胞外还常伴有大量嗜酸性粒细胞、嗜中性粒细胞浸润. (6)PBC及AIH-PBC OS Scheuer分级显示四级改变可同时出现在同一个患者中, 二者均伴有一定程度的纤维化. 但AIH-PBC OS患者Grade 1较PBC更常见, 表明AIH-PBC OS病变部位急性炎症反应更明显. 综上, AIH、AIH-PBC OS、PBC均有显著的汇管区炎症, 其中AIH的重要病理特征是界面性肝炎和肝细胞花环样排列; PBC的重要病理特征是淋巴细胞破坏性胆管炎和胆管增生; AIH-PBC OS则兼有AIH和PBC的病理特征, 其界面性肝炎和肝细胞花环样排列的发生率高于AIH, 淋巴细胞破坏性胆管炎和胆管增生的发生率却低于PBC, 组织学改变也表明, 与PBC相比, AIH-PBC OS更倾向于AIH.
影象学: 腹部BUS显示三者常伴有腹腔淋巴结肿大和脾大, 脾大常发生在肝硬化之前, 淋巴结和脾均属于免疫器官, 可能与免疫反应有关. AIH-PBC OS、PBC发生胆囊结石以及高脂血症较AIH常见, 这与两者胆管损伤造成的胆汁淤积有关.
总之, AIH和PBC是典型的分别选择性的损伤肝细胞及肝内小胆管的自身免疫性肝病, AIH-PBC OS同时具有AIH和PBC的临床病理学特征, 但更倾向AIH, 甚至较AIH更典型. 寻找三者特异性抗原进行肝组织免疫组化检查有助于更进一步的明确诊断, 从而更好的治疗.
自身免疫性肝病是一组免疫介导的肝脏损伤, 根据临床表现、生化、影象学和组织病理学特点不同, 可简单的分为以肝炎为主型(AIH)和以胆系损害及胆汁淤积为主型(PBC和PSC)及其重叠综合征, 这几种疾病均可表现为严重的肝脏病变, 并可进展为肝硬化.
唐霓, 副研究员, 教育部感染性疾病分子生物学重点实验室
目前自身免疫性肝病病因尚不明确, 有报道甲型肝炎病毒、丙型肝炎病毒、人类疱疹病毒6型等感染后可导致自身免疫性肝炎, 65%原发性胆汁性肝硬化患者伴有β-逆转录病毒感染, 目前治疗主要是免疫抑制治疗及利胆治疗, 找到确切的病因有利于疾病的诊治.
本文进一步证实了AIH、PBC以及AIH-PBC OS各自的临床病理学特征, 尤其对于其病理学特征(汇管区炎症、界面性肝炎、肝细胞花环样排列、淋巴细胞破坏性胆管炎、胆管增生以及纤维化分级等)及其影象学表现(腹部淋巴结肿大、脾大)作了详细的分析和比较. 对于自身免疫性肝病的诊治有较大的帮助.
1 界面性肝炎: 自身免疫性肝病表现为门管周围慢性渐进性单个或小簇肝细胞坏死, 即碎屑样坏死(PN), 由于PN伴有的炎症细胞浸润位于肝小叶实质区与间质区交界处, 因此, 从炎症角度称之为界面性肝炎. 2 肝细胞花环样排列: 表现为数个水样变性的肝细胞被炎症细胞和塌陷网状支架包绕成花环样结构, 其中心可见扩张的毛细胆管, 常见于汇管区周围. 3 淋巴细胞破坏性胆管炎: 表现为汇管区炎症, 淋巴细胞围绕受损的胆管周围, 并浸润至胆管基底膜和胆管上皮细胞内, 胆管上皮细胞呈空泡状变性, 进而引起上皮样组织细胞增生, 形成肉芽肿.
本研究整体设计合理, 临床资料详实, 分析有一定的深度, 对临床具有较好的参考价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Alvarez F, Berg PA, Bianchi FB, Bianchi L, Burroughs AK, Cancado EL, Chapman RW, Cooksley WG, Czaja AJ, Desmet VJ. International Autoimmune Hepatitis Group Report: review of criteria for diagnosis of autoimmune hepatitis. J Hepatol. 1999;31:929-938. [PubMed] [DOI] |
| 2. | Heathcote EJ. Management of primary biliary cirrhosis. The American Association for the Study of Liver Diseases practice guidelines. Hepatology. 2000;31:1005-1013. [PubMed] [DOI] |
| 3. | Chazouillères O, Wendum D, Serfaty L, Montembault S, Rosmorduc O, Poupon R. Primary biliary cirrhosis-autoimmune hepatitis overlap syndrome: clinical features and response to therapy. Hepatology. 1998;28:296-301. [PubMed] [DOI] |
| 8. | Sato Y, Harada K, Sudo Y, Watanabe K, Nakahama T, Morimoto H, Nakanuma Y. Autoimmune hepatitis associated with bile duct injury resembling chronic non-suppurative destructive cholangitis. Pathol Int. 2002;52:478-482. [PubMed] [DOI] |
| 9. | Czaja AJ. Current concepts in autoimmune hepatitis. Ann Hepatol. 2005;4:6-24. [PubMed] |
| 10. | Kumagi T, Heathcote EJ. Primary biliary cirrhosis. Orphanet J Rare Dis. 2008;3:1. [PubMed] [DOI] |
| 11. | Czaja AJ. Autoimmune liver disease. Curr Opin Gastroenterol. 2006;22:234-240. [PubMed] [DOI] |
| 12. | Rust C, Beuers U. Overlap syndromes among autoimmune liver diseases. World J Gastroenterol. 2008;14:3368-3373. [PubMed] [DOI] |
| 13. | Beuers U, Rust C. Overlap syndromes. Semin Liver Dis. 2005;25:311-320. [PubMed] |
| 14. | Schramm C, Lohse AW. Overlap syndromes of cholestatic liver diseases and auto-immune hepatitis. Clin Rev Allergy Immunol. 2005;28:105-114. [PubMed] [DOI] |
| 15. | Premoli A, Morello E, Bo S, Durazzo M. Diagnostic and therapeutic questions in overlap syndromes of autoimmune hepatitis. Minerva Gastroenterol Dietol. 2007;53:79-82. [PubMed] |