修回日期: 2008-09-12
接受日期: 2008-09-17
在线出版日期: 2008-10-18
目的: 研究mTOR/P70S6K信号通路在肝细胞肝癌(HCC)中的表达, 探讨其在HCC发生发展中的作用及意义.
方法: 用逆转录聚合酶链反应(RT-PCR)技术检测20例HCC患者癌组织、癌旁肝组织以及10例正常肝组织中mTOR及P70S6K mRNA表达情况; 并分析mTOR及P70S6K mRNA的表达与相关临床参数的关系.
结果: mTOR及P70S6K mRNA在HCC组织中的表达水平显著高于在癌旁肝组织和正常肝组织中的表达水平(mTOR mRNA: 0.594±0.218 vs 0.437±0.156, 0.594±0.218 vs 0.383±0.081, 均P<0.05; P70S6K mRNA: 0.610±0.147 vs 0.486±0.162, 0.610±0.147 vs 0.440±0.141, 均P<0.05). mTOR mRNA和P70S6K mRNA在HCC组织中的表达呈正相关(r = 0.548, P = 0.012), 且两者在癌旁肝组织及正常肝组织中的表达亦正相关性(r = 0.607, 0.737, P = 0.005, 0.015). mTOR及P70S6K mRNA在HCC组织中的表达水平与病理分期、门静脉癌栓等明显相关, 而与肿瘤直径、血清AFP 水平、性别等无明显关系.
结论: mTOR/P70S6K信号通路在HCC中特异性激活. mTOR/P70S6K信号通路可能在肝细胞肝癌的发生、发展中起重要作用.
引文著录: 彭贵主, 吴波, 单人锋, 周福庆. mTOR/P70S6K信号通路在肝细胞肝癌中的表达及临床意义. 世界华人消化杂志 2008; 16(29): 3279-3282
Revised: September 12, 2008
Accepted: September 17, 2008
Published online: October 18, 2008
AIM: To investigate expression of mTOR/P70S6K signaling pathway in human hepatocellualr carcinoma (HCC) and to discuss its role in the hepatocellular carcinogenesis.
METHODS: Reverse transcription polymerase chain reactions (RT-PCR) was employed to determine the mRNA expression of mTOR/P70S6K signaling pathway in cancerous and paracancerous tissuess of 20 HCC cases and normal healthy liver tissues of 10 cases. The relationship between expression of the genes mRNA in HCC tissues and related clinical parameters was analyzed.
RESULTS: The expression level of mTOR/P70S6K signaling pathway was markedly higher in the HCC tissues than in the paracancerous tissues or normal healthy liver tissues (mTOR mRNA: 0.594 ± 0.218 vs 0.437 ± 0.156, 0.594 ± 0.218 vs 0.383 ± 0.081, both P < 0.05; P70S6K mRNA: 0.610 ± 0.147 vs 0.486 ± 0.162, 0.610 ± 0.147 vs 0.440 ± 0.141, both P < 0.05). There was a positive correlation between mTOR mRNA and P70S6K mRNA expression in HCC tissues (r = 0.548, P = 0.012). There was also a positive correlation between mTOR mRNA and P70S6K mRNA expressions in paracancerous tissues and the normal liver tissues (r = 0.607, 0.737, P = 0.005, 0.015). The expression of mTOR/P70S6K signaling pathway in the HCC tissues was significantly correlated with the pathological grading, the pylic cancer embolus, but not with the diameter, level of the serous alpha - fetoprotein (AFP), and gender.
CONCLUSION: The mTOR/P70S6K signaling pathway is specifically activated in HCC tissues. The mTOR/P70S6K signaling pathway might play an important role in the pathogenesis of HCC.
- Citation: Peng GZ, Wu B, Shan RF, Zhou FQ. Expression and clinical significance of mTOR/P70S6K signaling pathway in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(29): 3279-3282
- URL: https://www.wjgnet.com/1009-3079/full/v16/i29/3279.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i29.3279
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是近年来发现的一种进化上保守的蛋白激酶, 也是一种重要的信号转导分子, 参与多种病理和生理过程, 在细胞的生长、分化、增殖、迁移和存活上扮演了重要的角色. P70S6激酶(P70S6K)是mTOR的直接作用底物, 被mTOR磷酸化后激活, 从而控制含5'-TOP结构的mRNA的翻译[1-4]. 越来越多的研究证明, mTOR/P70S6K信号通路在细胞的生存、生长与增殖中起中心调控作用, 他所介导的信号转导通路的异常与多种恶性肿瘤有关, 已成为肿瘤治疗的新靶点[5-11,14]. 本研究通过RT-PCR观察肝细胞肝癌中mTOR/P70S6K信号通路的表达情况及在肝细胞肝癌发生发展中的意义.
标本及一般资料: 2007-04/2008-04我院手术切除的新鲜肝细胞肝癌标本20例, 均取相应癌旁组织作对照, 和10例正常肝组织分别放入冻存管立即置于液氮中, 存储于-80℃冰箱. 男性16例, 女性4例, 年龄29-70岁, 平均年龄47.75岁, 诊断均经病理学检查证实. 所有患者均为第1次手术, 术前未接受放疗、化疗. BIOZOL总RNA提取试剂盒(杭州博日科技有限公司), BIORT逆转录扩增(RT-PCR)试剂盒(杭州博日科技有限公司), mTOR引物(上游引物批号02116, 下游引物批号02117)、P70S6K引物(上游引物批号02118、下游引物批号02119)以及β-actin内参引物(上游引物批号37496﹑下游引物批号37495)均为上海生工生物工程技术服务有限公司产品, 焦碳酸二乙脂(DEPC, BBI公司, 批号DB0154)溴化乙锭(EB, TaKaRa公司)琼脂糖, 无水乙醇, DNA Mark(DL2000, TaKaRa公司), GeneAmp 5700型PCR仪(美国应用生物系统公司), 凝胶电泳成像系统(Transilluminator公司), 紫外分光光度计(Cary-50)(澳大利亚Varian公司).
1.2.1 RT-PCR检测: (1)总RNA提取及cDNA合成: 按BIOZOL总RNA提取试剂盒说明进行提取组织总RNA, 逆转录合成cDNA按BIORT逆转录扩增(RT-PCR)试剂盒说明进行. (2)聚合酶链反应(PCR): 引物设计参考文献[12-13], 由上海生工生物工程有限公司合成, 引物序列及合成的产物大小见表1, 引物及其合成产物的正确性, 均在NCBI网站进行了BLAST验证(网址: http://www.ncbi.nlm.nih.gov/blast). (3)PCR: 按BIORT逆转录扩增(RT-PCR)试剂盒说明进行. 反应总体积25 μL. 10×PCR Buffer 2.5 μL, dNTP Mixture(10 mmol/L)0.5 μL, 每管加入mTOR上下游引物或者P70S6K上下游引物各0.5 μL, 上下游内参各0.5 μL, Taq mixDNA polymerase0.5 μL, RT产物2.5 μL, ddH2O 17 μL. PCR反应条件: 94℃ 3 min预变性; 94 ℃ 30 s, 60℃ 30 s和72℃ 90 s, 共经过35个循环反应. 所得PCR产物在含溴化乙锭的1.5 g/L的琼脂糖凝胶中电泳分离, 然后用凝胶成像系统分析结果.
| 基因 | 引物序列(5'-3') | 扩增片段长度(bp) |
| mTOR | 上游: CTG GGA CTC AAA TGT GTG CAG TTC | |
| 下游: GAA CAA TAG GGT GAA TGA TCC GGG | 537 | |
| P70S6K | 上游: TAC TTC GGG TAC TTG GTA A | |
| 下游: GAT GAA GGG ATG CTT TAC T | 188 | |
| β-actin | 上游: TCC TCC CTG GAG AAG AGC TA | |
| 下游: TCA GGA GGA GCA ATG ATC TTG | 302 |
1.2.2 结果判断: 用目的基因/看家基因两电泳条带的单位面积内的灰度比值来反映目的基因的相对表达水平. 目的基因相对表达水平 = (目的基因灰度值-背景灰度值)/(看家基因灰度值-背景灰度值).
统计学处理 对半定量RT-PCR结果应用SPSS11.5软件统计, 两两比较用t检验, 两因素的相关分析用直线相关分析(Pearson相关系数). P<0.05为差异具有统计学意义.
所得RNA琼脂糖凝胶电泳显示5S, 18S, 28S三条清晰条带, 再经紫外分光光度仪测定A260/A280及RNA浓度, 取A260/A280值在1.8-2.0者用于RT-PCR反应.
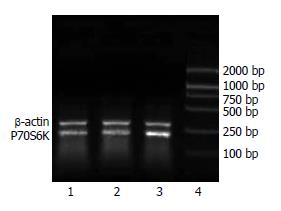
mTOR mRNA在HCC组织中的表达水平(0.594±0.218)明显高于癌旁组织(0.437±0.156)及正常肝组织(0.383±0.081, P<0.05). P70S6K mRNA在HCC组织中的表达水平(0.610±0.147)明显高于癌旁组织(0.486±0.162)及正常肝组织(0.440±0.141, P<0.05, 图1-2).
在mRNA水平mTOR、P70S6K在HCC(r = 0.548, P = 0.012)癌旁组织(r = 0.607, P = 0.005), 及正常肝组织(r = 0.737, P = 0.015)均呈正相关(表2).
| 分组 | n | mTOR | P70S6K | r | P |
| HCC组 | 20 | 0.594±0.218 | 0.610±0.147 | 0.548 | 0.012 |
| 癌旁组 | 20 | 0.437±0.156 | 0.486±0.162 | 0.607 | 0.005 |
| 正常肝组织 | 10 | 0.383±0.081 | 0.440±0.141 | 0.737 | 0.015 |
mTOR﹑P70S6K mRNA在HCC中的表达均与门脉癌栓﹑病理分级明显相关(P<0.05), 与性别﹑肿瘤直径﹑AFP无明显相关(P>0.05,表3).
| 临床参数 | n | mTOR mRNA | P70S6K mRNA |
| 性别 | |||
| 女 | 4 | 0.651±0.167 | 0.604±0.108 |
| 男 | 16 | 0.580±0.231 | 0.612±0.158 |
| AFP(μg/L) | |||
| >400 | 12 | 0.623±0.199 | 0.629±0.150 |
| <400 | 8 | 0.552±0.251 | 0.583±0.148 |
| 门脉癌栓 | |||
| 有 | 5 | 0.784±0.187 | 0.733±0.088 |
| 无 | 15 | 0.531±0.193 | 0.570±0.142 |
| 肿瘤直径(cm) | |||
| ≤5 | 7 | 0.497±0.266 | 0.617±0.227 |
| >5 | 13 | 0.647±0.146 | 0.607±0.092 |
| 病理分级 | |||
| iv | 7 | 0.734±0.167 | 0.745±0.145 |
| i-iii | 13 | 0.519±0.209 | 0.538±0.086 |
随着对肿瘤发生的分子生物学特性的深入了解, 针对肿瘤发展特异性生物环节的分子靶向药物治疗逐渐被人们所重视. 肝细胞肝癌通常在进展期才被诊断出来, 目前还没有有效的化疗方法. 新近的研究发现, 一部分调控细胞生长的信号途径功能紊乱是导致这一肿瘤表型的主要原因. 因此, 以这些信号途径为治疗靶的化疗方法逐渐被人们重视起来, 包括mTOR/P70S6K信号途径.
mTOR是一种非典型的丝氨酸/苏氨酸蛋白激酶. 分子量大小为289 kDa. mTOR基因位于人一号染色体短臂36.2位点. mTOR的C末端与PI3K的催化结构域高度同源, 因此又属于磷脂酰肌醇激酶相关蛋白家族(phos-phatidylinositol kinase-related kinases, PIKKs). P70S6激酶(P70S6K)是mTOR的直接作用底物. mTOR被PI3K/Akt信号传导通路介导的增生信号激活后, 磷酸化激活P70S6激酶, 后者又使40S核糖体蛋白S6磷酸化, S6磷酸化使40S亚单位参与活跃的多核糖体翻译, 从而增加包括编码核糖体蛋白、延长因子、胰岛素生长因子Ⅱ在内的含有5末端寡聚嘧啶的mRNAs的翻译.
mTOR信号通路在细胞生长中处于核心地位, mTOR信号传导通路活化可以抑制多种刺激诱发的细胞凋亡, 促进细胞周期进展, 从而促进细胞的生存和增殖, 同时参与血管形成, 在肿瘤的形成中扮演重要角色, 并参与肿瘤的侵袭和转移[1-5].
mTOR不仅对细胞正常生长增殖起着重要作用, 而且与正常细胞向癌细胞转化以及癌细胞的生长, 增殖密切相关. 许多肿瘤中存在有编码mTOR信号通路相关蛋白的基因突变, 这些蛋白的表达异常可引起mTOR通路的过度激活. 已有研究表明, 乳腺癌﹑白血病﹑小细胞肺癌﹑泌尿系肿瘤等均存在该信号通路的失调[5-11].
在本实验中, mTOR﹑P70S6K在肝细胞肝癌组织中的表达水平显著高于在癌旁肝组织和正常肝组织中表达水平, 说明肝细胞肝癌中存在异常活化的mTOR信号通路, 而且mTOR的表达水平越高, mTOR下游的重要靶点P70S6K表达水平亦越高, 呈正相关, 从而使细胞中蛋白合成越快, 即细胞生长越快, 这又进一步加速了细胞的恶化. 本实验还发现mTOR/P70S6K信号通路在肝细胞肝癌中的表达与门脉癌栓及病理分级明显相关, 而与性别﹑AFP﹑肿瘤直径无明显相关. 本研究结果说明mTOR信号通路的激活在肝细胞肝癌的发生发展中具有重要地位, 为肝细胞肝癌的分子靶向治疗提供一定的理论依据.
肝细胞肝癌是人类常见的恶性肿瘤之一, 现阶段肝细胞肝癌的治疗仍然是一个有待解决的难题, 迫切需要寻求新的治疗方法. 随着对肿瘤发生的分子生物学特性的深入了解, 针对肿瘤发展特异性生物环节的分子靶向药物治疗逐渐被人们所重视 .
孙殿兴, 主任医师, 白求恩国际和平医院肝病科
mTOR/P70S6K信号通路在细胞生长中的作用尤为重要.他可以整合营养-氨基酸、能量-ATP、生长因子等所激发的信号通路, 参与基因转录、蛋白质翻译、核糖体生物合成和细胞凋亡等多项细胞功能.许多肿瘤都伴有mTOR信号通路调节异常, 与肿瘤发生密切相关的多种生理过程如细胞生长增殖, 细胞周期调控, 细胞迁移等都受到mTOR调控, Cyclin D, c-myc等多种癌基因的表达在翻译水平也受到mTOR调控.
Qi et al研究发现在转基因小鼠的胆囊组织中存在mTOR/P70S6K信号通路活化, mTOR信号通路的抑制剂雷帕霉素能明显减少BK5.erbB2小鼠胆囊腺癌的发生率, 研究还发现人胆囊腺癌组织中存在mTOR/P70S6K信号通路活化. 侯桂琴 et al研究发现食管鳞癌细胞系EC9706中存在mTOR/P70S6K信号通路并且处于激活状态, 雷帕霉素能明显促进细胞凋亡并抑制该通路激活, 从而间接抑制翻译的进行.
关于mTOR/P70S6K信号通路在肝组织中的活化情况以及与肝细胞肝癌关系的报道尚少见. 本研究运用RT-PCR检测正常肝组织, 癌旁组织及HCC组织中mTOR/P70S6K信号通路的表达情况, 并分析其与HCC临床病理参数之间关系, 以期了解mTOR/P70S6K信号通路在HCC发生中的作用.
本研究证实mTOR/P70S6K信号通路在HCC中特异性激活. mTOR/P70S6K信号通路可能在肝细胞肝癌的发生、发展中起重要作用. 为HCC的分子靶向药物治疗提供一定的理论基础.
本研究设计合理, 方法可行, 结果可靠, 研究内容重要, 提供了一些有意义的信息, 为肝细胞肝癌的分子靶向治疗提供一定的理论依据.
编辑: 李军亮 电编:吴鹏朕
| 1. | Zheng Y, Collins SL, Lutz MA, Allen AN, Kole TP, Zarek PE, Powell JD. A role for mammalian target of rapamycin in regulating T cell activation versus anergy. J Immunol. 2007;178:2163-2170. [PubMed] |
| 2. | Peponi E, Drakos E, Reyes G, Leventaki V, Rassidakis GZ, Medeiros LJ. Activation of mammalian target of rapamycin signaling promotes cell cycle progression and protects cells from apoptosis in mantle cell lymphoma. Am J Pathol. 2006;169:2171-2180. [PubMed] [DOI] |
| 3. | Pene F, Claessens YE, Muller O, Viguie F, Mayeux P, Dreyfus F, Lacombe C, Bouscary D. Role of the phosphatidylinositol 3-kinase/Akt and mTOR/P70S6-kinase pathways in the proliferation and apoptosis in multiple myeloma. Oncogene. 2002;21:6587-6597. [PubMed] [DOI] |
| 4. | Wang X, Proud CG. The mTOR pathway in the control of protein synthesis. Physiology (Bethesda). 2006;21:362-369. [PubMed] [DOI] |
| 5. | Gao N, Flynn DC, Zhang Z, Zhong XS, Walker V, Liu KJ, Shi X, Jiang BH. G1 cell cycle progression and the expression of G1 cyclins are regulated by PI3K/AKT/mTOR/p70S6K1 signaling in human ovarian cancer cells. Am J Physiol Cell Physiol. 2004;287:C281-C291. [PubMed] [DOI] |
| 6. | Costa LJ, Drabkin HA. Renal cell carcinoma: new developments in molecular biology and potential for targeted therapies. Oncologist. 2007;12:1404-1415. [PubMed] [DOI] |
| 7. | Albert JM, Kim KW, Cao C, Lu B. Targeting the Akt/mammalian target of rapamycin pathway for radiosensitization of breast cancer. Mol Cancer Ther. 2006;5:1183-1189. [PubMed] [DOI] |
| 8. | Kopelovich L, Fay JR, Sigman CC, Crowell JA. The mammalian target of rapamycin pathway as a potential target for cancer chemoprevention. Cancer Epidemiol Biomarkers Prev. 2007;16:1330-1340. [PubMed] [DOI] |
| 9. | Cho D, Signoretti S, Regan M, Mier JW, Atkins MB. The role of mammalian target of rapamycin inhibitors in the treatment of advanced renal cancer. Clin Cancer Res. 2007;13:758s-763s. [PubMed] [DOI] |
| 10. | Gridelli C, Maione P, Rossi A. The potential role of mTOR inhibitors in non-small cell lung cancer. Oncologist. 2008;13:139-147. [PubMed] [DOI] |
| 11. | Wu Q, Kiguchi K, Kawamoto T, Ajiki T, Traag J, Carbajal S, Ruffino L, Thames H, Wistuba I, Thomas M. Therapeutic effect of rapamycin on gallbladder cancer in a transgenic mouse model. Cancer Res. 2007;67:3794-3800. [PubMed] [DOI] |
| 12. | 刘 奕, Sujuta HIDAYAT, 米 泽一仁, 于 秉治. mTOR及其底物在HeLa细胞的细胞周期不同时相中的表达. 中国生物化学与分子生物学报. 2004;20:358-362. |
| 13. | 侯 桂琴, 鲁 照明, 穆 欣, 刘 洪涛, 刘 兰琦, 许 培荣, 薛 乐勋, 王 建人. 雷帕霉素靶蛋白信号通路在食管癌细胞系中激活状态的研究. 中国肿瘤. 2007;16:260-262. |
| 14. | Abraham RT, Gibbons JJ. The mammalian target of rapamycin signaling pathway: twists and turns in the road to cancer therapy. Clin Cancer Res. 2007;13:3109-3114. [PubMed] [DOI] |