修回日期: 2008-09-17
接受日期: 2008-09-22
在线出版日期: 2008-10-18
目的: 探讨维甲酸诱导胃癌细胞BGC-803凋亡的作用及其与Fas、FasL、Caspase-3表达的关系.
方法: 以0.001、0.01、0.1、1、10、20 μmol/L的维甲酸作用BGC-803细胞72 h后, MTT法检测维甲酸对BGC-803细胞的生长抑制作用; 流式细胞术分析维甲酸对胃癌BGC-803细胞凋亡的诱导作用; Hoechst33342/PI双荧光染色观察细胞凋亡; RT-PCR法检测Fas、FasL、Caspase-3基因的mRNA表达变化.
结果: 0.1、1、10、20 μmol/L的维甲酸作用BGC-803细胞72 h后, 较对照组(未加药)能显著抑制细胞增殖(32.61%、44.42%、48.14%、51.15% vs 0.657%, 均P<0.01); 20 μmol/L维甲酸作用BGC-803细胞12、24和48 h后, G2/M期细胞比例显著增加, 出现凋亡特征性的亚G1峰; 细胞出现染色质凝集、核膜破裂等凋亡特征; 作用48 h后, Fas、FasL、Caspase-3 mRNA表达水平均较对照组显著上调.
结论: Fas、FasL、Caspase-3参与了维甲酸诱导胃癌细胞凋亡的调控过程.
引文著录: 张红英, 李锦毅, 张建永. Fas、FasL及Caspase-3在维甲酸诱导胃癌细胞凋亡中的作用. 世界华人消化杂志 2008; 16(29): 3255-3260
Revised: September 17, 2008
Accepted: September 22, 2008
Published online: October 18, 2008
AIM: To explore the effect on apoptosis of retinoic acid (RA)-induced BGC-803 gastric carcinoma cells and its relationship with the expression of Fas, FasL and Caspase-3.
METHODS: BGC-803 cells were treated with different concentrations of RA (0.001, 0.01, 0.1, 1, 10, 20 μmol/L) for 72 h. Then methyl-tetrazolium (MTT) assay was performed to determine the growth inhibition of BGC-803 cells; cell apoptosis rate was determined using flow cytometry; the feature of cell apoptosis was observed by Hoechst33342/PI staining; the mRNA expression of Fas, FasL and Caspase-3 were estimated using reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: After BGC-803 cells were treated with RA (0.1-20 μmol/L) for 72 h, RA inhibited the growth of cells significantly compared with that in the control group (32.61%, 44.42%, 48.14%, 51.15% vs 0.657%; all P < 0.01). Cells in G2/M were significantly increased after the cells were treated with 20 μmol/L RA for 12 h, 24 h and 48 h. G1 peak specific to apoptosis was observed and also observed were chromatic agglutination and rupture of caryon membrane. Expressions of Fas, FasL and Caspase-3 mRNA were up-regulated significantly by RA for 48 h compared with that in the control group.
CONCLUSION: Fas, FasL and Caspase-3 are involved in gastric carcinoma cell apoptosis induced by RA.
- Citation: Zhang HY, Li JY, Zhang JY. Effect of Fas, FasL and Caspase-3 on apoptosis of retinoic acid-induced gastric carcinoma cells. Shijie Huaren Xiaohua Zazhi 2008; 16(29): 3255-3260
- URL: https://www.wjgnet.com/1009-3079/full/v16/i29/3255.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i29.3255
胃Fas、FasL、Caspase-3是调控细胞凋亡的重要基因, 在肿瘤的发生、发展、转移中扮演着重要角色. Fas与其配体FasL结合后, 凋亡信号被传送到细胞内, 通过激活下游的Caspase-3诱导细胞凋亡. 维甲酸(retinoic acid, RA)研究较多的是诱导白血病细胞分化, 近年发现其对实体瘤细胞凋亡也有重要作用[1-3], 国外学者有一些相关报道, 但维甲酸诱导胃癌细胞凋亡的分子机制研究很少. 本文观察了维甲酸诱导细胞凋亡作用及Fas、FasL、Caspase-3表达对其的影响, 从而确定Fas、FasL、Caspase-3参与维甲酸诱导胃癌细胞凋亡的调控过程.
胃癌细胞株BGC-803由中科院肿瘤研究所提供. RA购自Sigma公司. RA用无水乙醇配成0.01 mol/L的储存液(乙醇终浓度控制在<1 mL/L, 避光、-20℃保存). 培养基RPMI 1640、噻唑蓝(MTT)、蛋白酶K、RNase、Hoechst33342、碘化丙啶(PI)和二甲基亚砜(DMSO)均购自Sigma公司. TRIzol购自Promega公司. RT-PCR试剂盒购自大连宝生物公司, 引物由上海生物工程技术服务公司合成.
1.2.1 细胞培养: 培养细胞在含100 mL/L灭活小牛血清、100 kU/L青霉素、100 mg/L链霉素的RPMI 1640培养液中, 于37℃的50 mL/L CO2饱和湿度下培养, 细胞初始浓度为5×108/L, 取指数生长期细胞进行实验.
1.2.2 MTT法检测RA作用胃癌细胞后细胞生长抑制: 将BGC-803细胞浓度调整为5×107/L, 接种96孔板, 每孔100 μL, 培养24 h后, 根据参考文献[4]分别加入RA, 终浓度分别为0.001、0.01、0.1、1、10、20 μmol/L. 设对照组(不加药)和空白组(培养液中无细胞), 每组设8个复孔, 在药物作用72 h, 加入MTT(5 g/L) 20 μL, 继续培养4 h, 离心, 弃上清, 加DMSO 200 μL, 避光振荡15 min, 全自动酶标仪测定570 nm处紫外吸光度值(A). 计算药物对细胞生长抑制率. 生长抑制率= [(对照组A-实验组A)/(对照组A-空白组A)]×100%.
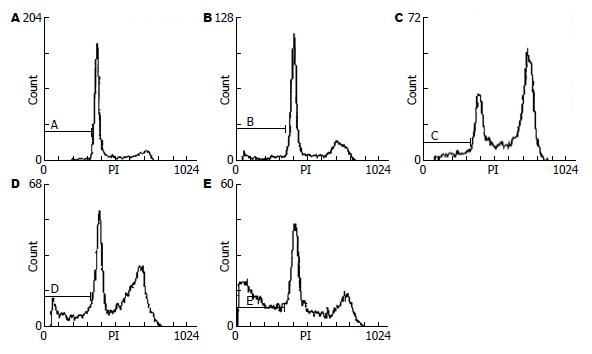
1.2.3 流式细胞光度术检测细胞凋亡: 通过预实验, 选择MTT实验抑制率最明显药物浓度为流式检测浓度. 以20 μmol/L RA处理BGC-803细胞0、12、24、36、48 h后收集细胞, 4℃体积分数为750 mL/L乙醇固定, -20℃冰箱保存. 检测前, PBS洗3次, RNA酶消化, PI染色, 流式细胞仪分析DNA含量, 计数10 000个细胞, 进行细胞凋亡和细胞周期分析, 检测群体细胞中G0/G1、S、G2/M期细胞百分率, 亚G1峰为凋亡细胞峰. 以0 h未加RA处理的BGC-803细胞为对照组.
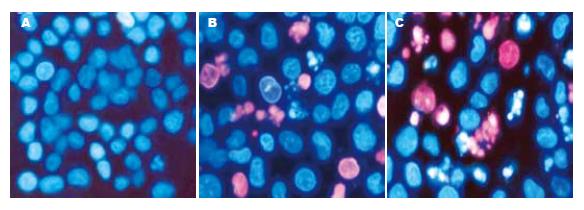
1.2.4 Hoechst33342/PI双荧光染色法检测细胞凋亡的形态学改变: 20 μmol/L RA处理BGC-803细胞0、24、48 h, 收集细胞, PBS洗涤, 移入Eppendorf管, 用200 μL PBS悬浮细胞, 加入Hoechst33342/PI染液(1:1) 40 μL, 37℃染色8 min, 离心弃上清, PBS吹打混匀, 涂片, 荧光显微镜(日本NikonE800)观察并照相.
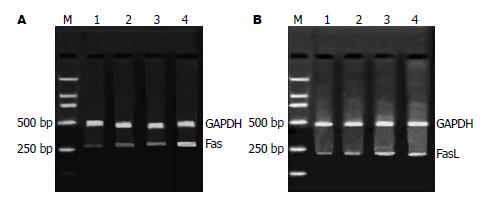
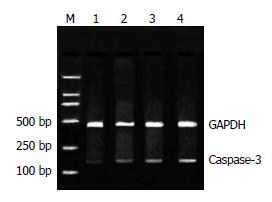
1.2.5 RT-PCR检测Fas、FasL、Caspase-3基因的表达: 以未加药的BGC-803细胞为对照组, 20 μmol/L RA处理的BGC-803细胞为实验组, 分别作用12、24、48 h. TRIzol法提取细胞总RNA, 以紫外分光光度计测RNA含量和纯度(RNA在260 nm和280 nm的吸光度比值为1.8-2.0之间), 以10 g/L琼脂糖凝胶电泳鉴定其完整性(28S和18S RNA条带比值≥2.0). 用1 μg总RNA进行逆转录合成cDNA, 反应条件如下: 30℃, 10 min, 42℃, 30 min, 99℃, 5 min, 5℃, 5 min. 将上述逆转录产物按RT-PCR试剂盒进行扩增反应, 以GAPDH作为内标, 应用Omiga2.0设计Fas的上游引物为: 5'-GACCCAGAATACCAAGTGCAGATGTA-3',下游引物: 5'-CTGTTTCAGGATTTAAGGTTGGAGATT-3', 扩增片段为296 bp. FasL的上游引物为: 5'-ATCCCTCTGGAATGGGAAGA-3', 下游引物: 5'-CCATATCTGTCCAGTACTGC-3', 扩增片段为240 bp. Caspase-3的上游引物: 5'-CATGGCCTGTCAGAAAATAC-3', 下游引物: 5'-TAACCCGAGTAAGAATGTGC-3', 扩增片段为176 bp. 循环条件: 预变性94℃, 2 min, 变性94℃, 30 s, 退火58℃, 1 min, 延伸72℃ 1 min. 33个循环后72℃维持5 min. PCR产物行20 g/L琼脂糖凝胶电泳, 凝胶自动成像2000系统扫描, 取其积分值作为量化指标, 以特异性基因条带与GAPDH基因条带的密度比值表示不同样本间的相对量.
统计学处理 所有数据以SPSS12.0统计软件处理, 两样本均数的比较采用t检验, 多组比较用单因素方差分析.
用0.001、0.01、0.1、1、10、20 μmol/L RA作用BGC-803细胞72 h, 对BGC-803细胞的生长抑制作用呈剂量依赖性, 细胞生长抑制率分别为0.984%、6.83%、32.61%、44.42%、48.14%和51.15%, 其中0.1、1、10、20 μmol/L RA的抑制作用显著强于对照组0.657%(P<0.01), 20 μmol/L RA的抑制率显著高于其他各组(P<0.01).
20 μmol/L RA处理BGC-803细胞12、24 h, 出现明显诱导G2/M期阻滞, 对照组G2/M期细胞所占百分率为10.4%, 实验组12、24、36、48 h后G2/M期细胞所占百分率为分别为22.3%、47.1%、40.3%、20.2%(表1). 结果显示在20 μmol/L RA作用细胞24 h后, 出现的G2/M期阻滞最为明显; 36、48 h后细胞所占百分率下降, 考虑可能为肿瘤细胞对于RA的耐药性引起. 20 μmol/L RA作用BGC-803细胞12、24、36、48 h的凋亡率, 均高于对照组的凋亡率(7.82%、9.88%、18.69%、40.14% vs 3.05%, P<0.05, 图1), 并出现凋亡典型性特征"亚G1峰".
| t(h) | 亚G1期 | G0/G1期 | S期 | G2/M期 |
| 0 | 3.8 | 63.7 | 26.3 | 10.4 |
| 12 | 6.8 | 53.7 | 28.9 | 22.3 |
| 24 | 10.2 | 22.5 | 34.5 | 47.1 |
| 36 | 19.6 | 33.8 | 26.7 | 40.3 |
| 48 | 38.7 | 42.5 | 40.8 | 20.2 |
Hoechst33342/PI双荧光染色法可区别正常细胞、凋亡细胞和坏死细胞, Hoechst33342是一种亲脂性物质, 为活细胞染料, 毒性较弱, 是双苯丙咪唑的衍生物, 可与DNA的A-T碱基区特异结合, 跨膜进入活细胞, 将活细胞和凋亡细胞中DNA染成蓝色; 当质膜不完整时, PI可嵌入到双链DNA或RNA中, 细胞被PI染色呈红色, 并可观察到断裂凝集的染色质. 由图2可见, 正常组BGC-803细胞大小一致, 被Hoechst33342染成淡蓝色荧光, 细胞形态规整, 细胞核较大(图2A). 20 μmol/L RA处理细胞24 h后, 可见下列规律性变化: 细胞被染成蓝色荧光,形态不规则, 核染色质凝集, 核分叶及碎片状, 核膜破裂等凋亡细胞形态(图2B); 48 h后上述变化更加明显(图2C).
2.4.1 RA诱导BGC-803细胞凋亡与Fas、FasL基因表达的变化: 20 μmol/L RA作用细胞12 h后, Fas和FasL表达强度无明显改变(P>0.05); 随着作用时间的延长, 24、48 h后, Fas表达增加(17.69±1.38, 23.35±2.13 vs 8.47±0.67, P<0.01); FasL表达显著(16.74±1.26, 22.35±1.94 vs 9.50±0.75, P<0.01, 图3).
2.4.2 RA诱导BGC-803细胞凋亡与Caspase-3基因表达的变化: 20 μmol/L RA作用细胞12 h后, Caspase-3表达强度无明显改变(P>0.05); 随着作用时间的延长, 24 h后Caspase-3表达增加(19.94±1.67 vs 6.42±0.47, P<0.01); 48 h后, Caspase-3表达增加显著(24.94±2.17 vs 6.42±0.47, P<0.01, 图4).
Fas又称Apo-1, 被命名为CD95, Fas是细胞膜Ⅰ型糖蛋白, 分子质量为48 kDa, 属于肿瘤坏死因子受体家族, 由325个氨基酸组成. Fas主要以膜受体形式存在, 在细胞凋亡中具有信号传导作用. FasL为Fas配体, Fas与FasL结合使细胞表面Fas分子交联, 凋亡信号被传到细胞内, 诱导表达Fas细胞凋亡. 所以FasL又称死亡因子[5]. Caspase-3是一类蛋白水解酶, 为Fas及FasL下游的效应分子, 活化的Caspase-3能裂解大量底物, 是凋亡机制的核心成分, 当FasL表达增高时, Caspae-3活性明显提高[6], Fas与FasL结合后, Fas相关蛋白(FADD)激活Caspase-8, Caspase-3、7等级联反应, 诱导细胞凋亡[7]. 维甲酸可通过激活相应的受体调控基因的转录活性, 从而产生调节增殖、分化和凋亡等多种生物学效应[8]. 研究表明, 维甲酸能够诱导卵巢癌[9]﹑神经母细胞瘤[10]等肿瘤细胞分化和凋亡, 从而达到抑制肿瘤细胞生长的作用.
本研究以人胃癌BGC-803细胞为靶标, 观察维甲酸对胃癌细胞生长的作用. MTT实验结果表明, 维甲酸能显著抑制BGC-803细胞生长, 通过0.001、0.01、0.1、1、10、20 μmol/L不同浓度维甲酸作用, 发现其对BGC-803细胞的生长抑制作用呈剂量依赖性, 0.1、1、10、20 μmol/L细胞生长抑制率分别为32.61%、44.42%、48.14%和51.15%. 0.1-20 μmol/L的抑制作用显著强于对照组0.657%(P<0.01), 20 μmol/L RA的抑制作用显著强于其他各组(P<0.01).
目前, 维甲酸对胃癌作用机制研究, 主要涉及到与细胞分化、增殖、凋亡调节有关的网络系统, 维甲酸主要作用是诱导细胞周期发生阻滞, 进而诱导细胞凋亡. 在实验中我们观察到, 在维甲酸作用后, 流式细胞光度术检测显示, 20 μmol/L维甲酸处理BGC-803细胞12 h、24 h后, 出现明显G2/M期阻滞, G2/M期百分率从0 h的10.4%分别升高到12 h的22.3%和24 h的47.1%(P<0.01); 48 h后下降至20.2%, 但仍明显高于对照组10.4%, 说明维甲酸对BGC-803细胞有G2/M期阻滞作用; 同时, 20 μmol/L维甲酸作用BGC-803细胞12、24、36、48 h后, 凋亡率分别为7.82%、9.88%、18.69%、40.14%, 均高于对照组(3.05%)(P<0.05), 结果显示, 维甲酸诱导BGC-803凋亡的作用呈时间依赖性. 在实验中我们利用Hoechst33342/PI双荧光染色法, 从形态学方面观察了细胞凋亡的变化, 荧光染色观察到, 随着RA作用时间的延长, 细胞呈现形态不规则, 核分叶及碎片状, 染色质凝集、核膜破裂等凋亡细胞形态改变.
Fas、FasL介导的信号传导通路是细胞凋亡的主要途径, 在此通路上任一环节缺失都可导致癌细胞逃逸细胞凋亡, 从而实现细胞无限增殖. 有报道指出, 肿瘤发生过程中Fas、FasL表达水平较低[11-15], Fas、FasL表达水平与肿瘤发生与转移密切相关[15-18]. 我们的实验结果表明, Fas、FasL及Caspase-3在BGC-803细胞中表达水平较低, 这与Falchetti et al[12]结果一致, 意味着胃癌细胞通过细胞凋亡数量减少, 有利于肿瘤细胞增殖. 20 μmol/LRA作用24、48 h后, Fas、FasL表达水平较对照组增加(P<0.01); 同时Caspase-3表达水平亦明显增加(P<0.01), 随着作用时间的延长, 表达水平增加, 提示Fas途径在诱导BGC-803细胞凋亡中起着重要作用, 而维甲酸可能通过这一途径激活Fas、FasL、Caspase-3之后, 上调其表达水平, 参与诱导细胞凋亡过程.
由此我们认为, 维甲酸可在体外呈时间和浓度依赖性抑制人胃癌BGC-803细胞的生长, 其作用机制可能主要是诱导细胞凋亡和影响细胞周期, 同时诱导细胞凋亡的机制可能部分是通过上调Fas、FasL、Caspase-3的表达实现的.
维甲酸(retinoic acid, RA)研究较多的是诱导白血病细胞分化, 近年发现其对实体瘤细胞凋亡也有重要作用, 是肿瘤治疗的一个新靶点.
刘连新, 教授, 哈尔滨医科大学第一临床医学院普通外科
维甲酸对细胞生长、分化和凋亡具有重要作用, 有研究表明其可诱导胃癌细胞凋亡, 但其诱导凋亡的具体机制及作用方式不甚清楚, 如能深入研究维甲酸诱导胃癌细胞凋亡机制, 将会为胃癌治疗提供新的途径和方法.
本文观察了不同剂量下维甲酸对胃癌细胞BGC-803的作用, 观察了20 μmol/L浓度下维甲酸诱导细胞凋亡的形态学变化, 发现在20 μmol/L浓度下随着维甲酸作用时间的延长, 上调了Fas、FasL、Caspase的表达水平. 由此我们认为, 维甲酸可在体外呈时间和浓度依赖性抑制人胃癌BGC-803细胞的生长, 其作用机制可能主要是诱导细胞凋亡和影响细胞周期, 同时诱导细胞凋亡的机制可能部分是通过上调Fas、FasL、Caspase-3的表达实现的.
本文研究维甲酸诱导胃癌细胞凋亡的有效浓度和剂量, 探讨其作用机制, 为维甲酸在临床胃癌治疗中提供了一定的理论基础.
本研究方法可靠, 应用准确, 数据可信, 具有一定的科学性和实用性.
编辑: 李军亮 电编:吴鹏朕
| 1. | Kao HW, Chen HC, Wu CW, Lin WC. Tyrosine-kinase expression profiles in human gastric cancer cell lines and their modulations with retinoic acids. Br J Cancer. 2003;88:1058-1064. [PubMed] [DOI] |
| 2. | Brabender J, Lord RV, Metzger R, Park J, Salonga D, Danenberg KD, Hölscher AH, Danenberg PV, Schneider PM. Role of retinoid X receptor mRNA expression in Barrett's esophagus. J Gastrointest Surg. 2004;8:413-422. [PubMed] [DOI] |
| 3. | Hellemans K, Verbuyst P, Quartier E, Schuit F, Rombouts K, Chandraratna RA, Schuppan D, Geerts A. Differential modulation of rat hepatic stellate phenotype by natural and synthetic retinoids. Hepatology. 2004;39:97-108. [PubMed] [DOI] |
| 4. | Czeczuga-Semeniuk E, Lemancewicz D, Wolczyński S. Can vitamin A modify the activity of docetaxel in MCF-7 breast cancer cells? Folia Histochem Cytobiol. 2007;45 Suppl 1:S169-S174. [PubMed] |
| 5. | Shimonishi T, Isse K, Shibata F, Aburatani I, Tsuneyama K, Sabit H, Harada K, Miyazaki K, Nakanuma Y. Up-regulation of fas ligand at early stages and down-regulation of Fas at progressed stages of intrahepatic cholangiocarcinoma reflect evasion from immune surveillance. Hepatology. 2000;32:761-769. [PubMed] [DOI] |
| 6. | Liang Y, Nylander KD, Yan C, Schor NF. Role of caspase 3-dependent Bcl-2 cleavage in potentiation of apoptosis by Bcl-2. Mol Pharmacol. 2002;61:142-149. [PubMed] [DOI] |
| 7. | Zheng TS, Schlosser SF, Dao T, Hingorani R, Crispe IN, Boyer JL, Flavell RA. Caspase-3 controls both cytoplasmic and nuclear events associated with Fas-mediated apoptosis in vivo. Proc Natl Acad Sci U S A. 1998;95:13618-13623. [PubMed] [DOI] |
| 8. | Hellemans K, Verbuyst P, Quartier E, Schuit F, Rombouts K, Chandraratna RA, Schuppan D, Geerts A. Differential modulation of rat hepatic stellate phenotype by natural and synthetic retinoids. Hepatology. 2004;39:97-108. [PubMed] [DOI] |
| 9. | Um SJ, Lee SY, Kim EJ, Han HS, Koh YM, Hong KJ, Sin HS, Park JS. Antiproliferative mechanism of retinoid derivatives in ovarian cancer cells. Cancer Lett. 2001;174:127-134. [PubMed] [DOI] |
| 10. | Lovat PE, Dobson M, Malcolm AJ, Pearson AD, Redfern CP. Differential gene regulation by 9-cis and all-trans retinoic acid in neuroblastoma cells. Med Pediatr Oncol. 2001;36:135-138. [PubMed] [DOI] |
| 11. | Lee TB, Min YD, Lim SC, Kim KJ, Jeon HJ, Choi SM, Choi CH. Fas (Apo-1/CD95) and Fas ligand interaction between gastric cancer cells and immune cells. J Gastroenterol Hepatol. 2002;17:32-38. [PubMed] [DOI] |
| 12. | Falchetti M, Saieva C, Lupi R, Masala G, Rizzolo P, Zanna I, Ceccarelli K, Sera F, Mariani-Costantini R, Nesi G. Gastric cancer with high-level microsatellite instability: target gene mutations, clinicopathologic features, and long-term survival. Hum Pathol. 2008;39:925-932. [PubMed] [DOI] |
| 13. | 毕 蔓茹, 杨 宝山, 马 英骥, 陈 立艳, 王 岩, 高 峰, 王 福祥. 复方甘草酸苷对小鼠暴发性肝衰竭Fas/FasL介导的肝细胞凋亡的保护作用. 世界华人消化杂志. 2005;13:26-30. [DOI] |
| 14. | Thorburn J, Moore F, Rao A, Barclay WW, Thomas LR, Grant KW, Cramer SD, Thorburn A. Selective inactivation of a Fas-associated death domain protein (FADD)-dependent apoptosis and autophagy pathway in immortal epithelial cells. Mol Biol Cell. 2005;16:1189-1199. [PubMed] [DOI] |
| 15. | Zhu Q, Liu JY, Xu HW, Yang CM, Zhang AZ, Cui Y, Wang HB. Mechanism of counterattack of colorectal cancer cell by Fas/Fas ligand system. World J Gastroenterol. 2005;11:6125-6129. [PubMed] |
| 16. | Abrams SI. Positive and negative consequences of Fas/Fas ligand interactions in the antitumor response. Front Biosci. 2005;10:809-821. [PubMed] [DOI] |
| 17. | Rupinder SK, Gurpreet AK, Manjeet S. Cell suicide and caspases. Vascul Pharmacol. 2007;46:383-393. [PubMed] [DOI] |
| 18. | 黄 文生, 彭 慧, 谭 进富, 谭 敏. 探讨Fas/FasL的表达与大肠癌发展及转移的关系. 中山大学学报(医学科学版). 2008;29:35-37. |