修回日期: 2008-08-30
接受日期: 2008-09-08
在线出版日期: 2008-10-08
目的: 探讨大鼠肝肾联合移植排斥反应中移植物RANTES的表达.
方法: 将SD、Wistar大鼠随机分为正常对照组(A组)、同种同基因移植组(B组)、同种异基因移植组(C组). 应用袖套法建立大鼠肝肾联合移植模型. 分别对A组肝肾组织及移植后1、4、7 d肝肾组织进行活检, 行免疫组化染色, 然后进行图像半定量分析, 以检测正常及移植肝肾组织中RANTES的表达水平.
结果: 移植1、4、7 d后, C组大鼠肝肾组织RANTES分子表达与A组及B组比较有差异(A组, 肝: 168.10±13.62, 129.10±9.04, 97.60±15.16 vs 226.20±5.73; 肾: 174.40±14.23, 149.19±18.88, 141.70±14.95 vs 219.40±10.70, 均P<0.05; B组, 肝: 224.25±12.15, 217.05±15.82, 214.28±12.00; 肾: 216.50±13.20, 211.70±11.02, 207.68±15.28), 且RANTES分子表达与移植术后的排斥程度呈正相关.
结论: 移植肝肾中RANTES的表达可能对诊断肝肾联合移植急性排斥及判断反应的严重程度具有参考价值.
引文著录: 杨芳, 江艺, 蔡秋程, 郑智勇, 宋屿娜, 吕立志. RANTES在肝肾联合移植排斥反应中的表达及意义. 世界华人消化杂志 2008; 16(28): 3221-3224
Revised: August 30, 2008
Accepted: September 8, 2008
Published online: October 8, 2008
AIM: To investigate the relationship between the ragulated upon activation normol T cell expressed and secreted (RANTES) and acute rejection of combined liver-kidney transplantation in rats.
METHODS: SD rats and Wistar rats were randomly divided into normal control group (group A), isograft group (group B), and allograft group (group C). The rat model of combined liver-kidney transplantation was set up uisng cuff methods. Liver and kidney biopsies from the recipients were obtained at day 1, 4, and 7 postoperatively to determine the expression level of RANTES in liver-kidney grafts. Using immunohistochemmistry staining, samples were firstly stained and then analyzed using image semiquantitive analysis.
RESULTS: At day 1, 7, 14 after transplantation, there were significant difference in expression level of RANTES between group C and group A (liver: 168.10 ± 13.62, 129.10 ± 9.04, 97.60 ± 15.16 vs 226.20 ± 5.73; kidney: 174.40 ± 14.23, 149.19 ± 18.88, 141.70 ± 14.95 vs 219.40 ± 10.70, all P < 0.05), and also group B (liver: 224.25 ± 12.15, 217.05 ± 15.82, 214.28 ± 12.00; kidney: 216.50 ± 13.20, 211.70 ± 11.02, 207.68 ± 15.28). Moreover, the expression level of RANTES was correlated positively to the degree of acute graft rejection.
CONCLUSION: Determination of RANTES in liver-kidney graft tissues may be helpful to the diagnosis of acute rejection and the judgment of the degree of acute rejection.
- Citation: Yang F, Jiang Y, Cai QC, Zheng ZY, Song YN, Lv LZ. Expression and significance of RANTES in rejection of combined liver-kidney transplantation in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(28): 3221-3224
- URL: https://www.wjgnet.com/1009-3079/full/v16/i28/3221.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i28.3221
异体器官移植可引起复杂的炎症反应和特异性免疫应答, 该反应主要由不同的细胞因子介导, 在不用免疫抑制剂的情况下, 通常导致急性移植排斥或移植物损坏. 急性排斥反应多属于迟发性超敏反应的细胞免疫应答, 伴有体液免疫的参与, 早期病变组织内常见单个核细胞浸润. 大量炎症细胞浸润诱导了移植微血管损伤, 组织破坏, 引起移植物机能不良, 导致移植失败. 近年来有研究表明[1-2]趋化因子RANTES通过活化T细胞、控制免疫细胞定向迁移、向移植物内募集免疫炎性细胞, 加速排斥反应. RANTES的表达水平与急性排斥反应的关系, 引起国内外学者的重视. 本研究首次在肝肾联合移植领域内采用免疫组化图像半定量分析法, 检测正常、排斥及非排斥情况下大鼠肝组织中RANTES的表达水平, 以探讨其表达与肝肾联合移植急性排斥反应的关系, 旨在寻找一种及时、敏感、准确的诊断肝移植排斥反应的方法.
成年健康近交系♂SD大鼠76只, Wistar大鼠28只, 体质量220-300 g, 由中科院上海实验动物中心提供. 兔抗人和动物RANTES pAb(武汉, Boster生物有限公司), PBS、EliVisionTM plus试剂盒(福建, Maxin生物有限公司).
1.2.1 分组: 实验小鼠分为A、B、C 3组: A组为正常对照组(n = 8), 均为SD大鼠, B组为同种同基因肝肾移植组(n = 24), 供受体均为SD大鼠, 为非排斥对照组; C组为同种异基因肝肾移植组(n = 24), 供体为Wistar大鼠, 受体为SD大鼠, 各24只, 为排斥组. 凡因手术失败致死或发生胆道、尿路梗阻、感染(出现症状并经细菌培养证实)等并发症者均排除在本实验分组外.
1.2.2 造模: 供体手术: 乙醚麻醉后, 腹部正中纵切口, 上自剑突, 下至耻骨联合, 采取多器官快速联合切取法. 先行胆管插管、右肾及右侧输尿管(带膀胱瓣)游离; 随后结扎切断结肠, 沿肠系膜根部锐性分离至肠系膜下动脉处, 暴露腹主动脉和下腔静脉. 肝素化后, 经腹主动脉予0-4 ℃平含肝素衡盐低压、匀速、原位灌注, 总量约为20 mL. 剪开膈肌, 于其上方剪断腹主动脉, 插管处下方剪断腹主动脉及下腔静脉, 沿脊柱前面向上锐性游离, 连同膈肌、肝、肾、胰、脾、肠道整块切取, 放入保存液中. 供体修整: 在保存液中, 贴腹主动脉根部剪断右肾动脉, 在左肾静脉根部剪断下腔静脉. 分离出肝动脉, 贴近肝门结扎、剪断. 进一步游离肝周血管、韧带后行肝上下腔静脉、门静脉、右肾下下腔静脉和右肾动脉分别行"袖套"式套管. 右肾动静脉预置血管夹阻断. 受者手术: 肝脏移植参照Harihara et al[3]氏三袖套法. 右肾动脉同样采用袖套法. 松开右肾动静脉的血管夹, 可见供肾颜色迅速变红, 恢复血供. 完成供体膀胱瓣与受体膀胱[4]的吻合及输尿管、肾脏的固定. 此时肝脏颜色红润, 胆汁由胆管中流出. 完成胆管吻合, 大网膜填塞胆管联结处. 生理盐水冲洗腹腔后, 留15 mL在腹中, 并倒入50 mg氨苄青霉素. 缝合腹壁切口. 去除麻醉后, 大鼠清醒翻身.
1.2.3 标本收集: 受体鼠在术后1, 4, 7 d分别随机抽取8只开腹取新鲜肝、肾组织, 各取一部分迅速浸入液氮中冷冻以备制作冰冻切片免疫组化染色; 另一部分用40 g/L甲醛固定以备病理检查, 以正常肝、肾组织作对照.
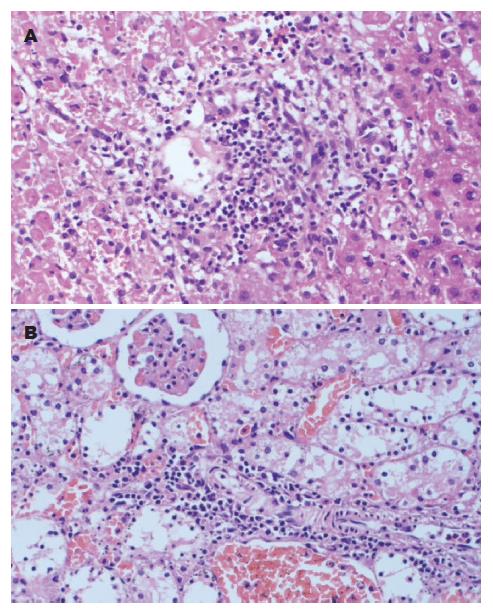
1.2.4 组织病理学检查: 将固定于甲醛中的肝肾组织制成石蜡切片, 用苏木素染色, 光镜下观察急性排斥反应, 肝肾均按Banff移植排斥诊断标准. 肝脏Banff移植排斥诊断标准[5]: 不确定:汇管区炎症浸润未达急性排斥反应诊断标准. 轻度(Ⅰ级)排斥浸润累及少数汇管区, 程度轻微, 局限在汇管区内. 中度(Ⅱ级)排斥浸润扩展至大多数或所有汇管区. 重度(Ⅲ级)同以上中度标准,浸润向汇管区周围肝实质扩散, 并有中度至重度的静脉周围炎, 伴静脉周围的肝细胞坏死. 肾脏Banff移植排斥诊断标准[6]: Ⅰ级: 中度肾间质单个核细胞浸润, 中度肾小管炎, 动脉无病变. Ⅱ级: 中度肾间质单个核细胞浸润, 重度肾小管炎和(或)轻至中度动脉内膜水肿, 内皮细胞肿胀、变性和脱落. Ⅲ级: 严重的动脉内膜变性和水肿和(或)全层性动脉炎, 动脉壁纤维素样坏死, 梗死, 肾间质出血以及肾小管炎间质性病变.
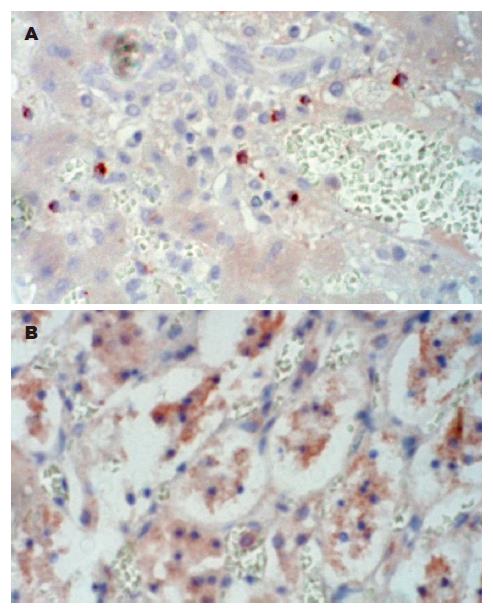
1.2.5 移植物免疫组织化学检查(EliVisionTM plus免疫组化染色法): 冰冻切片脱水和水化后, 用PBS(pH 7.4)冲洗, 在高压下对组织抗原进行相应的修复. 每张切片加1滴30 g/L的过氧化氢溶液, 室温下孵育10 min, 以阻断内源性过氧化物酶活性. PBS冲洗后, 每张切片加1滴兔抗人和动物-RANTES pAb(第一抗体), 室温下孵育60 min. 每张切片加1滴聚合物增强剂(试剂A), 室温下孵育20 min. PBS冲洗. 每张切片加1滴抗兔聚合物(试剂B), 室温下孵育30 min. PBS冲洗. 每张切片加2滴新鲜配置的AEC显色液, 显微镜控制显色. 蒸馏水冲洗, 苏木素复染, 10 mL/L盐酸分化, 自来水冲洗, PBS液冲洗返蓝, 水性封片剂封片. 以PBS代替一抗为阴性对照.
1.2.6 免疫组织化学定量: 细胞质内出现棕黄色颗粒为染色阳性细胞, 每分标本在×400倍高倍镜下通过病理图像分析法比较各组间反应产物的染色深浅, 即灰度有无差异, 灰度值分为0-256级, 染色越深, 灰度值越小.
统计学处理 结果采用mean±SD表示, 采用SPSS11.5软件在微机上将资料进行统计分析. 采用单因素方差分析, 以P<0.05为相差显著, P<0.01为相差非常显著.
手术成功率(72 h存活率)为92%, 供体手术、血管袖套准备及受体手术时间分别为40±5.7 min、18±5.5 min和42±6.6 min, 无肝期10-14 min. 热缺血时间为0 min, 冷缺血时间为32.4 min. 3 d内的死亡原因为套管失败, 门静脉血栓形成, 气栓形成, 及供体术中出血、受体切肝时麻醉过深等. 1 wk内死亡原因为胃肠道扩张、胆漏、尿漏、输尿管梗阻等.
A组和B组移植肝肾鲜见排斥反应表现. C组术后1 d肝组织中即可见小部分汇管区轻度炎症细胞浸润、静脉内皮细胞炎及胆管损伤, 为轻度排斥表现; 肾脏可见肾小管细胞空泡化, 变性, 肾小管间质少量淋巴细胞浸润, 为轻度排斥表现. 术后4 d肝组织炎症细胞浸润范围增大, 部分肝细胞坏死. 肾脏呈现肾间质单个核细胞浸润, 中重度肾小管炎, 动脉内膜肿胀、变性, 属中度排斥表现. 术后7 d肝实质与汇管区内均可见明显炎症细胞, 肝实质变性、肝细胞灶性坏死区域大, 中央静脉管壁纤维素样坏死, 炎症细胞大量浸润中央静脉, 呈重度排斥表现; 肾脏仍属中度排斥表现(图1).
RANTES在A组肝肾组织中均未见表达, B组肝组织偶见汇管区淋巴细胞微弱表达, 移植肾脏的肾小管上皮细胞及血管内膜细胞也有微弱表达, 在C组肝组织中, 移植后早期肝细胞、汇管区单核细胞、淋巴细胞和血管内皮细胞即有轻度表达, 与A、B组比较, 差异显著(P<0.05), 且其表达水平随着天数的增加而进一步升高, 在术后7 d达到峰值, C组肾脏在移植后早期肾小管上皮细胞, 血管内皮细胞也有轻度表达, 术后4-7 d表达升高, 在系膜细胞及脱落的肾小管上皮细胞内可见明显表达增强(表1, 图2).
RANTES即调节激活正常T细胞表达和分泌的细胞因子, 他属于趋化因子C-C家族(无插入其他氨基酸)中的一员. 由于趋化因子的活化部分吸引效应分子的特殊基团, 致使效应细胞向移植物募集, 导致移植排斥反应的发生.
本次研究中, 同基因移植组大鼠移植后RANTES在肝肾均有微弱表达, 并随时间增加而轻度增加, 但总体水平不高, 考虑与升高可能与继发的缺血再灌注损伤有关[7], 因同基因移植无进一步触发免疫应答, 而未导致如排斥反应发生时的大量表达. 同种异基因组术后移植物中RANTES在排斥反应早期(术后1-3 d)呈低表达的RANTES, 4-7 d RANTES表达明显增强, 在移植肾, 主要分布于肾小管上皮细胞胞质内, 即使脱落的上皮细胞也大量阳性表达. 其次浸润的淋巴细胞、肾小球系膜细胞也均表达, 在移植肝, 肝细胞胞质中表达明显增强, 汇管区浸润的单核细胞、T淋巴细胞、嗜酸性细胞中也表达此趋化因子. 两者均差异显著, 提示RANTES表达情况可作为肝肾联合移植中监测移植肝肾肾脏排斥反应发生程度的有用指标. 考虑为早期间质中度单个核细胞浸润, RANTES由炎症组织产生并沉积于内皮, 低水平的RANTES识别并促进巨噬细胞和T细胞黏附并进入组织, 数日后T细胞持续上调RANTES的产生, 吸引更多T细胞和巨噬细胞向炎症部位聚集并进入炎症组织, 从而放大上述炎性浸润反应, 造成器官损害[8].
本次研究中, 同种异基因移植组术后肝肾的排斥程度均随着天数的增加而加重, 7 d时肝脏达Ⅲ级(重度), RANTES表达也相应增强, 而肾脏则在4-7 d达到一相对稳定排斥程度, 为Ⅱ级(中度)排斥反应, 4、7两天肾脏RANTES表达无明显差异. 考虑肝肾联合移植肾脏排斥情况较文献报道的单独肾移植的程度轻[9], 原因可能是肝脏对肾脏的保护作用[10], 其机制有待进一步探讨.
RANTES与大鼠同种异体肝肾联合移植急性排斥反应中炎性细胞向移植物浸润及排斥反应的发生呈正相关. 这也许可以用来评价和监测受者的免疫状态, 移植肝肾中RANTES的表达可能对诊断肝肾联合移植急性排斥及判断反应的严重程度具有参考价值.
RANTES即调节激活正常T细胞表达和分泌的细胞因子, 他属于趋化因子C-C家族(无插入其他氨基酸)中的一员. 由于趋化因子的活化部分吸引效应分子的特殊基团, 致使效应细胞向移植物募集, 导致移植排斥反应的发生.
邰升, 副教授, 哈尔滨医科大学附属二院肝胆外科
近年来有研究表明趋化因子RANTES通过活化T细胞、控制免疫细胞定向迁移、向移植物内募集免疫炎性细胞, 加速排斥反应.
本研究首次在肝肾联合移植领域内采用免疫组化图像半定量分析法, 检测正常、排斥及非排斥情况下大鼠肝组织中RANTES的表达水平, 以探讨其表达与肝肾联合移植急性排斥反应的关系, 旨在寻找一种及时、敏感、准确的诊断肝移植排斥反应的方法.
本文立题新颖, 学术价值尚可, 但方法过于简单, 观察指标单调.
编辑: 李军亮 电编: 郭海丽
| 1. | Azzawi M, Hasleton PS, Geraghty PJ, Yonan N, Krysiak P, El-Gammal A, Deiraniya AK, Hutchinson IV. RANTES chemokine expression is related to acute cardiac cellular rejection and infiltration by CD45RO T-lymphocytes and macrophages. J Heart Lung Transplant. 1998;17:881-887. [PubMed] |
| 2. | Stojanovic T, Bedke J, Grone HJ, Proudfoot AE, Becker H, Markus P, Hecker M. Met-RANTES inhibition of mucosal perfusion failure in acute intestinal transplant rejection - role of endothelial cell-leukocyte interaction. J Vasc Res. 2002;39:51-58. [PubMed] [DOI] |
| 3. | Harihara Y, Sanjo K, Otsubo O, Idezuki Y. Simplified three-cuff method in concordant hamster-to-rat liver xenotransplantation. Transplant Proc. 1994;26:1191-1192. [PubMed] |
| 5. | Banff schema for grading liver allograft rejection: an international consensus document. Hepatology. 1997;25:658-663. [PubMed] [DOI] |
| 6. | Racusen LC, Solez K, Colvin RB, Bonsib SM, Castro MC, Cavallo T, Croker BP, Demetris AJ, Drachenberg CB, Fogo AB. The Banff 97 working classification of renal allograft pathology. Kidney Int. 1999;55:713-723. [PubMed] [DOI] |
| 7. | Ortiz BD, Nelson PJ, Krensky AM. Switching gears during T-cell maturation: RANTES and late transcription. Immunol Today. 1997;18:468-471. [PubMed] [DOI] |
| 8. | Goddard S, Williams A, Morland C, Qin S, Gladue R, Hubscher SG, Adams DH. Differential expression of chemokines and chemokine receptors shapes the inflammatory response in rejecting human liver transplants. Transplantation. 2001;72:1957-1967. [PubMed] [DOI] |