修回日期: 2008-08-30
接受日期: 2008-09-08
在线出版日期: 2008-10-08
肠黏膜屏障是指将肠腔内细菌、抗原等物质与肠黏膜固有层免疫细胞隔离开, 避免固有层免疫细胞激活的肠黏膜结构, 主要由肠黏膜基底膜、上皮细胞层及其表面的黏液层所构成. 炎症性肠病(inflammatory bowel disease, IBD)肠黏膜屏障损伤的机制为: IBD发病时, 肠黏膜所产生的大量炎症细胞因子、炎症介质等损伤肠上皮细胞, 诱导上皮细胞凋亡; 影响上皮细胞紧密连接蛋白的表达及分布, 破坏上皮细胞间紧密连接; 抑制黏蛋白的产生, 破坏上皮细胞表面的黏液层, 造成肠黏膜屏障障碍.
引文著录: 白爱平. 炎症性肠病肠黏膜屏障损伤机制. 世界华人消化杂志 2008; 16(28): 3187-3191
Revised: August 30, 2008
Accepted: September 8, 2008
Published online: October 8, 2008
Intestinal mucosal barrier, which mainly contains epithalial cells and mucus layer, keeps physiological function of immune cells in intestine. During the process of inflammatory bowel disease (IBD), mucosal integrity and barrier function are broken, which leads to translocation of luminal contents such as bacterial antigens, thus inducing expression of proinflammatory cytokines and triggering immune response. Meanwhile, the produced proinflammatory cytokines influence epithelial and mucosal barrier function by inducing apoptosis of intestinal epithelia, altering the expression and cellular distribution of tight junction proteins, and reducing the production of mucus.
- Citation: Bai AP. Intestinal barrier injury in inflammatory bowel disease. Shijie Huaren Xiaohua Zazhi 2008; 16(28): 3187-3191
- URL: https://www.wjgnet.com/1009-3079/full/v16/i28/3187.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i28.3187
肠黏膜屏障功能与消化系统疾病发病关系非常密切. 肠道感染、炎症、机械损伤等因素能诱导肠黏膜屏障功能异常, 使黏膜通透性增高, 导致肠腔内细菌、抗原等物质移位至黏膜固有层而激活免疫细胞, 诱导黏膜异常免疫反应的发生[1]. 另一方面, 肠道炎症性疾病如炎症性肠病发病(IBD)时, 一些损伤性因素如炎症细胞因子能破坏肠黏膜屏障, 加重黏膜异常免疫反应[2]. 目前普遍认为, 肠黏膜屏障功能异常是IBD发病的分子基础, IBD发病时肠黏膜屏障功能异常, 肠腔内抗原物质向肠黏膜固有层移位, 进一步激活固有层免疫细胞, 导致肠黏膜异常炎症反应[3]. 本文将对肠黏膜屏障的结构、IBD肠黏膜屏障损伤机制等进行介绍.
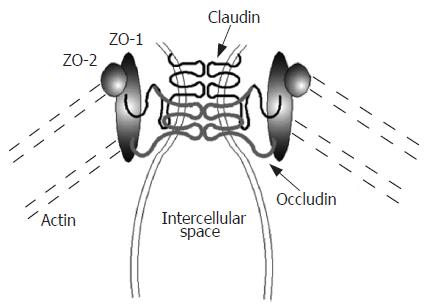
肠黏膜屏障是指将肠腔内细菌、抗原等物质与肠黏膜固有层免疫细胞隔离开, 避免固有层免疫细胞激活的肠黏膜结构, 主要由肠黏膜基底膜、上皮细胞层及其表面的黏液层所构成[4]. 肠黏膜上皮细胞相互连接, 形成了一个完整的生物屏障, 即肠上皮细胞屏障. 肠上皮细胞间的连接, 从顶端到基膜依次为紧密连接、黏附连接、桥粒和缝隙连接等, 其中以肠上皮细胞间的紧密连接(tight junction)最为重要. 肠上皮细胞紧密连接存在于靠近顶侧(肠腔侧)的细胞侧面, 是一个动态变化的、由多种蛋白及分子组成、具有多种功能的复合体. 上皮细胞紧密连接由紧密连接蛋白所构成, 这些蛋白主要包括闭锁蛋白(occludin)、Claudin、连接相关分子(JAM)等跨膜蛋白, 和闭锁小带(ZO)、丝状肌动蛋白等30多种胞内蛋白. 跨膜蛋白在细胞外与相邻细胞的跨膜蛋白相互作用, 封闭了细胞间的空隙. 跨膜蛋白在细胞内与ZO蛋白家族(包括ZO-1, ZO-2, 和ZO-3)、丝状肌动蛋白等胞内蛋白相互连接, 并被这些胞内蛋白固定(图1). 细胞间的紧密连接封闭了相邻肠上皮细胞间的空隙, 阻止肠腔内细菌、抗原等物质进入肠黏膜固有层激活固有层免疫细胞, 维护肠黏膜屏障功能的稳定, 避免了黏膜异常免疫反应的发生. 并且, 肠上皮细胞间的紧密连接在维持上皮细胞的形态结构、调节上皮细胞的分化、修复及细胞间物质运输、维护肠黏膜屏障功能和肠黏膜通透性等方面发挥了重要作用[5].
上皮细胞紧密连接主要由肌球蛋白轻链(myosin light chain, MLC)所调节, MLC被Rho相关激酶(ROCK)和肌球蛋白轻链激酶(MLCK)等激酶磷酸化, 磷酸化MLC(pMLC)经肌球蛋白Ⅱ让含有紧密连接蛋白的细胞膜被细胞内吞(endocytosis), 在细胞质形成空泡, 跨膜蛋白随之降解[6].
肠黏膜黏液层主要由肠黏膜杯状细胞、上皮细胞分泌的黏蛋白(mucin, MUC)所组成, 黏蛋白为糖蛋白, 主要由MUC1、MUC2、MUC3、MUC4、MUC5AB、MUC5AC、MUC6等组成[7]. 其中, 结肠的黏液层以MUC2为主, 而MUC3的表达则较少; 小肠的黏液层则以MUC3为主. 上皮细胞表达MUC, 受肠腔内微生物因素、短链脂肪酸等调节, 例如, 乳酸杆菌通过黏附肠上皮细胞, 诱导上皮细胞表达MUC2、MUC3, 并阻止致病性大肠杆菌对肠上皮细胞的黏附及损伤[8]; 丁酸盐也能诱导杯状细胞表达MUC[9].
IBD患者肠黏膜通透性是否增高尚存有争议, 有的学者认为, 与正常人群相比, IBD患者及直系亲属的肠黏膜通透性并不升高[10]; 而其他学者认为, IBD患者及直系亲属的肠黏膜通透性较正常人升高, 并且与CARD15基因突变具有很强的相关性[11]. 目前普遍认为, 肠黏膜屏障功能异常参与了IBD的发病, IBD发病时肠黏膜屏障功能异常, 肠腔内抗原物质向肠黏膜固有层移位并激活固有层免疫细胞, 导致大量炎症细胞因子及介质的产生, 所产生的炎症分子进一步损伤肠黏膜屏障功能[3]. IBD肠黏膜屏障功能异常与如下因素有关.
很多病理因素及肠道细菌感染能诱导肠上皮细胞发生凋亡, 例如, 沙门氏菌、致病性大肠杆菌、志贺氏痢疾杆菌、幽门螺杆菌、空肠弯曲杆菌等细菌对肠上皮细胞具有一定的黏附性, 通过对细胞的黏膜后侵入上皮细胞, 并诱导肠上皮细胞凋亡[12]. 另外, γ射线、活性氧自由基等物理及化学因素能直接损伤细胞DNA, 或激活线粒体凋亡途径, 诱导细胞凋亡[13-14].
IBD发病时, 大量的肠黏膜上皮细胞发生凋亡[15-16], 与凋亡细胞相邻的上皮细胞不能有效地封闭凋亡细胞所留下的空间, 导致肠黏膜通透性增高. 肠黏膜上皮细胞凋亡, 与炎症肠黏膜上皮层内淋巴细胞及固有层免疫细胞所产生的炎症细胞因子、炎症介质、活性氧自由基等有关, 这些细胞因子如TNF-α、INF-γ等能诱导上皮细胞内凋亡相关蛋白如Caspase-1的表达, 而抑制抗凋亡蛋白如Bcl-2等表达, 诱导上皮细胞发生凋亡[17-18]. 并且, 炎症肠黏膜的免疫细胞、炎症分子等能诱导肠上皮细胞表达Fas, 经Fas-FasL途径诱导上皮细胞凋亡[19].
有效地抑制肠上皮细胞凋亡, 能明显改善肠黏膜屏障功能. 针对炎症细胞因子诱导肠上皮细胞凋亡的关键作用, 有的学者通过使用这些炎症细胞因子特异性中和抗体治疗IBD, 发现炎症细胞因子的中和抗体能阻止炎症组织中肠上皮细胞发生凋亡, 降低肠黏膜通透性[20]. Steinkam et al发现, 肠黏膜神经胶质所分泌的神经营养因子能明显改善肠黏膜屏障功能, 其机制为神经营养因子激活上皮细胞内MAPK及Akt等蛋白, 抑制炎症组织中肠上皮细胞发生凋亡[21].
IBD患者炎症肠黏膜紧密连接蛋白的表达及分布出现异常. Gassler et al发现, IBD患者炎症肠黏膜紧密连接蛋白的表达明显降低, 而炎症未累及的肠黏膜上皮细胞紧密连接蛋白的表达与正常人群的表达无差异, 说明上皮细胞紧密连接蛋白表达异常仅见于炎症肠组织[22]. IBD炎症肠黏膜上皮细胞紧密连接蛋白的表达及分布出现异常, 主要由炎症肠黏膜高表达的细胞因子诱导所致. 同时, 动物实验发现, 若先天性基因敲除上皮细胞紧密连接蛋白, 该基因缺陷动物出生后会出现类似IBD的肠道病理改变[23], 说明上皮细胞紧密连接蛋白表达、分布异常, 可能参与了IBD的发病.
在IBD发病早期, 肠黏膜IFN-γ水平明显增高[17], Utech et al发现, IFN-γ不仅能直接抑制上皮细胞紧密连接蛋白Occludin、Claudin-1/4、JAM-1等表达, 并能上调Rho相关激酶(ROCK)和肌球蛋白轻链激酶(MLCK)等紧密连接调节蛋白的表达[24], 促使紧密连接蛋白被细胞内吞, 即紧密连接蛋白在细胞的分布发生异常, 并被降解, 导致肠黏膜通透性增高. TNF-α不仅能直接影响上皮细胞紧密连接蛋白表达及分布, 并能与IFN-γ呈协同作用, 诱导MLCK等紧密连接调节蛋白的表达[2]. IBD炎症肠黏膜高表达的其他细胞因子如IL-15、IL-2、IL-1β等也能影响上皮细胞紧密连接蛋白表达及分布[25-26].
最近, 有关IL-13对肠上皮细胞紧密连接蛋白表达影响的研究引人注目. Heller et al研究发现, 小鼠恶唑酮结肠炎模型的肠黏膜自然杀伤T细胞分泌大量的IL-13[27]. 这些学者还发现溃疡性结肠炎(UC)肠黏膜固有层细胞高表达IL-13[28], 他们认为IL-13为UC的重要致炎细胞因子, 在UC发病中发挥重要的作用. 其他学者发现, IL-13能增高肠黏膜通透性, 损伤肠黏膜屏障功能[29], 并且, 受IL-13的诱导, 上皮细胞Claudin-2的表达也平行增高, Claudin-2能诱导肠黏膜针对小分子物质的通透性增高, 导致UC临床症状的出现, 如腹泻等[30].
其他的一些致病因子也能影响肠黏膜上皮细胞紧密连接蛋白的表达及分布. McDermott et al发现[31], 线虫感染能诱导正常小鼠肠黏膜通透性增高, 但对基因敲除肥大细胞特异性蛋白酶的小鼠肠黏膜通透性没有任何影响, 说明线虫感染通过诱导肥大细胞释放特异性蛋白酶, 损伤肠黏膜屏障功能. 其他致病因素如致病菌通过释放内毒素, 或直接侵袭, 影响肠黏膜上皮细胞紧密连接蛋白的表达及分布[32].
有些保护因素能调节肠黏膜上皮细胞紧密连接蛋白的表达及分布, 保护肠黏膜屏障功能. Boivin et al发现, 糖皮质激素在Caco-2细胞核内与其受体结合, 形成糖皮质激素-受体复合物后与MLCK的启动子结合, 阻止了TNF-α所诱导的MLCK等紧密连接调节蛋白的表达及上皮细胞通透性的增高[33]. 其他的因素如益生菌、维生素D等也能保护肠黏膜屏障. 益生菌黏附肠黏膜上皮细胞后, 能诱导肠黏膜上皮细胞紧密连接蛋白的表达[34]. 维生素D不仅能调节免疫细胞的功能, 还能保护肠黏膜屏障. 维生素D缺乏时肠黏膜屏障更容易受损伤, IBD发病的危险性也增高[35].
黏蛋白主要由肠黏膜杯状细胞、柱状上皮细胞等表达, 损伤肠黏膜杯状细胞、柱状上皮细胞及影响这些功能的因素, 如炎症细胞因子、致病菌、放射线等, 都能抑制黏蛋白的表达. UC肠黏膜杯状细胞的数量明显减少, 导致MUC2的表达降低, 黏液层的厚度也较正常人薄[36-37], 并且, 黏液层中硫酸黏蛋白含量减少, 唾黏蛋白的含量增高, 上述黏液层的厚度及成份的改变与UC病情相关[38]. 由于克罗恩病(CD)的病变部位主要在小肠, 病变未累及结肠的CD患者结肠黏膜杯状细胞的数量变化不明显, 黏液层的成分及厚度与正常人相当. 不过, 由于小肠的黏液屏障主要由MUC3、MUC4、MUC5B等组成, 病变小肠的黏液层中MUC3、MUC4、MUC5B含量降低[39]. IBD患者上述黏液屏障的改变, 导致黏蛋白功能下降, 不能有效地清除肠黏膜表面所黏附的细菌, 黏液层中细菌含量增多, 容易诱导、加剧肠黏膜炎症反应.
目前普遍认为, 肠黏膜屏障功能障碍与IBD发病关系密切, 精神压力、肠道感染、机械损伤等因素能诱导肠黏膜屏障功能异常, 使黏膜通透性增高, 导致肠腔内细菌、抗原等物质移位至黏膜固有层而激活免疫细胞, 诱导黏膜免疫反应的发生, 另一方面, IBD发病时, 一些损伤性因素能破坏肠黏膜屏障, 加重黏膜异常免疫反应. 并且, 治疗IBD的药物不仅能抑制肠黏膜炎症反应, 还能有效地调节肠黏膜屏障功能. 改善肠黏膜屏障功能是IBD治疗的目标之一, 也是IBD的病理生理学研究热点. 目前国外有关肠黏膜屏障及功能的研究较多, 方法学也比较成熟, 但国内肠黏膜屏障功能的相关研究尚较少, 今后有必要加强肠黏膜屏障功能的研究, 尤其是与IBD发病关系的研究.
肠黏膜屏障是指将肠腔内细菌、抗原等物质与肠黏膜固有层免疫细胞隔离开, 避免固有层免疫细胞激活的肠黏膜结构, 主要由肠黏膜基底膜、上皮细胞层及其表面的黏液层所构成. 目前普遍认为, 肠黏膜屏障功能异常是IBD发病的分子基础, IBD发病时肠黏膜屏障功能异常, 肠腔内抗原物质向肠黏膜固有层移位, 进一步激活固有层免疫细胞, 导致肠黏膜异常炎症反应.
潘秀珍, 教授, 福建省立医院消化研究室; 任建林, 教授, 厦门大学附属中山医院消化内科
改善肠黏膜屏障功能是IBD治疗的目标之一, 也是IBD的病理生理学研究热点.
目前普遍认为, 肠黏膜屏障功能异常参与了IBD的发病, IBD发病时肠黏膜屏障功能异常, 肠腔内抗原物质向肠黏膜固有层移位并激活固有层免疫细胞, 导致大量炎症细胞因子及介质的产生, 所产生的炎症分子进一步损伤肠黏膜屏障功能.
本文内容较重要, 设计构思合理, 对IBD的发病原因有进一步的了解, 有利于IBD的临床防治.
编辑: 李军亮 电编: 何基才
| 1. | Lewis K, Caldwell J, Phan V, Prescott D, Nazli A, Wang A, Soderhölm JD, Perdue MH, Sherman PM, McKay DM. Decreased epithelial barrier function evoked by exposure to metabolic stress and nonpathogenic E. coli is enhanced by TNF-alpha. Am J Physiol Gastrointest Liver Physiol. 2008;294:G669-G678. [PubMed] [DOI] |
| 2. | Bruewer M, Luegering A, Kucharzik T, Parkos CA, Madara JL, Hopkins AM, Nusrat A. Proinflammatory cytokines disrupt epithelial barrier function by apoptosis-independent mechanisms. J Immunol. 2003;171:6164-6172. [PubMed] |
| 3. | Xavier RJ, Podolsky DK. Unravelling the pathogenesis of inflammatory bowel disease. Nature. 2007;448:427-434. [PubMed] [DOI] |
| 4. | Arrieta MC, Bistritz L, Meddings JB. Alterations in intestinal permeability. Gut. 2006;55:1512-1520. [PubMed] [DOI] |
| 5. | Turner JR. Molecular basis of epithelial barrier regulation: from basic mechanisms to clinical application. Am J Pathol. 2006;169:1901-1909. [PubMed] [DOI] |
| 6. | Laukoetter MG, Bruewer M, Nusrat A. Regulation of the intestinal epithelial barrier by the apical junctional complex. Curr Opin Gastroenterol. 2006;22:85-89. [PubMed] [DOI] |
| 7. | Corfield AP, Myerscough N, Longman R, Sylvester P, Arul S, Pignatelli M. Mucins and mucosal protection in the gastrointestinal tract: new prospects for mucins in the pathology of gastrointestinal disease. Gut. 2000;47:589-594. [PubMed] [DOI] |
| 8. | Mack DR, Ahrne S, Hyde L, Wei S, Hollingsworth MA. Extracellular MUC3 mucin secretion follows adherence of Lactobacillus strains to intestinal epithelial cells in vitro. Gut. 2003;52:827-833. [PubMed] [DOI] |
| 9. | Gaudier E, Jarry A, Blottière HM, de Coppet P, Buisine MP, Aubert JP, Laboisse C, Cherbut C, Hoebler C. Butyrate specifically modulates MUC gene expression in intestinal epithelial goblet cells deprived of glucose. Am J Physiol Gastrointest Liver Physiol. 2004;287:G1168-G1174. [PubMed] [DOI] |
| 10. | Vermeire S, Peeters M, Vlietinck R, Joossens S, Den Hond E, Bulteel V, Bossuyt X, Geypens B, Rutgeerts P. Anti-Saccharomyces cerevisiae antibodies (ASCA), phenotypes of IBD, and intestinal permeability: a study in IBD families. Inflamm Bowel Dis. 2001;7:8-15. [PubMed] [DOI] |
| 11. | Buhner S, Buning C, Genschel J, Kling K, Herrmann D, Dignass A, Kuechler I, Krueger S, Schmidt HH, Lochs H. Genetic basis for increased intestinal permeability in families with Crohn's disease: role of CARD15 3020insC mutation? Gut. 2006;55:342-347. [PubMed] [DOI] |
| 12. | Ramachandran A, Madesh M, Balasubramanian KA. Apoptosis in the intestinal epithelium: its relevance in normal and pathophysiological conditions. J Gastroenterol Hepatol. 2000;15:109-120. [PubMed] [DOI] |
| 13. | Kolesnick R, Fuks Z. Radiation and ceramide-induced apoptosis. Oncogene. 2003;22:5897-5906. [PubMed] [DOI] |
| 14. | Naito Y, Takagi T, Yoshikawa T. Molecular fingerprints of neutrophil-dependent oxidative stress in inflammatory bowel disease. J Gastroenterol. 2007;42:787-798. [PubMed] [DOI] |
| 15. | Di Sabatino A, Ciccocioppo R, Luinetti O, Ricevuti L, Morera R, Cifone MG, Solcia E, Corazza GR. Increased enterocyte apoptosis in inflamed areas of Crohn's disease. Dis Colon Rectum. 2003;46:1498-1507. [PubMed] [DOI] |
| 16. | Hagiwara C, Tanaka M, Kudo H. Increase in colorectal epithelial apoptotic cells in patients with ulcerative colitis ultimately requiring surgery. J Gastroenterol Hepatol. 2002;17:758-764. [PubMed] [DOI] |
| 17. | Bouma G, Strober W. The immunological and genetic basis of inflammatory bowel disease. Nat Rev Immunol. 2003;3:521-533. [PubMed] [DOI] |
| 18. | Koshiji M, Adachi Y, Sogo S, Taketani S, Oyaizu N, Than S, Inaba M, Phawa S, Hioki K, Ikehara S. Apoptosis of colorectal adenocarcinoma (COLO 201) by tumour necrosis factor-alpha (TNF-alpha) and/or interferon-gamma (IFN-gamma), resulting from down-modulation of Bcl-2 expression. Clin Exp Immunol. 1998;111:211-218. [PubMed] [DOI] |
| 19. | Souza HS, Tortori CJ, Castelo-Branco MT, Carvalho AT, Margallo VS, Delgado CF, Dines I, Elia CC. Apoptosis in the intestinal mucosa of patients with inflammatory bowel disease: evidence of altered expression of FasL and perforin cytotoxic pathways. Int J Colorectal Dis. 2005;20:277-286. [PubMed] [DOI] |
| 20. | Zeissig S, Bojarski C, Buergel N, Mankertz J, Zeitz M, Fromm M, Schulzke JD. Downregulation of epithelial apoptosis and barrier repair in active Crohn's disease by tumour necrosis factor alpha antibody treatment. Gut. 2004;53:1295-1302. [PubMed] [DOI] |
| 21. | Steinkamp M, Geerling I, Seufferlein T, von Boyen G, Egger B, Grossmann J, Ludwig L, Adler G, Reinshagen M. Glial-derived neurotrophic factor regulates apoptosis in colonic epithelial cells. Gastroenterology. 2003;124:1748-1757. [PubMed] [DOI] |
| 22. | Gassler N, Rohr C, Schneider A, Kartenbeck J, Bach A, Obermüller N, Otto HF, Autschbach F. Inflammatory bowel disease is associated with changes of enterocytic junctions. Am J Physiol Gastrointest Liver Physiol. 2001;281:G216-G228. [PubMed] |
| 23. | Hermiston ML, Gordon JI. Inflammatory bowel disease and adenomas in mice expressing a dominant negative N-cadherin. Science. 1995;270:1203-1207. [PubMed] [DOI] |
| 24. | Utech M, Ivanov AI, Samarin SN, Bruewer M, Turner JR, Mrsny RJ, Parkos CA, Nusrat A. Mechanism of IFN-gamma-induced endocytosis of tight junction proteins: myosin II-dependent vacuolarization of the apical plasma membrane. Mol Biol Cell. 2005;16:5040-5052. [PubMed] [DOI] |
| 25. | Nishiyama R, Sakaguchi T, Kinugasa T, Gu X, MacDermott RP, Podolsky DK, Reinecker HC. Interleukin-2 receptor beta subunit-dependent and -independent regulation of intestinal epithelial tight junctions. J Biol Chem. 2001;276:35571-35580. [PubMed] [DOI] |
| 26. | Al-Sadi RM, Ma TY. IL-1βeta causes an increase in intestinal epithelial tight junction permeability. J Immunol. 2007;178:4641-4649. [PubMed] |
| 27. | Heller F, Fuss IJ, Nieuwenhuis EE, Blumberg RS, Strober W. Oxazolone colitis, a Th2 colitis model resembling ulcerative colitis, is mediated by IL-13-producing NK-T cells. Immunity. 2002;17:629-638. [PubMed] [DOI] |
| 28. | Fuss IJ, Heller F, Boirivant M, Leon F, Yoshida M, Fichtner-Feigl S, Yang Z, Exley M, Kitani A, Blumberg RS. Nonclassical CD1d-restricted NK T cells that produce IL-13 characterize an atypical Th2 response in ulcerative colitis. J Clin Invest. 2004;113:1490-1497. [PubMed] |
| 29. | Heller F, Florian P, Bojarski C, Richter J, Christ M, Hillenbrand B, Mankertz J, Gitter AH, Bürgel N, Fromm M. Interleukin-13 is the key effector Th2 cytokine in ulcerative colitis that affects epithelial tight junctions, apoptosis, and cell restitution. Gastroenterology. 2005;129:550-564. [PubMed] |
| 30. | Amasheh S, Meiri N, Gitter AH, Schöneberg T, Mankertz J, Schulzke JD, Fromm M. Claudin-2 expression induces cation-selective channels in tight junctions of epithelial cells. J Cell Sci. 2002;115:4969-4976. [PubMed] [DOI] |
| 31. | McDermott JR, Bartram RE, Knight PA, Miller HR, Garrod DR, Grencis RK. Mast cells disrupt epithelial barrier function during enteric nematode infection. Proc Natl Acad Sci USA. 2003;100:7761-7766. [PubMed] [DOI] |
| 32. | Moriez R, Salvador-Cartier C, Theodorou V, Fioramonti J, Eutamene H, Bueno L. Myosin light chain kinase is involved in lipopolysaccharide-induced disruption of colonic epithelial barrier and bacterial translocation in rats. Am J Pathol. 2005;167:1071-1079. [PubMed] |
| 33. | Boivin MA, Ye D, Kennedy JC, Al-Sadi R, Shepela C, Ma TY. Mechanism of glucocorticoid regulation of the intestinal tight junction barrier. Am J Physiol Gastrointest Liver Physiol. 2007;292:G590-G598. [PubMed] [DOI] |
| 34. | Otte JM, Podolsky DK. Functional modulation of enterocytes by gram-positive and gram-negative microorganisms. Am J Physiol Gastrointest Liver Physiol. 2004;286:G613-G626. [PubMed] [DOI] |
| 35. | Kong J, Zhang Z, Musch MW, Ning G, Sun J, Hart J, Bissonnette M, Li YC. Novel role of the vitamin D receptor in maintaining the integrity of the intestinal mucosal barrier. Am J Physiol Gastrointest Liver Physiol. 2008;294:G208-G216. [PubMed] [DOI] |
| 36. | Shaoul R, Okada Y, Cutz E, Marcon MA. Colonic expression of MUC2, MUC5AC, and TFF1 in inflammatory bowel disease in children. J Pediatr Gastroenterol Nutr. 2004;38:488-493. [PubMed] [DOI] |
| 37. | Van Klinken BJ, Van der Wal JW, Einerhand AW, Büller HA, Dekker J. Sulphation and secretion of the predominant secretory human colonic mucin MUC2 in ulcerative colitis. Gut. 1999;44:387-393. [PubMed] |
| 38. | Einerhand AW, Renes IB, Makkink MK, van der Sluis M, Büller HA, Dekker J. Role of mucins in inflammatory bowel disease: important lessons from experimental models. Eur J Gastroenterol Hepatol. 2002;14:757-765. [PubMed] [DOI] |