修回日期: 2008-08-13
接受日期: 2008-08-19
在线出版日期: 2008-10-08
目的: 建立人巨细胞病毒(HCMV)先天性潜伏感染再激活致出血性坏死性肠炎BALB/c小鼠模型, 为HCMV致小肠炎发病机制及临床特异性诊断和抗病毒治疗奠定基础.
方法: 将HCMV先天性感染的小鼠饲养于SPF级屏障系统中, 18 mo后, 分别取病毒感染组18只、细胞对照组9只, 并按随机原则分别给病毒感染组中9只小鼠以及细胞对照组小鼠注射环磷酰胺, 建立HCMV潜伏再激活感染鼠模型. 采用无菌操作技术分别取细胞对照组、病毒潜伏组和病毒潜伏再激活组小鼠小肠组织, 进行病理组织学检查、体外细胞共培养分离病毒、PCR和RT-PCR检测HCMV UL83基因DNA及mRNA, 间接免疫荧光鉴定等.
结果: 病毒潜伏感染再激活组细胞共培养病毒分离实验发现小鼠小肠组织内病毒分离阳性, 在镜下可见HCMV在HF细胞内增殖产生特征性细胞病变, 病毒分离共培养物PCR检测到HCMV UL83 DNA, 间接免疫荧光检测可见苹果绿色阳性信号; 小鼠小肠组织PCR和RT-PCR分别检测到HCMV UL83 DNA和相应mRNA; HE染色镜检发现部分肠组织有非特异性小肠炎性病变, 有局灶性坏死及出血. 而病毒潜伏组仅小肠组织PCR检测到HCMV UL83 DNA, 出血和坏死现象不是很明显; 细胞对照组均是阴性.
结论: 成功构建了HCMV先天潜伏感染再激活小鼠小肠炎模型, 病理表现为出血性坏死性肠炎.
引文著录: 吴琼, 王明丽, 黄维, 赵俊, 胡雪影, 黎锐平. 人巨细胞病毒先天性潜伏感染再激活致小鼠肠炎. 世界华人消化杂志 2008; 16(28): 3157-3161
Revised: August 13, 2008
Accepted: August 19, 2008
Published online: October 8, 2008
AIM: To establish the model of hemorrhagic necrotic enteritis induced by reactivation of congenital latent infection of human cytomegalovirus (HCMV) in aged mice, and to explore the pathogenic mechanism of HCMV reactivation.
METHODS: Congenital latent HCMV-infected mice were raised in specific pathogen free (SPF) barrier system for 18 months. Eighteen virus-infected mice served as controls and 9 offspring mice were both treated with cyclophosphamide to reactivate the HCMV infection. Each group of the mice was sacrificed to obtain small intestine tissues for virus isolation. The expression of HCMV UL83 mRNA was determined using polymerase chain reaction (PCR), reverse transcription PCR (RT-PCR), HE staining and immunofluorescence with aseptic technique.
RESULTS: HCMV was isolated from the supernatant of small bowel tissue homogenate only in the group of infection-reactivated mice. Under microscopy, cytopathic effect caused by endogenous multiplication of HCMV in HF was observed. HCMV UL83 DNA was detected using PCR in the supernatant of cell culture with cytopathogenic effect (CPE). Masccline signal of apple green was seen using immunofluorescence. Pathological changes in bowels consisted of swollen cytoplasm, destroyed nuclei of enterocyte, distinct intranuclear inclusion in the enterocyte, and predominant infiltration of phagocytes. HCMV DNA was found by PCR in the group of infection-reactivated and latently-infected mice, but HCMV mRNA was only found in the group of infection-reactivated mice by RT-PCR.
CONCLUSION: A rat model of enteritis induced by reactivation of congenital latent HCMV infection was successfully established, and its pathological presentations indicate hemorrhagic necrotic enteritis.
- Citation: Wu Q, Wang ML, Huang W, Zhao J, Hu XY, Li RP. Enteritis induced by reactivation of congenital latent infection of human cytomegalovirus in mice. Shijie Huaren Xiaohua Zazhi 2008; 16(28): 3157-3161
- URL: https://www.wjgnet.com/1009-3079/full/v16/i28/3157.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i28.3157
人巨细胞病毒(human cytomegalovirus, HCMV)属β-疱疹病毒亚科, 是一种双股线形DNA病毒. HCMV在人群中感染非常普遍, 大多呈潜伏感染状态[1], 血清学检测发现: 发达国家及发展中国家的成人感染率分别为60%和90%[2-3]. HCMV已是胎儿先天性感染的最重要病因之一. 先天性感染又称宫内感染: 指由HCMV感染母亲所生育的子女于生后14 d内证实有HCMV感染[4]. 在新生儿中有0.2%-2.2%发生HCMV的先天性感染[5], 90%的先天性感染婴儿不出现明显的临床症状[6], 由于感染后病毒不能被彻底清除, 先天性感染后常出现HCMV长期或终生存在于宿主体内, 表现为潜伏感染状态. 此时患者体内无感染性子代病毒颗粒产生, 但在潜伏感染的细胞内可发现以不同形式存在于细胞核内的病毒基因组及其部分转录产物; 此种潜伏状态可被外来刺激因素(如机体免疫状态改变)激活而形成活动性感染. 潜伏感染状态对健康个体并没有危害, 而对免疫功能低下者, 如器官、骨髓移植患者和艾滋病患者等, 可导致视网膜炎、肺炎及脑炎等严重危及生命的疾病. HCMV潜伏感染还是老年人群的重要免疫风险表型(immune risk phenotype, IRP), 直接影响老年人的健康和寿命. Powell et al[7]研究报道, 溃疡性结肠炎与巨细胞包涵体病有关, 近年来的研究表明, HCMV 感染可导致胃肠道疾病, 尤其以婴幼儿、器官移植及艾滋病患者多见, 在这些病例中, 患者大多以急性肠炎、溃疡性结肠炎等多见, 少数发生胃肠道肿瘤[8]. 该病毒所致的胃肠病理改变主要为典型的黏膜充血、水肿、溃疡、出血、坏死等, 临床表现主要为腹痛、腹泻、消化道出血或穿孔等, 少数患者出现中毒性巨结肠症状. 这些患者在检测出HCMV之前一般均接受了一段时间的皮质激素治疗, 部分患者接受免疫抑制治疗和结肠切除术等, 死亡率高达44%[9]. 由于目前临床上对HCMV所致消化道感染尚不能明确诊断和有效治疗, 针对这一现况, 我室在长期从事人巨细胞病毒致病机制研究基础上, 结合临床需求, 建立了HCMV潜伏再激活致小鼠小肠炎模型, 观察到HCMV对小肠有明显致病作用. 现将结果报告如下.
HCMV UL83基因引物是采用Primer5.0软件设计, 由上海生工生物技术服务有限公司合成. HCMV UL83(HCMV主要被膜磷蛋白pp65编码的基因, 位于119352-121037, 全长1686 bp)引物: Primer: (sense)5'-GAGGACCTGACGATGACCCG-3'(antisense)5'-TCTGACCCTGAACCGTAGCC-3'此对引物分别位于HCMV UL83基因第754-773 bp和1500-1519 bp处, DNA和mRNA的产物长度皆为766 bp. 莱卡倒置荧光显微镜(Leica德国)、基因扩增仪(Hema8000, 珠海黑马医学仪器有限公司)、紫外凝胶成像系统(BioSens SC720型)等. 6-8代的人成纤维细胞株(HF), 安徽医科大学微生物教研室制备. HCMV AD169株由上海复旦大学医学院微生物学教研室提供, 使用前进行病毒复苏及增毒.
1.2.1 分组和造模: 参考文献[10-11], 本实验分为3组: 细胞对照组、病毒潜伏组和病毒潜伏再激活组. 首先建立HCMV先天性感染小鼠的模型, 将子代小鼠(病毒感染组、细胞对照组)饲养于SPF级屏障系统中18 mo, 期间小鼠生长, 发育状况正常, SPF级屏障系统由上海市实验动物质量监督检验站检测. 本次实验从子代小鼠中分别取病毒感染组18只、细胞对照组9只. 随机将病毒感染组中半数进行环磷酰胺激活, 建立HCMV潜伏再激活感染鼠模型. 将细胞对照组和病毒潜伏再激活组即病毒感染组小鼠按照实验设计注射环磷酰胺(剂量150 mg/kg, 每6天1次, 共3次), 最后1次激活后6 d颈椎脱臼处死动物, 无菌取小肠组织进行有关检测.
1.2.2 病理学观察: 取处死后小鼠的小肠组织, 常规病理固定, 石蜡包埋切片, HE染色, 光镜下观察.
1.2.3 体外细胞共培养分离病毒: 参照文献病毒分离[12], 无菌取小鼠小肠组织, 将其制备成1×109/L肠细胞悬液, 取细胞悬液接种到已经长满单层HF细胞的12孔培养板内, 37 ℃、50 mL/L CO2培养箱培养, 同时设正常细胞对照及HCMV AD169株阳性对照(各组均做3孔). 24 h后换维持液, 1 wk后盲传, 每周1次, 共3次. 观察CPE.
1.2.4 体外细胞共培养物PCR鉴定: 对出现特征性CPE者, 取上清液检测HCMV DNA. 按常规碱裂解法抽提小鼠小肠组织及细胞中的DNA, 并以此为模板进行PCR扩增(条件: 95 ℃ 2 min, 95 ℃ 1 min, 62 ℃ 45 s, 72 ℃ 1 min, 72 ℃ 10 min, 30循环), 将PCR扩增产物进行琼脂糖凝胶电泳, 经紫外透射仪观察凝胶电泳情况后, 再利用紫外凝胶成像系统拍照、记录.
1.2.5 体外细胞共培养物免疫荧光鉴定: 载有单层细胞培养物的盖玻片经40 g/L多聚甲醛固定后加10 g/L Triton×100, 37 ℃作用10 min, 加5%脱脂奶粉稀释的HCMV pp65 mAb的一抗(1:30)以盖满标本为准, 置于湿盒中4 ℃过夜, PBS 洗涤3次后, 覆盖上伊文斯蓝稀释的羊抗小鼠FITC-IgG(1:30), 37 ℃作用1 h后PBS洗涤3次. 900 mL/L甘油封片, 荧光显微镜下观察并记录结果.
1.2.6 小鼠小肠组织PCR及RT-PCR鉴定: 按常规方法抽提小鼠小肠组织中的DNA和RNA(RNA用DNA酶处理), 然后分别进行PCR、RT-PCR以及电泳检测等.
统计学处理 用SPSS11.0软件对实验数据进行录入统计, 结果以mean±SD表示, P<0.01为差异有统计学意义.
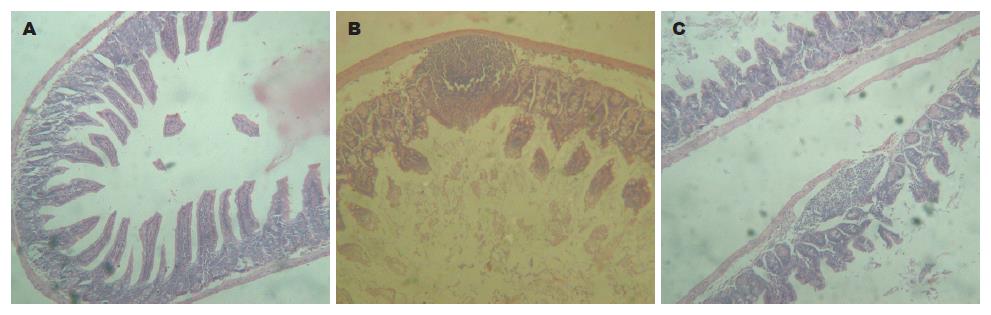
通过HE染色镜下观察, 发现病毒潜伏组以及病毒潜伏再激活组小肠黏膜结构已发生破坏, 被弥漫性出血所代替, 出血坏死已累及黏膜下肌层, 肠黏膜层可见大量炎症细胞呈弥散分布, 主要为淋巴细胞, 浆细胞及单核巨噬细胞. 肠黏膜部分绒毛及腺体已破坏, 层次结构消失, 坏死区被红色流出物所代替. 正常对照组小鼠小肠切片病理染色未见明显改变(图1).
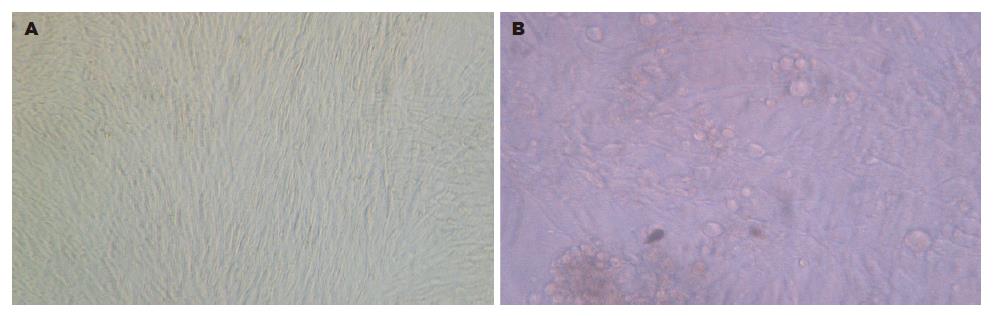
细胞对照组及病毒潜伏组小鼠的小肠组织研磨过滤后接种HF细胞, 4 wk内未观察到HCMV特征性CPE, 盲传3代后, CPE仍为阴性. 用HCMV特异性引物扩增后, 未见特异性条带, 病毒潜伏再激活组小肠组织匀浆接种HF细胞后3 wk左右, HF细胞开始肿胀、核变大, 形成巨核细胞, 病变在3-4 wk时最明显, 呈局灶性(图2), 用HCMV UL83基因特异性引物扩增后, 可见特异性条带.
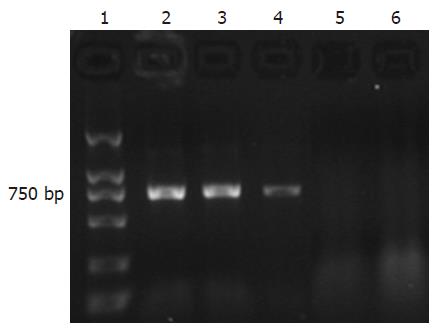
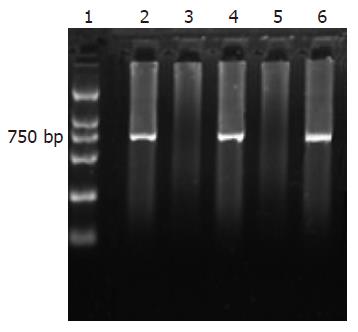
PCR检测病毒潜伏组激活前后小鼠小肠组织在766 bp处均可见到HCMV UL83基因特异性条带, 细胞对照组则均为阴性(图3).
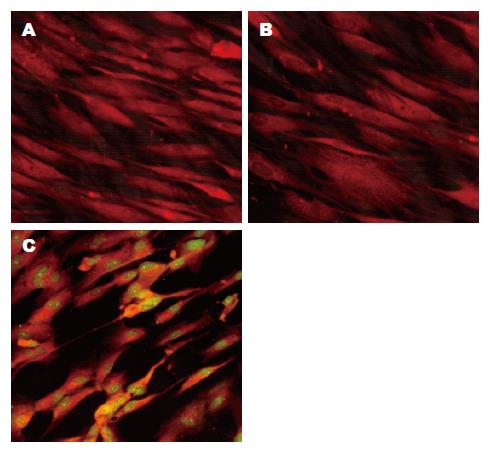
用HCMV pp65 mAb对HCMV先天性潜伏感染再激活组小鼠小肠细胞培养物进行间接免疫荧光检测, 可见苹果绿色荧光阳性信号位于被病毒感染的HF细胞的细胞核中, 并且随着培养时间的延长荧光信号逐渐增强, 胞核内出现阳性荧光信号. HCMV先天性潜伏感染组及细胞对照组均未见任何阳性信号(图4).
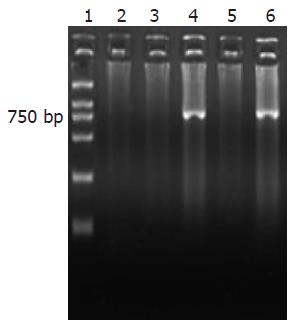
PCR检测病毒潜伏组激活前后小鼠小肠组织在766 bp处均可见到HCMV UL83基因特异性条带, 细胞对照组则均为阴性; RT-PCR产物凝胶电泳中只有病毒潜伏再激活组小肠组织在766 bp处显示有HCMV UL83基因的转录产物存在(图5-6).
HCMV在人群中感染非常普遍, 大多呈潜伏感染状态, 该状态下病毒不能被彻底清除, 而是以潜伏感染的状态长期或终生存在于宿主体内, 并且可被外来刺激因素(如机体免疫状态改变)激活而形成活动性感染. 近年来, Hertel et al学者提出HCMV感染与消化系统疾病存在一定相关性, 消化道上皮细胞既是HCMV攻击的靶细胞, 又是HCMV潜伏的位点[13]. 在炎症反应过程中, HCMV能刺激T细胞产生IL-2、TNF-β、INF-α等细胞因子, 调节白细胞迁移、HLA分子表达、抗原呈现, 诱导参与免疫反应的细胞黏附分子的表达[14], 进一步促进炎症反应, 加重疾病症状. 此外HCMV感染还可导致消化系统局部组织炎症、血管内皮细胞受损、黏膜缺血损伤, 最终导致血管闭塞、组织溃疡、出血、坏死等. 但由于没有良好的HCMV感染消化系统动物模型, 所以研究一直没有取得突破性进展.
本研究在已建立的HCMV先天性潜伏感染模型的基础上, 通过环磷酰胺降低HCMV先天性潜伏感染小鼠机体免疫力[15], 是潜伏感染的病毒再激活. 实验分为3组: 细胞对照组、病毒潜伏组和病毒潜伏再激活组, 采用细胞共培养病毒分离、间接免疫荧光、PCR及RT-PCR来确定模型的感染状态. 细胞共培养病毒分离试验发现病毒潜伏再激活组小鼠小肠组织分离出HCMV, 病毒分离阳性; 潜伏感染组以及细胞对照组小鼠病毒分离结果均为阴性; PCR以及RT-PCR结果显示, 病毒潜伏再激活组小鼠均呈阳性; 而病毒潜伏组小鼠HCMV UL83基因不转录, PCR可检测出UL83 DNA, RT-PCR检测不出相应的mRNA; 细胞对照组小鼠PCR、RT-PCR结果均为阴性. 以上结果说明本研究建立的小鼠模型感染状态与实验设计相符合. 病理学方法观察了小鼠发现病毒潜伏组以及病毒潜伏再激活组小鼠小肠组织黏膜结构已发生不同程度的病理损害, 尤其是再激活组被弥漫性出血所代替, 出血坏死可累及黏膜下肌层, 肠黏膜层可见大量炎症细胞呈弥散分布, 主要为淋巴细胞, 浆细胞及单核巨噬细胞. 肠黏膜部分绒毛及腺体已破坏, 层次结构消失, 坏死区被红色流出物所代替. 而细胞对照组小鼠小肠切片病理染色未见明显改变.
本试验通过对先天性潜伏感染的小鼠模型以及再激活的研究表明, 该模型可以较好地模拟人HCMV先天性感染后在患者体内长期潜伏以及潜伏再激活两种感染状态, 为研究HCMV先天性潜伏感染再激活导致严重临床消化道病症的临床诊断机制研究、药物筛选及疫苗的研制和应用提供了可靠的实验平台.
近年来的研究表明, 胃肠道疾病与巨细胞包涵体病有关, 但其发生机制, 临床诊断机制研究、药物筛选及疫苗的研制和应用尚不明确.
赵平, 副教授, 中国人民解放军第二军医大学微生物学教研室; 李杰, 副教授, 北京大学医学部基础医学院病原生物学系
近年来, 关于消化道疾病与HCMV的研究已有部分报道, 但目前临床上对HCMV所致消化道感染仍不能明确诊断和有效治疗.
本次实验建立了HCMV先天性潜伏感染的小鼠模型, 通过环磷酰胺的再激活, 成功构建了小鼠的肠炎模型.
本研究建立的HCMV先天性潜伏感染的小鼠模型, 为研究HCMV先天性潜伏感染再激活导致严重临床消化系病症的临床诊断机制、药物筛选及疫苗研制和应用提供了可靠的实验平台.
1 先天性感染: 又称宫内感染, 指由HCMV感染母亲所生育的子女于生后14 d内证实有HCMV感染.
2 潜伏感染再激活: 病毒的潜伏感染状态在外来刺激因素的作用下, 被激活而形成复发性感染, 从而导致免疫功能尚未成熟或低下的个体表现出明显的临床症状.
本研究成功建立了HCMV先天性感染再激活的小鼠模型, 观察到典型的肠炎病理改变, 对于进一步研究其致病机制具有一定价值, 不足之处在于一些研究结果或设计的严谨性有待斟酌.
编辑: 李军亮 电编: 何基才
| 1. | de Souza S, Bonon SH, Costa SC, Rossi CL. Evaluation of an in-house specific immunoglobulin G (IgG) avidity ELISA for distinguishing recent primary from long-term human cytomegalovirus (HCMV) infection. Rev Inst Med Trop Sao Paulo. 2003;45:323-326. [PubMed] [DOI] |
| 2. | Drew WL, Paya CV, Emery V. Cytomegalovirus (CMV) resistance to antivirals. Am J Transplant. 2001;1:307-312. [PubMed] |
| 3. | Leśnikowski ZJ, Paradowska E, Przepiórkiewicz M, Olejniczak A, Emery VC. [Drugs against human cytomegalovirus]. Pol Merkur Lekarski. 2002;13:242-249. [PubMed] |
| 4. | 闻 玉梅. 现代医学微生物学. 第1版. 上海: 上海医科大学出版社 1999; 926-936. |
| 5. | Sweet C. The pathogenicity of cytomegalovirus. FEMS Microbiol Rev. 1999;23:457-482. [PubMed] [DOI] |
| 6. | 阎 凤亭, 李 芬. 先天性巨细胞病毒感染. 国外医学·妇幼保健分册. 1998;9:161-164. |
| 7. | Powell RD, Warner NE, Levine RS, Kirsner JB. Cytomegalic inclusion disease and ulcerative colitis; report of a case in a young adult. Am J Med. 1961;30:334-340. [PubMed] [DOI] |
| 8. | Rahbar A, Boström L, Lagerstedt U, Magnusson I, Söderberg-Naucler C, Sundqvist VA. Evidence of active cytomegalovirus infection and increased production of IL-6 in tissue specimens obtained from patients with inflammatory bowel diseases. Inflamm Bowel Dis. 2003;9:154-161. [PubMed] [DOI] |
| 9. | Hommes DW, Sterringa G, van Deventer SJ, Tytgat GN, Weel J. The pathogenicity of cytomegalovirus in inflammatory bowel disease: a systematic review and evidence-based recommendations for future research. Inflamm Bowel Dis. 2004;10:245-250. [PubMed] [DOI] |
| 11. | Mayo DR, Hsu HS, Lim F. Interactions between salmonellae and macrophages of guinea pigs. IV. Relationship between migration inhibition and antibacterial action of macrophages. Infect Immun. 1977;18:52-59. [PubMed] |
| 13. | Hertel L, Lacaille VG, Strobl H, Mellins ED, Mocarski ES. Susceptibility of immature and mature Langerhans cell-type dendritic cells to infection and immunomodulation by human cytomegalovirus. J Virol. 2003;77:7563-7574. [PubMed] [DOI] |
| 14. | Hahn G, Revello MG, Patrone M, Percivalle E, Campanini G, Sarasini A, Wagner M, Gallina A, Milanesi G, Koszinowski U. Human cytomegalovirus UL131-128 genes are indispensable for virus growth in endothelial cells and virus transfer to leukocytes. J Virol. 2004;78:10023-10033. [PubMed] [DOI] |
| 15. | Ma J, Wang YL, Hu HM, Fox BA, Si LS. [Mechanism of augmented anti-tumor immunity in reconstituted lymphopenic mice immunized with melanoma vaccine]. Zhonghua Zhongliu Zazhi. 2005;27:708-712. [PubMed] |