修回日期: 2008-08-17
接受日期: 2008-08-26
在线出版日期: 2008-09-28
目的: 建立乙型肝炎病毒(hepatitis B virus, HBV)B基因型亚型的检测方法, 并对其进行临床研究.
方法: 根据GenBank中20株Ba亚型, 10株Bj亚型以及25株C型全长基因组序列设计Ba、Bj亚型特异探针以及巢式PCR引物. 采用反向杂交技术将B亚型特异探针固定在芯片上, 通过与地高辛标记的扩增产物杂交检测B型HBV亚型. 对镇江地区200例B基因型HBV血清样本进行亚型分析并对患者HBV DNA YMDD变异进行检测, 通过对部分血清中的HBV DNA进行序列分析验证该方法的准确性.
结果: 200例B基因型HBV患者中, Ba亚型184例(92%), Bj亚型16例(8%). 在持续使用拉米呋啶的80例患者中, Bj亚型6(0%)例, 均无YMDD变异, Ba亚型74例, YMDD变异21(28.4%)例.
结论: 镇江地区B基因型HBV以Ba亚型为主, Ba、Bj亚型在服用拉米呋啶1年后发生YMDD变异的几率并无统计学上的显著差异.
引文著录: 龚玉华, 谭友文, 李春明, 金跃明, 吴翠松, 张圆海, 刁仁联. 乙型肝炎病毒B基因型亚型的检测. 世界华人消化杂志 2008; 16(27): 3091-3094
Revised: August 17, 2008
Accepted: August 26, 2008
Published online: September 28, 2008
AIM: To develop a new method of detecting subtypes of hepatitis B virus (HBV) genotype B and to investigate its clinical application and significance.
METHODS: The probes specific to Ba and Bj subtypes of HBV were designed according to the phylogenetic analysis of 20 Ba, 10 Bj and 25 genotype C complete HBV genome sequences in GenBank. This method was based on the principle of reverse hybridization with Dig-labeled amplicons hybridizing to type-specific oligonucleotide probes that were immobilized on slides. Two hundred genotype B serum samples in Zhenjiang area were detected using the oligonucleotide chip, including 20 (ASC) and 180 (CH). The results of randomly chosen sera were confirmed by direct sequencing.
RESULTS: Of 200 HBV genotype B, subtype Ba and Bj accounted for 92% (n = 184) and 8% (n = 16), respectively. Of 80 cases treated with Lamivudine for 12 months, there were 6 Bj subtypes without YMDD mutations, and there were 74 cases of Ba subtypes with 21 YMDD mutations.
CONCLUSION: Ba subtype prevails in Zhenjiang area. The oligonucleotide chip is a reliable and convenient tool for the detection of HBV subtype. There is no significant difference of the response to the therapy between the two subtypes.
- Citation: Gong YH, Tan YW, Li CM, Jin YM, Wu CS, Zhang YH, Diao RL. Detection of subtypes of hepatitis B virus genotype B. Shijie Huaren Xiaohua Zazhi 2008; 16(27): 3091-3094
- URL: https://www.wjgnet.com/1009-3079/full/v16/i27/3091.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i27.3091
依据HBV核苷酸序列异质性≥8%可分成A-H共8种基因型, 其中又可进一步分为各基因亚型[1]. 在东亚地区, HBV基因型以B、C型为主, 且C型致病性更强[2]. 但Kao et al[3]却发现B型患者更易发展成肝癌. 同一HBV基因型感染出现不同病情可能与不同亚型有关. 因此, 近年来各国学者渐渐关注不同HBV基因型亚型的临床意义, 特别是不同亚型的预后及其与耐药性产生的关系都需要更多的临床研究. Sugauchi et al[4]研究发现, 根据是否与C基因型在preC和C区发生重组将B型主要分为Ba和Bj 2个亚型. Ba亚型与C基因型重组发生在5'端nt1740-1838和3'端nt2443-2485, 主要在preC区nt606-746, 重组区preC的核苷酸和氨基酸序列与C型有高度同源性. Ba亚型与C基因型毒株的病毒学特点更相近, 其致病性、临床表现及治疗效果与C型相似. 国内关于HBV基因亚型的临床研究不多, 本文借助寡核苷酸芯片技术对我国镇江地区B基因型HBV亚型进行检测, 并研究不同亚型与耐药性产生的关系.
血清DNA抽提试剂盒(美国Promega公司); PCR引物、寡核苷酸探针、PCR体系采用日本TaKaRa公司产品; 核酸扩增PCR仪采用美国ABI公司2400型PCR仪; 基片为美国CEL公司CSS-100醛基化基片; 芯片制作采用美国Cartesian公司7500点样仪. 实验所用血清为2006-01/2007-03本院收集B基因型HBV DNA阳性血清200份, 其中无症状携带者(ASC)20例, 慢性肝炎患者(CH)180例, 在180例CH患者中, 持续使用拉米呋啶进行抗病毒治疗12 mo以上者80例. 无症状携带者肝功能正常无异常生理指标. 慢性患者出现持续的慢性炎症反应. 临床诊断标准依据2005年《慢性乙型肝炎防治指南》[5]. HBV DNA定量使用上海复星公司试剂盒进行. HBV基因分型方法见文献[6]报道. HBV病毒YMDD检测使用杭州博赛公司荧光检测试剂盒进行. 在进行分析前所有血清均保存于-20 ℃.
1.2.1 探针及引物设计: 首先, 我们根据日本学者Sugauchi et al[4]的报道, 在GenBank中找到了有全长基因组序列的Ba序列20个, Bj序列10个. 鉴于HBV Ba型在C区和C型发生了重组, 因此在设计Ba、Bj特异探针序列时必须考虑到C型的DNA序列, 为此我们将20条Ba、10条Bj以及25条C型全基因组序列利用DNAStar软件(美国)进行了多重联配. 根据比对结果, 在nt2600附近发现了Ba、Bj的特征序列. 针对这一区域, 我们设计一套nest PCR的引物及B型、Ba、C型探针各一条, Bj探针两条. 探针5'端通过一个Poly(T)16手臂分子与氨基连接, 外侧引物扩增序列650 bp, 内侧为400 bp, 内侧反向引物5'端为地高辛标记. 探针引物均由TaKaRa公司合成, 序列见表1.
| 探针 | 寡核苷酸序列 | t(℃) |
| B型 | AATGAAAACAGGAGACTAAAATT | 54.1 |
| C型 | TTACATACTCTGTGGAAGGTGG | 55.1 |
| Ba | ATCCCAATGTTACTAAATTGCC | 54.8 |
| Bj1 | GGACGCCCACAAGGTG | 56.2 |
| Bj2 | TTAATAATGCCTGCTAGATTTTATCC | 56.2 |
| 阳性对照 | CACCATATTCTTGGGAACAAGA | 59.0 |
| 质控对照 | GTCAACACATAGCGCCTCATTTT | 55.0 |
| 外侧正向引物 | CTTTACGGGGCTCTATTCTTCTACA | 59.4 |
| 外侧反向引物 | TAGGCTGCCTTCCTGACTGC | 58.6 |
| 内侧正向引物 | TTACGGGGCTCTATTCTTCTACAGT | 60.1 |
| 内侧反向引物 | Dig-AAAATGAGGCGCTATGTGTTGAC | 57.2 |
1.2.2 HBV DNA的前处理和扩增: 血清HBV DNA抽提按照试剂盒说明书进行, 100 μL血清加入100 μL裂解液, 经酚、氯酚、异戊醇(50:49:1)抽提, 取上清用异丙醇沉淀, 再经750 mL/L乙醇洗涤干燥, 溶于20 μL无菌水. PCR反应体系如下: (1×Buffer, 1.5 mmol/L MgCl2, 10 pmol/L引物各一条, dATP、dGTP、dCTP、dTTP各0.1 mmol/L, Taq酶1.25 U, 核酸提取物即模板DNA 1.5 μL). 两轮PCR扩增均在ABI 2400扩增仪上进行, 扩增参数均为: 94 ℃, 4 min; 35个循环(94 ℃, 30 s; 56 ℃, 30 s; 72 ℃, 30 s); 72 ℃, 4 min.
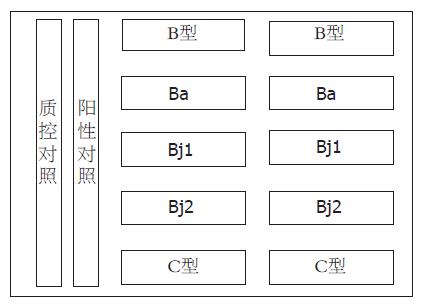
1.2.3 寡核苷酸芯片的制作: 将探针在点样液中稀释到终浓度10 µmol/L, 并使用点样仪Pixsys 7500将其点在醛基化的基片上. 每一个探针被点在排成一行的四个的点上. 质控对照和阳性对照被分别点在芯片阵列左边的第一、第二列处(图1), 点样完成后, 寡核苷酸芯片被置于25 ℃固定48 h, 干燥后备用.
1.2.4 杂交和扫描: 将2 μL带有Dig标记的第2次PCR产物, 混入10 μL DIG EASY Hyb杂交液中(加拿大Roche公司). 混合液95 ℃变性2 min, 然后在冰上冷却5 min. 将待杂交混合液置于芯片上的探针区域, 并盖上盖玻片(防止水分在杂交过程中蒸发), 置于37 ℃的湿盒中孵育30 min. 杂交后使用Roche配套的碱性磷酸酶标记抗体及显色体系进行显色, 取一块1 cm×1 cm的尼龙膜浸润显色液后小心盖于芯片表面, 避光室温静置30 min, 取下尼龙膜, 用去离子水洗后干燥(终止酶反应), Epson 1640(1600 dpi)光学扫描仪观察结果.
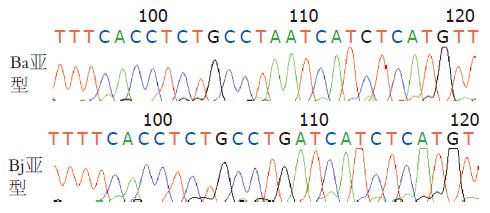
1.2.5 DNA序列分析: 在1838位点处Ba亚型均为A碱基, Bj型均为G碱基, 因此我们采取了直接测序检测序1838位点的碱基形式, 以此和芯片结果进行比较. 以HBV B基因型的一致序列为模板, 设计一套nest PCR引物正向外引物为C1(5'-ACGACCGACCTTGAGGCATACTTC-3', nt1691-1714), 反向为C2(5'-CAGAGCAGAGGCGGTGTCG-3', nt1998-2016); 正向内引物为C3(5'-GAGTTGGGGGAGGAGATTAGGTTA-3', nt1741-1765), 反向为C4(5'-AGGAAAGAAGTCAGAAGGCAAAAA-3', nt1957-1980), Nested-PCR扩增包括前C1838的前C片段, 产物长度分别为325 bp、239 bp, 选用内侧正向引物委托上海基康生物技术有限公司进行测序反应(ABI3700, 美国). 序列分析采用DNAStar软件中的clustal w method算法.
1.2.6 YMDD变异分析: HBV病毒YMDD变异检测采用荧光定量PCR的方法在Rotor Gene 3000(澳大利亚Corbett公司)使用杭州博赛公司乙型肝炎病毒耐药变异检测试剂盒进行.
统计学处理 采用SPSS10.0软件包进行χ2检验, 比较80例持续服用拉米呋啶的Ba、Bj亚型患者中YMDD变异的差异.
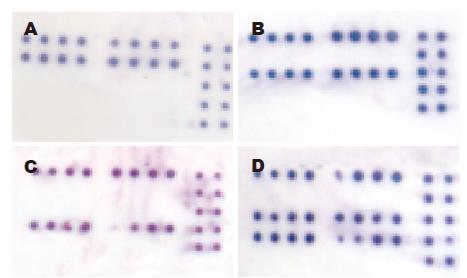
200例B基因型HBV患者中, Ba型184例(92%), Bj型16例(8%)(图2, 杂交显色结果与图1阵列呈镜像对映). 随机选择了Ba、Bj亚型各4例进行了序列分析, 结果与芯片分析完全一致(图3, nt1838位点即图3中阴影位置, Ba此处为A, Bj为G). 在持续使用拉米呋啶的80例患者中, Bj亚型6(0%)例, 均无YMDD变异, Ba亚型74例, YMDD变异21(28.4%)例.
最早Sugauchi建立的Ba、Bj的分型方法是在HBV基因组nt1838附近通过错配引物引入一个酶切位点进行RFLP, 电泳分析89 bp片段, 这个方法不仅十分繁琐, 最大的困难是最终结果难以判断[4]. 我们利用寡核苷酸芯片技术建立的亚型分析方法快速准确, 覆盖率高, 为临床亚型研究提供有力工具.
在我国早期关于HBV亚型的研究中鲜有Bj亚型报道, 据此Sugauchi认为, Bj(Japan)型仅限于日本地区, Ba(Asia)型则分布于除日本以外的亚洲各地区[7]. 根据我们的实验数据, 在镇江地区也有这两种亚型分布, Ba型为主(92%), Bj次之(8%). 之前在我国没有检出Bj亚型的主要原因大概是因为我国临床Bj分布较少, 另外也与所使用检测Ba、Bj亚型的技术方法有一定局限有关. 如, 温志立 et al[8]利用PCR-RFLP在湖南省进行的研究中检出Bj亚型; 李亚娟 et al[9]在北京、长春、南京等地进行的临床研究中, 采用巢式结合引物特异PCR的方法在145例B基因型中检出100例Ba亚型, 25例Bj亚型, 但尚有20例未能获得亚型检测结果. HBV感染后具有较为广泛的肝脏疾病谱, 从几乎没有临床表现的病毒携带者到肝硬化甚至肝细胞癌, 而不同的基因型及基因亚型在疾病的发展过程中所起的作用仍然不是十分清楚. 有研究表明B基因型不同亚型使用拉米呋啶发生YMDD变异几率不同, Bj产生耐药的比例低, 且发生时间较晚[10]. 而在一项众多日本学者参与的研究则认为Ba、Bj亚型对于服用拉米呋啶产生耐药变异的概率并无显著差异[11]. 对比我们的临床数据Ba、Bj亚型在服用拉米呋啶1年后发生YMDD变异的几率并无统计学上的显著差异, 但是可以看到, Bj亚型(0%)发生YMDD变异比例较Ba亚型(28.4%)低.
最早Sugauchi建立的Ba、Bj的分型方法是在HBV基因组nt1838附近通过错配引物引入一个酶切位点进行RFLP, 电泳分析89 bp片段, 这个方法不仅十分繁琐, 最大的困难是最终结果难以判断.
杨林, 副研究员, 中山大学附属第三医院感染病科; 倪润洲, 教授, 南通大学附属医院消化内科
根据是否与C基因型在preC和C区发生重组将B型主要分为Ba和Bj 2个亚型. Ba亚型与C基因型重组发生在5'端nt1740-1838和3'端nt2443-2485, 主要在preC区nt606-746, 重组区preC的核苷酸和氨基酸序列与C型有高度同源性. Ba亚型与C基因型毒株的病毒学特点更相近, 其致病性、临床表现及治疗效果与C型相似. 国内关于HBV基因亚型的临床研究不多.
温志立 et al利用PCR-RFLP在湖南省进行的研究中检出Bj亚型; 李亚娟 et al在北京、长春、南京等地进行的临床研究中, 采用巢式结合引物特异PCR的方法在145例B基因型中检出100例Ba亚型, 25例Bj亚型, 但尚有20例未能获得亚型检测结果.
本文利用寡核苷酸芯片技术建立的亚型分析方法快速准确, 覆盖率高, 为临床亚型研究提供有力工具.
本研究所做工作较多, 所用手段先进, 研究内容有一定临床意义.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Norder H, Courouee AM, Coursaget P, Echevarria JM, Lee SD, Mushahwar IK, Robertson BH, Locarnini S, Magnius LO. Genetic diversity of hepatitis B virus strains derived worldwide: genotypes, subgenotypes, and HBsAg subtypes. Intervirology. 2004;47:289-309. [PubMed] [DOI] |
| 2. | Bartholomeusz A, Schaefer S. Hepatitis B virus genotypes: comparison of genotyping methods. Rev Med Virol. 2004;14:3-16. [PubMed] [DOI] |
| 3. | Kao JH, Chen PJ, Lai MY, Chen DS. Hepatitis B genotypes correlate with clinical outcomes in patients with chronic hepatitis B. Gastroenterology. 2000;118:554-559. [PubMed] [DOI] |
| 4. | Sugauchi F, Orito E, Ichida T, Kato H, Sakugawa H, Kakumu S, Ishida T, Chutaputti A, Lai CL, Ueda R. Hepatitis B virus of genotype B with or without recombination with genotype C over the precore region plus the core gene. J Virol. 2002;76:5985-5992. [PubMed] [DOI] |
| 7. | Sugauchi F, Kumada H, Sakugawa H, Komatsu M, Niitsuma H, Watanabe H, Akahane Y, Tokita H, Kato T, Tanaka Y. Two subtypes of genotype B (Ba and Bj) of hepatitis B virus in Japan. Clin Infect Dis. 2004;38:1222-1228. [PubMed] [DOI] |
| 9. | 李 亚娟, 庄 辉, 李 杰, 董 庆鸣, 陈 雅洁, 牛 俊奇, 马 为民, 赵 伟, 赵 保安, 钟 金群. 乙型肝炎病毒感染者病毒基因型和亚型分布及其临床意义. 中华肝脏病杂志. 2005;13:724-729. |
| 10. | Akuta N, Suzuki F, Kobayashi M, Tsubota A, Suzuki Y, Hosaka T, Someya T, Kobayashi M, Saitoh S, Arase Y. The influence of hepatitis B virus genotype on the development of lamivudine resistance during long-term treatment. J Hepatol. 2003;38:315-321. [PubMed] [DOI] |
| 11. | Orito E, Fujiwara K, Tanaka Y, Yuen MF, Lai CL, Kato T, Sugauchi F, Kusakabe A, Sata M, Okanoue T. A case-control study of response to lamivudine therapy for 2 years in Japanese and Chinese patients chronically infected with hepatitis B virus of genotypes Bj, Ba and C. Hepatol Res. 2006;35:127-134. [PubMed] [DOI] |