修回日期: 2008-08-12
接受日期: 2008-08-19
在线出版日期: 2008-09-28
肝癌是世界常见恶性肿瘤之一, 其发生是多中心, 多病因和多基因参与的复合过程. 其目前的治疗仍以手术切除为主, 而肝癌确诊时大多已属中晚期, 治疗效果很差. 因此开发新的分子标志物早期诊断肝癌和寻找新的基因治疗靶点成为肝癌研究的热点. 缺氧诱导因子-1(HIF-1)参与肝癌发生、发展、转移及术后复发的多个环节, 对肝癌的早期诊断和分子靶向治疗具有潜在的应用前景. 本文就HIF-1的分子组成、活化机制以及与肝癌靶向治疗相关进展作一综述.
引文著录: 李月明, 姚登福. 缺氧诱导因子-1分子组成、活化机制及肝癌靶向治疗. 世界华人消化杂志 2008; 16(27): 3070-3076
Revised: August 12, 2008
Accepted: August 19, 2008
Published online: September 28, 2008
Hepatocellular carcinoma (HCC) is one of the most common malignant tumor in the world, with a complex process involving multi-center, multi-cause and multi-genes. Surgical resection is still the main treatment. However, the diagnosis of HCC mostly occurs at middle or advanced stage, and the prognosis is very poor. Therefore, the development of a novel molecular marker for early diagnosis and a new target for gene therapy become hot spots. Hypoxia-inducible factor-1 (HIF-1) takes part in the development, metastasis and recurrence of HCC, and it has potential applications in the early diagnosis and molecular targeted therapy of HCC. We presented a review on molecular composition, activation mechanism of HIF-1, and the targeted therapeutic approaches applied to hepatocellular carcinoma.
- Citation: Li YM, Yao DF. Molecular composition, activation mechanism of hypoxia-inducible factor-1 and targeted therapy of hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(27): 3070-3076
- URL: https://www.wjgnet.com/1009-3079/full/v16/i27/3070.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i27.3070
肝细胞肝癌(HCC)是血供丰富的恶性肿瘤, 由病毒、化学致癌物等多种病因作用, 经癌或癌相关基因激活、抑癌基因失活或胚胎期某些癌基因重新复活等诸多因素引起肝细胞生长失控而致癌变, 经历启动、促进、演变多阶段发病过程, 其中基因调控和表达, 与肝癌发生、发展及多种细胞因子等密切相关[1]. 局部缺氧和肿瘤血管的生成作为肝癌生态系统中的重要因素, 参与和影响肝癌的生物学行为, 在肝癌发生、发展及转归中发挥重要作用[2]. 缺氧诱导因子-1(HIF-1)为异二聚转录因子, 其过表达与肝癌生长、血管生成和转移相关, 是肿瘤的一个预后因素[3]. 本文重点就HIF-1分子组成、活化机制及其靶向治疗的研究进展等作一综述.
HIF-1定位于14Q21-Q24, 为含有α及β亚基的异源二聚体. 分子结构中均含有氨基末端的bHLH结构域与PAS结构域, 共同参与聚化作用和介导DNA结合功能[4-5]. α亚基含826个氨基酸残基, MW为120 kDa, 含有两个转录激活区(TADs): N-末端激活区(NAD)和C-末端激活区(CAD). α亚基还含有独特的氧依赖降解区域(ODD), 具有蛋白稳定和胞内氧浓度的调节作用. 生理活性主要取决于α亚基的表达[6]. β亚基为多种转录因子所共有, 又称芳烃受体核转运蛋白(ARNT), 由789(或774)个氨基酸组成, MW为94 kDa(或91 kDa), 转录激活区(TAD)定位于C-末端. β亚基在胞内不受氧浓度调节, 但α亚基需与β亚基形成异二聚体才有活性, HIF-1与HIF-2和HIF-3结构及生物学特性相似[7-8].
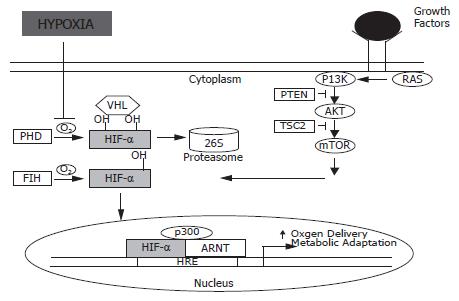
在正常氧浓度条件下, 细胞内HIF-1α不稳定, 半衰期不到5 min, 很快通过ODD介导的泛素蛋白酶体途径降解. 而在低氧情况下, HIF-1α稳定性增加, 转移到细胞核, 与HIF-1β亚单位结合成二聚体HIF-1, HIF-1再与目的基因HRG结合从而激活其转录过程. pVHL(Von hippel-lindau protein)蛋白是抑癌基因VHL表达的产物, 可以与elonginB, elonginC及Cul2形成复合物, 作为一种E3-泛素连接酶攻击HIF-1α的ODD使之迅速降解[7]. 在正常氧分压下HIF-1α的P564(HIF-2α的P531)脯氨酸残基的羟基化是pVHL与ODD区结合的必要条件; 在缺氧条件下由于羟基化过程障碍而导致pVHL与ODD区不能有效结合, HIF-1α与HIF-2α降解减少. 另外, 在正常氧分压下HIF-1α的N803(HIF-2α的N851)天冬酰胺羟基化会影响到C-端转录区的转录活性[9-11].
肿瘤细胞内HIF-1表达与氧依赖的信号传导密切相关, 调节机制包括氧依赖的HIF-1α降解、蛋白的磷酸化、转录水平的上调和蛋白稳定和配体结合能力及胞内定位[11-12]. 除此, 多种癌基因如c-jun, 肿瘤抑制基因如p53、VHL影响HIF-1α蛋白稳定性. 癌基因通过抑制脯氨酸羟化促进HIF-1表达. 野生型P53蛋白诱导HIF-1α亚基泛化, 抑制HIF-1活性, 同时可诱导产生血管生成抑制因子血小板反应素, 野生型P53缺失可促进HIF-1α、血管内皮生长因子(VEGF)积聚. pVHL是缺氧信号通路的重要成员, 常氧情况下, pVHLβ域结合到脯氨酸羟化的HIF-α亚基, 经泛素/蛋白酶体途径降解, pVHL失活可导致HIF-α持续稳定, 转录活性增强. 另外, 肿瘤抑制因子如PTEN的失活可通过磷脂酰肌醇(Ptd Ins)脂类肌醇环的3'-OH位去磷酸化有效抑制PI3K信号转导路径, 因此PTEN的失活可促进HIF-1相应靶基因的表达[11,13-14].
缺氧条件下, 肿瘤细胞内许多基因的转录和表达发生变化, 对缺氧作出应激反应, 被称为缺氧反应基因(HRG). HRG中受HIF-1α调控的基因称为HIF-1α的靶基因, 这些靶基因的启动子或增强子内含有一个或多个缺氧反应元件(HRE), 其典型的核苷酸序列为5'-TACGTG-3'是HIF-1α的DNA结合位点, 活化的HIF-1与之结合, 形成HIF-1、p300/CBP环腺苷酸反应元件结合蛋白(CREB), 以及其他转录因子的起始复合物, 从而启动靶基因的转录. HIF-1β亚基同靶基因上5'-CGTG-3'四核苷酸序列结合, p300/CBP通过其Chi区与HIF-1α发生作用, Chi区的4条螺旋结构稳定HIF-1α DNA的C-端. 如果5'-CGTG-3'发生突变或甲基化, 则HIF-1不能与靶基因结合[7-8,12]. HIF-1靶基因数目多达60余种, 涉及肿瘤能量、血管生成、转移、离子和儿茶酚胺代谢, 主要编码促红细胞生成素、VEGF、血红素氧合酶-1和诱导型一氧化氮合酶、葡萄糖载体蛋白-1、糖酵解酶和3-磷酸甘油醛脱氢酶、胰岛素样生长因子(IGF)-2、IGF结合蛋白和酪氨酸羟化酶及糖酵解酶类等[15-16].
常氧时, 脯氨酰羟化酶(PHDs)羟化HIF-1α分子中402位和564位的脯氨酸残基, 被羟化的HIF-1α与VHL蛋白结合, 泛素化后被26S蛋白酶体降解(图1). 脯氨酰羟化酶的羟化作用需要有O2、Fe2+、酮戊二酸等的参与才能实现, 所以该过程是氧依赖性的. 当细胞处于缺氧状态时, HIF-1α不能被羟化, 因而不能同VHL结合, 而使HIF-1α不能被泛素化而被蛋白酶体降解, 其转运至核内同HIF-1β结合形成异二聚体, 然后同其他转录因子及辅助活化因子p300结合转录激活一系列包含HRE的基因. HIF-1抑制因子FIH-1是一种天冬氨酸羟化酶, 氧存在的情况下, 羟化HIF-1α的803位天冬氨酸残基, 而抑制了CTAD同p300/CBP的结合, 阻抑了HIF-1α的转录活性. 而缺氧时羟化作用被抑制, 使HIF-1α的CTAD能同p300/CBP等辅助活化因子结合, 呈现转录活性[17-18].
除了缺氧以外其他许多机制如癌基因的激活, 抑癌基因的失活, 生长因子信号的活化也可激活HIF-1. 尤其是PI3K/Akt和MAPK信号通路对HIF-1的活化起重要作用. 癌基因如ras, src激活PI3K/Akt信号通路, PI3K/Akt和MAPK信号通路然后激活mTOR和蛋白合成机制, 上调HIF-1α表达导致HIF-1活化. 抑癌基因PTEN编码的磷酸酶可以使PI3K反应产物去磷酸化, 因此可对PI3K/Akt途径起负调节作用. 抑癌基因TSC-2通过影响PI3K/Akt激活mTOR而负性调节HIF-1的活化, 其失活可以导致HIF-1α蛋白的集聚[17,19]. 近来有研究表明肿瘤抑制因子PLK3可抑制缺氧诱导的HIF-1α核内集聚, 从而负性调节HIF-1的活化[20]. 而Egr1直接同HIF-1α促进子结合, 反式激活HIF-1α促进子, 从而上调HIF-1α基因表达[21].
HIF既可正性调节肿瘤生长, 又可抑制肿瘤生长. 在不同类型癌症患者, HIF与预后呈负相关, HIF参与调节肿瘤发生、发展, 也是恶性表型主要调节因子[7-8].
距血管>100 µm处癌细胞氧供和营养有限, 新血管生成对肿瘤进展尤为重要. 新血管生成需要多步骤称作 "血管生成开关"[22]. 其最终导致促血管生成因子失衡, HIF可直接激活一系列促血管生成因子, 包括VEGF、VEGF受体FLT-1和FLK-1, PAI-1, ANG-1, ANG-2, PDGF-B及其酪氨酸激酶TIE-2受体、基质金属蛋白酶MMP-2和MMP-9[12]. 在HIF诱导促血管生成因子中, VEGF-A由于其有力的血管生成特性及在人类肿瘤中大量表达而尤为显著[23]. HIF信号系统负责调节VEGF和肿瘤血管生成, 然而HIF家族成员在这个过程中的独立作用还存争议.
HIF-1具有促血管生成的作用, HIF-1缺陷的ES细胞形成的畸胎瘤相对于起源于野生型ES细胞的畸胎瘤其肿瘤血管密度和VEGF水平明显降低, HIF-1依赖的缺氧星形细胞中也发现了VEGF表达和血管形成, 证实了HIF-1介导血管生成[24-25]. HIF-1和HIF-2均能激活VEGF和肿瘤血管生成, 他们独立的作用似乎与细胞类型相关. 可因不同类型细胞中HIF-1和HIF-2水平差异所致, 也可与调节HIF活性辅助因子有关[11,26-27].
HIF-1直接参与调节与糖代谢有关的一系列基因表达, 包括缺氧和常氧细胞中糖运载体, 糖酵解酶, 乳酸产物和丙酮酸代谢[11,22]. 利用转染细胞表明HIF-1也可通过控制线粒体呼吸作用来调节细胞代谢. 在VHL缺陷的RCC细胞中HIF-1负性调节线粒体的量和氧耗. HIF可通过抑制c-Myc活性调节此类效应[28]. HIF通过激活涉及糖代谢的基因转录和调节c-Myc活性而直接或间接控制代谢的多个方面, 这些发现表明HIF是肿瘤代谢的一个重要调节子.
HIF-2在促肿瘤生长中发挥着重要作用, 在VHL缺陷的RCC细胞, HIF-2是维持肿瘤生长所必需的[10]. 起源于RCC细胞系的肿瘤, HIF-2过表达者比HIF-1过表达者生长更快[29]. HIF-2可通过多种机制促进肿瘤生长. HIF-2控制细胞增殖的机制之一是通过调节c-Myc活性, c-Myc通过调节细胞周期中细胞周期蛋白(CyclinD2)和细胞周期蛋白激酶抑制子(P21和P27)基因的表达来促进细胞增殖[30]. HIF-2可能也通过CyclinD1的激活推动细胞周期的进展[29].
转移是肿瘤发生的一个关键步骤, 也是患者死亡的主要原因, 包括肿瘤细胞侵入, 内渗, 外渗和增殖. HIF的激活与许多肿瘤的转移相关, 通过调节肿瘤细胞转移的关键因子包括E-钙粘素, LOX, CXCR4和SDF-1而促进转移[7-8]. E-钙粘素的失活增强转移潜力而其在肿瘤细胞中的表达抑制转移. HIF也通过激活细胞外基质蛋白LOX而促进转移, LOX是一种细胞外基质结构的单胺氧化酶, 促进癌细胞的侵袭和远处转移潜能, 在缺氧肿瘤细胞LOX是HIF的一个直接靶点, 在体内和体外从基因和药物上抑制LOX足以阻止缺氧诱导细胞的侵袭和转移 . 趋化因子受体CXCR4和他的配体SDF-1之间的相互作用在转移肿瘤细胞的定向迁移中起重要作用, CXCR4是肿瘤组织中表达最多的趋化因子[32-34].
肿瘤干细胞是肿瘤生长中的重要调节子, 肿瘤起源于一小类增殖细胞, 他们具有自我更新和异种分化的能力, 缺氧和HIF能够促进多种类型细胞处于未分化状态. 已表明缺氧抑制远祖细胞的分化而促进肿瘤细胞的逆分化. Gustafsson的资料表明Notch在维持一系列细胞缺氧时的逆向分化起重要作用, 包括皮层神经干细胞, 肌源性卫星细胞和C2C12细胞, 缺氧增强HIF-依赖途径中Notch信号, 通过HIF-1α与Notch相互作用稳定Notch ICD结构域. 除了调节Notch, HIF也可直接激活维持干细胞的基因表达而促进其处于未分化状态. 缺氧能够维持hES细胞处于未分化状态和保持干细胞多能性, 缺氧hES细胞未分化状态的维持和Oct4的表达相关[35-39].
肝癌是富血管的实体肿瘤, 其一个重要因素是HBV感染. HBX在HBV介导的肝癌形成中具有一定的作用. 利用免疫组化分析, HBX转基因小鼠的肝损区比非瘤区检测出更高水平的HBX, 同时在这些损害区也检测出HIF-1α和VEGF. 相反, 在非转基因小鼠的肝组织中则几乎检测不到HIF-1α和VEGF. HBX通过与HIF-1α直接作用增加HIF-1α的蛋白水平[40]. HBX的羧基末端增加HIF-1α蛋白的稳定性, 可通过抑制pVHL同HIF-1α之间的相互作用从而阻碍依赖途径的降解. HBX的羧基末端也通过增强HIF-1α与CBP的相互作用而增强HIF-1的转录活性, 而诱导VEGF表达, 促血管生成[41].
HBX通过MAPK信号通路的激活增强HIF-1的转录活性. HBX强有力地诱导MTA1和HDAC1基因在转录水平的表达, 而MTA1和HDAC1/2在HBX存在的情况下与HIF-1α相关, 可通过siRNA敲除MTA1而消除, HBX和MTA1/HDAC复合物在稳定HIF-1α间具有交叉作用[42]. HBX通过增强HIF-1α转录活性和MDR1基因转录活性增强MDR1运载体活性, HIF-1α在HBV介导的放化疗抵抗中具有重要作用[43]. HBx及HIF-1α在人肝癌组织中广泛表达, 并显著正相关; 常氧或缺氧状态下, HBx均可上调HIF-1α在HepG2细胞中表达, 并且HBx对HIF-1α的这种调节作用可能通过ROS通路实现[44].
尽管HCV感染同肝癌的发展紧密相关, 但诱导肝癌机制尚待阐明. HCV在人肝癌Huh-7细胞中具有诱导血管生成因子的作用. HCV诱导常氧下人肝癌细胞HIF-1α的稳定, 这是通过氧化应激和Ca2+信号通路介导的. HCV基因表达通过Ca2+和氧化应激途径激活STAT-3和NF-κB参与HIF-1α的稳定, 促进VEGF促进子的活性, 从而促进VEGF的合成和分泌. HCV基因表达诱导PI3K/Akt的激活, 在HCV相关的肝癌中, PI3K和p42/44激酶均参与HIF-1α的稳定和促进VEGF的合成. 除了VEGF, HCV诱导其他血管生成因子如IL-8, 转移因子如MMP-2和MMP-9的分泌, 可共同参与新血管形成[45-47].
肝癌是世界常见恶性肿瘤之一, 原发性肝癌由慢性肝损害诱导肝硬化发展而来. 这种慢性损害导致肝纤维化和正常血管系统损坏. 肝血管系统的损坏导致肝脏血液循环不足, 最终导致缺氧, 肝癌细胞的高度增殖也导致局部缺氧[48]. 肝切除、移植和局部消融疗法已成为肝癌的一线治疗, 而局部疗法用于因严重肝病或肝癌晚期而无法手术治疗的患者, 包括局部消融疗法(RFA, MCT或PEI, TAE, TACE, TARE)和其他一些体外能量治疗[49]. 而如TAE通过诱导缺氧导致血管生成, 联合TAE和抗血管生成治疗为肝癌治疗提供新的策略. 然而缺氧使肝癌细胞对TAE和抗血管生成治疗无效[48], 靶向缺氧调节因子的治疗可能对肝癌患者有益.
HIF-1反义寡核苷酸转染肝癌HepG2细胞, 抑制癌细胞增殖, 且降低HIF-1基因表达和蛋白合成[50]. 酪蛋白激酶2(CK2)siRNA通过升高P53蛋白水平降低缺氧时HIF-1活性[51]. 利用表达pshHIF-1α的质粒DNA转染Colon26和B16-BL6细胞, 其能在体外有效地抑制HIF-1α的表达, 且经门静脉注入pshHIF-1α至荷瘤鼠肝脏中, 正常肝细胞和肿瘤细胞HIF-1α蛋白表达均降低, 通过沉默正常和肿瘤细胞中HIF-1α表达, 抑制肝转移瘤生长可成为新的治疗方法[52]. 以siRNA表达质粒抑制HIF-1α表达, 癌细胞中HIF-1α mRNA水平和蛋白水平明显降低, 细胞生长明显受抑制, 且促进凋亡而非细胞周期阻滞[53]. 靶向HIF-1反义寡核苷酸和RNA干扰技术, 可成为肝癌和转移性肝癌基因治疗新策略.
很多化学制剂和天然提取物参与调节肝癌中HIF-1α表达的细胞过程. 如蛋白酶体抑制剂MG132明显地降低Hep3B和HEK293细胞中缺氧诱导的EPO和VEGFmRNA表达, 机制可能是使HIF-1αC-端转录激活域(CAD)失活, 干扰HIF-1α-p300相互作用[54]. 硼替佐米在癌细胞中通过增强FIH介导的p300招募抑制而抑制HIF-1α的转录活性[55]. 小分子YC-1(3-(5'-羟甲基-2'-呋喃基)-1-甲苯)通过上调P21CIP1/WAP1诱导细胞周期阻滞在G0-G1期和抑制肿瘤生长[56], 通过影响HIF-1α蛋白合成和稳定从而下调其表达, 而这种作用依赖于Mdm2[57].
姜黄素, 由调味品姜黄分离出来的一种天然的具有生物活性的复合物, 在肝癌HepG2细胞中明显降低HIF-1α水平而抑制HIF-1转录活性[58], 而姜黄素通过氧化过程和泛素蛋白酶体系统降解ARNT而使HIF-1失活, 而HIF-1α水平不变[59], 其在临床抗肿瘤治疗中的作用还不确定.
绿茶提取物和EGCG抑制缺氧和血清诱导的HIF-1α蛋白集聚, 并且抑制人肝癌HepG2细胞VEGF的表达, 机制似乎与HIF-1α蛋白通过ERK1/2和/或PI3K/Akt信号途径降解增多有关[60]. Resveratrol是普遍存在于葡萄和其他水果中的一种天然产物, 明显地抑制肿瘤细胞中缺氧诱导HIF-1α蛋白集聚, 其机制似乎涉及HIF-1α蛋白半衰期迅速缩短, 由通过26S蛋白酶体系统蛋白降解增加引起[61]. TX-402是一种生物合成药物, 缺氧时选择性地诱导P53依赖途径的肿瘤细胞凋亡, 剂量依赖性地抑制HepG2和Hep3B细胞中HIF-1α蛋白的表达[62]. 苯甲酸类似物是一类新的HIF-1抑制剂, 能够有效地抑制缺氧时人类肝癌Hep3B细胞中HIF-1α蛋白集聚和他的靶基因表达[63]. 雷帕霉素可通过下调VEGF和HIF-1α mRNA的水平而抑制肝癌的生长和转移[64].
肝癌最主要的特征是癌细胞难以调控的生长, 不断增多的细胞数导致细胞耗氧量增加, 容易造成癌组织内缺氧微环境的形成. HIF-1可在基因水平上从调节VEGF的转录活性和VEGFmRNA的稳定性两方面直接调控VEGF表达, 诱导新生血管, 为癌组织增加供血、供氧、供能, 改善局部组织严重缺氧及供能与耗能间的不平衡, 与肝癌的扩散、大血管侵犯及远处转移密切相关[65]; HIF-1在缺氧适应中起关键作用, 且与患者的预后相关, 他已成为肝癌抗肿瘤药物研制的潜在靶目标[66-67]. 针对HIF-1的基因治疗可降低HIF-1的表达和转录活性; 但目前仅能在细胞培养的实验中得到证实, 而临床应用还很困难. 化学制剂和天然提取物可抑制HIF, 但尚无直接、特异地以HIF-1为靶点的药物[68-70]. 需开发选择性更高的HIF-1抑制剂及基因治疗在临床的研究, 基因治疗和药物治疗的联合将为肝癌的治疗提供广阔的前景.
肝癌最主要的特征是癌细胞难以调控的生长, 不断增多的细胞数导致细胞耗氧量增加, HIF-1α可在基因水平上从调节VEGF的转录活性, 在缺氧适应中起关键作用, 他已成为肝癌抗肿瘤药物研制的潜在靶目标.
陈洪, 副教授, 东南大学附属中大医院消化科
HIF-1α参与肝癌发生、发展、转移及术后复发的多个环节, 对肝癌的早期诊断和分子靶向治疗具有潜在的应用前景,开发新的分子标记物早期诊断肝癌和寻找新的基因治疗靶点成为肝癌研究的热点.
肝癌为血管丰富的恶性肿瘤, HIF-1α能促进血管内皮生长因子依赖性的肿瘤血管形成, 以HIF-1α为靶点的抗肿瘤治疗正成为许多基础和临床研究所关注.
HIF-1已成为肝癌抗肿瘤药物研制的潜在靶目标, 目前仅在细胞培养的实验中得到证实, 需进一步开发选择性更高的HIF-1抑制剂及基因治疗在临床的研究.
HIF-1能在缺氧条件下促进血管内皮生长因子依赖性的肿瘤血管形成, HIF-1α是决定HIF-1活性的亚单位, 针对HIF-1α的基因靶向治疗将为肝癌治疗提供广阔的前景.
HIF-1: 调节肿瘤细胞缺氧反应的主要转录因子, 其中HIF-1α是决定HIF-1活性的亚单位, 其在许多肿瘤中高表达, 与肿瘤高度侵袭性、易转移、对放化疗不敏感和预后不良密切相关.
本文综述缺氧诱导因子-1在肝癌发生、发展、转移及术后复发等环节中所起作用, 较全面的介绍了其活化机制以及参与肝癌靶向治疗的相关进展, 具有较好的可读性.
编辑: 李军亮 电编: 郭海丽
| 1. | Raza SA, Clifford GM, Franceschi S. Worldwide variation in the relative importance of hepatitis B and hepatitis C viruses in hepatocellular carcinoma: a systematic review. Br J Cancer. 2007;96:1127-1134. [PubMed] [DOI] |
| 2. | Nakamura K, Zen Y, Sato Y, Kozaka K, Matsui O, Harada K, Nakanuma Y. Vascular endothelial growth factor, its receptor Flk-1, and hypoxia inducible factor-1alpha are involved in malignant transformation in dysplastic nodules of the liver. Hum Pathol. 2007;38:1532-1546. [PubMed] [DOI] |
| 3. | Semenza GL. Evaluation of HIF-1 inhibitors as anticancer agents. Drug Discov Today. 2007;12:853-859. [PubMed] [DOI] |
| 4. | Mabjeesh NJ, Amir S. Hypoxia-inducible factor (HIF) in human tumorigenesis. Histol Histopathol. 2007;22:559-572. [PubMed] |
| 5. | Ratcliffe PJ. HIF-1 and HIF-2: working alone or together in hypoxia? J Clin Invest. 2007;117:862-865. [PubMed] [DOI] |
| 6. | Fujita M, Yasuda M, Kitatani K, Miyazawa M, Hirabayashi K, Takekoshi S, Iida T, Hirasawa T, Murakami M, Mikami M. An up-to-date anti-cancer treatment strategy focusing on HIF-1alpha suppression: its application for refractory ovarian cancer. Acta Histochem Cytochem. 2007;40:139-142. [PubMed] [DOI] |
| 7. | Rankin EB, Giaccia AJ. The role of hypoxia-inducible factors in tumorigenesis. Cell Death Differ. 2008;15:678-685. [PubMed] [DOI] |
| 8. | Weidemann A, Johnson RS. Biology of HIF-1alpha. Cell Death Differ. 2008;15:621-627. [PubMed] [DOI] |
| 9. | Patel SA, Simon MC. Biology of hypoxia-inducible factor-2alpha in development and disease. Cell Death Differ. 2008;15:628-634. [PubMed] [DOI] |
| 10. | Lofstedt T, Fredlund E, Holmquist-Mengelbier L, Pietras A, Ovenberger M, Poellinger L, Pahlman S. Hypoxia inducible factor-2alpha in cancer. Cell Cycle. 2007;6:919-926. [PubMed] |
| 11. | Ke Q, Costa M. Hypoxia-inducible factor-1 (HIF-1). Mol Pharmacol. 2006;70:1469-1480. [PubMed] [DOI] |
| 12. | Hickey MM, Simon MC. Regulation of angiogenesis by hypoxia and hypoxia-inducible factors. Curr Top Dev Biol. 2006;76:217-257. [PubMed] [DOI] |
| 13. | Gwak GY, Yoon JH, Kim KM, Lee HS, Chung JW, Gores GJ. Hypoxia stimulates proliferation of human hepatoma cells through the induction of hexokinase II expression. J Hepatol. 2005;42:358-364. [PubMed] [DOI] |
| 14. | Schmid T, Zhou J, Brune B. HIF-1 and p53: communication of transcription factors under hypoxia. J Cell Mol Med. 2004;8:423-431. [PubMed] [DOI] |
| 15. | Gray MJ, Zhang J, Ellis LM, Semenza GL, Evans DB, Watowich SS, Gallick GE. HIF-1alpha, STAT3, CBP/p300 and Ref-1/APE are components of a transcriptional complex that regulates Src-dependent hypoxia-induced expression of VEGF in pancreatic and prostate carcinomas. Oncogene. 2005;24:3110-3120. [PubMed] [DOI] |
| 16. | Carroll VA, Ashcroft M. Role of hypoxia-inducible factor (HIF)-1alpha versus HIF-2alpha in the regulation of HIF target genes in response to hypoxia, insulin-like growth factor-I, or loss of von Hippel-Lindau function: implications for targeting the HIF pathway. Cancer Res. 2006;66:6264-6270. [PubMed] [DOI] |
| 17. | Tanaka H, Yamamoto M, Hashimoto N, Miyakoshi M, Tamakawa S, Yoshie M, Tokusashi Y, Yokoyama K, Yaginuma Y, Ogawa K. Hypoxia-independent overexpression of hypoxia-inducible factor 1alpha as an early change in mouse hepatocarcinogenesis. Cancer Res. 2006;66:11263-11270. [PubMed] [DOI] |
| 18. | Berchner-Pfannschmidt U, Frede S, Wotzlaw C, Fandrey J. Imaging of the hypoxia-inducible factor pathway: insights into oxygen sensing. Eur Respir J. 2008;32:210-217. [PubMed] [DOI] |
| 19. | Bardos JI, Ashcroft M. Negative and positive regulation of HIF-1: a complex network. Biochim Biophys Acta. 2005;1755:107-120. [PubMed] |
| 20. | Yang Y, Bai J, Shen R, Brown SA, Komissarova E, Huang Y, Jiang N, Alberts GF, Costa M, Lu L. Polo-like kinase 3 functions as a tumor suppressor and is a negative regulator of hypoxia-inducible factor-1 alpha under hypoxic conditions. Cancer Res. 2008;68:4077-4085. [PubMed] [DOI] |
| 21. | Liao H, Hyman MC, Lawrence DA, Pinsky DJ. Molecular regulation of the PAI-1 gene by hypoxia: contributions of Egr-1, HIF-1alpha, and C/EBPalpha. FASEB J. 2007;21:935-949. [PubMed] [DOI] |
| 22. | Semenza GL. HIF-1 mediates the Warburg effect in clear cell renal carcinoma. J Bioenerg Biomembr. 2007;39:231-234. [PubMed] [DOI] |
| 23. | Biju MP, Neumann AK, Bensinger SJ, Johnson RS, Turka LA, Haase VH. Vhlh gene deletion induces Hif-1-mediated cell death in thymocytes. Mol Cell Biol. 2004;24:9038-9047. [PubMed] [DOI] |
| 24. | Chavez JC, Baranova O, Lin J, Pichiule P. The transcriptional activator hypoxia inducible factor 2 (HIF-2/EPAS-1) regulates the oxygen-dependent expression of erythropoietin in cortical astrocytes. J Neurosci. 2006;26:9471-9481. [PubMed] [DOI] |
| 25. | Osada R, Horiuchi A, Kikuchi N, Yoshida J, Hayashi A, Ota M, Katsuyama Y, Melillo G, Konishi I. Expression of hypoxia-inducible factor 1alpha, hypoxia-inducible factor 2alpha, and von Hippel-Lindau protein in epithelial ovarian neoplasms and allelic loss of von Hippel-Lindau gene: nuclear expression of hypoxia-inducible factor 1alpha is an independent prognostic factor in ovarian carcinoma. Hum Pathol. 2007;38:1310-1320. [PubMed] [DOI] |
| 26. | Winter SC, Shah KA, Han C, Campo L, Turley H, Leek R, Corbridge RJ, Cox GJ, Harris AL. The relation between hypoxia-inducible factor (HIF)-1alpha and HIF-2alpha expression with anemia and outcome in surgically treated head and neck cancer. Cancer. 2006;107:757-766. [PubMed] [DOI] |
| 27. | Yoshimura H, Dhar DK, Kohno H, Kubota H, Fujii T, Ueda S, Kinugasa S, Tachibana M, Nagasue N. Prognostic impact of hypoxia-inducible factors 1alpha and 2alpha in colorectal cancer patients: correlation with tumor angiogenesis and cyclooxygenase-2 expression. Clin Cancer Res. 2004;10:8554-8560. [PubMed] [DOI] |
| 28. | Zhang H, Gao P, Fukuda R, Kumar G, Krishnamachary B, Zeller KI, Dang CV, Semenza GL. HIF-1 inhibits mitochondrial biogenesis and cellular respiration in VHL-deficient renal cell carcinoma by repression of C-MYC activity. Cancer Cell. 2007;11:407-420. [PubMed] [DOI] |
| 29. | Raval RR, Lau KW, Tran MG, Sowter HM, Mandriota SJ, Li JL, Pugh CW, Maxwell PH, Harris AL, Ratcliffe PJ. Contrasting properties of hypoxia-inducible factor 1 (HIF-1) and HIF-2 in von Hippel-Lindau-associated renal cell carcinoma. Mol Cell Biol. 2005;25:5675-5686. [PubMed] [DOI] |
| 30. | Arabi A, Wu S, Ridderstrale K, Bierhoff H, Shiue C, Fatyol K, Fahlen S, Hydbring P, Soderberg O, Grummt I. c-Myc associates with ribosomal DNA and activates RNA polymerase I transcription. Nat Cell Biol. 2005;7:303-310. [PubMed] [DOI] |
| 31. | Erler JT, Bennewith KL, Nicolau M, Dornhofer N, Kong C, Le QT, Chi JT, Jeffrey SS, Giaccia AJ. Lysyl oxidase is essential for hypoxia-induced metastasis. Nature. 2006;440:1222-1226. [PubMed] [DOI] |
| 32. | Arya M, Ahmed H, Silhi N, Williamson M, Patel HR. Clinical importance and therapeutic implications of the pivotal CXCL12-CXCR4 (chemokine ligand-receptor) interaction in cancer cell migration. Tumour Biol. 2007;28:123-131. [PubMed] [DOI] |
| 33. | Phillips RJ, Mestas J, Gharaee-Kermani M, Burdick MD, Sica A, Belperio JA, Keane MP, Strieter RM. Epidermal growth factor and hypoxia-induced expression of CXC chemokine receptor 4 on non-small cell lung cancer cells is regulated by the phosphatidylinositol 3-kinase/PTEN/AKT/mammalian target of rapamycin signaling pathway and activation of hypoxia inducible factor-1alpha. J Biol Chem. 2005;280:22473-22481. [PubMed] [DOI] |
| 34. | Zagzag D, Lukyanov Y, Lan L, Ali MA, Esencay M, Mendez O, Yee H, Voura EB, Newcomb EW. Hypoxia-inducible factor 1 and VEGF upregulate CXCR4 in glioblastoma: implications for angiogenesis and glioma cell invasion. Lab Invest. 2006;86:1221-1232. [PubMed] [DOI] |
| 35. | Sahlgren C, Gustafsson MV, Jin S, Poellinger L, Lendahl U. Notch signaling mediates hypoxia-induced tumor cell migration and invasion. Proc Natl Acad Sci USA. 2008;105:6392-6397. [PubMed] [DOI] |
| 36. | Parmar K, Mauch P, Vergilio JA, Sackstein R, Down JD. Distribution of hematopoietic stem cells in the bone marrow according to regional hypoxia. Proc Natl Acad Sci USA. 2007;104:5431-5436. [PubMed] [DOI] |
| 37. | Ezashi T, Das P, Roberts RM. Low O2 tensions and the prevention of differentiation of hES cells. Proc Natl Acad Sci USA. 2005;102:4783-4788. [PubMed] [DOI] |
| 38. | Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 2006;126:663-676. [PubMed] [DOI] |
| 39. | Covello KL, Kehler J, Yu H, Gordan JD, Arsham AM, Hu CJ, Labosky PA, Simon MC, Keith B. HIF-2alpha regulates Oct-4: effects of hypoxia on stem cell function, embryonic development, and tumor growth. Genes Dev. 2006;20:557-570. [PubMed] [DOI] |
| 40. | Moon EJ, Jeong CH, Jeong JW, Kim KR, Yu DY, Murakami S, Kim CW, Kim KW. Hepatitis B virus X protein induces angiogenesis by stabilizing hypoxia-inducible factor-1alpha. FASEB J. 2004;18:382-384. [PubMed] |
| 41. | Yoo YG, Cho S, Park S, Lee MO. The carboxy-terminus of the hepatitis B virus X protein is necessary and sufficient for the activation of hypoxia-inducible factor-1alpha. FEBS Lett. 2004;577:121-126. [PubMed] [DOI] |
| 42. | Yoo YG, Na TY, Seo HW, Seong JK, Park CK, Shin YK, Lee MO. Hepatitis B virus X protein induces the expression of MTA1 and HDAC1, which enhances hypoxia signaling in hepatocellular carcinoma cells. Oncogene. 2008;27:3405-3413. [PubMed] [DOI] |
| 43. | Han HK, Han CY, Cheon EP, Lee J, Kang KW. Role of hypoxia-inducible factor-alpha in hepatitis-B-virus X protein-mediated MDR1 activation. Biochem Biophys Res Commun. 2007;357:567-573. [PubMed] [DOI] |
| 45. | Nasimuzzaman M, Waris G, Mikolon D, Stupack DG, Siddiqui A. Hepatitis C virus stabilizes hypoxia-inducible factor 1alpha and stimulates the synthesis of vascular endothelial growth factor. J Virol. 2007;81:10249-10257. [PubMed] [DOI] |
| 46. | Waris G, Turkson J, Hassanein T, Siddiqui A. Hepatitis C virus (HCV) constitutively activates STAT-3 via oxidative stress: role of STAT-3 in HCV replication. J Virol. 2005;79:1569-1580. [PubMed] [DOI] |
| 47. | Koike K, Tsutsumi T, Miyoshi H, Shinzawa S, Shintani Y, Fujie H, Yotsuyanagi H, Moriya K. Molecular basis for the synergy between alcohol and hepatitis C virus in hepatocarcinogenesis. J Gastroenterol Hepatol. 2008;23 Suppl 1:S87-S91. [PubMed] [DOI] |
| 48. | Wu XZ, Xie GR, Chen D. Hypoxia and hepatocellular carcinoma: The therapeutic target for hepatocellular carcinoma. J Gastroenterol Hepatol. 2007;22:1178-1182. [PubMed] [DOI] |
| 49. | Lau WY, Lai EC. Hepatocellular carcinoma: current management and recent advances. Hepatobiliary Pancreat Dis Int. 2008;7:237-257. [PubMed] |
| 50. | WeiXing C, Tiantian H, Qun N, Chaohui Y, Ping X. Inhibitory effect of hypoxia inducible factor-1 antisense oligonucleotide on growth of human hepatocellular carcinoma cells. Med Oncol. 2008;25:88-92. [PubMed] [DOI] |
| 51. | Hubert A, Paris S, Piret JP, Ninane N, Raes M, Michiels C. Casein kinase 2 inhibition decreases hypoxia-inducible factor-1 activity under hypoxia through elevated p53 protein level. J Cell Sci. 2006;119:3351-3362. [PubMed] [DOI] |
| 52. | Takahashi Y, Nishikawa M, Takakura Y. Inhibition of tumor cell growth in the liver by RNA interference-mediated suppression of HIF-1alpha expression in tumor cells and hepatocytes. Gene Ther. 2008;15:572-582. [PubMed] [DOI] |
| 53. | Mizuno T, Nagao M, Yamada Y, Narikiyo M, Ueno M, Miyagishi M, Taira K, Nakajima Y. Small interfering RNA expression vector targeting hypoxia-inducible factor 1 alpha inhibits tumor growth in hepatobiliary and pancreatic cancers. Cancer Gene Ther. 2006;13:131-140. [PubMed] [DOI] |
| 54. | Shin DH, Li SH, Chun YS, Huang LE, Kim MS, Park JW. CITED2 mediates the paradoxical responses of HIF-1alpha to proteasome inhibition. Oncogene. 2008;27:1939-1944. [PubMed] [DOI] |
| 55. | Shin DH, Chun YS, Lee DS, Huang LE, Park JW. Bortezomib inhibits tumor adaptation to hypoxia by stimulating the FIH-mediated repression of hypoxia-inducible factor-1. Blood. 2008;111:3131-3136. [PubMed] [DOI] |
| 56. | Wang SW, Pan SL, Guh JH, Chen HL, Huang DM, Chang YL, Kuo SC, Lee FY, Teng CM. YC-1 [3-(5'-Hydroxymethyl-2'-furyl)-1-benzyl Indazole] exhibits a novel antiproliferative effect and arrests the cell cycle in G0-G1 in human hepatocellular carcinoma cells. J Pharmacol Exp Ther. 2005;312:917-925. [PubMed] [DOI] |
| 57. | Lau CK, Yang ZF, Lam CT, Tam KH, Poon RT, Fan ST. Suppression of hypoxia inducible factor-1alpha (HIF-1alpha) by YC-1 is dependent on murine double minute 2 (Mdm2). Biochem Biophys Res Commun. 2006;348:1443-1448. [PubMed] [DOI] |
| 58. | Bae MK, Kim SH, Jeong JW, Lee YM, Kim HS, Kim SR, Yun I, Bae SK, Kim KW. Curcumin inhibits hypoxia-induced angiogenesis via down-regulation of HIF-1. Oncol Rep. 2006;15:1557-1562. [PubMed] |
| 59. | Choi H, Chun YS, Kim SW, Kim MS, Park JW. Curcumin inhibits hypoxia-inducible factor-1 by degrading aryl hydrocarbon receptor nuclear translocator: a mechanism of tumor growth inhibition. Mol Pharmacol. 2006;70:1664-1671. [PubMed] [DOI] |
| 60. | Zhang Q, Tang X, Lu Q, Zhang Z, Rao J, Le AD. Green tea extract and (-)-epigallocatechin-3-gallate inhibit hypoxia- and serum-induced HIF-1alpha protein accumulation and VEGF expression in human cervical carcinoma and hepatoma cells. Mol Cancer Ther. 2006;5:1227-1238. [PubMed] [DOI] |
| 61. | Zhang Q, Tang X, Lu QY, Zhang ZF, Brown J, Le AD. Resveratrol inhibits hypoxia-induced accumulation of hypoxia-inducible factor-1alpha and VEGF expression in human tongue squamous cell carcinoma and hepatoma cells. Mol Cancer Ther. 2005;4:1465-1474. [PubMed] [DOI] |
| 62. | Miyoshi A, Kitajima Y, Ide T, Ohtaka K, Nagasawa H, Uto Y, Hori H, Miyazaki K. Hypoxia accelerates cancer invasion of hepatoma cells by upregulating MMP expression in an HIF-1alpha-independent manner. Int J Oncol. 2006;29:1533-1539. [PubMed] |
| 63. | Lee K, Lee JH, Boovanahalli SK, Jin Y, Lee M, Jin X, Kim JH, Hong YS, Lee JJ. (Aryloxyacetyla-mino)benzoic acid analogues: A new class of hypoxia-inducible factor-1 inhibitors. J Med Chem. 2007;50:1675-1684. [PubMed] [DOI] |
| 65. | Liao D, Johnson RS. Hypoxia: a key regulator of angiogenesis in cancer. Cancer Metastasis Rev. 2007;26:281-290. [PubMed] [DOI] |
| 66. | Belozerov VE, Van Meir EG. Hypoxia inducible factor-1: a novel target for cancer therapy. Anticancer Drugs. 2005;16:901-909. [PubMed] [DOI] |
| 67. | Semenza GL. Development of novel therapeutic strategies that target HIF-1. Expert Opin Ther Targets. 2006;10:267-280. [PubMed] [DOI] |
| 68. | Patiar S, Harris AL. Role of hypoxia-inducible factor-1alpha as a cancer therapy target. Endocr Relat Cancer. 2006;13 Suppl 1:S61-S75. [PubMed] [DOI] |
| 69. | Ziello JE, Jovin IS, Huang Y. Hypoxia-Inducible Factor (HIF)-1 regulatory pathway and its potential for therapeutic intervention in malignancy and ischemia. Yale J Biol Med. 2007;80:51-60. [PubMed] |
| 70. | Weng Q, Wang D, Guo P, Fang L, Hu Y, He Q, Yang B. Q39, a novel synthetic Quinoxaline 1,4-Di-N-oxide compound with anti-cancer activity in hypoxia. Eur J Pharmacol. 2008;581:262-269. [PubMed] [DOI] |