修回日期: 2008-07-24
接受日期: 2008-07-29
在线出版日期: 2008-09-28
肝型脂肪酸结合蛋白(L-FABP)是脂肪酸结合蛋白(FABPs)家族成员之一, 与其他成员结构和功能方面有相同之处又有区别. L-FABP主要表达于肝脏组织和小肠, 介导脂肪酸及多种疏水基团转运, 涉及多种疾病的发病机制. 多年来其转运机制备受关注, 研究方法从体外到体内, 从细胞分子水平到基因沉默动物水平. 虽然L-FABP的转运机制研究越来越深入, 但是仍需要进一步加强基础研究, 揭示其调控脂类转运的机制. 本文主要对L-FABP的特性、结构及体内研究现状作一综述.
引文著录: 张虎, 朱金玲, 张玉萍, 罗佳滨. 肝型脂肪酸结合蛋白与脂类转运. 世界华人消化杂志 2008; 16(27): 3065-3069
Revised: July 24, 2008
Accepted: July 29, 2008
Published online: September 28, 2008
Liver-type fatty acid-binding protein (L-FABP), a member of the genetically related cytosolic fatty acid binding protein (FABP) family, has both similar and different function and conformation compared with other family members. L-FABP, which is mainly found in liver and small intestine, participates in transporting fatty acids and combining a variety of hydrophobic group and is associated with many diseases. In recent years, the transfer mechanism of L-FABP was attracting great attention, and the research methods were developed from in vitro to in vivo, and from cell molecular level to gene ablation animals. Although a part of the mechanism has been revealed, the research should be continued to demonstrate it in deepth and resolve some new questions. This article aims to review the characteristics, conformation and in vivo study status of L-FABP.
- Citation: Zhang H, Zhu JL, Zhang YP, Luo JB. Liver-type fatty acid-binding protein and lipid transport. Shijie Huaren Xiaohua Zazhi 2008; 16(27): 3065-3069
- URL: https://www.wjgnet.com/1009-3079/full/v16/i27/3065.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i27.3065
哺乳动物脂肪酸结合蛋白(fatty acid binding proteins, FABPs)作为长链脂肪酸结合蛋白发现于20世纪70年代早期, 大量存在于胞质中. 连接蛋白重组实验和体外细胞培养表明肝型脂肪酸结合蛋白(liver fatty acid binding protein, L-FABP)在许多代谢有关的疏水基团转运过程中起到重要作用, 包括多不饱和脂肪酸、饱和脂肪酸、胆固醇和胆汁酸. L-FABP的生理功能也通过基因沉默动物得到研究. 最近的研究表明肝脏中L-FABP基因沉默破坏了脂肪酸吸收和利用的网络[1-3], 有力的证明了L-FABP在脂肪酸代谢过程中起到转运作用, 并且可以将结合物转运至细胞内特定区域.
L-FABP是一种与遗传有关的脂肪酸连接蛋白家族成员, 又名Z-蛋白、亚铁血红素结合蛋白, 分子量14.4 kDa, 在肝脏、小肠、肾脏、胰腺、胃中均有发现, 在以上组织中的表达量不同[4]. 肝脏中L-FABP占胞质蛋白总量的2%-5%左右, 且只有在肝脏中不与其他家族成员共表达.
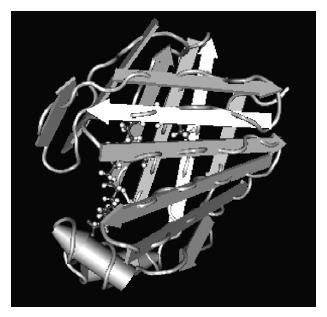
L-FABP基因与其他FABPs基因一样,也由4个外显子(67、173、93、51 bp)和3个内含子组成. 只是不同类型FABPs基因的内含子大小有差别(1.2-8.4 kb). L-FABP结构中有127个氨基酸残基, 2个脂肪酸结合位点[5]. 与家族成员间氨基酸序列有38-70%的同源性, 在空间结构上也有相似之处: 核苷酸链的N-端附近有两条短的α-螺旋, 紧接着是10条反平行的β-链, 然后他们组装成两个几乎正交的折叠[6].
肝细胞中L-FABP表达水平高(占胞质蛋白的2%-5%), 且这种高水平和脂肪酸代谢关系密切[7], 所以判断L-FABP对于肝细胞中脂类连接和脂类代谢起到重要作用. L-FABP可以介导脂肪酸由胞质转运至多种细胞器, 如线粒体(mitochondria)、过氧化物酶体(peroxisomes)、内质网(endoplasmic reticulum)、细胞核(nucleus)和脂滴(lipid droplets).
L-FABP具有独有的结合特征: 可以像结合长链脂肪酸一样结合其他的疏水基团, 包括磷脂、过氧化物酶体增殖物、酰基辅酶A、溶血磷脂、亚铁血红素和胆(汁)盐等[7-11]. 在溶解状态下, 其内部结合基团具有预知的U型构象和特异静电, 但是与观察到的晶体结构中单一构象相反的是溶解状态下展开的孔道区域内(门区域)具有结合多种精细构型的结构. L-FABP也具有其他家族成员共同具有的β-桶型结构. 而便于配基出入的门区域表现出构象的变异性, 还有一个特殊打开的β-桶型结构的盖子[12](图1). 这些结构帮助构建了一种模型: 配基通过构象改变来吻合螺旋-转角-螺旋结构, 打开或关闭β-桶型结构的盖子, 从而实现与L-FABP的结合. L-FABP的门区域易于配基接近, 利于通过扩散方式转运脂肪酸和多种配基.
脂肪酸由供体到受体膜的转运存在三种机制: (1)脂肪酸转运的自动发生, 自发转运率很低, 除非膜间距离非常小. (2)由非膜激活型受体协助发生, 通过增加溶解的脂肪酸浓度来促进扩散. (3)由膜激活型受体介导发生, 促进与受体膜作用过程中的分离与重新结合. 体外细胞膜脂类转运模型表明L-FABP介导脂类运输时并不与膜结构发生碰撞, 而是通过扩散作用达到转运目的[13].
膜间的脂肪酸转运至少需要3步: 供体膜分离, 水相扩散和受体膜连接. 每一步都是可逆的, 且是双向的. 脂肪酸趋向于从较高浓度脂肪酸的膜(如细胞膜)转运到较低浓度脂肪酸的膜(如线粒体膜). 如果其中一步速率较慢, 将决定整个转运速率. 这样的步骤称为限速步骤. 有研究表明前两步慢于第三步, 因此第三步很有可能是限速步骤.
2.3.1 L-FABP与脂肪酸转运: 虽然L-FABP是肝细胞中各种疏水基团的重要连接位点, 但是这种作用在体内的显著性不是很明了. 细胞分离培养系统和转化细胞的研究进一步说明L-FABP对肝细胞中脂类连接和脂类代谢有作用[14]. 例如在细胞离体培养中表明L-FABP刺激油酸脂化而抑制十六烷酸脂化. 过表达L-FABP肝细胞的研究表明脂肪酸吸收和脂化比例增加, 且磷脂和胆固醇脂数量增加[15]. 表达一条L-FABP反义RNA的HepG2细胞显示脂肪酸吸收剂量依赖性降低. 更有甚者, 过表达L-FABP的McA-RH7777[16]肝细胞与十六烷酸共孵育, 降低了甘油三脂的合成和分泌而增加了β-氧化和载脂蛋白B100的分泌[16].
体外脂肪酸结合蛋白的研究有其固有的局限性. 一种细胞类型特定一种脂类代谢, 不容易在细胞离体培养和转染细胞中模拟. 基因沉默小鼠补充了研究的局限性, 研究人员[17-18]检测到基因沉默小鼠中脂肪酸结合能力下降, 甘油三脂总量下降, 脂肪酸吸收和肝脏磷脂扩散改变. 首次定量研究了L-FABP对胞质脂肪酸连接能力的影响, 一定程度上说明了L-FABP是肝细胞脂类成分分布的重要决定因素. 但是也提出了新的问题, 如固醇结合蛋白-2/固醇结合蛋白-X(Sterol carrier protein-2/Sterol carrier protein-X SCP-2/SCP-X)参与胆固醇/固醇代谢[19], 与L-FABP共同影响脂类代谢, 使得L-FABP体内功能研究复杂化.
2.3.2 L-FABP与胆固醇代谢: 早期体外肝细胞实验表明L-FABP可以调节胆固醇吸收和代谢, 并且影响膜双分子层中的固醇移动. 近期关于L-FABP在体内的生理功能研究也有所进展. 不影响进食量和脂肪吸收量的基因沉默雄鼠实验[20]首次表明L-FABP可以改变胆固醇代谢, 影响体重和肥胖. 高胆固醇饮食的L-FABP基因沉默雌鼠肝中胆固醇和中性脂类(三酰基甘油和胆固醇脂)均升高. 虽然个别胆汁酸合成酶的生理学功能已经比较明了, 但是胆汁酸结合蛋白的生理学功能却不是很清楚[21-22]. 雄性L-FABP敲除小鼠用于研究L-FABP对于胆汁酸和胆汁固醇代谢的作用[23], 结果表明高胆固醇膳食后, L-FABP可能成为雄性小鼠胆汁酸合成、肝中胆固醇聚集的重要调节因素.
饮食中添加胆固醇可以调节许多遗传路径, 如固醇反应元件连接蛋白和肝X受体依赖途径, 每一条途径可以激活肝脏脂肪合成过程中的下游靶位[24-25]. 进一步的研究探讨了L-FABP沉默大鼠饮食中饱和脂肪酸和多不饱和脂肪酸不同的代谢途径. 多不饱合脂肪酸饱和脂肪酸饮食大鼠肝中脂肪酸转运蛋白-5(fatty acid transport protein-5, FATP-5)的表达也不同[26]. Newberry et al[27]研究发现西式饮食的L-FABP沉默大鼠不易发生肥胖, 最初原因是改变了饱和脂肪酸的代谢. 另一方面饮食中补加胆固醇不会使L-FABP沉默大鼠发生肥胖, 也不会积累过多甘油三脂. 胆固醇和甘油三脂代谢过程中的相互影响及L-FABP在其中的调控机制不是很明了.
细胞内长链脂肪酸与L-FABP的紧密关系提示L-FABP很可能参与细胞的有丝分裂, 因为长链脂肪酸可以作为新膜合成和能量供应的原材料. 体外细胞实验已经证明L-FABP与肝细胞有丝分裂活动相关. 近年来动物肝切除恢复试验[28-29]表明肝切除后短时间内L-FABP mRNA水平和蛋白水平均有所增加. 其蛋白水平的增加与肝内十六酸脂的清除有关, 而L-FABP低表达降低了肝修复活性. L-FABP在肝修复过程中起重要作用, 可以作为细胞分裂所需原材料的中间媒介. 预测L-FABP水平高低可能成为肝脏切除术后恢复的重要指标[30].
过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors PPARs)作为核受体超家族的一员, 其作用广泛, 涉及脂质和脂蛋白代谢、葡萄糖代谢、细胞增殖分裂和凋亡. PPAR在脂肪酸分解代谢率高的组织中高表达, 如肝脏、肾脏、心脏及肌肉组织中. 通过诱导线粒体和过氧化物酶体氧化水平及L-FABP基因表达来刺激脂肪酸分解代谢[31-32].
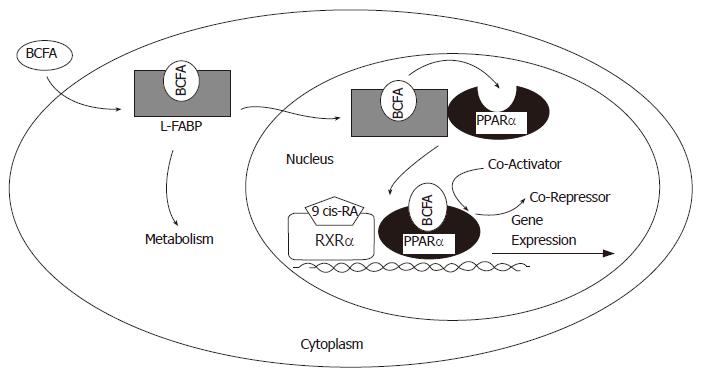
近来L-FABP通过增加过氧化物酶体增殖物激活受体-α(peroxisome proliferator-activated receptor-α, PPAR-α)活性或者基因表达水平来影响长链脂肪酸代谢的可能性引起重视. L-FABP和PPAR-α有相似的配基连接特性. L-FABP可以进入细胞核与核受体PPAR-α反应[33]. 肝细胞培养液中加入L-FABP受体, 激发了载有过氧化物酶体增殖物反应元件的报告基因的转录, 与内源性L-FABP关系密切. 也有学者提出假设: L-FABP介导支链脂肪酸(Branched chain fatty acid BCFA)至PPAR-α, 从而调控基因转录[34](图2). 这一过程中有许多问题急需解决, 例如: L-FABP如何识别PPAR-α及如何与之发生作用, 从而调节脂类相关基因表达[35].
过表达L-FABP的肝细胞增加了细胞核脂肪酸吸收[36], 可能激发了PPAR-α的活性, 也可能增加了其蛋白水平, 因为转染L-FABP cDNA的肝细胞增加了PPAR-αmRNA表达. L-FABP基因沉默小鼠喂食和饥饿的比较研究[37]表明L-FABP在长链脂肪酸(long chain fatty acid, LCFA)氧化过程中起作用. 饥饿状况下, 这种作用表现的更直接, 但不是通过最近预测的PPAR-α激活方式. 正常饮食情况下, 也确实观察到了L-FABP对于肝脏基因表达的影响. 可能L-FABP介导酶作用底物和影响基因表达方面的作用与机体生理状况有关. 另外他汀类药物诱导L-FABP表达实验表明其表达水平上调机制中有PPAR-α参与, 甚至PPAR-α可能是他汀类药物的靶位[38].
通过对罕见的遗传性不良脂类代谢患者与正常人对比研究发现细胞内脂类累积时L-FABP水平下降, 但是这种下降却与其mRNA表达下降无关[39]. 总之L-FABP的活性调控机制及其基因的转录调控机制目前没有统一的结论, PPAR-α可能在L-FABP的转录调控机制中起到重要作用.
脂肪酸转运蛋白的转运功能已经假定了几十年, 大量的直接或者间接的证据支持这一假说. 最近几年, 许多更加直接的研究手段得以应用, 包括体外分子水平模拟配基转运机制, 细胞水平和特定基因沉默动物水平定量研究L-FABP的吸收和转运功能. 所有这些证据也支持L-FABP的转运功能. 基因沉默动物、基因过表达肝细胞和更直接的利用生化手段操控L-FABP表达水平等研究方法更加直接、深入的研究了肝细胞内脂肪酸结合蛋白的转运机制. L-FABP转运机制的研究有助于2-型糖尿病、肥胖、胰岛素抵抗和脂肪肝等疾病的发病机理揭示与治疗[41]. 预测体外研究中, 特异结构和功能变异的L-FABP的应用和体内研究中寻找L-FABP特异性抑制剂将使得其生理功能更加清晰明了.
L-FABP是一种可在多组织中表达的蛋白, 特异性结合脂肪酸等诸多疏水配基, 在脂类代谢过程中起到重要的转运功能. 随着脂类代谢性疾病发生率的增加, L-FABP的生理功能逐渐得到重视, 揭示其转运机制有助于脂类代谢网络的研究.
高英堂, 研究员,天津市第三中心医院, 天津市肝胆疾病研究所分子细胞室
一系列体内和体外的实验证实了L-FABP转运脂肪酸这一功能, 尤其是基因工程小鼠的应用, 在生理水平上研究了其功能, 成为当今的热点. 但其存在固有的缺陷, 化学遗传学可以帮助研究者找到L-FABP的特异性抑制剂, 客观的揭示其生理功能.
Martin et al利用去基因小鼠从生理水平上研究了L-FABP在脂类代谢过程中的作用, 为脂类代谢机制做出了贡献. Besnard et al研究了PPAR-α与L-FABP调控脂类相关基因表达的机制, 从核酸水平揭示L-FABP对脂类代谢的影响.
本综述较系统的对L-FABP的特性与功能做出了总结, 概括了L-FABP研究领域的重点, 特别指出了寻找L-FABP的特异性抑制剂成为揭示L-FABP的生理功能的关键.
L-FABP参与体内脂肪酸等疏水配基转运, 在脂类代谢网络中起到重要作用. 随着脂类代谢综合症发病率日趋增高和L-FABP作用机制的进一步揭示, L-FABP很有可能成为2-型糖尿病、肥胖、胰岛素抵抗和脂肪肝等疾病治疗的靶位.
过氧化物酶体增殖物(peroxisome proliferator): 是一组多元化化学物质, 其中包括几种结构上不相关的降血脂药物、邻苯二甲酸酯和卤代溶剂. 通过结合PPAR-α调控相关基因表达.
本综述的内容较新颖, 结构层次较清晰, 文献引用新, 提供了有价值的参考信息.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Rajaraman G, Roberts MS, Hung D, Wang GQ, Burczynski FJ. Membrane binding proteins are the major determinants for the hepatocellular transmembrane flux of long-chain fatty acids bound to albumin. Pharm Res. 2005;22:1793-1804. [PubMed] [DOI] |
| 2. | Hung DY, Burczynski FJ, Chang P, Lewis A, Masci PP, Siebert GA, Anissimov YG, Roberts MS. Fatty acid binding protein is a major determinant of hepatic pharmacokinetics of palmitate and its metabolites. Am J Physiol Gastrointest Liver Physiol. 2003;284:G423-G433. [PubMed] |
| 3. | Hung DY, Siebert GA, Chang P, Burczynski FJ, Roberts MS. Reduced hepatic extraction of palmitate in steatosis correlated to lower level of liver fatty acid binding protein. Am J Physiol Gastrointest Liver Physiol. 2005;288:G93-G100. [PubMed] [DOI] |
| 4. | Richieri GV, Ogata RT, Zimmerman AW, Veerkamp JH, Kleinfeld AM. Fatty acid binding proteins from different tissues show distinct patterns of fatty acid interactions. Biochemistry. 2000;39:7197-7204. [PubMed] [DOI] |
| 5. | Chuang S, Velkov T, Horne J, Porter CJ, Scanlon MJ. Characterization of the drug binding specificity of rat liver fatty acid binding protein. J Med Chem. 2008;51:3755-3764. [PubMed] [DOI] |
| 6. | Hanhoff T, Lücke C, Spener F. Insights into binding of fatty acids by fatty acid binding proteins. Mol Cell Biochem. 2002;239:45-54. [PubMed] [DOI] |
| 7. | Storch J, Thumser AE. The fatty acid transport function of fatty acid-binding proteins. Biochim Biophys Acta. 2000;1486:28-44. [PubMed] |
| 8. | Stremmel W, Pohl L, Ring A, Herrmann T. A new concept of cellular uptake and intracellular trafficking of long-chain fatty acids. Lipids. 2001;36:981-989. [PubMed] [DOI] |
| 9. | Hertzel AV, Bernlohr DA. The mammalian fatty acid-binding protein multigene family: molecular and genetic insights into function. Trends Endocrinol Metab. 2000;11:175-180. [PubMed] [DOI] |
| 10. | Di Pietro SM, Veerkamp JH, Santomé JA. Isolation, amino acid sequence determination and binding properties of two fatty-acid-binding proteins from axolotl (Ambistoma mexicanum) liver. Evolutionary relationship. Eur J Biochem. 1999;259:127-134. [PubMed] [DOI] |
| 11. | Wolfrum C, Börchers T, Sacchettini JC, Spener F. Binding of fatty acids and peroxisome proliferators to orthologous fatty acid binding proteins from human, murine, and bovine liver. Biochemistry. 2000;39:1469-1474. [PubMed] [DOI] |
| 12. | He Y, Yang X, Wang H, Estephan R, Francis F, Kodukula S, Storch J, Stark RE. Solution-state molecular structure of apo and oleate-liganded liver fatty acid-binding protein. Biochemistry. 2007;46:12543-12556. [PubMed] [DOI] |
| 13. | Weisiger RA. Cytosolic fatty acid binding proteins catalyze two distinct steps in intracellular transport of their ligands. Mol Cell Biochem. 2002;239:35-43. [PubMed] [DOI] |
| 14. | Jolly CA, Wilton DC, Schroeder F. Microsomal fatty acyl-CoA transacylation and hydrolysis: fatty acyl-CoA species dependent modulation by liver fatty acyl-CoA binding proteins. Biochim Biophys Acta. 2000;1483:185-197. [PubMed] |
| 15. | Guo M, Gong S, Maric S, Misulovin Z, Pack M, Mahnke K, Nussenzweig MC, Steinman RM. A monoclonal antibody to the DEC-205 endocytosis receptor on human dendritic cells. Hum Immunol. 2000;61:729-738. [PubMed] [DOI] |
| 16. | Lindén D, Lindberg K, Oscarsson J, Claesson C, Asp L, Li L, Gustafsson M, Borén J, Olofsson SO. Influence of peroxisome proliferator-activated receptor alpha agonists on the intracellular turnover and secretion of apolipoprotein (Apo) B-100 and ApoB-48. J Biol Chem. 2002;277:23044-23053. [PubMed] [DOI] |
| 17. | Martin GG, Danneberg H, Kumar LS, Atshaves BP, Erol E, Bader M, Schroeder F, Binas B. Decreased liver fatty acid binding capacity and altered liver lipid distribution in mice lacking the liver fatty acid-binding protein gene. J Biol Chem. 2003;278:21429-21438. [PubMed] [DOI] |
| 18. | Newberry EP, Xie Y, Kennedy S, Han X, Buhman KK, Luo J, Gross RW, Davidson NO. Decreased hepatic triglyceride accumulation and altered fatty acid uptake in mice with deletion of the liver fatty acid-binding protein gene. J Biol Chem. 2003;278:51664-51672. [PubMed] [DOI] |
| 19. | Atshaves BP, McIntosh AL, Landrock D, Payne HR, Mackie JT, Maeda N, Ball J, Schroeder F, Kier AB. Effect of SCP-x gene ablation on branched-chain fatty acid metabolism. Am J Physiol Gastrointest Liver Physiol. 2007;292:G939-G951. [PubMed] [DOI] |
| 20. | Martin GG, Atshaves BP, McIntosh AL, Mackie JT, Kier AB, Schroeder F. Liver fatty-acid-binding protein (L-FABP) gene ablation alters liver bile acid metabolism in male mice. Biochem J. 2005;391:549-560. [PubMed] [DOI] |
| 21. | Meier PJ, Stieger B. Bile salt transporters. Annu Rev Physiol. 2002;64:635-661. [PubMed] [DOI] |
| 22. | Agellon LB, Torchia EC. Intracellular transport of bile acids. Biochim Biophys Acta. 2000;1486:198-209. [PubMed] |
| 23. | Martin GG, Atshaves BP, McIntosh AL, Mackie JT, Kier AB, Schroeder F. Liver fatty acid binding protein gene ablation potentiates hepatic cholesterol accumulation in cholesterol-fed female mice. Am J Physiol Gastrointest Liver Physiol. 2006;290:G36-G48. [PubMed] [DOI] |
| 24. | Hoekstra M, Stitzinger M, van Wanrooij EJ, Michon IN, Kruijt JK, Kamphorst J, Van Eck M, Vreugdenhil E, Van Berkel TJ, Kuiper J. Microarray analysis indicates an important role for FABP5 and putative novel FABPs on a Western-type diet. J Lipid Res. 2006;47:2198-2207. [PubMed] [DOI] |
| 25. | Maxwell KN, Soccio RE, Duncan EM, Sehayek E, Breslow JL. Novel putative SREBP and LXR target genes identified by microarray analysis in liver of cholesterol-fed mice. J Lipid Res. 2003;44:2109-2119. [PubMed] [DOI] |
| 26. | Newberry EP, Kennedy SM, Xie Y, Sternard BT, Luo J, Davidson NO. Diet-induced obesity and hepatic steatosis in L-Fabp / mice is abrogated with SF, but not PUFA, feeding and attenuated after cholesterol supplementation. Am J Physiol Gastrointest Liver Physiol. 2008;294:G307-G314. [PubMed] [DOI] |
| 27. | Newberry EP, Xie Y, Kennedy SM, Luo J, Davidson NO. Protection against Western diet-induced obesity and hepatic steatosis in liver fatty acid-binding protein knockout mice. Hepatology. 2006;44:1191-1205. [PubMed] [DOI] |
| 28. | Wang G, Chen QM, Minuk GY, Gong Y, Burczynski FJ. Enhanced expression of cytosolic fatty acid binding protein and fatty acid uptake during liver regeneration in rats. Mol Cell Biochem. 2004;262:41-49. [PubMed] [DOI] |
| 29. | Moser MJ, Gong Y, Zhang MN, Johnston J, Lipschitz J, Minuk GY. Immediate-early protooncogene expression and liver function following various extents of partial hepatectomy in the rat. Dig Dis Sci. 2001;46:907-914. [PubMed] [DOI] |
| 30. | Pelsers MM, Hermens WT, Glatz JF. Fatty acid-binding proteins as plasma markers of tissue injury. Clin Chim Acta. 2005;352:15-35. [PubMed] [DOI] |
| 32. | Ye JM, Iglesias MA, Watson DG, Ellis B, Wood L, Jensen PB, Sørensen RV, Larsen PJ, Cooney GJ, Wassermann K. PPARalpha /gamma ragaglitazar eliminates fatty liver and enhances insulin action in fat-fed rats in the absence of hepatomegaly. Am J Physiol Endocrinol Metab. 2003;284:E531-E540. [PubMed] |
| 33. | Wolfrum C, Borrmann CM, Borchers T, Spener F. Fatty acids and hypolipidemic drugs regulate peroxisome proliferator-activated receptors alpha - and gamma-mediated gene expression via liver fatty acid binding protein: a signaling path to the nucleus. Proc Natl Acad Sci USA. 2001;98:2323-2328. [PubMed] [DOI] |
| 34. | Schroeder F, Petrescu AD, Huang H, Atshaves BP, McIntosh AL, Martin GG, Hostetler HA, Vespa A, Landrock D, Landrock KK. Role of fatty acid binding proteins and long chain fatty acids in modulating nuclear receptors and gene transcription. Lipids. 2008;43:1-17. [PubMed] [DOI] |
| 35. | Tan NS, Shaw NS, Vinckenbosch N, Liu P, Yasmin R, Desvergne B, Wahli W, Noy N. Selective cooperation between fatty acid binding proteins and peroxisome proliferator-activated receptors in regulating transcription. Mol Cell Biol. 2002;22:5114-5127. [PubMed] [DOI] |
| 36. | Huang H, Starodub O, McIntosh A, Kier AB, Schroeder F. Liver fatty acid-binding protein targets fatty acids to the nucleus. Real time confocal and multiphoton fluorescence imaging in living cells. J Biol Chem. 2002;277:29139-29151. [PubMed] [DOI] |
| 37. | Erol E, Kumar LS, Cline GW, Shulman GI, Kelly DP, Binas B. Liver fatty acid binding protein is required for high rates of hepatic fatty acid oxidation but not for the action of PPARalpha in fasting mice. FASEB J. 2004;18:347-349. [PubMed] |
| 38. | Landrier JF, Thomas C, Grober J, Duez H, Percevault F, Souidi M, Linard C, Staels B, Besnard P. Statin induction of liver fatty acid-binding protein (L-FABP) gene expression is peroxisome proliferator-activated receptor-alpha-dependent. J Biol Chem. 2004;279:45512-45518. [PubMed] [DOI] |
| 39. | Guilmeau S, Niot I, Laigneau JP, Devaud H, Petit V, Brousse N, Bouvier R, Ferkdadji L, Besmond C, Aggerbeck LP. Decreased expression of Intestinal I- and L-FABP levels in rare human genetic lipid malabsorption syndromes. Histochem Cell Biol. 2007;128:115-123. [PubMed] [DOI] |
| 41. | Postic C, Girard J. Contribution of de novo fatty acid synthesis to hepatic steatosis and insulin resistance: lessons from genetically engineered mice. J Clin Invest. 2008;118:829-838. [PubMed] [DOI] |