修回日期: 2008-07-24
接受日期: 2008-08-12
在线出版日期: 2008-09-28
目的: 分析胃良恶性黏膜的固有荧光差异.
方法: 收集胃癌手术标本和胃低级别上皮内瘤变黏膜标本制成冰冻切片, 在激光共聚焦显微镜下观察并测定荧光强度.
结果: 固有荧光主要位于胃壁黏膜层和黏膜下层. 与正常胃黏膜相比, 在胃癌和低级别上皮内瘤变组织中平均绿红荧光强度比较低(1.57±0.69, 2.06±0.51 vs 3.75±1.41, P<0.01, 0.05). 同一患者的正常胃黏膜固有荧光强度明显高于胃腺癌胃黏膜(P<0.05), 而与低级别上皮内瘤变胃黏膜之间无显著差异.
结论: 胃癌黏膜绿色固有荧光强度变化可作为恶性病变的标志.
引文著录: 陈颖, 吴云林, 吴巍, 蔚青, 胡伟国, 郭强苏. 人胃癌与癌前病变组织的固有荧光特征. 世界华人消化杂志 2008; 16(27): 3055-3059
Revised: July 24, 2008
Accepted: August 12, 2008
Published online: September 28, 2008
AIM: To analyze the autofluorescence differences between the benign and malignant gastric mucosa.
METHODS: The specimens of gastric cancer and low-grade intraepithelial neoplasia were collected to make frozen sections. The autofluorescence intensity was observed and measured by laser confocal microscopy.
RESULTS: The autofluorescence was mainly located in gastric mucosa and submucosa. In comparison with that in nomal gastric mucosa, the green-red fluorescence intensity in gastric cancer and low-grade intraepithelial neoplasia decreased significantly (1.57 ± 0.69, 2.06 ± 0.51 vs 3.75 ± 1.41; P < 0.01, 0.05). The fluorescence intensity of green wavelength in normal gastric mucosa was significantly higher than that in gastric cancer mucosa, while it was significantly different from that in low-grade intraepithelial neoplasia mucosa.
CONCLUSION: The change of green fluorescence in gastric cancer mucosa may be a marker of malignant lesion.
- Citation: Chen Y, Wu YL, Wu W, Wei Q, Hu WG, Guo QS. Autofluorescence characteristics in human gastric cancer and precancerous tissues. Shijie Huaren Xiaohua Zazhi 2008; 16(27): 3055-3059
- URL: https://www.wjgnet.com/1009-3079/full/v16/i27/3055.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i27.3055
生物物质在一定光能量激发下, 产生比激发光波长更长的光, 当激发光消失这种光也消失, 我们称这种光为荧光. 由于荧光产生完全来自于生物体内部, 故称其为固有荧光(auto-fluorescence)[1-2]. 1924年Policard et al最早报道在紫外光照射下离体肿瘤组织可发出荧光[3]. 此后, 生物学家研究各种细胞大分子物质的荧光, 并且证实可以利用物质的荧光特性来推断他们的理化性质[4-5]. Majumder et al[6]对比了甲醛固定的乳腺组织和新鲜的乳腺组织标本的荧光强度认为固定作用可能破坏荧光物质致荧光强度降低. 为了尽可能保持胃癌固有荧光不被破坏, 我们选用新鲜胃组织标本快速制成冰冻切片, 再进行观察.
收集2006-09/2007-06我院胃腺癌标本共10例, 均为手术切除标本. 胃部增生性病变5例, 均为内镜下活检标本.
1.2.1 胃癌手术标本与内镜活检标本的取材与冰冻切片制备: (1)将手术切除的新鲜胃癌标本快速清洗去污后, 选择癌肿部位和邻近正常胃壁组织(与病灶至少5 cm以上的同一病例), 切取全层组织块, 大小约0.5-1 cm. (2)将内镜下活检的胃部病变标本与近旁的正常胃黏膜标本快速清洗去污. (3)将取得的组织标本放入装有OCT(optimal cutting temperature, 简称OCT)介质的冻存管中, 于-70 ℃冰箱内保存. (4)将冰冻于OCT介质的组织块取出, 置于冰冻切片机上, 修除组织块多余的边角后, 选取组织中心部位切取20±5 μm厚的组织, 切下的组织片在冰冻制片机器中迅速与玻片贴合. (5)在组织片上滴加1-2滴无荧光的矿物油, 以防止水分蒸发, 最后盖玻片封片, 在2 h内, 送CFM检测. 上述组织切片相邻的另一组织切片做常规HE染色, 然后盖玻片封片, 送白光显微镜下观察.
1.2.2 CFM下对冰冻组织切片固有荧光观测: 采用德国LSM510 Zeiss Inc.激光共聚焦显微镜, 工作参数为激发光能源, 氩离子; 功率: 1 mW; 激发光波长为488 nm; 双波长通道收集固有荧光范围为505-530 nm, >580 nm; 光通道针孔直径: 181 um; LSM Image 5软件系统进行图像信息保存和分析; 双通道固有荧光图像观测: 选用40×物镜, 调整图像至清晰. 以HE染色切片为参考, 先在白光光镜下迅速找到需观测的固有荧光的部位. 然后关闭白光, 打开氩离子激光, 投射到观察部位, 收集波长范围505-530 nm和>580 nm的图像. 每个图像平均扫描3次, 图像色素为1024×1024, 大小8 bits. 每幅图像平均扫描时间约6 s. 获得图像存入LSM Image 5软件系统做进一步分析.
统计学处理 采用SAS 6.12软件进行统计学处理, 计量资料以mean±SD表示, 两组间比较采用t检验.
所有手术标本病灶病理结果为腺癌, 浸润至黏膜和或黏膜下6例, 浸润至肌层4例. 5例内镜下活检标本病理显示低级别上皮内瘤变.
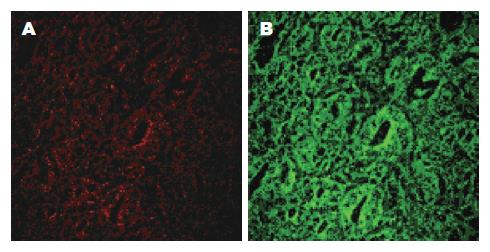
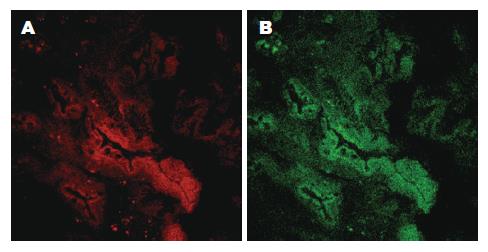
10例手术标本中正常胃壁冰冻切片中固有荧光图像观察, 我们发现胃壁呈现四层荧光结构. 黏膜层: 为绿色固有荧光较强区域, 荧光的不同强度勾勒出黏膜层内多个腺管样结构. 腺管排列无紊乱, 朝向管腔的腺上皮层以及管腔基底部的基底膜附近的荧光强度最强. 腺管壁可见排列较整齐的细胞的轮廓, 绿色荧光主要集中在细胞胞质内, 腺管壁还可见多个圆形小泡状无荧光区域. 腺泡间质的结缔组织中也可见条索样的绿色固有荧光(图1). 黏膜下层: 绿色荧光区域内见条索状荧光, 根据其形态与分布推断可能是黏膜下层的弹力纤维或胶原纤维. 部分荧光呈环形结构, 对照HE染色切片, 考虑为黏膜下层小血管管壁. 黏膜下层内红色固有荧光相对较弱, 双通道观察显示以绿色荧光为主(图2). 肌层与浆膜层: 两层紧密相连. 肌层较厚, 其中可见绿色固有荧光呈絮状不规则排列, 部分区域荧光如细弹簧状, 荧光强度明显弱于黏膜层和黏膜下层. 浆膜层较薄, 几乎没有荧光表现. 肌层内红色固有荧光散在分布, 强度非常弱, 双通道观察显示该层以绿色荧光为主(图3).
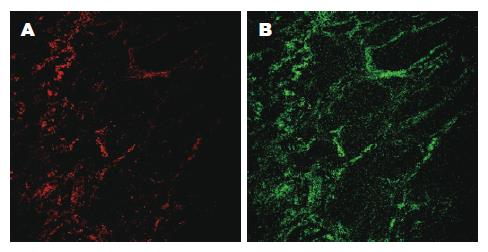
在绿色固有荧光区域观察低级别上皮内瘤变的胃黏膜, 可见黏膜层内多个腺管样结构. 腺管排列无紊乱, 朝向管腔的腺上皮层以及管腔基底部的基底膜附近的荧光强度无增强, 腺管荧光与周边间质界限模糊. 腺管壁荧光分布厚度不均, 腺管壁组成细胞的轮廓含混不清, 管壁较正常增厚. 腺泡间质的结缔组织中绿色固有荧光强度略弱于腺管壁. 间质内荧光分布较均一, 无法辨别间质结构(图4).
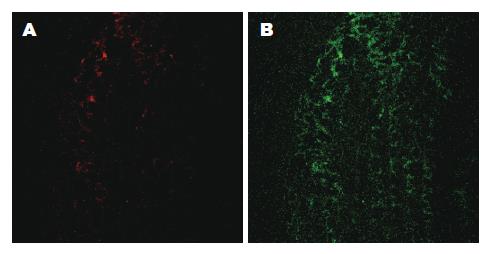
在绿色固有荧光区域观察胃腺癌的胃黏膜, 可见黏膜层内腺管样结构散在, 数量减少, 腺管排列紊乱, 管腔形态不规则. 朝向管腔的腺上皮层荧光强度有增强而管腔基底部的基底膜附近的荧光强度无增强, 腺管荧光与周边间质界限模糊. 腺管壁荧光分布不均, 腺管壁组成细胞的轮廓含混不清, 管壁明显增厚. 腺泡间质的结缔组织中绿色固有荧光强度略弱于腺管壁. 部分无法区分间质结构与增厚的腺管壁(图5).
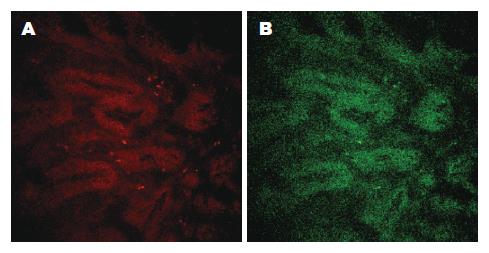
对比红绿双通道复合观察正常和低级别上皮内瘤变以及腺癌胃黏膜三种胃黏膜的固有荧光激光共聚焦图像可以看到: 正常黏膜层内红色固有荧光相对较弱, 双通道观察显示以绿色荧光为主; 上皮内瘤变黏膜层内红色固有荧光相对较弱, 双通道观察显示以黄绿色与略成棕色荧光为主, 棕色偏红色主要集中在腺管间的基质中; 胃癌黏膜层内红色固有荧光相对较强, 双通道观察显示以黄绿色与略呈棕色荧光为主, 棕色偏红色主要集中在腺管间的基质中以及部分腺管壁(图6).
10例正常胃黏膜的绿/红荧光强度比平均为3.75±1.41; 10例胃癌胃黏膜的绿/红荧光强度比平均为1.57±0.69; 5例低级别上皮内瘤变胃黏膜的绿/红荧光强度比平均为2.06±0.51. 胃癌与正常胃黏膜层绿红荧光强度比统计学差异非常显著(P<0.01), 低级别上皮内瘤变与正常胃黏膜层绿红荧光强度比统计学差异显著(P<0.05).
测量绿色波段正常和低级别上皮内瘤变以及腺癌胃黏膜三种胃黏膜的固有荧光强度, 我们发现: 同一患者的正常胃黏膜固有荧光强度明显高于胃腺癌胃黏膜(P<0.05), 同一患者正常胃黏膜固有荧光强度与低级别上皮内瘤变胃黏膜的固有荧光强度统计学上无显著差异(P>0.05).
分子生物学研究显示, 正常黏膜需经历多步骤多基因改变才最终发展为癌肿. 在癌症发生初期, 并没有肉眼可以观察到的改变, 甚至也没有显微镜可以观察到的细胞和组织形态学的改变[7-8]. 但是从生物分子构成分析良恶性的界限已经出现. 许多调节细胞生长的物质如一些氨基酸, 参与能量代谢的辅酶等小分子物质以及细胞因子都能产生荧光[9-10].
本研究设计时摈弃了传统的研究固定组织切片的方法, 而是采用胃壁组织冰冻切片组织并严格控制检测过程中的各项条件, 使组织内各荧光物质处于新鲜的状态. 通过488 nm蓝色光激发正常胃壁组织冰冻切片各层. 在红光与绿光光谱双通道复合图像中可以观察到从黏膜层到浆膜层都是以绿光区域内的固有荧光为主的. 此外, 黏膜层和黏膜下层的固有荧光强度明显高于肌层和浆膜层, 显示胃壁固有荧光主要来源于黏膜和黏膜下层.
但是在低级别上皮内瘤变(根据2000年WHO肿瘤分类对上皮组织癌前病变的诊断[11], 病变表现相当于低度和中度异型增生)病灶中我们发现绿红荧光强度比也明显低于正常, 也就是说用传统的绿红荧光强度比可能无法区分胃癌和癌前病变. 正如Ohkawa et al[12]采用438 nm激发光对53例胃部良性病变、40例早期胃癌、16例腺瘤共109个病灶进行研究, 采用绿红比诊断方法. 所有的胃癌100%被诊断出来, 但是49.1%的良性病灶被误判为恶性. 存在相当高的误诊率, 即特异度较低.
从这次研究得到的红绿双通道合成固有荧光图像中, 我们发现绿红比下降即呈现粉红或棕红区域一般都位于腺体的底部或者腺体的间质中. 组织内红色区域的荧光主要来源于血卟啉成分[13-14]. 由此我们推测在癌症或癌前病变病灶中组织液内血卟啉成分明显高于正常黏膜, 红光荧光强度增加致绿红比下降. 但这种特征并非来源于癌变的细胞本身, 而是来于机体与病变细胞或腺体的相互作用, 如反复炎症反应或组织变性等. 所以绿红荧光强度比下降可以出现在炎症、腺瘤、异型增生、癌变等多个良恶性病变中, 并不能作为判断组织癌变的唯一诊断依据. 而单纯绿光波段的荧光强度降低具有胃癌特异性, 可以此区分胃癌和癌前期病变.
当然, 目前我们的研究是对胃癌和癌前病变固有荧光激光共聚焦图像特征的初步探讨, 尚存在一定的局限性. 由于医学伦理要求癌前病变固有荧光研究只能取材于活检标本, 而不能取到胃壁全层作CFM观测. 对于更深处组织尤其是黏膜下层的固有荧光图像变化的信息无法研究, 是一个遗憾. 今后可能可以通过动物模型对此进行弥补.
此外, 近年来激光共聚焦内镜已开始应用于临床[15-16], 通过他在活体内就能直接观察到细胞和组织结构, 但由于不同于常规的病理切片染色, 我们发现激光共聚焦内镜在图像上仍较难识别癌变的病灶. 本次实验提示将固有荧光技术与激光共聚焦技术相结合完全有可能更准确显示出癌变病灶, 而且该方法无需注入任何显影剂, 较为安全.
固有荧光亦被称为自体荧光(auto-fluorescence), 激光诱发自体荧光(LIF)等, 是指不借助任何外源性荧光物质, 在一定波长、一定能量的光激发下, 利用人体组织自身荧光物质发出荧光, 根据正常组织与异常组织不同的荧光光谱与荧光图像, 对生长在上皮黏膜的癌前病变进行诊断. 固有荧光技术是利用肿瘤组织的荧光光谱特点进行内镜诊断的一项新技术.
郑鹏远, 教授, 郑州大学第二附属医院消化科
肉眼通过普通白光内镜诊断一些表浅平坦的病灶以及炎症水肿严重或多发病灶仍然较为困难. 自20世纪80年代以来, 固有荧光肿瘤诊断技术得到长足发展, 国内外先后有固有荧光肿瘤诊断仪研制成功,并开始应用于临床诊断.
综合已发表的文献报道, 固有荧光技术对于癌前期低级别上皮内瘤变的诊断准确率较低, 本文对此进行了研究.
本次实验将固有荧光技术与激光共聚焦技术相结合完全有可能更准确显示出癌变病灶, 而且该方法无需注入任何显影剂, 较为安全, 也为固有荧光与激光共聚焦两项技术的融合提供了实验基础.
本课题学术性强, 设计严谨, 具有较大的理论及临床意义.
编辑: 李军亮 电编: 何基才
| 1. | Elleder M, Borovanský J. Autofluorescence of melanins induced by ultraviolet radiation and near ultraviolet light. A histochemical and biochemical study. Histochem J. 2001;33:273-281. [PubMed] [DOI] |
| 2. | Monici M. Cell and tissue autofluorescence research and diagnostic applications. Biotechnol Annu Rev. 2005;11:227-256. [PubMed] [DOI] |
| 3. | Inaguma M, Hashimoto K. Porphyrin-like fluorescence in oral cancer: In vivo fluorescence spectral characterization of lesions by use of a near-ultraviolet excited autofluorescence diagnosis system and separation of fluorescent extracts by capillary electrophoresis. Cancer. 1999;86:2201-2211. [PubMed] [DOI] |
| 4. | Rocheleau JV, Head WS, Piston DW. Quantitative NAD(P)H/flavoprotein autofluorescence imaging reveals metabolic mechanisms of pancreatic islet pyruvate response. J Biol Chem. 2004;279:31780-31787. [PubMed] [DOI] |
| 5. | Moesta KT, Ebert B, Handke T, Nolte D, Nowak C, Haensch WE, Pandey RK, Dougherty TJ, Rinneberg H, Schlag PM. Protoporphyrin IX occurs naturally in colorectal cancers and their metastases. Cancer Res. 2001;61:991-999. [PubMed] |
| 6. | Majumder SK, Ghosh N, Gupta PK. N2 laser excited autofluorescence spectroscopy of formalin-fixed human breast tissue. J Photochem Photobiol B. 2005;81:33-42. [PubMed] [DOI] |
| 7. | Li BH, Xie SS. Autofluorescence excitation-emission matrices for diagnosis of colonic cancer. World J Gastroenterol. 2005;11:3931-3934. [PubMed] |
| 8. | Sargan I, Motoc A, Vaida MA, Bolintineanu S, Vîscu S. Anatomic and pathological aspects in the pathology of malignant gastric tumors. Rom J Morphol Embryol. 2006;47:163-168. [PubMed] |
| 9. | Heinzel FR, Luo Y, Dodoni G, Boengler K, Petrat F, Di Lisa F, de Groot H, Schulz R, Heusch G. Formation of reactive oxygen species at increased contraction frequency in rat cardiomyocytes. Cardiovasc Res. 2006;71:374-382. [PubMed] [DOI] |
| 10. | Gerstbrein B, Stamatas G, Kollias N, Driscoll M. In vivo spectrofluorimetry reveals endogenous biomarkers that report healthspan and dietary restriction in Caenorhabditis elegans. Aging Cell. 2005;4:127-137. [PubMed] [DOI] |
| 11. | Vieth M, Stolte M. Elevated risk for gastric adenocarcinoma can be predicted from histomorphology. World J Gastroenterol. 2006;12:6109-6114. [PubMed] |
| 12. | Ohkawa A, Miwa H, Namihisa A, Kobayashi O, Nakaniwa N, Ohkusa T, Ogihara T, Sato N. Diagnostic performance of light-induced fluorescence endoscopy for gastric neoplasms. Endoscopy. 2004;36:515-521. [PubMed] [DOI] |
| 13. | Ueda Y, Kobayashi M. Spectroscopic studies of autofluorescence substances existing in human tissue: influences of lactic acid and porphyrins. Appl Opt. 2004;43:3993-3998. [PubMed] [DOI] |
| 14. | Endlicher E, Messmann H. Photodynamic diagnosis in the gastrointestinal tract. Gastrointest Endosc Clin N Am. 2004;14:475-485, viii. [PubMed] [DOI] |
| 15. | Yoshida S, Tanaka S, Hirata M, Mouri R, Kaneko I, Oka S, Yoshihara M, Chayama K. Optical biopsy of GI lesions by reflectance-type laser-scanning confocal microscopy. Gastrointest Endosc. 2007;66:144-149. [PubMed] [DOI] |