修回日期: 2008-07-31
接受日期: 2008-08-04
在线出版日期: 2008-09-28
非甾体类抗炎药非甾体抗炎药(non-steroid anti-inflammatory drugs, NSAIDs)是一类具有抗炎、镇痛、解热等作用的药物. 他是目前全球处方量最大的药物之一. 本文介绍了NSAIDs与胃肠道疾病以及对胃肠损伤的防治, 并就NSAIDs的作用机制及临床应用等进行综述.
引文著录: 张小晋. 非甾体抗炎药与胃肠道疾病. 世界华人消化杂志 2008; 16(27): 3021-3025
Revised: July 31, 2008
Accepted: August 4, 2008
Published online: September 28, 2008
Non-steroid anti-inflammatory drugs (NSAIDs) are a group of medicine used for anti-inflammation, analgesia and antipyretic. Currently NSAIDs are one of the most commonly prescribed medicines world-wide. In this article, we summarized the effect of NSAIDs on digestive diseases, and indroduced the prevention and treatment for mucosal injury of gastrointestenal tract. Meanwhile, we elaborated the pharmaceutical machanism and clinic application of NSAIDs.
- Citation: Zhang XJ. Non-steroid anti-inflammatory drugs and digestive diseases. Shijie Huaren Xiaohua Zazhi 2008; 16(27): 3021-3025
- URL: https://www.wjgnet.com/1009-3079/full/v16/i27/3021.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i27.3021
非甾体抗炎药(non-steroid anti-inflammatory drugs, NSAIDs)是一类具有抗炎、镇痛、解热等作用的药物, 这类药物的命名是为把他们与抗炎的糖皮质激素和非麻醉性阿片类镇痛剂区别开来. 与激素相对而言, 这一类药物其化学结构中缺乏激素所具有的甾环, 故而得名. 目前NSAIDs是全球处方量最大的药物之一, 在内、外、妇、儿科广泛使用[1]. 据统计全球约一亿五千万人长期服用NSAIDs[2]. 随着应用的日趋广泛, 其不良反应的报道也日益增多. 据美国FDA资料, NSAIDs约占药物不良反应的1/3[3]. 其中对胃肠损害的研究报道最多, 也日益受到关注. 本文就NSAIDs与胃肠道疾病作一综述.
目前已经发现三种COX, 分别为COX-1, COX-2和COX-3. COX-1诱导产生的前列腺素(prostaglandin, PG)PGE2和PGI2的平衡, 维持胃肠道黏膜的完整性以及调节肾血流量. PG通过诱导产生血栓素A2(thromboxane A2, TXA2)维持血小板的凝血功能以及通过诱导PGI2的产生维持内皮细胞功能. COX-1在各种组织中广泛表达, 主要起维持正常生理功能的作用. 而COX-2在大多数正常组织中无表达. COX-2主要表达在炎症部位巨噬细胞、成纤维细胞、上皮细胞和内皮细胞等部位[4]. 随着对COX研究的进展, 显示两种COX生理和病理功能上有很大重叠. 他们不仅都参与炎症反应, 还参与许多重要的生理过程[5-7]. COX-3是新发现的COX: 1999年, Simmons et al[8]发现了COX-3, 认为他是COX-2的异构体. COX-3蛋白在体内和离体实验中均产生一些具有抗炎活性的因子[9-10].
在关节与骨的炎症中, PG和白三烯是重要的炎症因子, 他们引起炎症的主要作用机制是促进白细胞趋化, 增加血管通透性, 促进组织红肿; 此外, PG还可以使痛觉神经末梢增敏, 产生疼痛[1].
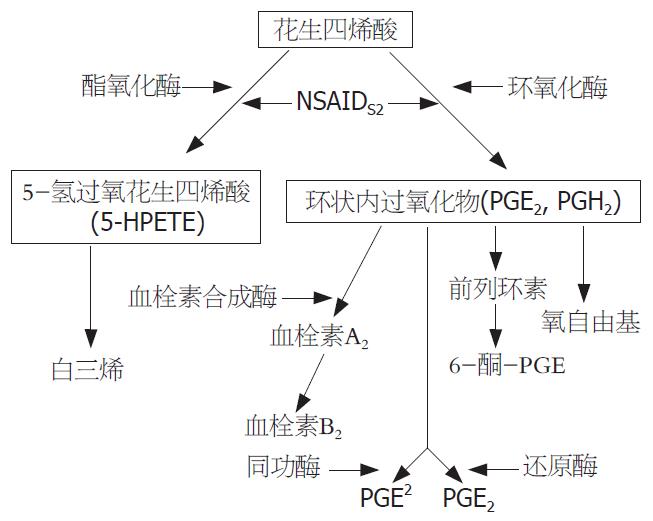
组织中的磷脂在磷脂酶A2作用下, 产生游离花生四烯酸, 花生四烯酸经过脂氧合酶作用而生成白三烯. 花生四烯酸经过COX作用催化加入氧分子, 形成前列腺素PGG2; 同时环氧化酶分子也有内过氧化物合酶活性,他可以催化生成PGE2, 在血栓素合成酶作用下生成血栓素TXA2和血栓素TXB2, 促进血小板凝集.
NSAIDs主要是通过抑制环氧化酶、阻断前列腺素和血栓素TXA2的产生而起到抗炎、镇痛、退热、抗血小板聚集等作用[11]. 另外, NSAIDs的作用机制还包括: 解除氧化磷酸化偶联; 从血浆蛋白里置换出内源性抗炎多肽; 抑制溶酶体酶释放; 抑制补体活化; 拮抗激酶活性及其产生; 抑制氧自由基产生; 抑制白细胞聚集和黏附(图1)[12].
一般认为NSAIDs通过抑制COX-2产生抗炎、镇痛等治疗作用, 而通过抑制COX-1产生胃肠道和肾脏等部位的不良反应[4]. 选择性COX-2抑制剂镇痛消炎作用和非选择性COX-2抑制剂无显著差别, 但胃肠道不良反应较少.
NSAIDs的分类是根据其对环氧化酶(COX)抑制作用的选择性划分的(表1). IC50COX-2/IC50COX-1比值越大, 对COX-1抑制作用越强. 反之, 表明对COX-2抑制作用强.
| 类别 | 代表药物 | IC50COX-2/IC50COX-1比值 |
| 选择性COX-1抑制剂 | Aapirin(低剂量阿司匹林) | >1 |
| Indometacin(消炎痛) | ||
| 非选择性COX-1抑制剂 | Piroxicam(吡罗昔康) | >1 |
| Diclofenac(双氯芬酸) | ||
| Meloxicam(美洛昔康) | ||
| 选择性COX-2抑制剂 | Nabumetone(萘丁美酮) | 0.1-0.01 |
| Celecoxib(塞来昔布) | ||
| 特异性COX-2抑制剂 | Rofecoxib(罗非昔布) | 0.01-0.001 |
NSAIDs的主要临床应用包括: (1)抗炎: NSAIDs抗炎应用于风湿性疾病、慢性炎性关节病; 运动损伤; 软组织风湿症, 如肩周炎、腰肌劳损、肌纤维组织炎; 某些感染性疾病, 如扁桃体炎、呼吸道感染、泌尿系感染等. (2)镇痛: 主要用于术后、癌性和神经性疼痛、痛经等; 有研究表明, 在治疗剧痛时, 与阿片类镇痛药联合应用, 可是阿片类药物的用量减少20%-50%[13]. (3)预防心脑血管疾病: NSAIDs(特别是阿司匹林)可以抑制血小板聚集和黏附, 防止血栓形成. (4)防治肿瘤: 流行病学研究证实, NSAIDs与食管、胃、乳腺、前列腺、膀胱和卵巢癌的死亡率降低有关. 长期应用, 可使结肠癌或结肠腺瘤的危险性和死亡率下降30%-50%. (5)防治阿尔茨海默病(alzheimer's disease, AD). (6)对脑损伤后炎症的影响: 研究发现, NSAIDs对缺血性脑损伤发挥脑保护作用.
黏液-碳酸氢盐屏障的完整性, 丰富的黏膜血流, 细胞更新和修复, 上皮生长因子等均是胃黏膜保护因子. PG可以刺激黏液和碳酸氢盐分泌, 增加黏膜血流, 促进损伤喉黏膜的修复, 减少炎症介质的释放, 内源性的前列腺素降低引起黏膜的损伤[14].
目前认为, NSAIDs是通过局部和全身两种方式引起胃黏膜损害的. 局部损害的机制是: (1)通过"离子捕获"(iron traping)过程对黏膜细胞直接损伤而增加氢离子反渗. (2)干扰细胞能量代谢, 引起细胞通透性改变和离子转运抑制. (3)降低黏液层疏水性, 在局部引起胃黏膜浅表损害, 表现为黏膜下出血和糜烂[15]. NSAIDs通过全身引起胃黏膜的损伤的机制: (1)主要是抑制COX的产生, 使内源性的前列腺素特别是PGE1、PGE2和PGEI2的合成减少, 影响胃黏膜细胞分泌黏蛋白和表面磷脂, 削弱了胃黏膜屏障, 同时抑制了胃和十二指肠上皮中碳酸盐的分泌, 削弱了上皮的修复和更新[16]. (2)干扰生长因子, 减少溃疡边缘的内皮细胞增生, 减少溃疡创的血管生成, 减少肉芽组织的生长, 使溃疡愈合延期. (3)通过白三烯诱发中性粒细胞黏附致内皮细胞上而使血管收缩使局部血流减少. (4)抑制氧化磷酸过程, 从而使ATP减少, 引起黏膜通透性增加[17]. (5)诱导胃肠道细胞凋亡. 主要是通过影响细胞内能量代谢, 包括线粒体的能量代谢、糖酵解和磷酸戊糖途径[18].
不同的NSAIDs对COX-1和COX-2的抑制作用不同, 其对胃肠道黏膜的损伤也有差异. 传统观点认为, 抑制COX-1为主的NSAIDs毒性作用大, 抑制COX-2为主的NSAIDs主要作用是抗炎、止痛, 对胃肠道的毒性作用相对小. 最新研究表明, COX-1和COX-2在炎症反应部位和胃肠道、肾脏共同存在、共同发挥作用. 因而, 传统所谓"COX-2抑制作用越特异, 副作用越小"的观点可能是错误的[19]. 有学者认为, 在已存在胃肠道损伤和/或损伤因素时, COX-2抑制剂也可能引起或加重胃肠道的副作用[20].
3.3.1 NSAIDs的上消化道损伤: 服用NSAIDs可引急慢性胃炎、胃十二指肠溃疡、出血甚至穿孔. NSAIDs引起的胃炎以黏膜弥漫的出血点、出血斑以及表浅糜烂为主要的内镜下表现. NSAIDs导致溃疡的发生率在15%-30%. 是正常人溃疡发生率的3-4倍. NSAIDs所致消化性溃疡中胃溃疡多于十二指肠溃疡; 值得注意的是, 只有2%-4%的患者有症状, 没有前驱症状的患者往往是以上消化道出血为首发症状就诊. 特别是要注意有高危因素的患者, 如溃疡病史、吸烟、高龄(>60岁)、幽门螺杆菌感染、饮酒、同时服用激素、服用两种以上NSAIDs以及长时间、大剂量服用NSAIDs等更易出现上消化道黏膜损伤、溃疡, 甚至消化道出血. 无论是COX-1和COX-2都有引起上消化道损伤的报道[19].
3.3.2 NSAIDs小肠损害: 包括小肠炎症、溃疡(较常见)、穿孔、狭窄和NSAIDs肠病(NSAIDs enteropathy)等. NSAIDs肠病在肠道损害中最常见. NSAIDs肠病是指长期使用NSAIDs药物引起的空肠、回肠黏膜炎症性病变. 主要临床表现的非特异性肠病. 包括出血、蛋白丢失、吸收障碍、黏膜通透性改变等. 研究显示, 长期服用NSAIDs的患者60%-70%有无症状肠病, 大多发展到出现严重并发症才能被发现. 诊断要依靠服药史及临床表现. 有服用NSAIDs后慢性失血的表现, 内镜检查无阳性发现, 可考虑此病. 若有低蛋白血症更高度提示NSAIDs肠病. 可行小肠镜、核素、测定粪便Calprotectin(一种为降解的中性粒细胞胞质蛋白)等检查方法进一步明确诊断.
小肠狭窄一般分为两种类型: 一种是非特异性狭窄, 常由溃疡进展而来; 另一类称为"膈样疾病"(diaphragm disease), 是NSAIDs的特征性改变, 主要表现为多发(3-70个)、细小(2-4 mm)环状的分隔. 由于这种狭窄不引起肠管扭曲, 故钡餐检查难以与小肠皱襞区别. 临床上常表现为亚急性肠梗阻. 现在由于小肠镜的应用, 可通过内镜充气使肠腔扩张而达到治疗目的.
3.3.3 NSAIDs的结肠损害: 其主要表现炎症、溃疡、穿孔、狭窄. 他不仅损害正常结肠, 而且还可以使原有的结肠疾病如憩室病、炎症性肠病等加重[21-22], 导致结肠出血、肠穿孔、窦道形成等并发症的发生. 结肠炎主要表现为血性或非血性腹泻、弥漫性腹痛、急性出血和穿孔也有可能发生. 结肠溃疡和糜烂的形成多半在右半结肠, 在黏膜皱襞的溃疡处形成瘢痕导致横隔膜样狭窄. 患者的一般主诉为腹痛、排便习惯改变, 体质量下降, 甚至急性并发症如肠梗阻或者在隔膜的基部穿孔. 在使用NSAIDs栓剂的患者中, 可以导致直肠炎、直肠溃疡、肛门直肠狭窄[22]. 诊断依据为有服药史, 停药后症状好转; 除非再次服药. 一般无复发; 结肠镜显示黏膜水肿、红斑、糜烂、变浅溃疡病变多分布于各个肠段; 组织学显示固有层各种炎症细胞浸润. 50%有隐窝结构排列紊乱, 无肉芽肿形成; 便培养阴性.
3.3.4 NSAIDs与胃肠道肿瘤: 近年来NSAIDs的抗肿瘤作用逐渐成为人们关注的焦点. 最初的证据来源于流行病学的研究. 早期的研究表明类风湿患者在服用NSAIDs后实体肿瘤的发病率降低[23]. 另外, 在对许多消化道肿瘤患者, 如结肠癌、食管癌、胃癌等的检测中也发现, NSAIDs的作用靶点COX-2以及PGs在这些胃肠道肿瘤中, 均有较高和稳定的表达[24-25], 而在大多数正常组织中不存在或少量存在COX-2. Thun et al[26]的一项调查表明, 有规律地服用阿司匹林或其他NSAIDs, 可使结肠癌的发生率降低40%-50%. Kawabe et al[27]实验检测了91例胃癌组织中COX-2表达与抑癌基因p53突变的联系, 发现有p53突变者比无p53突变者COX-2表达明显增强(P<0.005), 提示胃癌p53突变可能与COX-2的过度表达有关. 对此, 人们首先开始探索选择性的COX-2抑制剂对消化道肿瘤的预防效应. 有较多的证据证实NSAIDs对结直肠癌有抑制作用, 但副作用太大. 在美国有一个长达几年NSAIDs临床试验, 用于防止家族性结肠息肉向癌症转变. 在药物观察发展到18 mo时, 发现心脑血管不良事件发生率比对照药物要高, 就此美国FDA发出对非甾类抗炎药应用警示声明. 要求所有处方性非甾类药物的厂商在说明书中加入黑框警示, 以警示服用该类药物可能增加心血管事件和消化道出血的危险性.
NSAIDs是否对食管癌及胃癌有预防作用, 这方面的报道甚少. Farrow et al[28]曾报道一组流行病学资料提示, 长期服用阿司匹林或其他NSAIDs可降低食管癌和胃癌发生的危险性. 但这项研究的结果是否可靠有待进一步证实.
目前的研究认为, NSAIDs的抗肿瘤机制有以下几种: (1)抑制COX-2, 从而抑制了PGs的合成. 有观察认为, COX-2过度表达和PGE2水平升高在肿瘤的发生中起重要作用, 其表达强度与肿瘤组织学类型和分化程度有关[29]. (2)诱导细胞凋亡; (3)促进细胞的免疫检测及肿瘤杀伤功能; (4)抑制肿瘤血管生长以及侵袭转移. (5)抗氧化作用等; (6)抑制癌基因的激活和促进抑癌基因突变的失活等[23,30].
在使用NSAIDs的过程中必须做到: (1)严格掌握适应证和禁忌证, 防止滥用. (2)注重原发病治疗: NDSAIDs仅能改善症状, 不影响病程. (3)小剂量、短疗程, 个体化用药. 不宜同时使用两种NSAIDs. (4)合并应用预防和治疗溃疡病的药物, 如米索前列醇、质子泵抑制剂、H2受体阻止剂、胃黏膜保护剂等, 可有效的降低和预防胃肠道的损伤. (5)改变给药时间、途经和药物剂型: 餐后服药、肛门给药、皮肤给药、以及静脉给药都可不同程度的降低NSAIDs对胃肠道的损害. (6)发展和使用新药: 国外大规模的临床观察发现, COX-2特异制剂, 如罗非昔布、塞来昔布可以明显减少消化系统的不良反应. 塞来昔布治疗骨关节炎200 mg/d, 类风湿性关节炎200 mg, 2次/d; 急性疼痛, 首次400 mg, 然后根据症状的缓解情况, 200 mg, 1次/d; 家族性腺瘤息肉, 400 mg, 2次/d, 但要监控心血管的不良反应. 美国疼痛学会、美国老年病学会、美国风湿病学会和欧洲风湿病防治联盟等均推荐: 治疗中、重度骨关节炎和类风湿性关节炎疼痛, 应使用选择性COX-2抑制剂; 需长期每日镇痛治疗的患者应避免使用非选择性NSAIDs. 需NSAIDs治疗的老年患者, 应使用选择性COX-2抑制剂, 或者使用非选择性NSAIDs加胃黏膜保护剂.
一个药物使用的时间越长, 人们越能了解他的真实性. NSAIDs已经使用100多年, 有着非常好的治疗效果. 目前国内外要使用NSAIDs的人群数量是非常庞大的. 尽管有这样那样的不良反应, 但在目前尚没有更好的药物来替代, 也就是说这类药物是还不能被替代的药物. 深入认识NSAIDs不良反应及其作用机制, 对于指导临床合理用药是十分必要的. 随着NSAIDs的实验研究和临床应用, 随着他的新的治疗适应症逐渐被发现, 特别是随着新一代的NSAIDs不断问世, 我们可以相信, 他的治疗作用会越来越好, 而其胃肠道以及其他系统的不良反应会逐渐减少和被预防的.
非甾体抗炎药(NSAIDs)是一类具有抗炎、镇痛、解热等作用的药物. 目前NSAIDs是全球处方量最大的药物之一, 在内、外、妇、儿科广泛使用. 据统计全球约15 000万人长期服用NSAIDs. 随着应用的日趋广泛, 其不良反应的报道也日益增多. 其中对胃肠损害的研究报道最多, 也日益受到关注.
张筱茵, 副教授, 中国人民解放军第四军医大学西京医院消化疾病研究所; 冯志杰, 主任医师, 河北医科大学第二医院消化内科
本文介绍了NSAIDs与胃肠道疾病以及对胃肠损伤的防治, 并就NSAIDs的作用机制, 临床应用以及应用中的注意要点等进行综述. 对临床医师应用此类药物有一定指导意义.
NSAIDs具有抗炎、镇痛、解热等多种作用, 是临床上的常用药物, 但其不良反应的报道也逐渐增多, 特别是胃肠道方面. 本文对NSAIDs与胃肠道疾病的关系, 并就NSAIDs引起胃肠道疾病(包括上消化道、小肠、结肠损伤以及肠道肿瘤)的机制、临床防治等进行综述. 文章参考了较多的国内外文献, 论据较充分, 对临床具有一定参考价值.
编辑: 李军亮 电编: 吴鹏朕
| 2. | 王 玉芳, 欧阳 钦. 非甾体抗炎药肠道损害. 国外医学·内科学分册. 2001;28:211-214. |
| 3. | Griffin MR. Epidemiology of nonsteroidal anti-inflammatory drug-associated gastrointestinal injury. Am J Med. 1998;104:23S-29S; discussion 41S-42S. [PubMed] [DOI] |
| 4. | Crofford LJ. COX-1 and COX-2 tissue expression: implications and predictions. J Rheumatol Suppl. 1997;49:15-19. [PubMed] |
| 5. | DeKosky ST. Similar enzymes, different mechanisms: COX-1 and COX-2 enzymes in neurologic disease. Arch Neurol. 2003;60:632-633. [PubMed] [DOI] |
| 6. | Davidson JM, Breyer MD. Inflammatory modulation and wound repair. J Invest Dermatol. 2003;120:xi-xii. [PubMed] [DOI] |
| 7. | Gruenenfelder J, McGuire EJ, Faerber GJ. Acute urinary retention associated with the use of cyclooxygenase-2 inhibitors. J Urol. 2002;168:1106. [PubMed] [DOI] |
| 8. | Simmons DL, Botting RM, Robertson PM, Madsen ML, Vane JR. Induction of an acetaminophen-sensitive cyclooxygenase with reduced sensitivity to nonsteroid antiinflammatory drugs. Proc Natl Acad Sci USA. 1999;96:3275-3280. [PubMed] [DOI] |
| 9. | Schwab JM, Schluesener HJ, Laufer S. COX-3: just another COX or the solitary elusive target of paracetamol? Lancet. 2003;361:981-982. [PubMed] [DOI] |
| 10. | Chandrasekharan NV, Dai H, Roos KL, Evanson NK, Tomsik J, Elton TS, Simmons DL. COX-3, a cyclooxygenase-1 variant inhibited by acetaminophen and other analgesic/antipyretic drugs: cloning, structure, and expression. Proc Natl Acad Sci USA. 2002;99:13926-13931. [PubMed] [DOI] |
| 11. | Vane JR. Inhibition of prostaglandin synthesis as a mechanism of action for aspirin-like drugs. Nat New Biol. 1971;231:232-235. [PubMed] |
| 12. | Smith TJ. Cyclooxygenases as the principal targets for the actions of NSAIDs. Rheum Dis Clin North Am. 1998;24:501-523. [PubMed] [DOI] |
| 13. | Catella-Lawson F, Reilly MP, Kapoor SC, Cucchiara AJ, DeMarco S, Tournier B, Vyas SN, FitzGerald GA. Cyclooxygenase inhibitors and the antiplatelet effects of aspirin. N Engl J Med. 2001;345:1809-1817. [PubMed] [DOI] |
| 14. | 陈 灏珠. 实用内科学. 第12版. 北京: 人民卫生出版社 2006; 1868-1869. |
| 15. | 于 皆平, 沈 志祥, 罗 和生. 实用消化病学. 第2版. 北京: 科学出版社 2007; 247-248. |
| 16. | Schoen RT, Vender RJ. Mechanisms of nonsteroidal anti-inflammatory drug-induced gastric damage. Am J Med. 1989;86:449-458. [PubMed] [DOI] |
| 19. | Whittle BJ. Mechanisms underlying intestinal injury induced by anti-inflammatory COX inhibitors. Eur J Pharmacol. 2004;500:427-439. [PubMed] [DOI] |
| 20. | 崔 旭蕾, 郭 向阳, 任 洪智. 非甾体类抗炎药临床应用的研究进展. 国际麻醉学与复苏杂志. 2007;28:122-125. |
| 21. | Kurahara K, Matsumoto T, Iida M. [Clinical features of nonsteroidal anti-inflammatory drug-induced colopathy]. Nippon Rinsho. 2007;65:1875-1878. [PubMed] |
| 22. | Thiefin G, Beaugerie L. Toxic effects of nonsteroidal antiinflammatory drugs on the small bowel, colon, and rectum. Joint Bone Spine. 2005;72:286-294. [PubMed] [DOI] |
| 25. | Yu HP, Shi LY, Lu WH, Su YH, Li YY, Xu SQ. Expression of cyclooxygenase-2 (COX-2) in human esophageal cancer and in vitro inhibition by a specific COX-2 inhibitor, NS-398. J Gastroenterol Hepatol. 2004;19:638-642. [PubMed] [DOI] |
| 26. | Thun MJ, Namboodiri MM, Calle EE, Flanders WD, Heath CW Jr. Aspirin use and risk of fatal cancer. Cancer Res. 1993;53:1322-1327. [PubMed] |
| 27. | Kawabe A, Shimada Y, Uchida S, Maeda M, Yamasaki S, Kato M, Hashimoto Y, Ohshio G, Matsumoto M, Imamura M. Expression of cyclooxygenase-2 in primary and remnant gastric carcinoma: comparing it with p53 accumulation, Helicobacter pylori infection, and vascular endothelial growth factor expression. J Surg Oncol. 2002;80:79-88. [PubMed] [DOI] |
| 28. | Farrow DC, Vaughan TL, Hansten PD, Stanford JL, Risch HA, Gammon MD, Chow WH, Dubrow R, Ahsan H, Mayne ST. Use of aspirin and other nonsteroidal anti-inflammatory drugs and risk of esophageal and gastric cancer. Cancer Epidemiol Biomarkers Prev. 1998;7:97-102. [PubMed] |