修回日期: 2008-09-05
接受日期: 2008-09-08
在线出版日期: 2008-09-18
目的: 研究苦参碱干预体外培养的大鼠肝卵圆细胞分化中Wnt-1信号通路的作用.
方法: 体外培养大鼠肝卵圆细胞, 分别用不同浓度的苦参碱(0.001、0.01、0.05、0.2、0.5、1、1.5、2 g/L)处理卵圆细胞, HE染色观察细胞的形态变化, 免疫细胞化学检测细胞内甲胎蛋白、白蛋白、Wnt-1信号蛋白的表达.
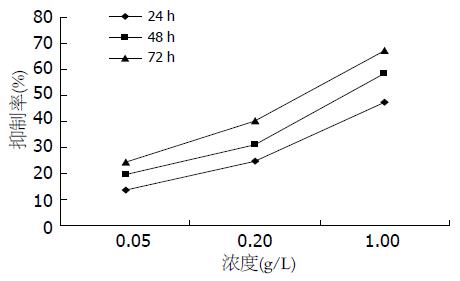
结果: 苦参碱对肝卵圆细胞的生长有抑制作用, 且苦参碱浓度越大, 作用时间越长, 抑制作用越明显, 0.05、0.2、1 g/L的苦参碱作用72 h后, 对卵圆细胞的抑制率分别为24.16%±2.03%、40.25%±3.92%和67.31%±6.04%. 0.01 g/L的苦参碱即可使肝卵圆细胞的形态发生变化, 细胞核变大、变圆, 核浆比例减小, 双核细胞增多; 免疫细胞化学结果显示, 0.2 g/L的苦参碱能够使肝卵圆细胞的ALB表达增高, AFP的表达降低, Wnt-1信号蛋白的表达量降低.
结论: 苦参碱可以抑制Wnt信号通路的传导, 使卵圆细胞向着成熟肝细胞的趋势分化.
引文著录: 高金昙, 殷飞, 姚树坤. 苦参碱诱导大鼠肝卵圆细胞株WB-F 344细胞分化中Wnt-1信号通路的作用. 世界华人消化杂志 2008; 16(26): 2935-2939
Revised: September 5, 2008
Accepted: September 8, 2008
Published online: September 18, 2008
AIM: To study the role of Wnt-1 signal pathway in matrine-induced differentiation of rat oval cell line WB-F 344.
METHODS: Hepatic oval cells were treated with different concentrations of matrine (0.001, 0.01, 0.05, 0.2, 0.5, 1, 1.5, 2 g/L). The morphological changes were measured using HE staining and protein expressions of the albumin, AFP and Wnt-1 were detected using immunohistochemistry.
RESULTS: Seventy two hours after the treatment of matrine at concentrations of 0.05, 0.2 and 1 g/L , the inhibitory rates were 24.16% ± 2.03%, 40.25% ± 3.92% and 67.31% ± 6.04%, respectively. 0.01 g/L matrine induced morphological changes of hepatic oval cell, including diminished karyoplasmic ratio, bigger and rounder karyon and increased dikaryocyte. Immunohistochemical results showed that the expression of albumin was significantly increased, the expressions of AFP and Wnt-1 protein were significantly decreased compared with normal hepatic oval cell after treatment of 0.2 g/L matrine.
CONCLUSION: Matrine induces rat hepatic oval cells to differentiate into mature hepatocytes, and inhibits the conduction of Wnt signal pathway.
- Citation: Gao JT, Yin F, Yao SK. Role of Wnt-1 signal pathway in matrine-induced differentiation of rat hepatic oval cell line WB-F 344. Shijie Huaren Xiaohua Zazhi 2008; 16(26): 2935-2939
- URL: https://www.wjgnet.com/1009-3079/full/v16/i26/2935.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i26.2935
肝卵圆细胞是当肝脏受到严重损害, 肝细胞大量缺失, 或者肝细胞的分裂增殖受到毒素或者致癌因子抑制时, 在肝内汇管区出现的一种胞质少、核呈卵圆形的小细胞, 具有分化为肝细胞和胆管上皮细胞的双向分化能力. 在肝脏发生发育过程及肝癌形成过程中, 同样可以发现卵圆细胞的存在[1]. 本实验应用苦参碱干预体外培养的大鼠卵圆细胞, 探讨苦参碱对体外培养的肝卵圆细胞增殖和分化的影响.
苦参碱标准品购自中国药品生物制品检定所, 1640培养基与胰酶均为Gibco产品, 多克隆抗体ALB、AFP、Wnt-1均购自美国Santa cruze公司, SP法山羊二抗试剂盒、PV法兔二抗试剂盒、DAB试剂盒均购自北京中杉公司. HARRIS CO2培养箱, SW-CJ-IF垂直净化工作台, COIC-XSZ-D2光学显微镜和倒置显微镜. WB-F 344细胞株, 购自北京中国医学科学院, 并在含200 mL/L胎牛血清的1640培养基中, 37 ℃ 50 mL/L CO2的恒温培养箱培养.
1.2.1 MTT法绘制苦参碱的剂量曲线并筛选最适剂量: 取生长良好、已长满融合的WB-F 344, 0.25%胰酶消化、吹打成单细胞悬液, 调整细胞密度为2.5×104/mL, 以1640培养液(200 mL/L胎牛血清)接种于96孔板, 每组12个复孔, 每孔200 mL, 细胞贴壁后更换成正常培养基和苦参碱浓度为0.001、0.01、0.05、0.2、0.5、1、1.5、2 g/L的8个浓度的含药培养基, 37 ℃ 50 mL/L CO2的恒温培养箱培养24 h后取出培养板, 在倒置相差显微镜下观察细胞生长情况, 任选4复孔, 细胞计数板计数, 余8个复孔加入10 mL MTT(5 g/L)于每孔中, 继续培养4 h后吸净每孔内液体, 加入100 mL DMSO溶液, 并在微型振荡器上振荡10 min以充分溶解结晶, 调零孔同样加入100 mL DMSO溶液. 酶联免疫检测仪测定各孔吸光度(A)值, 检测波长为490 nm, 计算不同浓度药物对WB-F 344增殖的抑制率(抑制率 = 1-(各浓度药物吸光度值-对照组吸光度值)/对照组吸光度值×100%). 绘制浓度曲线, 选取1、0.2、0.05 g/L 3个浓度进行时间曲线测定.
1.2.2 在药物最适剂量干预下绘制时间曲线, 筛选最适作用时间: 取以上3个药物浓度的培养基干预培养板中细胞, 并在24、48、72、96 h进行测定, 每个时间平行12个复孔. 余步骤同前.
1.2.3 免疫细胞化学的细胞培养: 取生长良好、已长满融合的WB-F 344, 0.25%胰酶消化、吹打成单细胞悬液, 调整细胞密度为2.5×104/mL, 以1640培养液(200 mL/L胎牛血清)接种于载玻片的16孔板, 每孔500 mL, 细胞贴壁后更换成正常培养基和苦参碱浓度0.2、0.05 g/L的培养基37 ℃、50 mL/L CO2条件下干预培养48 h. 吸出培养基, PBS清洗三次, 40 g/L甲醛溶液固定15 min, 取出细胞爬片, 室温干燥, 后冻存于-20 ℃备用.
1.2.4 免疫细胞化学: 取细胞爬片, 30 mL/L过氧化氢灭活内源性过氧化物酶, 血清封闭液封闭内源性生物素, 加入一抗(山羊抗大鼠抗体ALB 1:80、AFP 1:80、Wnt-1 1:50)4 ℃过夜, 加入二抗37 ℃处理15 min, 生物素标记的辣根过氧化物酶37 ℃处理15 min, 二氨基联苯胺(DAB)显色, 苏木素复染, 树脂封片后光镜下观察照像.
统计学处理 SPSS10.0统计软件进行单因素方差分析, P<0.05有统计学意义.
用噻唑蓝(MTT)测定细胞生长曲线的方法中490 nm处的吸光度值大小与活细胞数的多少成正比即吸光度值越大细胞数越多. 与对照肝卵圆细胞相比, 用苦参碱处理后细胞的490 nm处的吸光度值明显降低, 表明苦参碱对肝卵圆细胞的生长有抑制作用, 且苦参碱浓度越大, 作用时间越长, 抑制作用越明显(表1, 图1).
| 0.05 g/L | 0.20 g/L | 1.00 g/L | |
| 24 h | 13.36±1.55 | 24.50±3.24 | 47.20±5.23 |
| 48 h | 19.62±1.74 | 31.06±3.67 | 58.49±5.78 |
| 72 h | 24.16±2.03 | 40.25±3.92 | 67.31±6.04 |
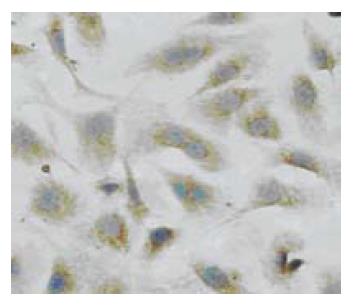
用不同浓度的苦参碱干预WB-F 344细胞, 其中0.01 g/L的苦参碱即可使肝卵圆细胞出现明显的形态改变, 如细胞变大变圆, 核浆比减小. 用0.2 g/L的苦参碱处理24 h后即可见细胞变大变圆, 核浆比减小, 有双核细胞形成, 48 h后可见双核细胞明显增多, 96 h后双核细胞约占总细胞数的50%左右(图2). 而当苦参碱的浓度达到2 g/L时, 24 h后即可见到约50%的细胞空泡样变, 进而出现细胞核的溶解、碎裂, 出现细胞凋亡的形态学表现.
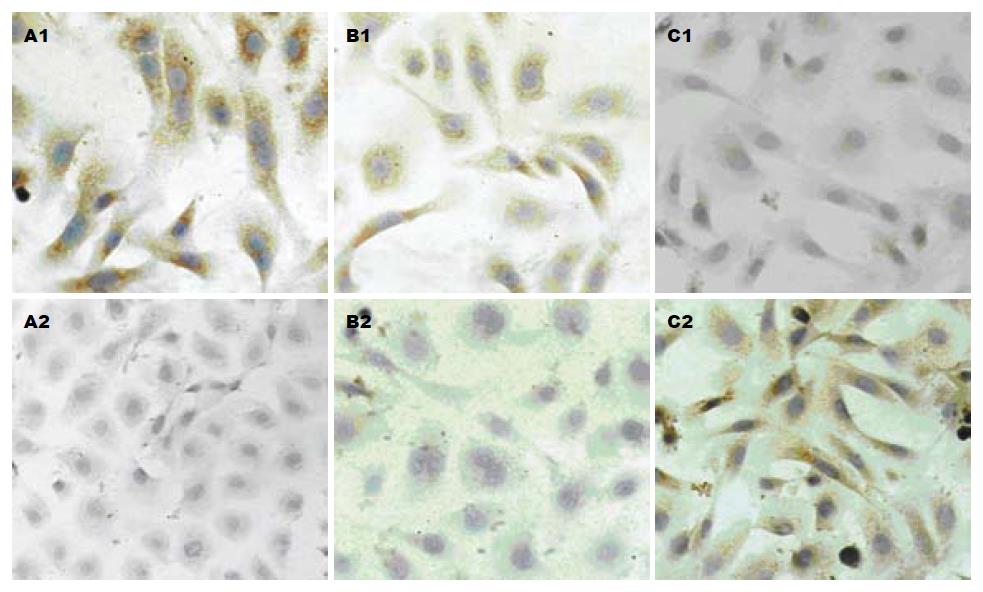
于对照肝卵圆细胞相比, 苦参碱干预的肝卵圆细胞中的ALB含量增加, AFP含量减少, 而且, 随苦参碱浓度的增高肝卵圆细胞的AFP含量降低, ALB含量增加(图3).
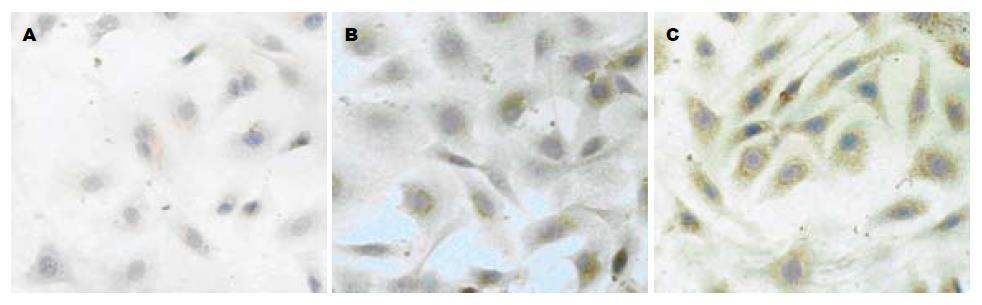
Wnt-1主要表达于肝卵圆细胞的细胞质内, 与对照组相比, 苦参碱干预后肝卵圆细胞的Wnt-1含量降低, 且随苦参碱浓度的增高而Wnt-1的表达量减少(图4).
肝细胞的分化过程是从骨髓干细胞到卵圆细胞和小肝细胞, 再从卵圆细胞和小肝细胞到肝细胞和胆管上皮细胞, 构成了一条骨髓干细胞横向分化为肝细胞和胆管上皮的细胞的链[2]. 肝卵圆细胞目前被认为具有干细胞潜能, 具有分化为肿瘤细胞和正常肝细胞的二重潜能性. 我们用苦参碱干预体外培养的肝卵圆细胞, 结果发现, 随着苦参碱浓度的提高和干预时间的延长, 肝卵圆细胞形态出现细胞核增大、核浆比例增加、双核细胞增多等变化; 免疫细胞化学结果显示, 苦参碱干预卵圆细胞后细胞内AFP的表达量减少, ALB的表达量增高, 这说明苦参碱干预后, 肝卵圆细胞有向近似于正常成熟肝细胞的方向分化的趋势. 但随着苦参碱浓度的增加, 剩余细胞量减少, 这说明苦参碱有一定的细胞毒性作用.
当肝脏受到严重损伤, 肝细胞大量缺失或者肝细胞增殖受到毒素或者致癌因子的抑制时, 就会激活卵圆细胞. 这些被激活的卵圆细胞迅速生长, 最早出现于胆管旁, 然后迁移到肝脏实质进一步分化为肝细胞和胆管细胞, 修复和重建肝脏[3-4]. 在多种肝脏疾病和肝癌中都发现了卵圆细胞, 他在增殖分化修复肝组织的同时, 受细胞内外信号分子的作用和影响, 可能参与了肝脏多种病理改变的形成和发展, 其分化异常也可能诱导原发性肝癌的发生[5-6]. 卵圆细胞与肝脏疾病的关系非常复杂. 在肝卵圆细胞增殖与分化过程中, 细胞因子的调控及其信号的转导机制, 起着极其重要和关键的作用, 而其调控机制还不清楚.
Wnt家族是成体干细胞的外源性调控因子, 是一条控制动物胚胎发育、细胞命运及组织器官形态发生的重要信号通路, 其编码蛋白在细胞间有传递生长和发育信息功能, 可控制胚胎轴向的正常发育[7-8]. Wnt基因是从小鼠乳腺癌中克隆的一种原癌基因, Wnt-1是19个已知人类Wnt基因中的最经典的成员[9-10]. 研究发现, Wnt蛋白通过扩散与主动运输到达靶细胞时, 靶细胞中Wnt的跨膜受体卷曲蛋白便与Wnt分子发生特异性结合, 激活胞内散乱蛋白, 防止胞内游离β-连环蛋白降解并使其逐渐在胞质内积聚, 进而被运输到核内, 与LEF/TCF家族成员等典型转录因子形成复合物, 激活相关基因的转录系统. 当无Wnt信号分子作用时, 由糖原合酶激酶3、结肠癌抑制因子和轴素形成复合物, 促使β-连环蛋白发生磷酸化, 并被泛素化而降解, 导致核内无β-连环蛋白, 使得辅阻遏物groucho、CtBP与TCF作用, 抑制相关基因转录[11-14].
Wnt信号途径被异常激活时, 靶器官的分化受到抑制, 仍保持干细胞特性, 进而导致细胞增生和肿瘤形成. 由于Wnt信号对细胞增殖分化调控的广泛性, 推测其对肝卵圆细胞的增殖分化也有调控作用. Wnt基因通常在胚胎发育过程中表达活跃, 在发育的不同时期表达不同Wnt蛋白. 而在成年机体, Wnt基因多处于相对静止状态[15-19]. 本研究在肝过程中观察到了苦参碱干预后Wnt基因的表达减少. 免疫组织化学和免疫荧光技术的结果均显示: 正常卵圆细胞表达Wnt-1的量较高, 苦参碱干预后Wnt-1表达减少, 其后随时间延长, Wnt-1表达逐渐减少, 结合细胞形态的变化, 可发现苦参碱干预后Wnt-1的时间和剂量依赖性表达与细胞形态的变化相吻合. Wnt-1在正常卵圆细胞中较高表达, 可能正是这点使正常卵圆细胞得以维持增生的高活性状态, 即此时信号通路处于"开放"状态. 苦参碱干预后24 h, Wnt-1表达减少, 此时卵圆细胞逐渐分化成熟, 之后随着分化的进行, Wnt-1表达进一步逐渐减少, 则卵圆细胞进入成熟阶段. Wnt-1的下调很可能是促使卵圆细胞向成熟肝细胞分化的内在因素. 因此, 本研究表明, Wnt-1在卵圆细胞增殖分化中起重要调控作用. 有关卵圆细胞的分化过程中详细的Wnt信号途径还有待进一步实验阐明. 深入开展Wnt信号通路与卵圆细胞分化关系的研究将对研究和开发肝组织的再生医学及其临床应用具有重大的指导意义.
Wnt信号通路在生物的正常发育中起重要作用, 是组织发育、分化所必须的关键性信号通路之一. 近年研究发现, Wnt信号通路与肿瘤的发生、干细胞分化增殖有密切关系, 在正常干细胞内, Wnt信号通路有一定活性, 使干细胞具有向正常功能细胞分化的趋势; Wnt信号通路被异常激活时, 干细胞也可以分化为肿瘤细胞. 肝卵圆细胞作为肝脏的干细胞在肝癌形成过程中发挥的重要作用. 现阶段, 对卵圆细胞分化过程中Wnt信号通路的作用还鲜有研究.
李玉明, 教授, 江苏省南通市第一人民医院消化内科
癌前病变期虽然细胞形态尚未发生明显改变, 但已出现一些酶学及蛋白表达异常, 这些细胞在某些因素持续作用下可发生癌变, 故深入研究此阶段的病理机制, 为早期干预逆转这种初始病变、阻断肿瘤形成提供了理论依据. 目前信号传导在肿瘤形成过程中的作用正在逐步被阐明, 信号传导通路已成为抗肿瘤药物研究的新靶点.
Plescia et al发现在二甲基亚砜诱导肝卵圆细胞分化为肝细胞的过程中发现Wnt/β链蛋白(β-catenin), 纤连蛋白和层黏连蛋白受体表达下调, 而转录调控因子(GATA)-4、GATA-6等上调.
本文从肝脏癌前病变细胞-卵圆细胞的分化、增殖着眼, 研究了Wnt信号通路的传导的变化, 从而阐明苦参碱抑制肝脏癌前病变的发生、发展.
肝卵圆细胞: 是一种多源性兼性细胞, 具有分化成肝细胞、胆管上皮细胞及其它类型细胞的潜力. 在肝实质严重受损的情况下卵圆细胞可发生增殖、分化, 修复肝组织; 其间也可能参与肝纤维化的形成和发展; 同时其分化异常可能诱导原发性肝癌的发生.
本文用苦参碱处理体外培养大鼠肝卵圆细胞, 观察其对细胞生长的影响, 并用免疫细胞化学方法检测细胞内甲胎蛋白等蛋白的表达水平的变化, 有一定可取之处, 但实验方法有待进一步改进.
编辑: 李军亮 电编: 郭海丽
| 1. | Suzuki A, Zheng YW, Kaneko S, Onodera M, Fukao K, Nakauchi H, Taniguchi H. Clonal identification and characterization of self-renewing pluripotent stem cells in the developing liver. J Cell Biol. 2002;156:173-184. [PubMed] [DOI] |
| 2. | Zhang Y, Bai XF, Huang CX. Hepatic stem cells: existence and origin. World J Gastroenterol. 2003;9:201-204. [PubMed] |
| 3. | Alison MR, Poulsom R, Forbes SJ. Update on hepatic stem cells. Liver. 2001;21:367-373. [PubMed] [DOI] |
| 4. | Strick-Marchand H, Morosan S, Charneau P, Kremsdorf D, Weiss MC. Bipotential mouse embryonic liver stem cell lines contribute to liver regeneration and differentiate as bile ducts and hepatocytes. Proc Natl Acad Sci USA. 2004;101:8360-8365. [PubMed] [DOI] |
| 6. | Miller JR, Moon RT. Signal transduction through beta-catenin and specification of cell fate during embryogenesis. Genes Dev. 1996;10:2527-2539. [PubMed] [DOI] |
| 7. | Sell S. Heterogeneity and plasticity of hepatocyte lineage cells. Hepatology. 2001;33:738-750. [PubMed] [DOI] |
| 8. | Hamada-Kanazawa M, Ishikawa K, Nomoto K, Uozumi T, Kawai Y, Narahara M, Miyake M. Sox6 overexpression causes cellular aggregation and the neuronal differentiation of P19 embryonic carcinoma cells in the absence of retinoic acid. FEBS Lett. 2004;560:192-198. [PubMed] [DOI] |
| 9. | Smolich BD, Papkoff J. Regulated expression of Wnt family members during neuroectodermal differentiation of P19 embryonal carcinoma cells: overexpression of Wnt-1 perturbs normal differentiation-specific properties. Dev Biol. 1994;166:300-310. [PubMed] [DOI] |
| 10. | Tulac S, Nayak NR, Kao LC, Van Waes M, Huang J, Lobo S, Germeyer A, Lessey BA, Taylor RN, Suchanek E. Identification, characterization, and regulation of the canonical Wnt signaling pathway in human endometrium. J Clin Endocrinol Metab. 2003;88:3860-3866. [PubMed] [DOI] |
| 11. | Castelo-Branco G, Wagner J, Rodriguez FJ, Kele J, Sousa K, Rawal N, Pasolli HA, Fuchs E, Kitajewski J, Arenas E. Differential regulation of midbrain dopaminergic neuron development by Wnt-1, Wnt-3a, and Wnt-5a. Proc Natl Acad Sci USA. 2003;100:12747-12752. [PubMed] [DOI] |
| 12. | Miller JR. Wnt signaling transduction. The cancer handbook. London: Nature Publushing Group 2002; 195-208. [PubMed] |
| 13. | Meirmanov S, Nakashima M, Rogounovitch T, Fukuda E, Nakayama T, Sato F, Sekine I. Small cell carcinoma of the endometrium: report of a case with analysis of Wnt/beta-catenin pathway. Pathol Res Pract. 2003;199:551-558. [PubMed] [DOI] |
| 14. | Kikuchi A. Tumor formation by genetic mutations in the components of the Wnt signaling pathway. Cancer Sci. 2003;94:225-229. [PubMed] [DOI] |
| 15. | Smolich BD, Papkoff J. Regulated expression of Wnt family members during neuroectodermal differentiation of P19 embryonal carcinoma cells: overexpression of Wnt-1 perturbs normal differen-tiation-specific properties. Dev Biol. 1994;166:300-310. [PubMed] [DOI] |
| 16. | Pennisi E. How a growth control path takes a wrong turn to cancer. Science. 1998;281:1438-1439, 1441. [PubMed] [DOI] |
| 17. | Glinka A, Wu W, Delius H, Monaghan AP, Blumenstock C, Niehrs C. Dickkopf-1 is a member of a new family of secreted proteins and functions in head induction. Nature. 1998;391:357-362. [PubMed] [DOI] |
| 18. | Tate SS, Meister A. gamma-Glutamyl transpeptidase: catalytic, structural and functional aspects. Mol Cell Biochem. 1981;39:357-368. [PubMed] [DOI] |
| 19. | Lustig B, Behrens J. The Wnt signaling pathway and its role in tumor development. J Cancer Res Clin Oncol. 2003;129:199-221. [PubMed] |