修回日期: 2008-07-14
接受日期: 2008-07-21
在线出版日期: 2008-09-08
目的: 探讨血管内皮生长因子(VEGF)反义寡核苷酸(ASODN)对体外生长的人大肠癌HT-29细胞的抑制作用.
方法: 实验设空白对照组、脂质体转染组、错义链转染组(SODN组)和不同浓度反义链转染组(ASODN组). 用LipofectamineTM2000介导的VEGF ASODN和错义寡核苷酸(SODN)转染人大肠癌细胞株HT-29, 半定量RT-PCR检测各组细胞VEGF mRNA的表达; Western blot测定转染48、72 h后VEGF蛋白表达; MTT法和流式细胞术检测细胞增殖和凋亡.
结果: 转染48 h后, ASOND组的VEGF mRNA表达水平明显低于脂质体对照组和SODN组(0.455±0.032 vs 0.934±0.031, 0.915±0.004, P<0.01); 脂质体对照组与SODN组之间无显著差异. 细胞转染48、72 h后, ASODN组蛋白表达明显弱于脂质体对照组和SODN组, 且72 h弱于48 h. 与对照组比较, VEGF ASODN对HT-29细胞有明显的生长抑制作用, 并且抑制呈剂量和时间依赖性(P<0.05).
结论: VEGF ASODN通过抑制VEGF的基因表达, 对体外生长的人大肠癌HT-29细胞的增殖进行抑制.
引文著录: 焦得闯, 吴爱国, 邵国利, 纪术峰. VEGF反义寡核苷酸对体外生长的大肠癌HT-29细胞的抑制作用. 世界华人消化杂志 2008; 16(25): 2831-2835
Revised: July 14, 2008
Accepted: July 21, 2008
Published online: September 8, 2008
AIM: To investigate the inhibitory effect of vascular endothelial growth factor (VEGF) antisense oligonucleotide (ASODN) on human colorectal cancer cell line HT-29 in vitro.
METHODS: Human colorectal cancer HT-29 cells were transfected with VEGF ASODN and scrambled oligodeoxynueleotide (SODN) by LipofectamineTM2000. The expression of VEGF mRNA in HT-29 cells was detected using semi-quantitive reverse transcription-polymerase chain reaction (RT-PCR) and the excretion of VEGF protein was measured by Western blot 48 and 72 hours after transfection. The proliferation and apoptosis of HT-29 cells were measured using MTT assay and flow cytometry respectively.
RESULTS: The expression of VEGF mRNA in HT-29 cells transfected with ASODN was significantly lower 48 h after transfection than that in the plasmid controls or SODN controls (0.455 ± 0.032 vs 0.934 ± 0.031, 0.915 ± 0.004; both P < 0.01). There was no marked difference between the two control groups. The expression of VEGF protein in HT-29 cells was confirmed and the specific band on PVDF membrane in the ASODN group was obviously weaker than that in the control groups. VEGF ASOND inhibited the proliferation of HT-29 cells in a dose- and time-dependent manner (P < 0.05); the apoptotic index of HT-29 cells in the ASODN group was obviously higher than that in the control groups (P < 0.05) 72 h after transfection.
CONCLUSION: VEGF ASODN can inhibit the proliferation and induce the apoptosis of HT-29 cells in vitro by inhibiting VEGF gene expression.
- Citation: Jiao DC, Wu AG, Shao GL, Ji SF. Inhibitory effect of VEGF antisense oligonucleotide on HT-29 human colorectal cancer cells in vitro. Shijie Huaren Xiaohua Zazhi 2008; 16(25): 2831-2835
- URL: https://www.wjgnet.com/1009-3079/full/v16/i25/2831.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i25.2831
血管内皮生长因子(vascular endothelial growth factor, VEGF)是肿瘤血管生成研究领域的中心焦点, 他不仅在肿瘤的生长和转移中发挥重要的作用, 而且对肿瘤细胞本身的增殖和凋亡也有一定的影响[1-4]. 反义核酸技术是近年来兴起的一种新的基因治疗技术, 反义技术中的反义寡核苷酸技术是目前最有可能应用于临床的基因治疗方法. 他具有高度靶特异性、设计容易、多样且合成简单的特点, 这都是常规药物设计、生产和作用所不可比拟的, 因而具有巨大的研究价值. 本实验运用LipofectamineTM 2000介导的VEGF ASODN转染体外生长的人大肠癌HT-29细胞, 观察HT-29细胞VEGF mRNA和蛋白的表达, 测定其对HT-29细胞增殖和凋亡的影响, 以探讨VEGF在肿瘤细胞生长中的作用, 从而为反义核酸应用于大肠癌的治疗提供理论依据.
人大肠癌HT-29细胞株由广东省人民医院细胞室惠赠; RPMI 1640培养基和胎牛血清购自莱德尔公司; LipofectamineTM 2000为Invitrogen公司产品; 小鼠抗人mAb及羊抗小鼠IgG为Santa Cruz公司产品; Annexin V-FITC细胞凋亡检测试剂盒购自凯基生物公司; 反义及错义寡核苷酸链由上海生物工程公司合成, ASODN序列为: 5'-TGGCTTGAAGATGTACTCGAT-3'; SODN序列为: 5'-TACGTAGTATGGTGTACGATC-3', 均采取全程硫代磷酸化修饰.
1.2.1 细胞的培养、转染和分组: HT-29细胞用含100 mL/L胎牛血清的RPMI 1640培养基(含青霉素和链霉素浓度均为1×105 U/L), 培养于37 ℃、50 mL/L CO2的培养箱中. 取对数生长期的HT-29细胞以每孔3×105接种于6孔板内, 约80%细胞融合时开始实验. 设置空白对照组、脂质体转染组、1000 nmol/L错义链转染组和不同浓度(200、600、1000 nmol/L)反义链转染组, 每组设6个复孔. 细胞转染按LipofectamineTM 2000试剂盒说明书进行.
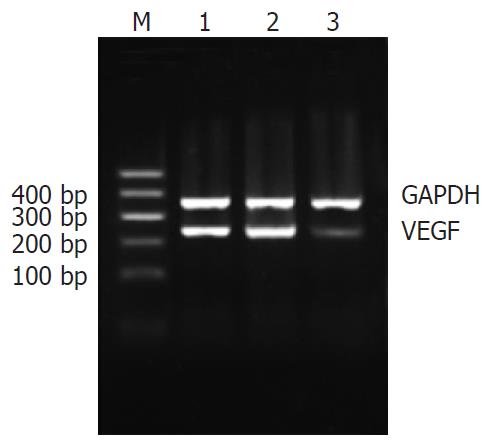
1.2.2 RT-PCR法检测细胞VEGF mRNA的表达: (1)细胞总RNA的提取及浓度的测定: 细胞转染48 h后, 按TRIzol试剂盒说明书提取总RNA, 经氯仿处理, 异丙醇沉淀, 750 mL/L乙醇洗涤后, 略干燥, 无RNA酶水溶解, -70 ℃保存. 以核酸紫外分析仪检测A260/A280值为1.9, 计算RNA浓度, RNA浓度(g/L) = A260×稀释倍数×0.04. 用DEPC水定量到1 g/L. (2)RT-PCR: 提取的RNA按照MMLV第一链合成试剂盒说明书合成cDNA. VEGF上游引物: 5'-GTGCCCACTGAGGAGTCCAACAT-3', 下游引物: 5'-CGGCTTGTCACATCTGCAAGTAC-3', GAPDH上游引物: 5'-CGGGAAGCTTGTCATCAATGG-3', 下游引物: 5'-GGCAGTGATGGCATGGACTG-3'. 反应体系体积为50 μL, PCR反应条件为94 ℃, 2 min, 反转录酶灭活和RNA/cDNA引物预变性; 94 ℃ 30 s, 59.8 ℃ 30 s, 72 ℃ 2 min, 39个循环, 最后72 ℃延伸7 min. 产物于20 g/L琼脂糖进行凝胶电泳, 拍照记录电泳结果, 图像分析仪测定电泳产物灰度值A, 以同一标本的GAPDH mRNA作为内参进行校正, 对VEGF PCR产物相对定量.
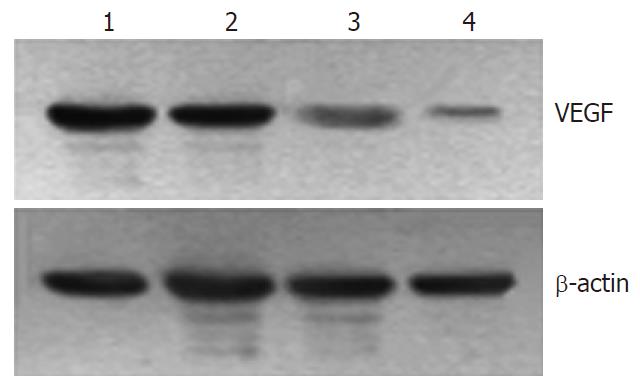
1.2.3 Western blot检测VEGF蛋白表达: 转染48、72 h后, 提取各组细胞的总蛋白质, 用紫外分光光度法测定其浓度. 取50 μg蛋白经120 g/L SDS聚丙烯酰胺凝胶电泳, 常规湿法转膜后, 与1:1000小鼠抗人VEGF mAb 4 ℃孵育过夜, 1:2000辣根过氧化物酶标记的羊抗小鼠IgG室温轻摇1 h. EMC显色, 常规显影和定影, 观察结果.
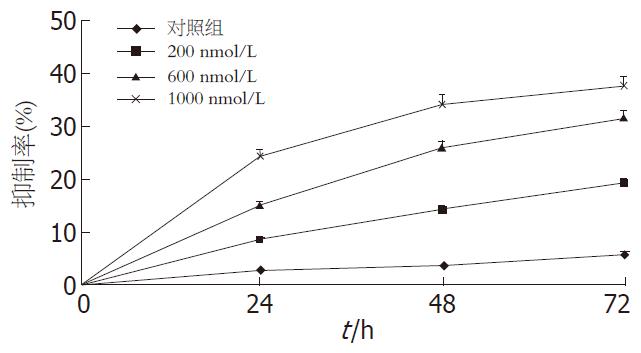
1.2.4 MTT法观察细胞增殖抑制情况: 各组细胞在96孔板内分别培养24、48和72 h后进行实验. 每孔加入MTT溶液(5 g/L)20 μL, 37 ℃、50 mL/L CO2培养箱中继续孵育4 h后, 弃去孔内培养液, 每孔加入150 μL DMSO, 振荡10 min, 用酶联免疫检测仪测定A490. 每组取各复孔的平均值, 计算细胞增殖抑制率: 抑制率 = (1-处理组A/细胞对照组A)×100%.
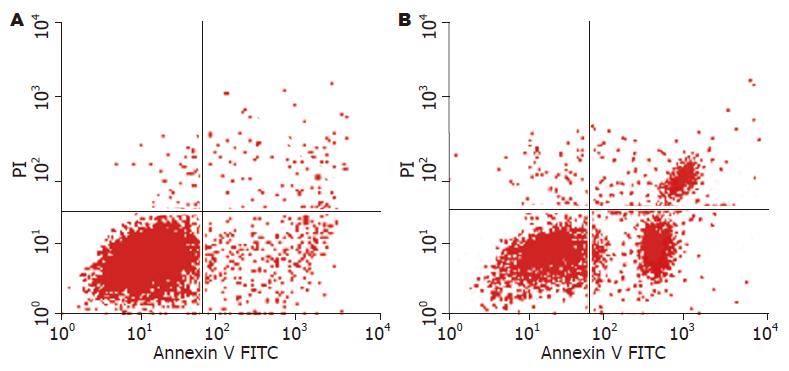
1.2.5 流式细胞仪检测细胞凋亡比率: ASODN组和脂质体对照组的细胞分别培养72 h后, 每组计数3×105个细胞用于实验, 用500 μL Binding Buffer(1×)垂悬细胞, 每组加入Annexin V-FITC 5 μL, 避光反应15 min, 加入PI 10 μL, 15 min内上机进行流式细胞检测.
统计学处理 应用SPSS11.0统计软件进行统计学分析, 实验数据中计量资料以mean±SD表示, 采用方差分析, P<0.05为有显著性差异.
脂质体对照组、SODN组和ASODN组成功扩增出相应目的基因的PCR产物, 条带与Marker比较证实扩增的目的片段大小完全吻合(图1). 电泳条带经凝胶电泳图像扫描仪扫描, 测各条带的灰度值, 经同一标本的GAPDH条带的灰度值校正后进行比较. ADODN组(0.455±0.032)对HT-29细胞VEGF mRNA的表达有明显的抑制作用, 与脂质体对照组(0.934±0.031)和SODN组(0.915±0.004)比较有统计学意义(P<0.01). 脂质体对照组与SODN组之间无显著差异(P>0.05).
细胞转染48、72 h后, ASODN(1000 nmol/L)组蛋白表达条带明显弱于脂质体对照组和SODN(1000 nmol/L)组, 72 h弱于48 h(图2).
MTT法测定结果显示, 与对照组比较, VEGF ASODN对HT-29细胞有明显的生长抑制作用, 并且抑制呈剂量和时间依赖性(P<0.05, 图3).
流式细胞检测结果显示, VEGF ASODN对HT-29细胞有一定的凋亡诱导作用, 与对照组比较有统计学意义(P<0.05, 图4).
大肠癌是世界范围内四大最常见恶性肿瘤之一, 近年来我国的大肠癌的发病率呈上升趋势, 且以每年4%的幅度递增, 递增速度为世界水平的2倍. 传统的治疗方法效果并不理想. 基因治疗是当代医学和生物学的一个新的研究领域, 随着分子生物学及基因工程的发展, 基因治疗已成为研究重点, 也成为提高大肠癌患者预后的一种有前景的途径.
血管生成是实体肿瘤生长和转移必不可少的条件, 多种血管生长因子在肿瘤血管的生成中发挥作用, VEGF家族是目前研究最深入的血管生长因子家族, 也被越来越多的研究者作为抗肿瘤血管生成基因治疗的靶点. VEGF家族包括VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E、胎盘生长因子[5-7]和新近从蛇毒中发现的VEGF-F[8], 通常所说的VEGF即VEGF-A, 其分子质量为34-45 kDa, 以5种不同的亚型出现, 即VEGF121、VEGF165、VEGF189、VEGF206和VEGF145, 体内以VEGF165最常见[9]. VEGF表达量与癌细胞的浸润、淋巴结的转移及肝转移等多种生物学行为有关[10-12]. 对多种肿瘤中VEGF的作用机制的研究发现, VEGF可以通过旁分泌和自分泌两种方式对肿瘤细胞的生长和转移产生影响. VEGF受体包括VEGFR-1(flt-1)、VEGFR-2(KDR/flk)和VEGFR-3(flt-4). 另外, KDR还有一个辅助受体Neuropilin-1(NP-1), 他可使KDR与VEGF165的结合增加. flt-4主要分布在淋巴管内皮细胞, 而flt-1和KDR主要在血管内皮细胞表达, 但现在也有在肿瘤细胞表面发现[13-14].
以往的研究多集中在VEGF对血管的发生和生成的作用上, 现在随着VEGF自分泌作用途径的发现, 越来越多的研究证实, 除了通过改变血供来影响肿瘤细胞的生长外, VEGF可以通过抑制肿瘤细胞凋亡等途径对肿瘤细胞的生物学行为造成影响.
用VEGF ASODN抗大肠癌的治疗比传统的治疗方法有很大的优势. 首先, 反义脱氧寡核苷酸的设计和批量生产较容易, 硫代磷酸化修饰后可使其稳定性增加, 利用脂质体转染的方法可使转染效率提高; 其次, 给药方式也较反义RNA载体传递途径简单, 更方便应用于临床. 另外, 脂质体转染法在短期应用的基因治疗中也有明显的优点, 他可以靠静电作用结合寡核苷酸链形成"寡核苷酸链-脂质体"复合物, 同时又吸附于带负电的细胞膜表面, 增加了转染的效率[15-16].
本实验把VEGF ASODN的靶序列定位于VEGF基因的第三外显子[17], 体外合成的寡核苷酸序列经过全硫代修饰, 在不影响其与靶序列特异性结合的同时, 又增加了其稳定性.
RT-PCR和Western blot结果显示, 与对照组比较, VEGF ASODN能够明显抑制HT-29细胞mRNA及蛋白的表达, 同时发现其对蛋白的抑制作用在72 h较强. 脂质体对照组和SODN组则无此作用, 说明此效应是序列特异的.
MTT结果显示, 利用VEGF ASODN封闭VEGF基因后, HT-29细胞的增殖率明显降低, 且这种抑制作用具有剂量和时间的依赖关系. 流式细胞结果证明, 与脂质体对照组比较, VEGF ASODN对体外生长的HT-29也有一定的凋亡诱导作用.
以上结果证实VEGF ASODN能够通过降低VEGF基因的表达, 抑制人大肠癌HT-29细胞的体外增殖, 并对其具有一定的凋亡诱导作用. 同时也提示HT-29细胞可以表达VEGF受体, VEGF可以通过自分泌的方式发挥作用. 但VEGF ASODN在对体内大肠癌细胞是否也具有这些作用尚有待动物实验和临床实验证实. 本实验的结果为以后VEGF ASODN用于大肠癌的基因治疗提供了一定的理论依据.
VEGF是肿瘤治疗中抗血管生成治疗具有良好前景的靶点, 目前已有大量针对该靶标的药物进入临床实验阶段或已应用于临床, 随着对VEGF研究的深入, 越来越多的学者发现VEGF除了在肿瘤血管生成方面发挥作用外, 还能够诱导肿瘤细胞分裂增殖.
王志刚, 副主任医师, 上海市第六人民医院普外科
目前肿瘤基因治疗的研究热点主要集中在靶基因的选择、如何提高基因药物的靶向性以及载体的选择和制备等几个方面.
Masood et al通过对AIDS-Kaposi肉瘤的研究发现, 反义VEGF寡核苷酸可以自分泌的方式抑制肉瘤细胞的生长; Mercurio et al证实VEGF有阻碍乳腺癌细胞程序性死亡的功能, 可通过直接作用于肿瘤细胞本身而发挥作用.
本文从反义VEGF寡核苷酸对体外生长的大肠癌细胞的增殖和凋亡的影响入手, 探讨VEGF在肿瘤细胞生长中的作用以及以VEGF为靶点的药物的作用机制.
反义寡核苷酸(ASODN): 人工合成的, 与靶基因DNA或mRNA某一区段互补的核酸片段, 可以通过碱基互补原则结合于靶基因DNA或mRNA上, 从而封闭基因的表达.
本研究选题新颖, 从体外细胞水平研究提示VEGF除传统认为的血管作用外, 可能还有对肿瘤细胞的直接作用, 值得探讨, 有一定的学术价值.
编辑: 李军亮 电编: 何基才
| 1. | Mercurio AM, Lipscomb EA, Bachelder RE. Non-angiogenic functions of VEGF in breast cancer. J Mammary Gland Biol Neoplasia. 2005;10:283-290. [PubMed] [DOI] |
| 2. | 李海军, 庞作良, 毛拉艾沙·买买提. VEGF反义寡核苷酸对胆囊癌细胞VEGF, Flt-1及KDR mRNA表达和VEGF蛋白分泌的影响. 世界华人消化杂志. 2007;15:1225-1231. [DOI] |
| 5. | Meyer M, Clauss M, Lepple-Wienhues A, Waltenberger J, Augustin HG, Ziche M, Lanz C, Büttner M, Rziha HJ, Dehio C. A novel vascular endothelial growth factor encoded by Orf virus, VEGF-E, mediates angiogenesis via signalling through VEGFR-2 (KDR) but not VEGFR-1 (Flt-1) receptor tyrosine kinases. EMBO J. 1999;18:363-374. [PubMed] [DOI] |
| 6. | Neufeld G, Cohen T, Gengrinovitch S, Poltorak Z. Vascular endothelial growth factor (VEGF) and its receptors. FASEB J. 1999;13:9-22. [PubMed] |
| 7. | Clauss M. Molecular biology of the VEGF and the VEGF receptor family. Semin Thromb Hemost. 2000;26:561-569. [PubMed] [DOI] |
| 8. | Roy H, Bhardwaj S, Ylä-Herttuala S. Biology of vascular endothelial growth factors. FEBS Lett. 2006;580:2879-2887. [PubMed] [DOI] |
| 9. | Takayama K, Ueno H, Nakanishi Y, Sakamoto T, Inoue K, Shimizu K, Oohashi H, Hara N. Suppression of tumor angiogenesis and growth by gene transfer of a soluble form of vascular endothelial growth factor receptor into a remote organ. Cancer Res. 2000;60:2169-2177. [PubMed] |
| 10. | Maehara Y, Kabashima A, Koga T, Tokunaga E, Takeuchi H, Kakeji Y, Sugimachi K. Vascular invasion and potential for tumor angiogenesis and metastasis in gastric carcinoma. Surgery. 2000;128:408-416. [PubMed] [DOI] |
| 11. | Soufla G, Sifakis S, Baritaki S, Zafiropoulos A, Koumantakis E, Spandidos DA. VEGF, FGF2, TGFB1 and TGFBR1 mRNA expression levels correlate with the malignant transformation of the uterine cervix. Cancer Lett. 2005;221:105-118. [PubMed] [DOI] |
| 12. | Xu T, Chen D, Chen J. Expression of vascular endothelial growth factor C and its correlation with lymph node metastasis in colorectal carcinoma. J Huazhong Univ Sci Technolog Med Sci. 2004;24:596-598. [PubMed] |
| 13. | Bellamy WT, Richter L, Frutiger Y, Grogan TM. Expression of vascular endothelial growth factor and its receptors in hematopoietic malignancies. Cancer Res. 1999;59:728-733. [PubMed] |
| 14. | Ishigami SI, Arii S, Furutani M, Niwano M, Harada T, Mizumoto M, Mori A, Onodera H, Imamura M. Predictive value of vascular endothelial growth factor (VEGF) in metastasis and prognosis of human colorectal cancer. Br J Cancer. 1998;78:1379-1384. [PubMed] |
| 15. | Martinez LA, Naguibneva I, Lehrmann H, Vervisch A, Tchénio T, Lozano G, Harel-Bellan A. Synthetic small inhibiting RNAs: efficient tools to inactivate oncogenic mutations and restore p53 pathways. Proc Natl Acad Sci USA. 2002;99:14849-14854. [PubMed] [DOI] |
| 16. | Donzé O, Picard D. RNA interference in mammalian cells using siRNAs synthesized with T7 RNA polymerase. Nucleic Acids Res. 2002;30:e46. [PubMed] [DOI] |
| 17. | Masood R, Cai J, Zheng T, Smith DL, Naidu Y, Gill PS. Vascular endothelial growth factor/vascular permeability factor is an autocrine growth factor for AIDS-Kaposi sarcoma. Proc Natl Acad Sci USA. 1997;94:979-984. [PubMed] [DOI] |