修回日期: 2008-07-28
接受日期: 2008-08-04
在线出版日期: 2008-09-08
目的: 观察舒林酸对人结肠癌Lovo细胞株凋亡的影响, 以及舒林酸作用后的该细胞基因表达谱改变.
方法: 应用透射电镜, 流式细胞仪观察舒林酸作用48 h、72 h对Lovo细胞凋亡的影响; 基因芯片法检测舒林酸作用前后Lovo细胞的差异表达基因.
结果: 经舒林酸处理后细胞有典型的凋亡小体形成; 经舒林酸0.6、0.9、1.2 mmol/L作用后, 细胞凋亡率与对照组比较明显升高(48 h: 4.2±1.04, 4.26±0.28, 7.51±2.09 vs 1.81±0.91; 72 h: 6.21±0.56, 7.48±1.45, 10.40±1.30 vs 2.06±1.43; 均P<0.05). 与含有17101个cDNA的基因芯片杂交, 筛选出差异表达基因1013条, 其中178条为凋亡相关基因(表达上调82条, 下调96条), 占所有差异表达基因的17.87%.
结论: 舒林酸具有诱导Lovo细胞发生凋亡的作用, 上调或下调某些凋亡相关基因的表达可能是其诱导凋亡的分子机制之一.
引文著录: 聂家艳, 黄杰安, 唐国都, 刘诗权. 舒林酸对人结肠癌细胞凋亡及相关基因表达谱的作用. 世界华人消化杂志 2008; 16(25): 2826-2830
Revised: July 28, 2008
Accepted: August 4, 2008
Published online: September 8, 2008
AIM: To observe the changes of cell apoptosis and gene expression profile of human colon carcinoma cell line Lovo after sulindac treatment.
METHODS: Transmission electron microscopy and flow cytometry were used to observe the apoptosis changes of LoVo cells 48 and 72 h after sulindac treatment; meanwhile, cDNA microarray was used to detect the genes differetially expressed in LoVo cells.
RESULTS: Apoptotic bodies were found and the apoptotic rates of LoVo cells increased greatly after treatment with 0.6, 0.9 and 1.2 mmol/L sulindac in comparison with those of control cells (48 h: 4.2 ± 1.04, 4.26 ± 0.28, 7.51 ± 2.09 vs 1.81 ± 0.91; 72 h: 6.21 ± 0.56, 7.48 ± 1.45, 10.40 ± 1.30 vs 2.06 ± 1.43; all P < 0.05). Hybridization with cDNA microarray containing 17101 genes screened 1013 differetially expressed genes, of which 178 genes (17.87%) were associated with cell apoptosis. Of the 178 genes, 82 were up-regulated while 96 were down-regulated.
CONCLUSION: Sulindac can induce apoptosis of LoVo cells, and its mechanism may attribute to up-regulation or down-regulation of some apoptosis-related genes.
- Citation: Nie JY, Huang JA, Tang GD, Liu SQ. Effect of sulindac on apoptosis and related gene expression profile of human colon cancer cells. Shijie Huaren Xiaohua Zazhi 2008; 16(25): 2826-2830
- URL: https://www.wjgnet.com/1009-3079/full/v16/i25/2826.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i25.2826
结肠癌作为严重危害人类健康的常见恶性肿瘤在经济发达的欧美国家仅次于肺癌, 列恶性肿瘤死因的第2位. 在我国随着生活方式和饮食结构的改变, 其发病率逐年上升[1], 然而其发病机制还不是很明确. 近年来NSAIDs治疗消化系肿瘤是人们十分关注的话题, 并且取得了一定的疗效. 流行病学资料显示, 长期服用NSAIDs可以降低40%-60%结直肠癌的发生[2]. 在家族性腺瘤性息肉病(familial adenomatous polypsis, FAP)的小鼠实验模型中发现舒林酸可减少肿瘤的形成[3]. 我们的前期研究结果显示, 舒林酸可使结肠癌Lovo细胞生长明显减慢, 使Lovo细胞周期阻滞于G0/G1期[4]. 国外大量学者进行体外细胞培养干预实验也证实, NSAIDs具有抑制肿瘤细胞生长增值的作用, 而且其对正常细胞毒性作用小, 认为其机制可能与诱导细胞凋亡或直接的细胞毒作用等多方面有关[5-7]. 本研究检测舒林酸对细胞凋亡的影响, 同时利用基因芯片技术检测基因的表达, 以探讨其体外抗肿瘤的作用机制.
人结肠癌细胞Lovo株由上海复旦大学惠赠, 舒林酸、过氧化氢酶PI、RnaseA、NP-40均为美国Sigma公司产品. 标准胎牛血清, 杭州四季清生物技术有限公司产品; NaCl、KCl、Na2HPO4·H2O、KH2PO4、NaHCO3、酚红等其他试剂均为国产分析纯, 基因芯片购自上海生物芯片有限公司, 含有17101个cDNA.
1.2.1 透射电镜观察: 取对数生长期细胞, 实验组加入舒林酸(0.9 mmol/L), 对照组加入新鲜培养液, 作用48 h, 收集细胞, 离心10 min, 4 ℃预冷PBS(0.01 mol/L)再次离心, 弃上清, 加入100 mol/L胎牛血清蛋白1滴, 混合离心5 min, 弃上清, 加入4 ℃预冷的0.2 mol/L戊二醛固定液固定30 min, 4 ℃ PBS(0.1 mol/L)洗3次, 按电镜常规制作超薄切片, 双重染色, 观察照相.
1.2.2 流式细胞仪Annexin V/PI双染法检测细胞凋亡: 取对数生长期细胞, 实验组加不同浓度(0.6、0.9、1.2 mmol/L)的舒林酸, 对照组加入新鲜培养液, 分别作用48、72 h, 结合缓冲液调整细胞浓度, 上流式细胞仪检测细胞凋亡情况(具体按试剂盒说明进行).
1.2.3 总RNA抽提: 取对数生长期细胞, 实验组加入舒林酸(0.9 mmol/L), 对照组加入新鲜培养液, CO2培养箱中继续培养48 h后, 收集细胞, 每2×106细胞加入1 mL TRIzol, 用移液器反复吹打, 液氮保存送上海生物有限公司. 总RNA的质量检测、芯片探针制备、杂交及洗涤、数据分析、标准化处理由上海生物有限公司合作完成.
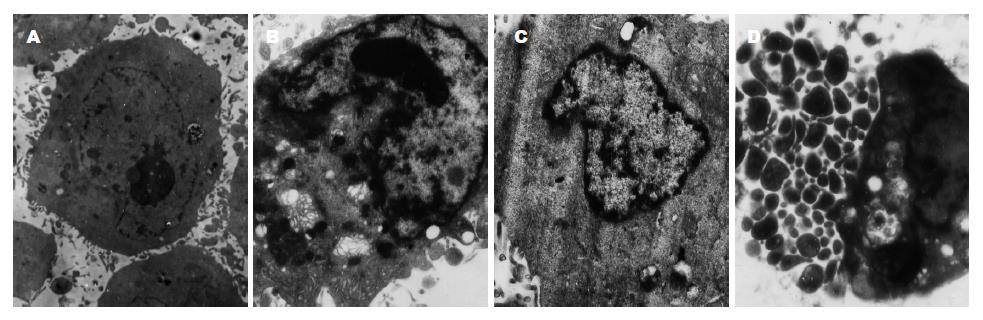
对照组的Lovo细胞核形态规则, 核仁清晰, 核染色质均匀分布细胞核内. 经舒林酸处理后细胞体积缩小, 染色质高度凝聚, 边缘化浓缩呈境界分明的细小团块状沿核膜内侧排列, 部分细胞核解体, 核仁消失, 包膜下陷, 形成由质膜包裹内含完整的细胞器、核碎片等细胞内容物的凋亡小体(图1).
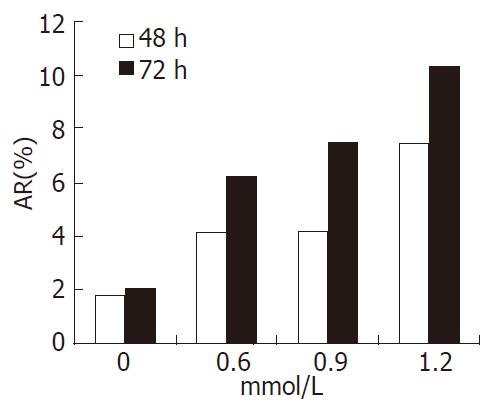
经舒林酸0.6、0.9、1.2 mmol/L作用48/72 h后, 细胞凋亡率分别为4.2±1.04/6.21±0.56、4.26±0.28/7.48±1.45和7.51±2.09/10.40±1.30, 而对照组仅为1.81±0.91/2.06±1.43, 处理组与对照组比较差异均有统计学意义(P<0.05), 细胞凋亡率(AR)逐渐上升, 且呈时间-剂量依赖性(图2).
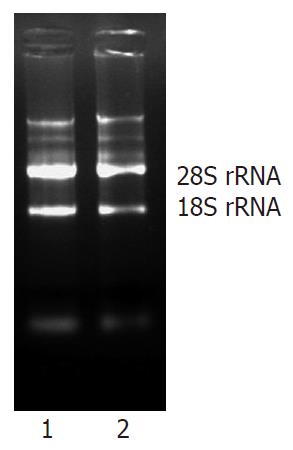
实验组和对照组的总RNA定量以及紫外分光光度法测得RNA在260nm和280nm的A值比值即A260/280见表1; 琼脂糖凝胶电泳结果分18srRNA 和28srRNA 条带清晰, 两条带的亮度之比约为1:2(图3), 以上说明所提取组织的总RNA完整性好没有降解, 纯度高可以用于杂交探针制备.
| 分组 | 纯化前总量(μg) | A260/280 | 电泳检测 |
| 处理组 | 1203 | 2.06 | 合格 |
| 对照组 | 2131.02 | 2.12 | 合格 |
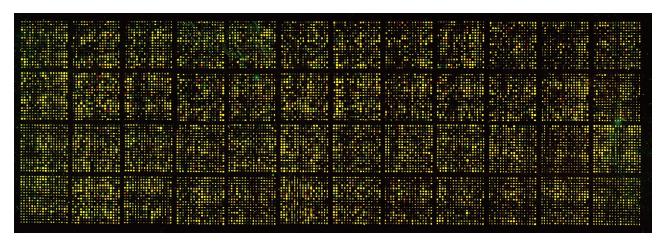
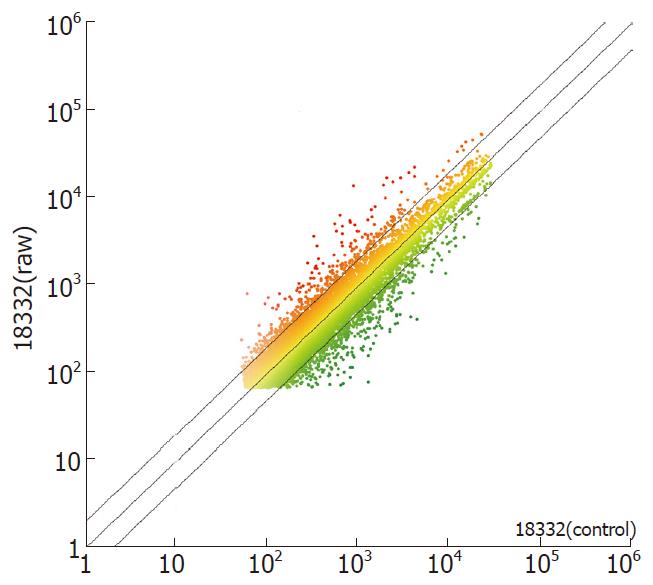
点样杂交后,对芯片进行Cy3和Cy5荧光扫描显示: 芯片信号强度高, 片内信号均一, 基因点清晰,没有基因点漏点、点重叠、以及不正常荧光的情况; Cy3、Cy5的背景值均匀, 符合要求(图4). 实验中对处理组探针标记Cy3荧光素(呈红色), 对照组探针标记Cy5荧光素(呈绿色), 则红绿色的差异就表示该基因在处理组和对照组中表达水平上的差异, 黄色代表水平无差异, 各组探针信号值的散点分布图(图5), 显示大部分基因位于回归线内, 表明大部分基因在两种组织中表达接近, 少部分基因产生表达差异, 且随着差异基因倍数逐渐增加, 差异基因数量逐渐减少(图5).
本实验按照差异显著阳性的标准, 以Ratio(Cy3/Cy5)值≥2或≤0.5作为差异表达基因点, >2表示基因表达上调, <0.5表示基因表达下调. 在与含有17101个cDNA的基因芯片杂交, 筛选出差异表达基因1013条, 其中表达上调基因434条(占42.84%), 表达下调的基因579条(占51.76%); 根据Affymetrix分析中心GO(Gene Ontology)分类数据库中基因生物学过程的描述对差异表达基因进行功能分类, 其中178条为凋亡相关基因(表达上调的有82条, 下调的有96条), 占所有差异表达基因的17.87%, 未知分子功能的有30条(上调13条, 下调17条). 将舒林酸作用Lovo细胞后诱导与凋亡相关的上调基因(cy3/cy5>3)以及下调明显的基因(cy3/cy5<0.2)从小到大排列见表2.
| GenBank | 基因名称 | 基因简写 | Ratio(Cy3/Cy5) |
| NM_001946 | Dual specificity phosphatase 6 | DUSP6 | 4.084 |
| NM_000389 | Cyclin-dependent kinas inhibitor 1A (p21, Cip1) | CDKN1A | 4.139 |
| NM_002203 | Integrin, alpha 2(CD49B, alpha 2 subunit of VLA-2 receptor) | ITGA2 | 4.151 |
| AF332558 | BCL2 binding component 3 | BBC3 | 4.383 |
| NM_002818 | Proteasome (prosome, macropain) activator subunit 2 (PA28 beta) | PSME2 | 5.277 |
| NM_003330 | Thioredoxin reductase 1 | TXNRD1 | 5.36 |
| NM_002229 | Jun B proto-oncogene | JUNB | 5.649 |
| NM_005980 | S100 calcium binding protein P | S100P | 6.143 |
| NM_001964 | Early growth response 1 | EGR1 | 8.357 |
| NM_016270 | Kruppel-like factor 2 (lung) | KLF2 | 9.428 |
| NM_001657 | Amphiregulin (schwannoma-derived growth factor) | AREG | 11.54 |
| NM_004864 | Growth differentiation factor 15 | GDF15 | 13.88 |
| NM_001168 | Baculoviral IAP repeat-containing 5 (survivin) | BIRC5 | 0.113 |
| NM_012291 | Extra spindle poles like 1 (S. cerevisiae) | ESPL1 | 0.119 |
| NM_007019 | Ubiquitin-conjugating enzyme E2C | UBE2C | 0.122 |
| NM_001237 | Cyclin A2 | CCNA2 | 0.127 |
| NM_002658 | Plasminogen activator, urokinase | PLAU | 0.144 |
| AF220267 | Ubiquitin-like, containing PHD and RING finger domains, 1 | UHRF1 | 0.155 |
| NM_004217 | Aurora kinase B | AURKB | 0.158 |
| AF070648 | Caveolin 1, caveolae protein, 22 kDa | CAV1 | 0.159 |
| NM_005030 | Polo-like kinase 1 (Drosophila) | PLK1 | 0.167 |
| NM_014750 | Discs, large homolog 7 (Drosophila) | DLG7 | 0.184 |
| NM_016426 | G-2 and S-phase expressed 1 | GTSE1 | 0.192 |
近年来, 大量研究发现肿瘤的发生不仅是增殖和分化异常的疾病, 也是细胞凋亡异常的疾病, 也即肿瘤的发生不仅与细胞的生长速度有关, 也与死亡速度有关, 许多抗肿瘤药物可以通过触发肿瘤细胞发生凋亡从而达到治疗肿瘤的目的[8-10]. 本实验采用定性检测凋亡的金标准-"透射电镜"进行形态学观察, 并用流式细胞仪对凋亡做定量检测. 实验发现, 经舒林酸处理的细胞出现了核固缩、核裂解等典型的凋亡形态学改变.流式细胞仪结果也显示, 舒林酸能诱导Lovo细胞发生凋亡, 且凋亡率呈时间和剂量依赖性增加. 以上说明舒林酸具有诱导Lovo细胞发生凋亡的作用, 而且这种作用可能是其抗肿瘤生长增殖的作用机制之一, 这与以往的报导一致[11].
众所周知, 肿瘤的发生、发展是一个多基因、多因素参与的过程, 因此从基因水平上研究药物抗肿瘤作用具有十分重要的意义, 我们应用基因芯片技术检测舒林酸诱导结肠癌细胞Lovo基因表达谱的改变, 结果显示, 舒林酸通过上调或下调某些凋亡相关基因从而发挥其诱导凋亡的作用. 分析与凋亡相关上调显著的基因, GDF15(growth and differentiation factor 15, 生长分化因子15)上调最为显著, cy3/cy5为13.88, 其本身是一个与信号转导相关的基因, 属于TGF-β超家族成员之一, 在胎盘和前列腺中高表达, 在其他组织和器官(包括心脏)中的表达量很低或几乎不表达[12], 在结肠癌、前列腺癌、乳腺癌、胰腺癌等癌症中, GDF15基因在病灶部位的表达显著上调, 国外学者研究发现, GDF15在HCT-116结肠肿瘤细胞中高表达完全消除了该细胞在裸鼠中引发的肿瘤生长[13-14]. 本实验中, GDF15基因上调显著, 说明舒林酸可能通过诱导其高表达从而发挥抗肿瘤的作用.
上调同样明显的CDC16, 作为APC (anaphase-promoting complex)核心亚基之一, 被认为其磷酸化程度与细胞周期有关[15]. JunB, 属于AP-l(activator protein-1)的亚单位, 与同属于AP-l亚单位正性调节生长的c-jun[16]相比, JunB(可能还有JunD)则可负性调节细胞增生, 抑制肿瘤生长. 来源于JunB过度表达小鼠的纤维母细胞, 其细胞G1周期延长, 细胞过早老化而显示增生减缓[17]. CDKN1A、EGR1是两种重要的抑癌基因, 其编码的抑制因子能使细胞周期阻滞于G1期[18], 以上相关基因均可使细胞周期阻滞于G0/G1, 这与我们前期的实验结果一致[4], 说明舒林酸能抑制有增殖能力的静止细胞进入增殖周期, 肿瘤细胞从此脱离细胞周期进入凋亡程序, 增殖受到抑制, 从而有效控制肿瘤的发展.
在下调基因中, 与凋亡相关最密切的是BIRC5, 此基因编码的蛋白为凋亡抑制剂, 在细胞周期G2/M期表达, BIRC5与有丝分裂纺锤体微管以及抑制凋亡活性有关. PLK1是一种高度保守的丝氨酸/苏氨酸蛋白酶, G1期几乎不能检出, 于S期开始积累, G2及M期表达水平较高, 分裂完成后急剧下降[19]. 大量研究发现其在许多肿瘤中如肺癌[20]、乳腺癌[21]卵巢癌[22]等存在过表达. Takahashi et al[23]研究认为, PLK1在大肠癌中的过表达与肿瘤侵犯深度、淋巴结转移、Duke'分期有关. 但也有研究发现, PLK1基因在结肠癌淋巴结转移中成低表达[24]. 本研究中, 经舒林酸处理后的结肠癌细胞PLK1基因低表达, 从一定程度上说明了PLK1基因通过抑制凋亡从而促进肿瘤细胞的生长, 而舒林酸则可抑制这种作用.
结肠癌作为危害人类健康的恶性肿瘤之一, 在我国, 其发病率呈逐年上升趋势, 然其发病率还不是很清楚. 近年来NSAIDs治疗消化系肿瘤是人们十分关注的话题, 并且取得了一定的疗效.
张声生, 教授, 首都医科大学附属北京中医医院消化中心
NSAIDs药可以抑制肿瘤细胞的增殖, 但其作用机制一直是研究的热点, 其在基因水平上如何抑制肿瘤细胞的生长仍有待进一步的研究.
本研究在基因水平上探讨舒林酸抗Lovo细胞增殖的作用机制, 不同于以往仅仅在分子生物学研究其作用机制.
本研究为舒林酸抗结肠癌作用机制在基因水平上提供了线索, 有助于加深对舒林酸抗肿瘤机制的认识.
本研究方法技术可靠, 数据准确, 行文流畅, 有一定的学术价值.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Pohl C, Hombach A, Kruis W. Chronic inflammatory bowel disease and cancer. Hepatogastroenterology. 2000;47:57-70. [PubMed] |
| 2. | Vane JR, Botting RM. Mechanism of action of nonsteroidal anti-inflammatory drugs. Am J Med. 1998;104:2S-8S; discussion 21S-22S. [PubMed] [DOI] |
| 3. | Uefuji K, Ichikura T, Mochizuki H. Cyclooxygenase-2 expression is related to prostaglandin biosynthesis and angiogenesis in human gastric cancer. Clin Cancer Res. 2000;6:135-138. [PubMed] |
| 4. | 聂 家艳, 黄 杰安, 唐 国都, 梁 志海, 廖 晓霞. 舒林酸对结肠癌Lovo细胞生长增殖及凋亡的作用研究. 中国肿瘤医学文摘·肿瘤学. 2007;21:362-366. |
| 5. | Hsu AL, Ching TT, Wang DS, Song X, Rangnekar VM, Chen CS. The cyclooxygenase-2 inhibitor celecoxib induces apoptosis by blocking Akt activation in human prostate cancer cells independently of Bcl-2. J Biol Chem. 2000;275:11397-11403. [PubMed] [DOI] |
| 6. | Gao J, Niwa K, Sun W, Takemura M, Lian Z, Onogi K, Seishima M, Mori H, Tamaya T. Non-steroidal anti-inflammatory drugs inhibit cellular proliferation and upregulate cyclooxygenase-2 protein expression in endometrial cancer cells. Cancer Sci. 2004;95:901-907. [PubMed] [DOI] |
| 7. | Okami J, Nakamori S, Hiraoka N, Tsujie M, Hayashi N, Yamamoto H, Fujiwara Y, Nagano H, Dono K, Umeshita K. Suppression of pancreatic cancer cell invasion by a cyclooxygenase-2-specific inhibitor. Clin Exp Metastasis. 2003;20:577-584. [PubMed] [DOI] |
| 9. | Kamesaki H. Mechanisms involved in chemotherapy-induced apoptosis and their implications in cancer chemotherapy. Int J Hematol. 1998;68:29-43. [PubMed] [DOI] |
| 10. | Darzynkiewicz Z. Apoptosis in antitumor strategies: modulation of cell cycle or differentiation. J Cell Biochem. 1995;58:151-159. [PubMed] [DOI] |
| 12. | Paralkar VM, Vail AL, Grasser WA, Brown TA, Xu H, Vukicevic S, Ke HZ, Qi H, Owen TA, Thompson DD. Cloning and characterization of a novel member of the transforming growth factor-beta/bone morphogenetic protein family. J Biol Chem. 1998;273:13760-13767. [PubMed] [DOI] |
| 13. | Baek SJ, Kim KS, Nixon JB, Wilson LC, Eling TE. Cyclooxygenase inhibitors regulate the expression of a TGF-beta superfamily member that has proapoptotic and antitumorigenic activities. Mol Pharmacol. 2001;59:901-908. [PubMed] |
| 14. | Albertoni M, Shaw PH, Nozaki M, Godard S, Tenan M, Hamou MF, Fairlie DW, Breit SN, Paralkar VM, de Tribolet N. Anoxia induces macrophage inhibitory cytokine-1 (MIC-1) in glioblastoma cells independently of p53 and HIF-1. Oncogene. 2002;21:4212-4219. [PubMed] [DOI] |
| 15. | Peters JM, King RW, Hoog C, Kirschner MW. Identification of BIME as a subunit of the anaphase-promoting complex. Science. 1996;274:1199-1201. [PubMed] [DOI] |
| 17. | Passeque E, Waqner EF. JunB suppresses cell proliferation by transcriptional activation of p16(INK4a) expression. EMBO J. 2000;19:2969-2979. [PubMed] [DOI] |
| 19. | Anger M, Kues WA, Klima J, Mielenz M, Kubelka M, Motlik J, Esner M, Dvorak P, Carnwath JW, Niemann H. Cell cycle dependent expression of Plk1 in synchronized porcine fetal fibroblasts. Mol Reprod Dev. 2003;65:245-253. [PubMed] [DOI] |
| 20. | Zhou Q, Su Y, Bai M. Effect of antisense RNA targeting Polo-like kinase 1 on cell growth in A549 lung cancer cells. J Huazhong Univ Sci Technolog Med Sci. 2008;28:22-26. [PubMed] |
| 22. | Weichert W, Denkert C, Schmidt M, Gekeler V, Wolf G, Kobel M, Dietel M, Hauptmann S. Polo-like kinase isoform expression is a prognostic factor in ovarian carcinoma. Br J Cancer. 2004;90:815-821. [PubMed] [DOI] |
| 23. | Takahashi T, Sano B, Nagata T, Kato H, Sugiyama Y, Kunieda K, Kimura M, Okano Y, Saji S. Polo-like kinase 1 (PLK1) is overexpressed in primary colorectal cancers. Cancer Sci. 2003;94:148-152. [PubMed] [DOI] |