修回日期: 2008-07-31
接受日期: 2008-08-04
在线出版日期: 2008-08-28
目的: 探讨黄芪等12味中药对人调节性T细胞的分化的影响, 为溃疡性结肠炎的中药组方研究提供实验依据.
方法: 分离正常人外周血淋巴细胞和单核细胞, 在体外培养中用人肠道厌氧菌抗原刺激单核细胞, 然后将激活的单核细胞与淋巴细胞混合培养, 分别加入黄芪等12种不同的中药煎液, 最后用流式细胞术检测其对CD4+CD25+FOXP3+调节性T细胞分化的影响.
结果: 与PBS组比较, CD4+细胞中CD25及FOXP3双阳细胞的百分比在黄芪及丹参组明显升高(5.6%±0.6%, 5.5%±0.8% vs 4.3%±0.8%; 均P<0.01), 同时CD4+CD25+细胞中FOXP3的表达率也显著升高(50.0%±3.8%, 45.1%±3.3% vs 30.9%±4.5%; 均P<0.01).
结论: 黄芪和丹参可能通过调节性T淋巴细胞的分化平衡来发挥其治疗作用, 可作为溃疡性结肠炎组方的首选中药.
引文著录: 董文毅, 胡刚正, 张博, 郑长青, 陈苏宁, 刘万里, 史业东. 黄芪等12味中药在体外培养中对人调节性T细胞分化的影响. 世界华人消化杂志 2008; 16(24): 2770-2774
Revised: July 31, 2008
Accepted: August 4, 2008
Published online: August 28, 2008
AIM: To investigate the effects of 12 Chinese herbals (including Astragalus) on the differentiation of human regulatory T cells, and to provide experimental basis for the treatment of ulcerative colitis (UC) using traditional Chinese medicine (TCM).
METHODS: Normal human peripheral lymphocytes and monocytes were seperated and cultured in vitro. The monocytes challenged by anaerobic intestinal bacterial antigens were co-cultured with lymphocytes and then treated with 12 different decoctions of Chinese herbs including Astragalus. Flow cytometry was used to detect the differentiation of CD4+CD25+FOXP3+ regulatory T cells.
RESULTS: As compared with that in the PBS control group, CD4+CD25+FOXP3+ regulatory T cell population increased significantly in the Astragalus-treated group and Salvia-treated group (5.6% ± 0.6%, 5.5% ± 0.8% vs 4.3% ± 0.8%; both P < 0.01), and FOXP3 expression in CD4+CD25+ cells increased significantly as well (50.0% ± 3.8%, 45.1% ± 3.3% vs 30.9% ± 4.5%; both P < 0.01).
CONCLUSION: Salvia Miltiorrhiza and Astragalus may be the first choice for the treatment of ulcerative colitis due to their regulatory effects on the balance of T lymphocyte differentiation.
- Citation: Dong WY, Hu GZ, Zhang B, Zheng CQ, Chen SN, Liu WL, Shi YD. Effects of twelve Chinese herbs on human regulatory T cell differentiation in vitro. Shijie Huaren Xiaohua Zazhi 2008; 16(24): 2770-2774
- URL: https://www.wjgnet.com/1009-3079/full/v16/i24/2770.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i24.2770
炎症性肠病(inflammatory bowel disease, IBD)是一组病因未明的主要累及肠道的免疫失耐受性疾病, 包括溃疡性结肠炎(ulcerative colitis, UC)和克隆氏病(crohn's disease, CD). 在我国为常见病、多发病, 且近年来发病率有逐渐上升趋势[1]. 有效控制该病复发及诱导重度患者临床缓解是目前临床治疗具有挑战意义的课题. 氨基水杨酸类和环孢素A等西药有一定疗效, 但有长期应用副作用较大等不足[2]. UC在我国很早就被认识, 且中医药积累了丰富的治疗经验. 近几十年来, 国内也大量报道了中西药结合治疗UC的临床实验, 疗效一般高于单纯西药, 而且副作用较小[3-4]. 尽管如此, 中药治疗该病的作用机制仍未更深入研究. 近年来, 越来越多的研究者认为UC由肠道局部持续过强的免疫反应所诱发, T淋巴细胞与自身肠道菌群抗原的相互作用在此免疫反应的激发和维持中起到中心作用. T淋巴细胞在正常人体肠道局部免疫耐受的形成中发挥关键作用, 而在UC中, 这种耐受被打破[5-9].
CD4+CD25+调节性T细胞是近年来才发现的一群以抑制免疫反应为主要功能的T细胞亚群, 是维持外周免疫耐受的主要免疫调节细胞[10-12]. 动物实验证实: 缺乏此群细胞能造成IBD模型[13]. 人体研究也证实: IBD患者体内存在此群细胞的相对不足[14]. 依据这些研究进展为基础, 探讨中药治疗IBD机制并进行深一步的组方研究是开发中医药临床价值的一条重要策略. 本研究先从国内大量有关中药临床实验的文献中(检索2001-2007年《中医杂志》和《中国中西医结合杂志》等十余种杂志中共115篇相关文献, 经计算统计分析)筛选出疗效及论证强度较高的中药组方, 再从其组方中选出使用频率较高的12味中药. 通过分离正常人外周血中的淋巴细胞和单核细胞, 在体外培养中用人体肠道来源的厌氧菌抗原刺激单核细胞, 然后将激活的单核细胞与淋巴细胞混合培养, 分别加入上述12种不同的中药煎液, 最后用流式细胞术检测其对CD4+CD25+FOXP3+调节性T细胞分化的影响.
Human Regulatory T Cell Staining Kit购于eBioscience公司: 包括FITC-CD4(RPA-T4)、APC-CD25(BC96)、PE-Foxp3(PCH101-PE)、PE-Rat IgG2a同型对照、正常大鼠血清、染色缓冲液、浓穿孔/固定液、穿孔/固定稀释液和穿孔缓冲液; RPMI 1640液、胎牛血清及HEPES购于Hyclone公司; Lympholyte-H液购于Cedarlane公司; Percoll液购于Amersham Bioscience公司. 疱肉培养基基础及牛肉粒购于北京陆桥技术公司. DNase I购于TaKaRa公司. 考马斯亮蓝总蛋白定量试剂购于南京建成生物工程研究所. 黄芪等12味中药均为深圳三九医药集团生产的无菌袋装免煎中药颗粒(10 g/袋). 流式细胞仪(FACSCalibur, BD Bioscience, USA); 低温离心机(Centrifuge 5810R, Eppendorf, Germany); 电子pH计(pH510, Eutech instrument, Singapore); 倒置显微镜(PM-20, Olympus, Japan); 普通显微镜(BX50, Olympus, Japan); 比色计(500P, Secoman, France); 二氧化碳孵箱(Hera cell 150, Heraeus, Germany).
1.2.1 外周血淋巴细胞/单核细胞的分离: 分别从8名健康志愿者采外周血20 mL, 立即注入肝素抗凝管, 30 min内与15 mL含1 mmol/L EDTA的PBS混合, 加入至50 mL离心管, 用接6号加长针头的一次性注射器抽10 mL Lymphocyte-H, 缓慢地铺在抗凝血下面, 18℃、800 g离心20 min, 取灰白层, 用PBS洗两遍以去除血小板, 加8 mL含100 mL/L胎牛血清、100 kU/L青霉素和链霉素、pH7.2的RPMI 1640(含L-Glutamine和HEPES)完全培养基混悬, 于15 mL离心管中室温放置10 min, 用10 mL注射器抽4 mL低密度Percoll(1.068 kg/L, 335 mOsm), 连接6号加长针头, 排净空气后缓慢地铺在细胞悬液下面, 然后抽高密度Percoll(1.080 kg/mL, 335 mOsm)铺在管底, 18℃、660 g离心15 min, 用吸管吸弃上液至单核细胞层上约10 mm, 将吸管先后插入单核细胞层和淋巴细胞层中下部, 平稳地吸取单核细胞和淋巴细胞悬液, 洗两次, 台盼蓝染色计数活细胞, 取约1×105细胞离心涂片后Giemsa-white染色鉴定细胞的纯度, 结果淋巴细胞的纯度和活性均大于95%, 单核细胞的活性大于95%, 纯度大于80%.
1.2.2 肠道细菌抗原的制作: 肠镜下取健康者大肠标本, 立即将其表面所带细菌接种到50 mL疱肉培养基中, 液体石蜡封闭, 37℃培养48 h, 取菌液离心4000 r/min, 20 min沉淀, 加1.5 mL去离子水及100 U DNase I混悬, 冰上超声破碎, 过滤除菌. 考马斯亮蓝法测细菌抗原总蛋白浓度.
1.2.3 中药煎液的配制: 取黄芪、党参、白术、茯苓、黄连、黄柏、黄芩、白头翁、当归、丹参、红花、赤芍各20 g, (根据文献中各组方的剂量范围及《中药学》和临床常用剂量, 取各中药成分均为20 g), 分别加于已消毒的烧瓶中, 加蒸馏/去离子水200 mL, 置水浴箱中95℃震荡50 min, 取10 mL加于15 mL离心管中, 15 000 r/min离心20 min, 取上清液5 mL, 针头滤器过滤, 作为20倍浓度的储藏液4℃保存备用.
1.2.4 细胞培养: 培养基为RPMI 1640, 含100 mL/L胎牛血清、双抗(100 kU/L青霉素+30 kg/L庆大霉素)、10 mL HEPES及0.05 mL β-ME. 单核细胞以1×105个/孔, 加入96孔板, 并以20 mg/L蛋白浓度加入肠道厌氧菌群抗原, 16 h后每隔2 h半量换液1次, 共4次, 以稀释除去细菌抗原, 然后每孔加入8×104个淋巴细胞, 分别加入不同的中药煎液或PBS, 隔天半量换液1次, 混合培养的第8天收集淋巴细胞做流式细胞检测.
1.2.5 流式细胞: 操作规程按照试剂盒说明进行, 先加FITC/CD4和APC/CD25混合抗体, 4℃避光孵育40 min, 用染色缓冲液洗1次后加穿孔/固定液孵育40 min, 先后加染色缓冲液及穿孔缓冲液洗3次后再加正常大鼠血清, 孵育20 min, 最后加PE/FOXP3抗体孵育40 min, 穿孔缓冲液洗2次后加10 g/L多聚甲醛(pH7.2)固定并上机检测, 数据用CellQuest软件收集, 用WinMDI 2.8软件分析.
统计学处理 所有数据均用mean±SD表示, 计算用SPSS11.5软件包完成, 比较采用单向方差分析, 多重比较采用SNK法, P<0.05被认为分别具有统计学意义.
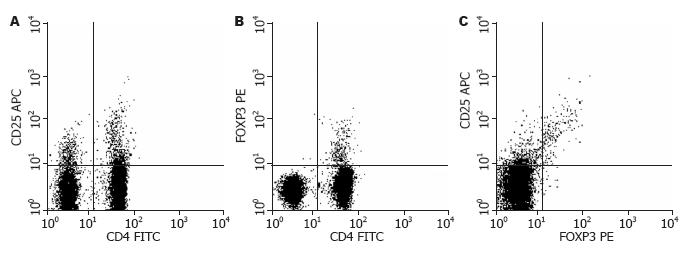
由于CD4、CD25和FOXP3的表达在T细胞分化中具有不同的含义, 此处重点分析其比例变化(表1)及阳性标准的划分(图1). CD4+细胞是T细胞的主要成分, 是介导适应性免疫反应及免疫耐受的主要细胞, 在体外培养中经细菌抗原刺激1 wk后其约占总淋巴细胞的60%, 与对照组比较, 各中药组的差异均无显著性意义. CD4+细胞中表达CD25或FOXP3的细胞约分别占12%和6.5%, 各组间差异无统计学意义. 值得注意的是, CD4+细胞中CD25及FOXP3双阳细胞的百分比在黄芪及丹参组明显升高, 同时CD4+CD25+细胞中FOXP3的表达率也显著升高(均P<0.01).
| CD4+ | CD25+/CD4+m | FOXP3+/CD4+m | CD25+FOXP3+/CD4+m | CD25+FOXP3+/ CD4+CD25+n | |
| PBS | 58.0±7.2 | 13.9±3.8 | 6.5±2.1 | 4.3±0.8 | 30.9±4.5 |
| 黄芪 | 62.5±6.9 | 11.2±2.7 | 7.2±1.7 | 5.6±0.6b | 50.0±3.8b |
| 党参 | 60.8±7.5 | 13.3±4.1 | 6.7±2.7 | 3.6±1.2 | 27.1±3.6 |
| 白术 | 61.4±9.7 | 14.8±4.8 | 6.2±1.9 | 4.0±0.5 | 27.0±2.1 |
| 茯苓 | 59.9±10.4 | 12.0±3.3 | 7.1±1.6 | 4.4±0.7 | 36.6±4.3 |
| 黄连 | 63.1±14.7 | 11.7±3.5 | 6.4±2.2 | 4.0±0.7 | 34.2±4.5 |
| 黄柏 | 58.6±13.5 | 12.8±2.9 | 6.5±1.9 | 4.3±1.0 | 33.6±3.7 |
| 黄芩 | 56.7±12.8 | 13.1±4.2 | 6.6±1.3 | 3.9±0.8 | 29.7±2.9 |
| 白头翁 | 60.3±8.5 | 10.8±4.9 | 6.9±1.7 | 4.1±1.2 | 37.8±4.7 |
| 当归 | 61.1±8.2 | 13.6±3.2 | 6.5±1.2 | 4.5±0.6 | 33.1±2.8 |
| 丹参 | 62.8±10.3 | 12.2±3.6 | 7.0±1.9 | 5.5±0.8b | 45.1±3.3b |
| 红花 | 59.2±15.3 | 12.6±4.4 | 6.3±1.5 | 4.2±0.9 | 33.3±4.1 |
| 赤芍 | 58.7±15.1 | 14.5±4.7 | 6.1±1.1 | 3.9±0.4 | 26.9±3.5 |
目前广泛接受的IBD的发病机制为易感个体免疫系统对自体肠道的部分共生菌群的抗原失耐受而诱发异常免疫反应, T胞在这种免疫反应的激发和维持中处于中心地位. 简而言之, 就是T淋巴细胞对自体肠道的细菌抗原刺激不能形成免疫耐受. 近几年来, 基础免疫学领域在T细胞介导的免疫耐受形成机制的认识上有一个重大的突破, 即机体内存在以抑制免疫反应为主要功能特点的较独立的T细胞亚群(现倾向于称为调节性T细胞). 调节性T细胞/致病性T细胞(反应性T细胞)平衡是机体调节免疫反应的重要模式之一. 正常机体很大程度上靠调节性T细胞的形成来控制免疫反应的不必要放大, 从而避免自身免疫反应和外来抗原诱发的高敏反应, CD4+CD25+FOXP3+ T细胞是目前所发现的最主要的一群调节性T细胞.
目前已有大量的临床研究证实, 中医药治疗UC有较高的疗效, 但其机制尚不清楚. 本研究筛选出临床治疗IBD使用频率较高的12种中药, 其中黄芪、党参、白术和茯苓为主要的补气药; 黄连、黄柏、黄芩和白头翁为常用的清热解毒药; 当归、丹参、红花和赤芍为常用的活血化瘀药. 本研究旨在通过体外实验, 初步探讨这些中药是否能够促进调节性T细胞的分化, 为进一步组方研究提供依据. 为了更好的模拟体内抗原呈递的实际状况, 此处没有直接培养外周血单个单核细胞, 而是分离淋巴细胞和单核细胞, 先用抗原激活单核细胞, 然后再与淋巴细胞共同培养. 我们用渗透压轻度提高的两种漂浮密度的Percoll液很理想的分离出单核细胞和淋巴细胞, 既提高了单核细胞的纯度和回收率又减少了红细胞对淋巴细胞的污染. 由于肠道正常菌群抗原是激发UC肠道异常免疫反应的主要抗原, 厌氧菌占大肠菌群的99%以上, 因此我们没有采用多克隆刺激剂, 而是使用正常人肠道来源的厌氧菌抗原来刺激淋巴细胞.
已经很明确, 人CD4+CD25+ T细胞包括两种功能相反的亚群: 调节性T细胞和新鲜活化的效应细胞, 有人试图用CD25的表达强度来区分, 认为高表达的为调节性T细胞, 但高表达的划分标准具有明显的人为性, 目前广泛认可的最可靠的区分标志为FOXP3的同时表达[11-12,15], 所以此处利用近年来发展出来的FOXP3特异抗体及胞内染色技术, 在单细胞水平同时检测CD4、CD25及FOXP3的表达情况, 以期更确切的分析调节性T细胞/效应性T细胞平衡. 我们发现, 尽管中药黄芪和丹参不能提高CD4+CD25+ T细胞及CD4+FOXP3+ T细胞的比例, 但能提高CD4+CD25+FOXP3+ T细胞的比例, 这提示其能促进CD4+ T细胞向着调节性T细胞分化, 提高调节性T细胞/效应性T细胞的比例. UC患者临床上常有乏力、厌食、消化不良、贫血等症状属于中医脾虚气弱、气血两虚的证候范畴; 而UC患者的脓血便、发热等表现则属于中医大肠湿热毒盛的证候范畴; 患者血液黏稠度升高等改变则属于中医瘀血阻滞等证候范畴. 而黄芪、党参、白术和茯苓恰恰是补脾益气、健脾和中的最主要药物, 加当归能补血活血而不留瘀, 共同改善消化不良、贫血等症状. 黄连、黄柏、黄芩及白头翁均有清热利湿解毒等功效, 现代实验研究证明他们均有抗菌抗病毒作用, 其清泻大肠湿热毒邪的功效可能是通过调节肠道菌群来发挥的. 当归、丹参、红花和赤芍等具有活血化瘀作用的中药可能通过改善肠道微循环来发挥作用的. 本研究同时提示黄芪和丹参还可能通过调节T淋巴细胞的分化平衡来发挥治疗作用, 因此可考虑作为UC组方的首选中药.
炎症性肠病(IBD)是一组病因未明的主要累及肠道的免疫失耐受性疾病, 包括溃疡性结肠炎(UC)和克隆氏病(CD). 在我国为常见病、多发病, 且近年来发病率有逐渐上升趋势.
管冬元, 副教授, 上海中医药大学基础医学院实验中医学教研室; 许玲, 副教授, 中国人民解放军第二军医大学长征医院中医科.
有效控制该病复发及诱导重度患者临床缓解是目前临床治疗具有挑战意义的课题.
近几年来, 基础免疫学领域在T细胞介导的免疫耐受形成机制的认识上有一个重大的突破, 即机体内存在以抑制免疫反应为主要功能特点的较独立的T细胞亚群(现倾向于称为调节性T细胞).
黄芪和丹参还可能通过调节T淋巴细胞的分化平衡来发挥治疗作用, 因此可考虑作为UC组方的首选中药.
本研究思路清晰, 方法适当, 实用性较强, 有一定的创新性, 学术价值较好.
编辑: 李军亮 电编: 何基才
| 1. | Zheng JJ. Incidence of inflammatory bowel disease. Inflammatory bowel disease: basis and clinic. Beijing: Science Press 2001; 36. |
| 2. | Jani N, Regueiro MD. Medical therapy for ulcerative colitis. Gastroenterol Clin North Am. 2002;31:147-166. [PubMed] [DOI] |
| 5. | Macdonald TT, Monteleone G. Immunity, inflammation, and allergy in the gut. Science. 2005;307:1920-1925. [PubMed] [DOI] |
| 6. | Rook GA, Brunet LR. Microbes, immunoregulation, and the gut. Gut. 2005;54:317-320. [PubMed] [DOI] |
| 7. | Powrie F. Immune regulation in the intestine: a balancing act between effector and regulatory T cell responses. Ann N Y Acad Sci. 2004;1029:132-141. [PubMed] [DOI] |
| 8. | Strober W, Fuss I, Mannon P. The fundamental basis of inflammatory bowel disease. J Clin Invest. 2007;117:514-521. [PubMed] [DOI] |
| 9. | Allez M, Mayer L. Regulatory T cells: peace keepers in the gut. Inflamm Bowel Dis. 2004;10:666-676. [PubMed] [DOI] |
| 10. | Roncarolo MG, Battaglia M. Regulatory T-cell immunotherapy for tolerance to self antigens and alloantigens in humans. Nat Rev Immunol. 2007;7:585-598. [PubMed] [DOI] |
| 11. | Fontenot JD, Rudensky AY. A well adapted regulatory contrivance: regulatory T cell development and the forkhead family transcription factor Foxp3. Nat Immunol. 2005;6:331-337. [PubMed] [DOI] |
| 12. | Sakaguchi S. Naturally arising Foxp3-expressing CD25+CD4+ regulatory T cells in immunological tolerance to self and non-self. Nat Immunol. 2005;6:345-352. [PubMed] [DOI] |
| 13. | Cong Y, Weaver CT, Lazenby A, Elson CO. Bacterial-reactive T regulatory cells inhibit pathogenic immune responses to the enteric flora. J Immunol. 2002;169:6112-6119. [PubMed] |
| 14. | Maul J, Loddenkemper C, Mundt P, Berg E, Giese T, Stallmach A, Zeitz M, Duchmann R. Peripheral and intestinal regulatory CD4+ CD25(high) T cells in inflammatory bowel disease. Gastroenterology. 2005;128:1868-1878. [PubMed] [DOI] |