修回日期: 2008-07-16
接受日期: 2008-07-21
在线出版日期: 2008-08-28
目的: 对已发表的文献进行系统回顾, 评价服用非甾体抗炎药(non-steroidal anti-inflammatory drugs, NSAIDs)与结肠息肉危险性的关系.
方法: 检索1966/2007-12数据库PubMed, EMBASE, Cancerlit, ISI以及Cochrane Collaboration controlled trials register收录的文献. 若研究的临床和方法学合理, 则以随机效应模型统计OR值和95%CI. 对研究设计方法、研究人群、药物种类、服用NSAIDs的频率和疗程进行亚组分析.
结果: 共纳入39篇文献. 其中17篇为随机对照临床试验, 12篇为病例对照研究, 10篇队列研究. NSAIDs显著降低散发性结直肠息肉的发生或复发, 随机对照临床试验OR为0.63(95%CI: 0.53-0.75, P = 0.37), 病例对照研究OR值为0.70(95%CI: 0.61-0.80, P = 0.02), 队列研究OR值为0.86(95%CI: 0.77-0.96, P = 0.02). NSAIDs减少家族性腺瘤型息肉病(FAP)患者息肉的数量和大小. 分层分析显示, 阿司匹林和其他NSAIDs降低结肠息肉危险性的作用相似, 并存在剂量依赖性.
结论: NSAIDs减少结直肠息肉的危险性, 还需临床研究进一步确定在特殊人群中预防性使用NSAIDs的最佳剂量和疗程.
引文著录: 王蔚虹, 刘芳勋, 王静, 胡伏莲. 非甾体抗炎药与结直肠息肉的关系: 系统回顾与Meta分析. 世界华人消化杂志 2008; 16(24): 2724-2733
Revised: July 16, 2008
Accepted: July 21, 2008
Published online: August 28, 2008
AIM: The evaluate the association between use of nonsteroidal anti-inflammatory drugs (NSAIDs) and the risk of colorectal polyps.
METHODS: A fully recursive literature search from 1966 to December 2007 was conducted in PubMed, EMBASE, Cancerlit, ISI and Cochrane Collaboration controlled trials register to identify relevant studies. Summary odds ratios (OR) and 95% confidence intervals (CI) were calculated under a random-effects model.
RESULTS: Thirty nine studies (17 controlled clinical trials, 12 case-control and 10 cohort) were identified. The use of NSAIDs was associated with a statistically significant reduction for the recurrence or occurrence of colorectal polyps in patients with sporadic adenomas, with a summary OR of 0.63 (95%CI: 0.53-0.75, P = 0.37) for randomized controlled trials, 0.70 (95%CI: 0.61-0.80, P = 0.02) for case-control studies, and 0.86 (95%CI: 0.77-0.96, P = 0.02) for cohort studies. Seven controlled clinical trials reported a significant regression and a reduction in the number and size of polyps in patients with familial adenomatous polyposis after NSAIDs treatment. As for the type of drugs, the use of aspirin and non-aspirin NSAIDs demonstrated a similar magnitude of risk reduction. A dose-dependent association between NSAIDs use and the risk reduction of colorectal polyps was confirmed in six randomized controlled trials, three case-control and one cohort studies.
CONCLUSION: Use of NSAIDs is associated with a decreased risk of colorectal polyps in a dose-dependent manner. The findings warrant proper clinical trials to define the optimal dose and duration of treatment, and to balance the risks and benefits of prophylactic use of NSAIDs in specific populations.
- Citation: Wang WH, Liu FX, Wang J, Hu FL. Use of non-steroidal anti-inflammatory drug and colorectal polyps: a systematic review and Meta-analysis. Shijie Huaren Xiaohua Zazhi 2008; 16(24): 2724-2733
- URL: https://www.wjgnet.com/1009-3079/full/v16/i24/2724.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i24.2724
体外研究结果显示, 非甾体抗炎药(non-steroidal anti-inflammatory drugs, NSAIDs)及环氧化酶-2特异性抑制剂可通过抑制细胞增殖、诱导凋亡、诱导细胞周期停顿, 以及通过环氧化酶依赖及非依赖的机制干扰肿瘤血管生成[1-3], 达到抑制结直肠肿瘤形成的作用. 结肠腺瘤患者是结直肠癌的高危人群, 化学药物预防对腺瘤患者具有潜在的益处. 在结直肠肿瘤高危人群中进行的一些随机对照临床试验, 由于纳入研究的病例数量少[4-5], 使用不同的药物、剂量和疗程[4-8]而得到不同的结果. 最近发表的两个大的随机、安慰剂对照临床试验显示, 长期服用低剂量阿司匹林能够降低高危人群结肠腺瘤的复发率[9-10]. Sandler et al[9]发现与未服用阿司匹林相比, 服用阿司匹林可减少腺瘤的数量, 但两组之间腺瘤的平均大小及进展期腺瘤患者所占比例均没有统计学差异. Boron et al[10]发现, 与安慰剂组相比, 低剂量阿司匹林组腺瘤的复发率显著降低, 但大剂量阿司匹林并没有显著降低腺瘤的复发率. 因此, 阿司匹林或NSAIDs对结肠息肉的保护作用, 及发挥保护作用的的剂量和疗程还没有确定.
本文系统回顾了所有的临床和流行病学研究, 评价NSAIDs和结直肠息肉危险性的关系; 探讨阿司匹林和非阿司匹林的NSAIDs对结直肠息肉的保护作用是否不同, 以及这种保护作用是否存在剂量依赖性, 不同的试验设计和研究人群得到的结果是否相同.
检索PubMed, Medline, EMBASE, Cancerlit, ISI以及Corchrane Collaboration Controlled Trials Register数据库(1966-2007/12), 检索词为polyps, adenoma, 或adenomas与NSAID, aspirin, ibuprofen, naproxen, sulindac, ketoprofen, ketorolac, flurbiprofen, diclofenac, indomethacin, piroxicam, eodolac, nabumetone, meloxicam, rofecoxib, celecoxib, etoricoxib, valdecoxib相组合. 并检索美国消化疾病周(1995-2005), 国际胃肠病大会(1998, 2002, 2005), 美国胃肠病周会(1998-2003)以及欧洲胃肠病周会(1995-2003)的光盘. 手工检索所有综述及原始文献的参考文献, 寻找电子检索没有检索到的文献. 浏览文献的题目和摘要确定其相关性. 如果不能确定, 则通过浏览全文决定是否纳入. 3位研究者独立进行文献检索和纳入. 纳入所有评价NSAIDs对结直肠腺瘤和息肉预防的临床试验和观察性研究(病例对照研究和队列研究). 临床研究应给出下列结果之一: (1)治疗后发生结直肠息肉的病例数; (2)治疗后息肉好转的病例数; (3)治疗前后息肉的数量和大小, 或治疗后息肉数量和大小较基线改变的百分比. 病例对照研究和队列研究应提供病例组和对照组服用NSAIDs的原始数据. 所有研究必须明确描述NSAIDs的服用情况和经病理证实的腺瘤型息肉. 排除没有原始数据和重复的研究.
2位研究者独立进行数据录入. 研究者通过讨论来达到意见统一. 主要的录入信息包括试验设计方法、研究人群的种族、研究时限、纳入和排除标准、研究人群的特点、诊断方法、腺瘤的位置、肿瘤的类型、NSAIDs暴露的定义、给药类型、剂量、频率和疗程、结果评价方法、匹配方法. 用Jadad标准评价临床研究[11], 包括随机方法、盲法的水平、患者依从性. 用Lichtenstein标准评价病例对照研究和队列研究, 包括研究问题的陈述、病例组和对照组的选择、阿司匹林或NSAIDs暴露的定义、数据搜集的方法、分析方法的描述和样本大小. 为避免主观评价, 我们没有给定任何质量评分, 而是通过可靠性标准来对研究进行分级.
统计学处理 计算比值比(ORs)及95%可信区间(CI). 如果研究的临床和方法学合理, 则使用随机效应模型进行数据的综合统计[12]. 用P值来评价统计学异质性, P<0.1提示存在统计学异质性. 广泛探究异质性的来源, 通过敏感性分析评价排除某一研究是否改变总体的统计结果. 对研究设计方法(随机对照临床试验、病例对照研究、队列研究); 研究人群(没有息肉的普通人群、有家族性多发性腺瘤病的高危人群、散发性息肉人群); 药物种类(阿司匹林, 非阿司匹林的NSAIDs); 服用NSAIDs的频率和疗程进行亚组分析. 很多试验观察了治疗前后息肉的数量、大小或百分比的改变. 然而, 由于没有治疗后改变的原始数据及其标准差, 不能进行综合分析. 所以, 如果数据情况允许, 将针对具体研究进行分析评价病例组与对照组NSAIDs治疗后息肉的平均数量和大小的改变. 通过OR值的对数和标准误构建漏斗图来评价发表偏倚[12]. 使用Corchrane推荐的meta分析软件Review manager 4.2.8进行统计分析.
共检索到1352篇文献及摘要. 浏览题目及摘要后, 有91篇文献可能相关. 其中39篇符合纳入标准[4-10,13-44], 其他的53篇被排除: 20篇没有原始数据或数据不清, 8篇为序贯试验, 5篇没有清楚的描述研究人群的特征, 17篇重复的文章, 2篇病例报道.
纳入的39篇文献中, 34篇为全文发表[4-10,13-15,17-28,31,32,34-40,42-44], 5篇为摘要[16,29,30,33,41]. 17篇文献为临床对照试验[4-10,13-22], 其中16篇为随机对照, 1篇为非随机对照[22](表1). 12篇为病例对照研究[23-34], 10篇为前瞻性队列研究[35-44].
| 作者 | 实验设计方法 | NSAIDs类型 | 诊断方法 | 病例特点 | 结果评价 |
| Baron et al[10] | D-b RCT | 阿司匹林 | 结肠镜组织学 | 腺瘤, 3-16 mo内切除 | 1年时CRA患者的比例 |
| Benamouzig et al[6] | D-b RCT | 阿司匹林 | 结肠镜组织学 | ≥3 个腺瘤或一个腺瘤 ≥6 mm, 3 mo内切除 | 息肉患者的比例, 1年时息肉的大小和负荷 |
| Steinbach et al[7] | D-b RCT | 塞来昔布 | 结肠镜 组织学 | FAP, 未行结肠切除术, ≥5个息肉直径≥2 mm , | 6 mo后息肉数量和大小改变 的平均百分比 |
| Higuchi et al[13] | D-b RCT | 罗非昔布 | 结肠镜 | FAP, >100个结直肠息肉,已或未行结肠切除术 | 息肉的数量和大小 |
| Sandler et al[9] | D-b RCT | 阿司匹林 | 结肠镜 组织学 | CRC患者, 4 mo内行肿瘤及息肉切除术 | 腺瘤患者的比例, 腺瘤复发的 数量, 发生腺瘤的时间 |
| Giardiello et al[4] | D-b RCT | 舒林酸 | 结肠镜 组织学 | 基因型异常, 表型正常的FAP患者 | 48 mo或实验结束时息肉的数量和大小 |
| Giardiello et al[14] | D-b RCT | 舒林酸 | 结肠镜 组织学 | FAP患者, 已或未行结肠切除术, ≥5个直肠腺瘤 | 基线及3, 6, 9,12 mo息肉数量及直径改变的平均百分比 |
| Ladenheim et al[5] | D-b RCT | 舒林酸 | 乙状结肠镜 | 息肉≤1 cm, 成人 | 治疗4 mo后复查内镜 |
| Labayle et al[15] | D-b cross-over RCT | 舒林酸 | 结肠镜 组织学 | 结肠切除术后FAP患者, 有直肠息肉 | 治疗4 mo后复查内镜 |
| Tangrea et al[8] | RCT | 任何 NSAIDs | 结肠镜 组织学 | ≥1 CRA, 息肉切除术后 | 息肉复发的数量 |
| Baron et al[17] | D-b RCT | 罗非昔布 | 结肠镜 组织学 | ≥1 CRA, 12 wk内切除 | 治疗开始3年内≥1个CRA患者的的累积比例 |
| Bertagnolli et al[18] | D-b RCT | 塞来昔布 | 结肠镜 组织学 | 31-88岁, 6 mo内腺瘤切除, 复发高危患者 | 3年随访间期发现腺瘤的患者 的比例 |
| Iwama et al[19] | D-b RCT | Tiracoxib | 结肠镜 组织学 | ≥100个腺瘤的FAP患者 | 指定息肉较基线数量和直径改变的百分比 |
| Arber et al[20] | D-b RCT | 塞来昔布 | 结肠镜 组织学 | 散发腺瘤, 腺瘤切除术后 | 3年时腺瘤的数量和大小及总 的腺瘤负荷 |
| Arber et al[21] | D-b RCT | 依昔舒林 | 结肠镜 组织学 | ≥1个散发腺瘤 | 散发腺瘤好转 |
| Logan et al[16] | D-b RCT | 阿司匹林 | 结肠镜 组织学 | ≥1个腺瘤, >0.5 cm, 6 mo内切除 | 组织学证实CRA或CRC |
| Winde et al[22] | non-ran-domized RCT | 舒林酸 | 内镜 组织学 | 结肠切除术后至少3年的FAP患者CRA复发 | 息肉的数量 |
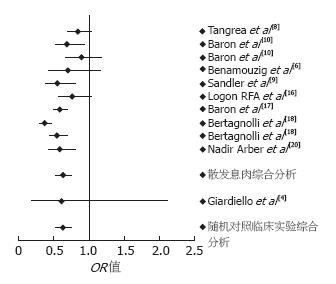
2.3.1 安慰剂对照临床试验: 17项安慰剂对照临床试验[4-10,13-22]包括11 986例患者(NSAIDs = 6195, 安慰剂 = 5791). 9项随机对照临床试验提供了腺瘤复发或发生的原始数据[4,6,8-10,16-18,20], 腺瘤的复发或发生在NSAIDs组为30.7% (1612/5251), 安慰剂对照组为42.2%(2398/5677). NSAIDs治疗使发生结直肠息肉的危险减少了37%(OR = 0.63, 95%CI: 0.53-0.75, 异质性检验P = 0.37). 与NSAIDs治疗相比, 单纯阿司匹林治疗两组OR值的强度没有差别(OR = 0.77, 95%CI: 0.68-0.87, 异质性检验 P = 0.39). 8项对散发性腺瘤切除术后患者进行二级预防的随机对照研究中[6,8-10,16-18,20], 接受NSAIDs治疗的患者有 30.7%(1603/5230)腺瘤复发, 安慰剂组有42.2%(2387/5657)患者腺瘤复发, 提示服用NSAIDs使散发性腺瘤患者腺瘤复发率降低(OR = 0.63; 95%CI: 0.53-0.75; 异质性检验P = 0.27). 另一项研究对表型正常而基因型异常的FAP患者进行的一级预防研究[4], 与安慰剂相比(11/20, 55.0%), 服用舒林酸(9/21, 42.9%)结直肠息肉的发生率没有统计学显著意义(OR = 0.61; 95%CI: 0.18-2.11)[4](图1). 3项临床试验提供了舒林酸治疗后结直肠息肉好转患者的原始数据[5,15,22]. 其中, 2项试验纳入表型FAP患者[15,22], 结果显示NSAIDs组81.6%(31/38)的患者及安慰剂组10.0%(2/20)的患者息肉好转(OR = 48.73, 95%CI: 6.95-341.92, 异质性检验P = 0.72). 然而, 由于病例数少, 95%可信区间范围大. 另外的一项研究纳入散发性腺瘤患者, 舒林酸组和安慰剂组在结肠息肉好转方面没有统计学显著性意义(OR = 1.86, 95%CI: 0.39-8.99)[5]. 15项临床研究评价了治疗前后腺瘤大小和数量的改变, 或治疗后腺瘤的大小和数量改变的百分比[4-7,9,13-22](表2). 6项随机研究探讨了不同剂量NSAIDs对结直肠息肉的影响[7-8,10,18-19,21], 其中4项研究[7-8,18,21]提示NSAIDs与结直肠腺瘤危险性降低之间有剂量依赖性(表3).
| 作者 | 病例类型 | NSAIDs类型 | 剂量 | 疗程 | 病例数治疗组/安慰剂组 | 结果 |
| Benamouzig et al[6] | 散发腺瘤 切除术后 | 阿司匹林 | 160或300 mg/d | 1年 | 140/132 | 腺瘤复发的平均数量: 阿司匹林组0.45, 安慰剂组0.86, P = 0.01 |
| Logan et al[16] | 散发腺瘤 切除术后 | 阿司匹林 | 300 mg/d | 4 mo | 434/419 | 腺瘤复发的平均数量: 阿司匹林组101/434. 安慰剂组120/419, RR = 0.81, 95%CI: 0.65-1.02 |
| Arber et al[20] | 散发腺瘤 切除术后 | 塞来昔布 | 400 mg/d | 3年 | 589/334 | 腺瘤复发的平均数量: 塞来昔布组95/589; 安慰剂组 83/334 |
| Ladenheim et al[5] | 散发腺瘤 | 舒林酸 | 150 mg 2 次/d | 4 mo | 22/22 | 舒林酸组和安慰剂组腺瘤的数量较基线降低39%与19%; 分别有5/22, 3/22完全好转 |
| Arber et al[21] | 散发腺瘤 | 依昔舒林 | 200 mg/d | 12 mo | 91/95 | 依昔舒林组和安慰剂组腺瘤的数量较基线降低20%与25% |
| 400 mg/d | 12 mo | 95/95 | 依昔舒林组和安慰剂组腺瘤的数量较基线降低50%与25% | |||
| Sandler et al[9] | CRC患者, 肿瘤 及息肉切除术后 | 阿司匹林 | 325 mg/d | >30 mo | 317/318 | 腺瘤复发的平均数量: 阿司匹林组0.3, 安慰剂组0.49, P = 0.003 |
| Bertagnolli et al[18] | CRC患者, 肿瘤及息肉切除术后 | 塞来昔布 | 400 mg/d | 6 mo | 613/608 | 腺瘤复发的平均数量: 塞来昔布组186/613与安慰剂组 271/608, P<0.001 |
| 800 mg/d | 6 mo | 601/608 | 腺瘤复发的平均数量: 塞来昔布组137/601与安慰剂组271/608, P<0.001 | |||
| Baron et al[17] | CRC患者, 肿瘤及息肉切除术后 | 罗非昔布 | 25 mg/d | 3年 | 1158/1218 | 腺瘤复发的平均数量: 罗非昔布组460/1158与安慰剂组 646/1218, P<0.01 |
| Giardiello et al[4] | 基因型FAP | 舒林酸 | 75或 150 mg bid | ≤4年 | 21/20 | 腺瘤的平均数量: 舒林酸组5.9, 安慰剂组7.5, P = 0.69; 腺瘤的平均大小: 舒林酸组0.7, 安慰剂组1.2, P = 0.17 |
| Giardiello et al[14] | 有腺瘤的FAP患者 | 舒林酸 | 150 mg bid | 9 mo | 11/11 | 较基线腺瘤的数量舒林酸组降低44%安慰剂组增加13%; 舒林酸组腺瘤大小较基线降低35% |
| Labayle et al[15] | 有腺瘤的FAP患者 | 舒林酸 | 100 mg tid | 4 mo | 10/10 | 舒林酸组6/10完全好转, 3/10部分好转; 安慰剂组 2/10 部分好转 |
| Steinbach et al[7] | 有腺瘤的FAP患者 | 塞来昔布 | 100 mg 2 次/d | 6 mo | 32/15 | 塞来昔布800 mg/d组和200 mg/d组与安慰剂组腺瘤数量较基线分别降低28.0%和 |
| 400 mg 2 次/d | 6 mo | 30/15 | 11.9%与4.5%; 腺瘤大小分别降低30.7%和14.6%与4.9% | |||
| Winde et al[22] | 有腺瘤的FAP患者 | 舒林酸 | 100-300 | 6 mo | 28/10 | 舒林酸组与安慰剂组22/28与 0/10完全好转; 平均息肉数量降低: 舒林酸组12.5与安慰剂组0.7 |
| Higuchi et al[13] | 有腺瘤的FAP患者 | 罗非昔布 | 25 mg/d | 9 mo | 12/9 | 罗非昔布组与安慰剂组息肉数量较基线降低6.8%与增加3.1%; 腺瘤大小降低16.2%与增加1.5% |
| Iwama et al[19] | 有腺瘤的FAP患者 | tiracoxib | 150 mg/d | 26 wk | 21/21 | tiracoxib组与安慰剂组息肉数量较基线增加1%与6%; 腺瘤大小增加3%与4% |
| 200 mg/d | 26 wk | 19/21 | tiracoxib组与安慰剂组息肉数量较基线增加0%与6%; 腺瘤大小增加4%与4% |
| 作者 | NSAIDs | 剂量 | 病例数治疗组/安慰剂组 | 结果 |
| Baron et al[10] | 阿司匹林 | 81 mg/d | 377/372 | 息肉复发: 阿司匹林组37.1%与安慰剂组46.0%(OR = 0.69, 95%CI: 0.52-0.93) |
| 325 mg/d | 372/372 | 息肉复发: 阿司匹林组43.0%与安慰剂组46.0%(OR = 0.89, 95%CI: 0.66-1.19)) | ||
| Tangrea et al[8] | 阿司匹林 | ≤325 mg/d | 369/1474 | 息肉复发: 阿司匹林组27.4%与安慰剂组40%(OR = 0.99, 95%CI: 0.79-1.25) |
| >325 mg/d | 62/1474 | 息肉复发: 阿司匹林组39.8%与安慰剂组40%(OR = 0.57, 95%CI: 0.32-0.99) | ||
| Steinbach et al[7] | 塞来昔布 | 100 mg bid | 32/15 | 息肉数量较基线减少: 塞来昔布组11.9%与安慰剂组4.5%;腺瘤大小较基线减少: 塞来昔布组14.6%与安慰剂组4.9% |
| 400 mg bid | 30/15 | 息肉数量较基线减少: 塞来昔布组28.0%与安慰剂组4.5%;腺瘤大小较基线减少: 塞来昔布组30.7%与安慰剂组4.9% | ||
| Bertagnolli et al[18] | 塞来昔布 | 400 mg/d | 613/608 | 腺瘤复发的平均数量: 塞来昔布组186/613与安慰剂组271/608, P<0.001 |
| 800 mg/d | 601/608 | 腺瘤复发的平均数量: 塞来昔布组137/601与安慰剂组271/608, P<0.001 | ||
| Iwama et al[19] | Tiracoxib | 150 mg/d | 21/21 | tiracoxib组与安慰剂组息肉数量较基线增加1%与6%; 腺瘤大小增加3%与4% |
| 200 mg/d | 19/21 | tiracoxib组与安慰剂组息肉数量较基线增加0%与6%; 腺瘤大小增加4%与4% | ||
| Arber et al[21] | 依昔舒林 | 400 mg/d | 91/95 | 依昔舒林组和安慰剂组腺瘤的数量较基线降低20%与25% |
| 800 mg/d | 95/95 | 依昔舒林组和安慰剂组腺瘤的数量较基线降低50%与25% |
2.3.2 病例对照研究: 12项病例对照研究包括2632例散发性结直肠腺瘤患者, 4121例对照[23-34](表4). 病例组和对照组总的NSAIDs使用率分别为32.0%(842/2632)和43.4%(1790/4121), OR值为0.70(95%CI: 0.61-0.80), 提示服用NSAIDs使发生散发性结直肠腺瘤的危险性减少了30%. 然而, 研究间存在异质性(P = 0.02). Weissfeld et al[29]的研究造成了异质性, 该项研究以摘要形式发表, 未提供匹配方法和NSAIDs暴露时间. 排除此研究后, 结果未变(P = 0.64, 95%CI: 0.56-0.74, 异质性检验P = 0.21). 4项病例对照研究分别提供了服用阿司匹林和非阿司匹林的NSAIDs的原始数据[23,28,31-32], 分组研究显示, 阿司匹林显著降低患结直肠息肉的危险(OR = 0.53, 95%CI: 0.37-0.75, 异质性检验P = 0.89), 而非阿司匹林NSAIDs降低患结直肠息肉的危险无统计学显著意义(OR = 0.63, 95%CI: 0.30-1.31, 异质性检验P = 0.14). 3项研究将NSAIDs暴露分为规律服用及不规律服用[24-25,28](表4), 亚组分析表明, 与未服用者相比, 规律服用NSAIDs显著降低患结直肠息肉的危险(OR = 0.68, 95%CI: 0.52-0.88, 异质性检验P = 0.58). 虽然不规律服药同样降低患结直肠息肉的危险性, 但没有统计学意义(OR = 0.80, 95%CI: 0.42-1.53, 异质性检验P = 0.02). 研究结果存在异质性, Logan et al[28]的研究造成了异质性. 此研究将粪便潜血阴性者作为对照组, 不能明确是否目前或者既往患有结直肠息肉的患者全部被排除, 且该研究对NSAIDs服用的定义不严谨. 3项研究将NSAIDs服用分为5年以下及超过5年[23,25,28]. 病例组3.32%(22/663)例服用NSAIDs 5年及以上, 而对照组为8.57%(85/992), (总OR = 0.38, 95%CI: 0.16-0.89, 异质性检验P = 0.13). 病例组服用NSAIDs 5年以下者占8.14%(54/663), 而对照组为12.4%(124/992), (总OR = 0.83, 95%CI: 0.48-1.44异质性检验P = 0.13).
| 作者 | 诊断方法 | 病例组 | 对照组 | NSAID 定义 | OR (95%CI) |
| Breuer-Katschinski et al[23] | 结肠镜组织学 | 177例CRA, 息肉切除术后 | 177例年龄性别匹 配; 无腺瘤型息肉 | 阿司匹林: 0.65(0.28-1.48) 其他NSAIDs: 3.07(0.61-15.42) 任何NSAIDs: 1.00(0.49-2.03) 阿司匹林: 0.49(0.23-1.06) 其他NSAIDs: 0.48(0.18-1.32) 任何NSAIDs: 0.50(0.27-0.92) | |
| >1片,4 次/wk, 至少3 mo | |||||
| 182例CRA, 息肉切除术后 | 182例年龄性别匹 配的居民 | ||||
| Martin et al[24] | 结肠镜 70%组织学 | 226例CRA | 493相同年龄无CRA | 规律: ≥ 3 d/wk; 偶尔: <3 d/wk; 很少: <1次/wk | 阿司匹林和/或其他NSAIDs: 0.77(0.47-1.25) |
| Martinez et al[25] | 结肠镜 组织学 | 157例CRA | 480相同年龄无CRA | 用药: >3 mo, >1次/wk; 规律用药: 1 次/d; 不规律用药: <1 次/d | 阿司匹林和/或其他NSAIDs: 0.59(0.38-0.92) |
| Boyapati et al[26] | 结肠镜 | ||||
| Sandler et al[27] | 结肠镜 组织学 | 177例>1个腺瘤 210例腺瘤患者 | 228例无腺瘤患者 169例无腺瘤患者 | 至少1 次/wk 用药: >15 次/mo; 正在用药: 近1年>15 次/mo | NSAIDs: 0.77(0.52-1.14) NSAIDs: 0.73(0.48-1.09) |
| Logan et al[28] | 结肠镜 组织学 | 147例CRA, 便潜血阳性 | 153例便潜血阴性 患者 | 规律用药: 按处方用药≥3 mo, 不规律用药: 不按处方用药 | 阿司匹林: 0.58(0.33-0.99) 其他NSAIDs: 0.53(0.27-1.43) 任何NSAIDs: 0.46(0.29-0.75) |
| Weissfeld et al[29] | 乙状结肠镜 组织学 | 158例社区志 愿者CRA | 1059相同年龄社 区志愿者, 无CRA | 至少1 次/d | 阿司匹林: 1.15(0.82-1.61) |
| Pinillos et al[30] | 结肠镜 | 15例CRA | 13例无CRA | 至少1 次/wk | NSAIDs: 0.22(0.05-1.09) |
| Potter et al[31] | 结肠镜 组织学 | 527例腺瘤患者 | 633例相同年龄 无息肉 | n/a | NSAIDs: 0.58(0.43-0.79) |
| 200例增生性息 肉患者 | 同上 | n/a | NSAIDs: 0.84(0.57-1.24) | ||
| Gao et al[32] | 结肠镜 组织学 | 25例无症状息 肉患者 | 125例无症状无 息肉 | n/a | 阿司匹林: 0.44(0.14-1.36) 布洛芬: 0.12(0.02-0.93) 任何NSAIDs: 0.20(0.07-0.56) |
| 37例结直肠息肉 | 66 例无结直肠息 肉和癌 | n/a | 阿司匹林: 0.32(0.10-1.04) 其他NSAIDs: 0.88(0.25-3.14) 任何NSAIDs: 0.30(0.11-0.81) | ||
| Ramaraju et al[33] | 结肠镜 | 100例CRA | 112 例无结直肠 肿瘤 | n/a | NSAIDs: 0.78(0.44-1.38) |
| Gunter et al[34] | 乙状结肠镜 结肠镜 | 244例CRA | 231例年龄性别 匹配, 无CRA | n/a | NSAIDs: 0.57(0.39-0.82) |
2.3.3 队列研究: 10项前瞻性队列研究包括1 046 499例患者, 随访1-18年[35-44]. 8项研究在中危人群中进行[35-37,39,40,42-44], 2项研究在高危人群中进行[38,41](表5). 6项研究提供了服用阿司匹林的原始数据[36,38-42], 其中1项研究同时给出了服用非阿司匹林NSAIDs的原始数据[40], 5项研究没有区分阿司匹林及非阿司匹林NSAIDs[35,37,42-44]. NSAIDs组及对照组结直肠息肉的发病率分别为36.7%(2630/7174)和46.2%(44208/95773), OR值为0.86(95%CI: 0.77-0.96, 异质性检验P = 0.02), 长期服用NSAIDs结直肠息肉的危险性降低了14%. Purdue et al[43]的研究造成了异质性, 该研究仅纳入了55-74岁的老年女性, 目的为筛查左半结肠腺瘤, 且NSAIDs暴露的定义不明确(表5). 敏感性分析排除此项研究不改变结果(OR = 0.83, 95%CI: 0.75-0.92, 异质性检验P = 0.20). 对NSAIDs种类进行分层分析, 结果服用阿司匹林与非阿司匹林的NSAIDs总OR值分别为0.86 (95%CI: 0.76-0.96, 异质性检验P = 0.21)和0.66 (95%CI: 0.47-0.94), 二者差异无统计学意义. 5项研究提供了随访时间的原始数据. 其中4项研究随访了1-6年, 提示服用NSAIDs患结直肠息肉的危险性有降低的趋势[35,37-39]. 仅1项随访18年的研究发现服用阿司匹林结直肠息肉患病率的降低具有统计学显著意义[36](表5), 此前瞻性研究同时研究了阿司匹林的剂量、疗程对结直肠息肉的预防作用, 提示两者之间有很明确的剂量、疗程依赖性[36].
| 作者 | 诊断方法 | 病例特点 | NSAID定义 | 随访时间 | OR (95%CI) |
| Giovannucci et al[35] | 乙状结肠镜 | 10 521例美国健康男性医务人员 | >2 次/wk | 6年 | 阿司匹林和/或其他NSAIDs: 0.92(0.75-1.12) |
| Chan et al[36] | 结肠镜组织学 | 27 077例美国女性注册护士 | 规律用药:≥2 片/wk | 18年 | 阿司匹林: 0.82(0.73-0.92) |
| Rex et al[37] | 结肠镜组织学 | 368例无症状无或只有增生性息肉患者 | 规律用药: ≥1片, ≥4次/wk, ≥2年 | 5.5年 | 阿司匹林和/或其他NSAIDs: 0.47(0.21-1.05) |
| N Greenberg et al[38] | 结肠镜组织学 | 793例≥1个腺瘤, 3 mo前切除 | 持续用药: 1年内用药 间断用药:按表服药 | 1年 | 阿司匹林: 0.63(0.39-1.02) 阿司匹林: 0.94(0.60-1.48) |
| M Gann et al[39] | 问卷调查 | 22 071例美国男性内科医生 | 阿司匹林325 mg qod | 5年 | 阿司匹林: 0.86(0.68-1.10) |
| L Rodriguez et al[40] | 计算机编码 | 943903例在普通医疗研究数据库登记的患者 | 长期服药: >1年 | n/a | 阿司匹林: 1.010.79-1.28) 其他NSAIDs: 0.66(0.47-0.94) |
| Lawitz et al[41] | 结肠镜组织学 | 102例无症状的息肉切除患者 | 每天服药: ≥5年 | n/a | 阿司匹林: 0.34(0.14-0.85) |
| L Rahme et al[42] | 结肠镜组织学 | 8033例因CRA或CRC行结肠镜或钡灌肠患者 | ≥3 mo | n/a | 阿司匹林: 0.92(0.74-1.14)阿司匹林和/或其他NSAIDs: 0.85(0.70-1.03) |
| Purdue et al[43] | 乙状结肠镜 | 20 771女性, PLCO筛查试验 | 规律服药: 按表服药 | 8年 | 阿司匹林或布洛芬: 0.77(0.65-0.91) |
| Gondal et al[44] | 结肠镜组织学 | 12 960例, 挂号处随机纳入 | 每天服药≤5年 | n/a | NSAIDs: 男性0.81(0.61-1.08);女性0.76(0.53-1.11) |
| 每天服药>5年 | n/a | NSAIDs: 男性0.62(0.38-1.00);女性0.73(0.38-1.41) |
对每项研究OR值的对数及标准误绘制漏斗图, 没有提示存在发表偏倚.
本文系统回顾了评价NSAIDs与结直肠息肉危险性的临床及流行病学研究, 并在数据允许的情况下对其相关性进行了定量分析. 与Asano et al[45-46]及Dube et al的系统回顾不同, 本文纳入了更多的文献[47-48], 并进行了多项亚组分析, 对NSAIDs剂量、疗程、类型及不同研究人群进行了分层分析. 研究确认了NSAIDs对结直肠息肉的保护作用.
本文进一步研究了在散发性息肉或FAP患者中NSAIDs的保护作用是否相同. 纳入的流行病学研究[23-44]及对照研究[4-10,13-22]提示NSAIDs显著降低散发性息肉的平均发病危险及减少息肉切除后的复发率. 然而, 只有一小部分散发性息肉的患者会发展为结直肠癌, 因此需要对长期NSAIDs预防治疗进行成本效益和安全性评估.
本文纳入的7项随机对照临床试验[4,7,13-15,19,22]提示服用NSAIDs的FAP患者明显好转, 较基线相比, 治疗后息肉的数量和大小明显减少. 基于本文的结论, NSAIDs治疗可能成为表型FAP患者手术及内镜监测之外的辅助治疗. 然而, NSAIDs治疗的益处可能是暂时的, 因为有研究发现在停药数月后息肉的数量和大小增加[14-15]. 需要更多的临床研究证实NSAIDs治疗是否真正能够减少FAP患者手术的机会, 以及是否阻止息肉向癌发展. 因为只有1项研究对基因型异常而表型正常的FAP患者进行了研究[4], 提示服用舒林酸和安慰剂息肉的数量和大小没有差异, 因此, NSAIDs治疗对这样的患者是否有效还不能确定.
虽然本文提示NSAIDs降低结直肠息肉的危险性, 但理想的治疗剂量和疗程还不能确定. 从机制上看, 低剂量NSAIDs足够抑制结肠前列腺素的合成[49], 但需要大剂量NSAIDs来抑制结肠上皮细胞环氧化酶-2表达[50]. 当服用大剂量NSAIDs时, 一些潜在的不依赖环氧化酶途径的抗肿瘤作用机制可能发挥作用[51-52]. 以往评价上胃肠道癌症与NSAIDs关系的研究发现类似的剂量依赖关系[53-54]. 然而, 由于纳入的研究数量较少, 对本研究结果的解释应谨慎. 此外, 3项病例对照研究[24-25,28]的NSAIDs定义为使用频率而非实际药物剂量, 6项随机对照临床试验使用的NSAIDs剂量均不同[18-19,21].
治疗疗程同样重要. 结果显示服用NSAIDs的疗程与结直肠癌危险性降低之间的相关性比服用剂量和频率更密切[55-56]. 本研究基于3项病例对照研究的数据[23,25,28], 服用NSAIDs 5年及以上能够显著降低结直肠息肉的危险性. 在队列研究中, Chan et al[36]指出服用NSAIDs从5年至超过20年, 两者之间的相关性大大增加. 但是, 由于研究的设计方法、剂量和疗程的不同, 本文不能确认两者之间的关系.
本文的结果存在局限性. 第一, 作为Meta分析, 一般而言, 研究质量依赖于原始研究的质量. 本研究中, 纳入了不同试验设计方法、纳入标准、结果评价的文献. 第二, 由于缺少随机, 观察性研究不能提供确定的证据. 由于病例对照研究为回顾性研究存在各种偏倚, 包括回忆偏倚. 虽然纳入了17项随机对照临床试验, 但只有9项[4,6,8-10,16-18,20]能够进行汇总分析. 第三, 虽然我们为NSAIDs与结直肠息肉危险性降低之间剂量依赖性的关系提供了证据, 但NSAIDs暴露的定义及剂量的不同妨碍我们对理想的剂量和疗程做出有意义的临床建议. 第四, 本文仅对NSAIDs与结直肠腺瘤型息肉之间的关系进行了评价. 尽管在化学预防结直肠癌的研究中通常使用对腺瘤型息肉的预防为替代终点, 但这并不与预防结直肠癌同义[57]. 所以, 需要对本文的结果进行谨慎的解释, 尤其是用于预计NSAIDs对结直肠癌的影响时.
总之, 本研究证实了NSAIDs对结直肠息肉预防的益处. 然而, 广泛推荐NSAIDs作为结直肠腺瘤的化学预防药物还不成熟. 需要更多的随机干预临床试验来确定能够从预防性使用NSAIDs中获益的人群, 及药物的最佳剂量和疗程.
感谢香港大学内科学系王振宇教授和Ge-Fan Zheng医生对本研究文献收集和部分数据采集给予的帮助.
结肠腺瘤患者是结直肠癌的高危人群, 化学药物预防对腺瘤患者具有潜在的益处. 体外研究结果显示, NSAIDs可抑制结直肠肿瘤及腺瘤性息肉的发生. 流行病学的观察性研究及在结直肠肿瘤高危人群中进行的临床试验尚未能确定NSAIDs对结肠腺瘤的保护作用, 及发挥保护作用的剂量和疗程.
李华山, 副主任医师, 中国中医科学院广安门医院肛肠科.
目前是否推荐NSAIDs作为结直肠腺瘤的化学预防药物尚不能确定, 还需要更多的符合循证医学的临床试验评价其风险和效益, 对预防性使用NSAIDs的最佳剂量和疗程, 也需要进一步的临床试验来确定.
Asano et al及Dube et al分别以系统回顾的方法探讨了服用阿司匹林或其他非甾体抗炎药对结肠息肉及结肠癌的预防作用, 提示NSAIDs对结直肠息肉的保护作用.
本文系统回顾和评价了NSAIDs与结直肠腺瘤危险性的临床及流行病学研究, 并在数据允许的情况下进行定量分析, 表明阿司匹林和其他NSAIDs可减少结直肠腺瘤的发生及复发的危险性, 并且这种保护作用存在剂量依赖性.
结肠腺瘤: 大肠黏膜上皮细胞增生形成的肿瘤性息肉, 组织学上分为管状、绒毛状和混合性三类. 多发性者常见为家族性腺瘤病, 其他尚有非家族性腺瘤病及伴有消化系外肿瘤的Gardner综合征、Turcot综合征等.
本文收集资料全面, 可读性较强, 研究方法可靠, 具有一定的学术价值.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Huls G, Koornstra JJ, Kleibeuker JH. Non-steroidal anti-inflammatory drugs and molecular carcinogenesis of colorectal carcinomas. Lancet. 2003;362:230-232. [PubMed] [DOI] |
| 2. | Chan TA. Nonsteroidal anti-inflammatory drugs, apoptosis, and colon-cancer chemoprevention. Lancet Oncol. 2002;3:166-174. [PubMed] [DOI] |
| 3. | Chan TA. Cyclooxygenase inhibition and mechanisms of colorectal cancer prevention. Curr Cancer Drug Targets. 2003;3:455-463. [PubMed] [DOI] |
| 4. | Giardiello FM, Yang VW, Hylind LM, Krush AJ, Petersen GM, Trimbath JD, Piantadosi S, Garrett E, Geiman DE, Hubbard W. Primary chemoprevention of familial adenomatous polyposis with sulindac. N Engl J Med. 2002;346:1054-1059. [PubMed] [DOI] |
| 5. | Ladenheim J, Garcia G, Titzer D, Herzenberg H, Lavori P, Edson R, Omary MB. Effect of sulindac on sporadic colonic polyps. Gastroenterology. 1995;108:1083-1087. [PubMed] [DOI] |
| 6. | Benamouzig R, Deyra J, Martin A, Girard B, Jullian E, Piednoir B, Couturier D, Coste T, Little J, Chaussade S. Daily soluble aspirin and prevention of colorectal adenoma recurrence: one-year results of the APACC trial. Gastroenterology. 2003;125:328-336. [PubMed] [DOI] |
| 7. | Steinbach G, Lynch PM, Phillips RK, Wallace MH, Hawk E, Gordon GB, Wakabayashi N, Saunders B, Shen Y, Fujimura T. The effect of celecoxib, a cyclooxygenase-2 inhibitor, in familial adenomatous polyposis. N Engl J Med. 2000;342:1946-1952. [PubMed] [DOI] |
| 8. | Tangrea JA, Albert PS, Lanza E, Woodson K, Corle D, Hasson M, Burt R, Caan B, Paskett E, Iber F. Non-steroidal anti-inflammatory drug use is associated with reduction in recurrence of advanced and non-advanced colorectal adenomas (United States). Cancer Causes Control. 2003;14:403-411. [PubMed] [DOI] |
| 9. | Sandler RS, Halabi S, Baron JA, Budinger S, Paskett E, Keresztes R, Petrelli N, Pipas JM, Karp DD, Loprinzi CL. A randomized trial of aspirin to prevent colorectal adenomas in patients with previous colorectal cancer. N Engl J Med. 2003;348:883-890. [PubMed] [DOI] |
| 10. | Baron JA, Cole BF, Sandler RS, Haile RW, Ahnen D, Bresalier R, McKeown-Eyssen G, Summers RW, Rothstein R, Burke CA. A randomized trial of aspirin to prevent colorectal adenomas. N Engl J Med. 2003;348:891-899. [PubMed] [DOI] |
| 11. | Jadad AR, Moore RA, Carroll D, Jenkinson C, Reynolds DJ, Gavaghan DJ, McQuay HJ. Assessing the quality of reports of randomized clinical trials: is blinding necessary? Control Clin Trials. 1996;17:1-12. [PubMed] [DOI] |
| 12. | DerSimonian R, Laird N. Meta-analysis in clinical trials. Control Clin Trials. 1986;7:177-188. [PubMed] [DOI] |
| 13. | Higuchi T, Iwama T, Yoshinaga K, Toyooka M, Taketo MM, Sugihara K. A randomized, double-blind, placebo-controlled trial of the effects of rofecoxib, a selective cyclooxygenase-2 inhibitor, on rectal polyps in familial adenomatous polyposis patients. Clin Cancer Res. 2003;9:4756-4760. [PubMed] |
| 14. | Giardiello FM, Hamilton SR, Krush AJ, Piantadosi S, Hylind LM, Celano P, Booker SV, Robinson CR, Offerhaus GJ. Treatment of colonic and rectal adenomas with sulindac in familial adenomatous polyposis. N Engl J Med. 1993;328:1313-1316. [PubMed] [DOI] |
| 15. | Labayle D, Fischer D, Vielh P, Drouhin F, Pariente A, Bories C, Duhamel O, Trousset M, Attali P. Sulindac causes regression of rectal polyps in familial adenomatous polyposis. Gastroenterology. 1991;101:635-639. [PubMed] |
| 16. | Logan RFA, Muir KR, Grainge MJ. On behalf of the UKCAP Trial Group. Aspirin for the prevention of recurrent colorectal adenomas: results of the UKCAP trial. Gut. 2006;55:A90. |
| 17. | Baron JA, Sandler RS, Bresalier RS, Quan H, Riddell R, Lanas A, Bolognese JA, Oxenius B, Horgan K, Loftus S. A randomized trial of rofecoxib for the chemoprevention of colorectal adenomas. Gastroenterology. 2006;131:1674-1682. [PubMed] [DOI] |
| 18. | Bertagnolli MM, Eagle CJ, Zauber AG, Redston M, Solomon SD, Kim K, Tang J, Rosenstein RB, Wittes J, Corle D. Celecoxib for the prevention of sporadic colorectal adenomas. N Engl J Med. 2006;355:873-884. [PubMed] [DOI] |
| 19. | Iwama T, Akasu T, Utsunomiya J, Muto T. Does a selective cyclooxygenase-2 inhibitor (tiracoxib) induce clinically sufficient suppression of adenomas in patients with familial adenomatous polyposis? A randomized double-blind placebo-controlled clinical trial. Int J Clin Oncol. 2006;11:133-139. [PubMed] [DOI] |
| 20. | Arber N, Eagle CJ, Spicak J, Rácz I, Dite P, Hajer J, Zavoral M, Lechuga MJ, Gerletti P, Tang J. Celecoxib for the prevention of colorectal adenomatous polyps. N Engl J Med. 2006;355:885-895. [PubMed] [DOI] |
| 21. | Arber N, Kuwada S, Leshno M, Sjodahl R, Hultcrantz R, Rex D. Sporadic adenomatous polyp regression with exisulind is effective but toxic: a randomised, double blind, placebo controlled, dose-response study. Gut. 2006;55:367-373. [PubMed] [DOI] |
| 22. | Winde G, Schmid KW, Brandt B, Müller O, Osswald H. Clinical and genomic influence of sulindac on rectal mucosa in familial adenomatous polyposis. Dis Colon Rectum. 1997;40:1156-168; discussion 1156-168;. [PubMed] [DOI] |
| 23. | Breuer-Katschinski B, Nemes K, Rump B, Leiendecker B, Marr A, Breuer N, Goebell H. Long-term use of nonsteroidal antiinflammatory drugs and the risk of colorectal adenomas. The Colorectal Adenoma Study Group. Digestion. 2000;61:129-134. [PubMed] [DOI] |
| 24. | Martin C, Connelly A, Keku TO, Mountcastle SB, Galanko J, Woosley JT, Schliebe B, Lund PK, Sandler RS. Nonsteroidal anti-inflammatory drugs, apoptosis, and colorectal adenomas. Gastroenterology. 2002;123:1770-1777. [PubMed] [DOI] |
| 25. | Martínez ME, McPherson RS, Levin B, Annegers JF. Aspirin and other nonsteroidal anti-inflammatory drugs and risk of colorectal adenomatous polyps among endoscoped individuals. Cancer Epidemiol Biomarkers Prev. 1995;4:703-707. [PubMed] |
| 26. | Boyapati SM, Bostick RM, McGlynn KA, Fina MF, Roufail WM, Geisinger KR, Wargovich M, Coker A, Hebert JR. Calcium, vitamin D, and risk for colorectal adenoma: dependency on vitamin D receptor BsmI polymorphism and nonsteroidal anti-inflammatory drug use? Cancer Epidemiol Biomarkers Prev. 2003;12:631-637. [PubMed] |
| 27. | Sandler RS, Galanko JC, Murray SC, Helm JF, Woosley JT. Aspirin and nonsteroidal anti-inflammatory agents and risk for colorectal adenomas. Gastroenterology. 1998;114:441-447. [PubMed] [DOI] |
| 28. | Logan RF, Little J, Hawtin PG, Hardcastle JD. Effect of aspirin and non-steroidal anti-inflammatory drugs on colorectal adenomas: case-control study of subjects participating in the Nottingham faecal occult blood screening programme. BMJ. 1993;307:285-289. [PubMed] |
| 29. | Weisssfeld J, Schoen R, Kuller L. Aspirin, non-steroidal anti-inflammatory drugs (NSAIDs) and colorectal adenomas in a clinical trial of screening sigmoidoscopy. Am J Epidemiol. 1996;143:251. |
| 30. | Pinillos H, Holt P, Muscat J, Lazarus P. Pilot study on UDP-glucuronosyltransferase polymorphisms and risk of colorectal adenomatous polyps in African-Americans. Gastroenterology. 2004;126:A243. |
| 31. | Potter JD, Bigler J, Fosdick L, Bostick RM, Kampman E, Chen C, Louis TA, Grambsch P. Colorectal adenomatous and hyperplastic polyps: smoking and N-acetyltransferase 2 polymorphisms. Cancer Epidemiol Biomarkers Prev. 1999;8:69-75. [PubMed] |
| 32. | Gao X, Sun S, Sun F, Li M, Sun H, Zhang W, Song S. [Nonsteroidal anti-inflammatory drugs and the risk of polyposis, colon carcinoma and rectal carcinoma]. Zhonghua Yufang Yixue Zazhi. 2002;36:332-335. [PubMed] |
| 33. | Ramaraju GA, Mokuolu AO, Olofinlade O, Daniel SJ. Chemoprevention against colorectal cancer and NSAID use in minority population. Am J Gastroenterol. 2001;96:S162. [DOI] |
| 34. | Gunter MJ, Canzian F, Landi S, Chanock SJ, Sinha R, Rothman N. Inflammation-related gene polymorphisms and colorectal adenoma. Cancer Epidemiol Biomarkers Prev. 2006;15:1126-1131. [PubMed] [DOI] |
| 35. | Giovannucci E, Rimm EB, Stampfer MJ, Colditz GA, Ascherio A, Willett WC. Aspirin use and the risk for colorectal cancer and adenoma in male health professionals. Ann Intern Med. 1994;121:241-246. [PubMed] |
| 36. | Chan AT, Giovannucci EL, Schernhammer ES, Colditz GA, Hunter DJ, Willett WC, Fuchs CS. A prospective study of aspirin use and the risk for colorectal adenoma. Ann Intern Med. 2004;140:157-166. [PubMed] |
| 37. | Rex DK, Cummings OW, Helper DJ, Nowak TV, McGill JM, Chiao GZ, Kwo PY, Gottlieb KT, Ikenberry SO, Gress FG. 5-year incidence of adenomas after negative colonoscopy in asymptomatic average-risk persons [see comment]. Gastroenterology. 1996;111:1178-1181. [PubMed] [DOI] |
| 38. | Greenberg ER, Baron JA, Freeman DH, Mandel JS, Haile R. Reduced risk of large-bowel adenomas among aspirin users. The Polyp Prevention Study Group. J Natl Cancer Inst. 1993;85:912-916. [PubMed] [DOI] |
| 39. | Gann PH, Manson JE, Glynn RJ, Buring JE, Hennekens CH. Low-dose aspirin and incidence of colorectal tumors in a randomized trial. J Natl Cancer Inst. 1993;85:1220-1224. [PubMed] [DOI] |
| 40. | García Rodríguez LA, Huerta-Alvarez C. Reduced incidence of colorectal adenoma among long-term users of nonsteroidal antiinflammatory drugs: a pooled analysis of published studies and a new population-based study. Epidemiology. 2000;11:376-381. [PubMed] [DOI] |
| 41. | Lawitz EJ, Meier NJ, Kadakia SC. Prevalence of colonic adenomas in average risk asymptomatic patients on daily aspirin. Gastrointestinal Endoscopy. 1999;49; AB63. [DOI] |
| 42. | Rahme E, Barkun AN, Toubouti Y, Bardou M. The cyclooxygenase-2-selective inhibitors rofecoxib and celecoxib prevent colorectal neoplasia occurrence and recurrence. Gastroenterology. 2003;125:404-412. [PubMed] [DOI] |
| 43. | Purdue MP, Mink PJ, Hartge P, Huang WY, Buys S, Hayes RB. Hormone replacement therapy, reproductive history, and colorectal adenomas: data from the Prostate, Lung, Colorectal and Ovarian (PLCO) Cancer Screening Trial (United States). Cancer Causes Control. 2005;16:965-973. [PubMed] [DOI] |
| 44. | Gondal G, Grotmol T, Hofstad B, Bretthauer M, Eide TJ, Hoff G. Lifestyle-related risk factors and chemoprevention for colorectal neoplasia: experience from the large-scale NORCCAP screening trial. Eur J Cancer Prev. 2005;14:373-379. [PubMed] [DOI] |
| 45. | Asano TK, McLeod RS. Nonsteroidal anti-inflammatory drugs and aspirin for the prevention of colorectal adenomas and cancer: a systematic review. Dis Colon Rectum. 2004;47:665-673. [PubMed] [DOI] |
| 46. | Asano TK, McLeod RS. Non steroidal anti-inflammatory drugs (NSAID) and Aspirin for preventing colorectal adenomas and carcinomas. Cochrane Database Syst Rev. 2004;CD004079. [PubMed] |
| 47. | Dubé C, Rostom A, Lewin G, Tsertsvadze A, Barrowman N, Code C, Sampson M, Moher D. The use of aspirin for primary prevention of colorectal cancer: a systematic review prepared for the U.S. Preventive Services Task Force. Ann Intern Med. 2007;146:365-375. [PubMed] |
| 48. | Rostom A, Dubé C, Lewin G, Tsertsvadze A, Barrowman N, Code C, Sampson M, Moher D. Nonsteroidal anti-inflammatory drugs and cyclooxygenase-2 inhibitors for primary prevention of colorectal cancer: a systematic review prepared for the U.S. Preventive Services Task Force. Ann Intern Med. 2007;146:376-389. [PubMed] |
| 49. | Sample D, Wargovich M, Fischer SM, Inamdar N, Schwartz P, Wang X, Do KA, Sinicrope FA. A dose-finding study of aspirin for chemoprevention utilizing rectal mucosal prostaglandin E(2) levels as a biomarker. Cancer Epidemiol Biomarkers Prev. 2002;11:275-279. [PubMed] |
| 50. | Patrono C, Coller B, Dalen JE, FitzGerald GA, Fuster V, Gent M, Hirsh J, Roth G. Platelet-active drugs : the relationships among dose, effectiveness, and side effects. Chest. 2001;119:39S-63S. [PubMed] [DOI] |
| 51. | Jiang XH, Lam SK, Lin MC, Jiang SH, Kung HF, Slosberg ED, Soh JW, Weinstein IB, Wong BC. Novel target for induction of apoptosis by cyclo-oxygenase-2 inhibitor SC-236 through a protein kinase C-beta(1)-dependent pathway. Oncogene. 2002;21:6113-6122. [PubMed] [DOI] |
| 52. | Shureiqi I, Chen D, Lotan R, Yang P, Newman RA, Fischer SM, Lippman SM. 15-Lipoxygenase-1 mediates nonsteroidal anti-inflammatory drug-induced apoptosis independently of cyclooxygenase-2 in colon cancer cells. Cancer Res. 2000;60:6846-6850. [PubMed] |
| 53. | Corley DA, Kerlikowske K, Verma R, Buffler P. Protective association of aspirin/NSAIDs and esophageal cancer: a systematic review and meta-analysis. Gastroenterology. 2003;124:47-56. [PubMed] [DOI] |
| 54. | Wang WH, Huang JQ, Zheng GF, Lam SK, Karlberg J, Wong BC. Non-steroidal anti-inflammatory drug use and the risk of gastric cancer: a systematic review and meta-analysis. J Natl Cancer Inst. 2003;95:1784-1791. [PubMed] |
| 55. | Rosenberg L, Louik C, Shapiro S. Nonsteroidal antiinflammatory drug use and reduced risk of large bowel carcinoma. Cancer. 1998;82:2326-2333. [PubMed] [DOI] |
| 56. | Reeves MJ, Newcomb PA, Trentham-Dietz A, Storer BE, Remington PL. Nonsteroidal anti-inflammatory drug use and protection against colorectal cancer in women. Cancer Epidemiol Biomarkers Prev. 1996;5:955-960. [PubMed] |
| 57. | Courtney ED, Melville DM, Leicester RJ. Review article: chemoprevention of colorectal cancer. Aliment Pharmacol Ther. 2004;19:1-24. [PubMed] [DOI] |