修回日期: 2008-07-08
接受日期: 2008-08-04
在线出版日期: 2008-08-28
目的: 以整合素α6单抗阻断肝癌细胞与细胞外基质层黏连蛋白(laminin, LN)的相互作用, 观察肝细胞肝癌在与细胞外基质发生黏附之后所引起的细胞表型的变化.
方法: 以LN作为细胞外基质, 牛血清白蛋白(bovine serum albumin, BSA)为对照基质, 常规培养人肝细胞癌细胞系BEL-7402细胞; 以整合素α6单抗作用后检测细胞黏附于LN之后的变化; 免疫细胞化学检测BEL-7402细胞整合素α6的表达; 酸性磷酸酶法检测细胞在不同基质上的黏附率; 采用BrdU试剂盒检测细胞的增殖变化; Boyden小室检测细胞迁移及侵袭能力; 明胶酶谱法检测细胞基质金属蛋白酶的分泌.
结果: 免疫细胞化学染色显示BEL-7402细胞胞膜及胞质有整合素a6的强染色. 细胞在LN基质上的黏附率较对照组明显增加, 而以整合素a6抗体作用后细胞黏附率明显下降(104.4% vs 187.2%, P<0.05). 经整合素a6抗体阻断后, BEL-7402细胞侵袭能力明显下降(穿膜细胞数: 88.7±9.9 vs 103.2±16.5, P<0.01). 明胶酶谱法检测发现细胞黏附于细胞外基质后基质金属蛋白酶种类及分泌量明显增加, 加入整合素a6抗体后基质金属蛋白酶的分泌明显受到抑制.
结论: 阻断整合素α6与细胞外基质LN的相互作用可能会降低肿瘤细胞的转移潜能.
引文著录: 乔世峰, 朱理玮. 层黏连蛋白-整合素α6的相互作用对肝癌细胞黏附过程中表型变化的影响. 世界华人消化杂志 2008; 16(24): 2708-2712
Revised: July 8, 2008
Accepted: August 4, 2008
Published online: August 28, 2008
AIM: To investigate the effect of laminin (LN)-integrin α6 interaction on the phenotype changes after adherent junctions between hepatocellular carcinoma (HCC) cell line BEL-7402 and extracellular matrix.
METHODS: BEL-7402 cells were routinely cultured on LN or bovine serum albumin (BSA) matrix. The effect of anti-integrin α6 monoclonal antibody on cell phenotypes after adherent junctions was examined. The expression of integrin α6 was detected by immunocytochemistry. Acid phosphatase analysis was used to examine the adhesion rate. Cell proliferation was examined by BrdU kit. Galatin zymography was use to measure the matrix metalloproteinases secreted by BEL-7402 cells, and Boyden Chambers to cell invasive ability.
RESULTS: Cultured BEL-7402 cells had positive staining of anti-integrin α6 monoclonal antibody. The adhesion rate of BEL-7402 cells was increased markedly, but was significantly decreased after treatment with anti-integrin α6 antibody (104.4% vs 187.2%, P < 0.05); meanwhile, the invasive ability of BEL-7402 cells was obviously lowered (transmembrane cell number: 88.7 ± 9.9 vs 103.2 ± 16.5, P < 0.01). Galatin zymography found that the types and amount of the secreted matrix metalloproteinases were remarkably increased after adherent junctions, but were notably decreased after anti-integrin α6 antibody was added.
CONCLUSION: Interaction between LN and integrin α6 may regulate human HCC cell phenotypes of proliferation and invasion, which may lower the metastatic potency of tumor cells.
- Citation: Qiao SF, Zhu LW. Laminin-integrin α6 interaction affects phenotypes of hepatocellular carcinoma cells during the process of adherence. Shijie Huaren Xiaohua Zazhi 2008; 16(24): 2708-2712
- URL: https://www.wjgnet.com/1009-3079/full/v16/i24/2708.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i24.2708
原发性肝细胞肝癌是一种恶性度高、较早即发生肝内及肝外转移的肿瘤, 预后远较其他癌症差, 早期侵袭转移是重要因素之一[1]. 在肿瘤侵袭进程中, 必须成功地完成3个过程: 降解细胞外基质(extracellular matrix, ECM)蛋白、离开ECM转移到别处、黏附ECM生长[2]. 癌细胞的迁移取决于细胞对外周基质的降解及黏附过程, 探讨癌细胞黏附过程中细胞表型的变化对于研究癌细胞的转移机制具有重要意义. 整合素属于细胞表面的黏附分子类, 其亚单位整合素α6作为ECM主要成分之一-LN的受体, 与肿瘤的发生、发展和转移有着非常密切的关系. 正常肝细胞不表达整合素α6及LN, 而在大多数肝癌中可以检测到α6b1在细胞表面连续分布而且明显的与LN共表达, 许多研究表明高表达的整合素α6 mRNA预示着肝癌的高度恶性、高转移性和预后不良[3]. 整合素介导的细胞黏附对于如胚胎发育、肿瘤发生和迁移等生理和病理过程是关键的[4], 整合素与LN的相互作用对于肝癌细胞黏附过程中细胞表型的变化是重要的, 但调节机制还不清楚, 本研究利用肝癌细胞系BEL-7402对此进行了初步的探讨.
Bel-7402人肝癌细胞系为本室常规传代培养. RPMI 1640为Gibco产品; 抗整合素α6抗体GoH3购自Chemicon; ABC法免疫组化检测试剂盒购自Santa Cruz公司; BrdU检测试剂盒购自Chemicon公司. 主要制品: LN、人工基膜(Matrigel)及下室趋化因子、Boyden小室均由北京大学医学部细胞学系制备及惠赠.
细胞在含100 mL/L胎牛血清的RPMI 1640培养基, 50 mL/L CO2培养箱内, 37℃培养. 将基质LN以40 mg/L, Matrigel 0.4 g/L, 1 mL/cm2表面积的量加至培养板或培养瓶, 4℃包被过夜, 50 g/L BSA于37℃封闭40 min. 无血清RPMI 1640漂洗3次后备用. 对照组不加基质而仅以50 g/L BSA封闭. 培养的单层细胞经预冷并PBS漂洗后, 加入细胞裂解液, 用细胞刮棒把细胞集中, 经4℃ 12 000 g离心2 min去除细胞骨架成分, 取上清. BEL-7402细胞在含100 mL/L小牛血清的RPMI 1640中培养, 取其细胞制成适当浓度的细胞悬液滴微孔板, 37℃, 50 mL/L CO2培养箱培养5-7 h. 待细胞铺展后, 4℃甲醇∶丙酮(1∶1)固定5-7 min; 抗整合素α6单抗为一抗, 阴性对照加PBS, 加EnVision反应液, 常规DAB显色, 镜检. 取状态良好的Bel-7402细胞, 制成细胞悬液, 每100 μL稀释液中含细胞8000个, 加入基质包被的96孔板中, 100 μL/孔, 实验组加整合素α6单抗(1∶100), 对照组以PBS代替, 37℃ 50 mL/L CO2孵育1 h. 用无血清培养基100 μL/孔轻柔漂洗3次以除去未黏附的细胞, 加入酸性磷酸酶底物应用液(0.2 mol/L乙酸钠缓冲液中含2 mL/L TritonX-100、20 mmol/L硝基苯磷酸盐, pH5.5)100 μL/孔, 37℃ 2 h, 加入1 mol/L NaOH 10 μL/孔终止反应, 室温放置10 min, 用全自动酶标仪在405 nm处检测每孔的光吸收值. 计算公式: 黏附率% = (实验组细胞A值/BSA组细胞A值-1)×100%. 制备细胞悬液, 浓度为5×104个细胞/mL, 将细胞加入包被不同基质的96孔板, 100 μL孔, 置于50 mL/L CO2培养箱中于37℃培养. 培养12 h后按照Brdu细胞增殖检测试剂盒中的步骤进行检测. 每组设4复孔作为平行样. 收集细胞培养液离心后以细胞数为依据调整体积, 进行SDS-PAGE电泳; 电泳结束后, 将胶置于25 mL/L Triton X-100液中室温摇动1 h. 然后将胶浸于酶孵育液中(50 mmol/L Tris-HCl(pH7.8), 150 mmol/L NaCl, 5 mmol/L CaCl2), 37℃摇18 h; 考马斯亮蓝染色(5 g/L考马斯亮蓝R-250, 300 mL/L甲醇, 100 mL/L冰乙酸)后脱色(300 mL/L甲醇, 100 mL/L冰乙酸)至蓝色背景下的透明条带显出. 参照Albini et al[5]的体外侵袭实验方法. Bel-7402细胞分组制备细胞悬液, 浓度为35万个/mL, 安装好Boyden Chamber, 在Matrigel凝胶上加入细胞悬液200 μL, 置于50 mL/L CO2培养箱中于37℃培养18 h. 将膜固定后, 苏木精染色, 镜下观察. 每张膜随机选取5个高倍视野, 计数穿过聚碳酸酯膜的细胞数, 每组细胞设3个复孔.
统计学处理 所得数据以mean±SD表示, 数据处理用SPSS11.0统计软件, 与对照组比较用t检验, P<0.05为差异具有显著性统计学意义.
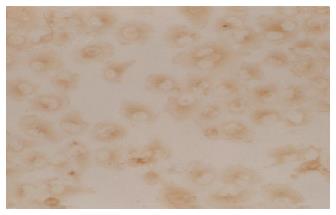
Bel-7402细胞为贴壁培养细胞, 以抗整合素α6单抗为一抗, 对人肝癌细胞系BEL-7402细胞染色显示, 该抗体与BEL-7402细胞呈强阳性反应. 在接近细胞核的一侧可见刷状着色, 细胞膜有明显带状棕色染色(图1).
酸性磷酸酶法检测细胞黏附的结果表明: BEL-7402肝癌细胞的黏附以405 nm的A值表示, 在LN基质上A值为0.856; 在无基质包被的A值为0.298, 二者相比较差异有显著意义(P<0.05). 用抗整合素α6单抗10 mg/L作用后二者的黏附细胞均有减少, A值分别为0.370和0.181, 与抗体作用前相比较有显著性差异(P<0.05). LN组黏附率为187.2%, 抗体组为104.4%, 黏附率明显下降, 两者相比差异有显著意义(P<0.05).
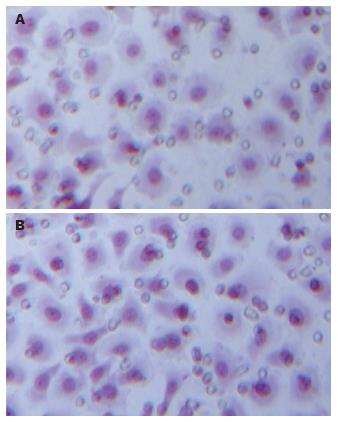
Bel-7402细胞穿过Matrigel发生侵袭的细胞数分别为每高倍视野103.2±16.5个, 抗整合素α6单抗10 mg/L作用后为88.7±9.9个, 穿膜的细胞数明显减少, 有显著性差异(P<0.01, 图2).
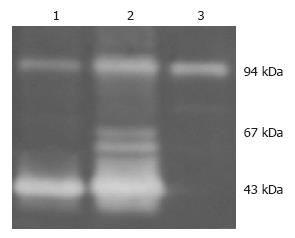
利用明胶酶谱分析检测BEL-7402细胞MMPs分泌的影响, 可以看出: 细胞在黏附过程中, 没有LN铺板的BEL-7402细胞有两条明显条带; 而细胞在LN基质上孵育48 h后, 条带明显增多、加深; 而加入抗体后只有94 kDa的条带, 其余条带消失. 表明抗整合素α6单抗抑制了肝癌细胞产生及分泌多种基质金属蛋白酶(图3).
肝癌是我国常见恶性肿瘤之一, 目前对该病的病因及发病机制认识尚不清楚. 肿瘤的转移是一个多阶段复杂的过程, 包括肿瘤细胞的脱落、迁移、黏附和生长等. 其中细胞黏附在癌细胞侵袭转移过程中, 发挥着重要作用. 细胞黏附可分为两类: 一是细胞-细胞黏附, 二是细胞-基质黏附. 当肿瘤细胞发生转移时, 肿瘤细胞离开基质进入循环, 必须黏附于ECM才能在其他部位转移生长, 因此抑制黏附的过程可能是阻断肿瘤转移的有效手段. 肿瘤的发生、发展是细胞ECM与共同参与的多步骤的过程, LN是各种基膜的主要成分, LN整合素族受体中α6b1及α6b4是最主要的单特异性受体. 整合素α6为跨膜糖蛋白, 由α和b亚单位组成异二聚体, 可以介导细胞与细胞、细胞与ECM间的识别与结合, 并进一步激活细胞内信号系统和/或引起细胞骨架成分的重新组装, 从而影响细胞的基因表达和各种生物学行为[6]. 有报道LN可以促进黏附连接, 并可以促进细胞聚集, 其间有大量的黏附分子表达上调, 但机制不清[7]. 我们利用免疫细胞化学检测肝癌细胞系BEL-7402整合素α6的表达, 结果呈强染色, 染色部位在胞膜及胞质. 为进一步探讨整合素α6-LN相互作用对肝细胞癌在黏附过程中细胞表性的改变, 我们利用BEL-7402细胞在LN及对照BSA包被的基质上培养, 用抗整合素α6单抗阻断α6受体与LN基质的结合, 检测了BEL-7402增殖、侵袭等多种表型的改变.
肝癌与整合素α6有着密切的关系, 在肝细胞癌变发生中, 大多数可以检测到α6b1, 表达水平与患者的预后呈负相关[8]. BEL-7402细胞黏附实验发现细胞在LN上的黏附率明显高于对照组, 细胞增殖明显增加; 在以抗整合素α6单抗进行阻断时, 其黏附和增殖明显受到抑制. 肿瘤细胞的侵袭依赖于细胞的迁移和ECM蛋白的水解, 肿瘤细胞在时间和空间上对ECM沉积和降解的有序调控是其实现转移过程的关键. MMPs是降解ECM的主要酶类, 参与了肿瘤转移过程中的多个步骤, 在原位和转移部位都可以促进肿瘤的生长. 据报道MMPs的表达水平和活性与多种肿瘤细胞的侵袭和转移潜能正相关, 而ECM作为MMPs的底物又可以通过与细胞表面整合素受体相结合, 调节MMPs的分泌. 肝癌组织中产生MMPs的细胞是肝间质细胞和肝癌细胞[9], 本实验中发现BEL-7402细胞可以分泌MMPs, 在无LN基质时, 只有少量分泌; 而在以LN为基质时, MMP种类和分泌量明显增加, 说明LN可以促进肝癌细胞MMP的分泌, 且其活性增强. 但当细胞与整合素α6单抗共同孵育后, MMP的分泌明显受到了抑制, 只显示有一条MMP条带, 提示肝癌细胞在LN基质作用下MMPs的分泌增多是通过α6b1介导的.
有文献报道[10]肝癌组织分泌活化型MMP2、活化型基质溶酶和膜型MMP-1等参与肝癌的转移, 而且与肝癌的肝内、外转移及术后1年复发率等临床指标相关. 肿瘤细胞穿过铺板的Matrigel的能力与他们在动物体内迁移的能力一致, 肿瘤细胞在穿过基底膜的侵袭过程中会变得更具侵袭性, 在一些肿瘤细胞已有显示LN诱导了MMP2的升高, LN促进迁移扩散的机制之一是诱导蛋白裂解活动[11]. 因此我们进一步进行了BEL-7402细胞的体外侵袭实验. 结果发现, 整合素α6单抗可以明显抑制细胞的侵袭能力, 穿膜细胞数明显减少, 推断整合素α6在肝癌组织的高表达促进MMPs的分泌, 进而促进了肝癌细胞实现肝内侵袭生长和向远处器官的转移. ECM是一种连接组织成分的混合物, 包括胶原、LN、蛋白多糖及其他分子, 基底膜蛋白的表达与多种肿瘤的病理分型和肿瘤侵袭的程度有关, 因此在肿瘤的黏附和侵袭过程种可能还会有其他黏附分子及ECM的参与, 还需要进一步的研究. 本研究为肝细胞癌的侵袭和转移提供了新的证据, 阻断LN-整合素α6的相互作用可以抑制BEL-7402细胞的黏附和增殖, 并降低侵袭潜能.
原发性肝细胞癌恶性度较高, 较早即发生肝内外转移. 黏附在转移过程中是非常关键的, 癌细胞在黏附发生中会伴随细胞表型的改变, 从而更有利于转移的发生, 而整合素介导的细胞黏附对于肿瘤的发生和迁移过程是关键的.
王广义, 教授, 吉林大学第一医院普外科.
细胞的黏附对于肿瘤细胞的迁移非常重要, 此过程中LN及其整合素a6受体的作用也非常关键, 受体在肿瘤进展和播散中可以改变肿瘤的侵袭表型. 针对肿瘤细胞表面受体表达的变化开发新的药物可能会成为肿瘤防治的新途径.
国外已有报道FHIT基因过表达能增加胰腺癌细胞系对外源性凋亡诱导剂的敏感性. 体内实验结果显示FHIT基因的转导能阻止肿瘤的生长, 延长模型小鼠的生存时间, 抑制暴露致癌环境下小鼠体内肿瘤的产生.
本文利用肝细胞癌细胞系, 以LN作为ECM, 研究肝细胞肝癌在与LN发生黏附过程中细胞增殖、侵袭表型的变化以及细胞分泌基质金属蛋白酶的改变, 探讨肝癌细胞转移的机制.
本文对于肝癌的转移和侵袭提供了新的证据, 为肝细胞癌的治疗提供了理论依据.
本研究实验设计新颖, 方法和结果可靠, 符合伦理学要求, 具有很好的研究意义.
编辑: 李军亮 电编: 何基才
| 1. | Locker J. A new way to look at liver cancer. Hepatology. 2004;40:521-523. [PubMed] [DOI] |
| 2. | Malinda KM, Kleinman HK. The laminins. Int J Biochem Cell Biol. 1996;28:957-959. [PubMed] [DOI] |
| 3. | Ozaki I, Yamamoto K, Mizuta T, Kajihara S, Fukushima N, Setoguchi Y, Morito F, Sakai T. Differential expression of laminin receptors in human hepatocellular carcinoma. Gut. 1998;43:837-842. [PubMed] |
| 4. | Brown NH, Gregory SL, Martin-Bermudo MD. Integrins as mediators of morphogenesis in Drosophila. Dev Biol. 2000;223:1-16. [PubMed] [DOI] |
| 5. | Albini A, Iwamoto Y, Kleinman HK, Martin GR, Aaronson SA, Kozlowski JM, McEwan RN. A rapid in vitro assay for quantitating the invasive potential of tumor cells. Cancer Res. 1987;47:3239-3245. [PubMed] |
| 6. | Tian B, Li Y, Ji XN, Chen J, Xue Q, Ye SL, Liu YK, Tang ZY. Basement membrane proteins play an active role in the invasive process of human hepatocellular carcinoma cells with high metastasis potential. J Cancer Res Clin Oncol. 2005;131:80-86. [PubMed] [DOI] |
| 7. | Cereijido M, Shoshani L, Contreras RG. The polarized distribution of Na+, K+-ATPase and active transport across epithelia. J Membr Biol. 2001;184:299-304. [PubMed] [DOI] |
| 8. | Torimura T, Ueno T, Kin M, Inuzuka S, Sugawara H, Tamaki S, Tsuji R, Sujaku K, Sata M, Tanikawa K. Coordinated expression of integrin alpha6beta1 and laminin in hepatocellular carcinoma. Hum Pathol. 1997;28:1131-1138. [PubMed] [DOI] |
| 9. | Matsunaga Y, Koda M, Murawaki Y. Expression of matrix metalloproiteinases (MMPs) and tissue inhibitors of metalloproteinases (TIMPs) in hepatocellular carcinoma tissue, compared with the surrounding non-tumor tissue. Res Commun Mol Pathol Pharmacol. 2004;115-116:143-150. [PubMed] |
| 10. | Yamamoto H, Itoh F, Adachi Y, Sakamoto H, Adachi M, Hinoda Y, Imai K. Relation of enhanced secretion of active matrix metalloproteinases with tumor spread in human hepatocellular carcinoma. Gastroenterology. 1997;112:1290-1296. [PubMed] [DOI] |
| 11. | Nabeshima K, Inoue T, Shimao Y, Sameshima T. Matrix metalloproteinases in tumor invasion: role for cell migration. Pathol Int. 2002;52:255-264. [PubMed] [DOI] |