修回日期: 2008-07-12
接受日期: 2008-07-14
在线出版日期: 2008-08-18
目的: 研究人食管癌组织、癌旁组织及其远端正常黏膜组织中DNA聚合酶β(DNA polymerase beta, polβ)基因启动子的突变情况.
方法: 采用聚合酶链反应(PCR)、DNA序列分析技术对25例食管癌患者手术切除的病变标本进行DNA polβ基因启动子序列检测, 并利用DNASIS、OMIGA等软件分析测序数据.
结果: 25例中, 食管癌组织、癌旁组织和正常黏膜组织中DNA polβ基因启动子发生突变者分别为8、6、5例, 三组间突变率差异无统计学意义. 在三组标本中共有35个突变点(癌组织包括18个突变点, 癌旁组织包括9个突变点, 正常黏膜组织8个突变点), 25个点在polβ核心启动子区域, 其中, -37位C→A突变出现8次; -65位G→T突变出现7次; 29位T→C突变出现2次; -19位出现C的缺失和插入C突变各1次.
结论: DNA polβ基因启动子突变可能与食管癌的发生和发展有关.
引文著录: 李月白, 于雅丽, 赵国强, 王欢, 董子明. DNA聚合酶β基因启动子在食管癌组织中的突变分析. 世界华人消化杂志 2008; 16(23): 2649-2652
Revised: July 12, 2008
Accepted: July 14, 2008
Published online: August 18, 2008
AIM: To investigate the mutations of DNA polymerase β (polβ) gene promoter in esophageal cancer tissue, the corresponding cancer-adjacent tissue and distal normal mucosal tissue.
METHODS: We examined the promoter sequence of polβ gene in tumor tissues, the corresponding cancer-adjacent tissues and normal mucosal tissues from 25 patients with esophageal cancer using polymerase chain reaction (PCR) and DNA sequence analysis. DNASIS and OMIGA softwares were used to analyze the DNA sequencing results.
RESULTS: The mutation of polβ gene promoter was found in 8 esophageal cancer tissues, 6 corresponding cancer-adjacent tissues and 5 normal mucosa tissues, respectively. No significant change was found among three groups. There were 18, 9 and 8 mutation points in three groups (35 mutation points in total), respectively. Of the 35 mutation points, 25 located the core region of polβ gene promoter. In all the specimens, mutation forms of C→A at -37 nt, G→T at-65 nt, and T→C at 29 nt were found 8, 7 and 2 times, respectively. Also, the mutation form of C deletion and insertion at -19 nt was found one time, respectively.
CONCLUSION: The mutation of DNA polβ gene promoter may be related to the carcinogenesis and development of esophageal cancer.
- Citation: Li YB, Yu YL, Zhao GQ, Wang H, Dong ZM. Mutation analysis of DNA polymerase β gene promoter in human esophageal cancer. Shijie Huaren Xiaohua Zazhi 2008; 16(23): 2649-2652
- URL: https://www.wjgnet.com/1009-3079/full/v16/i23/2649.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i23.2649
DNA po1β在脊椎动物的细胞内是一个基本表达的碱基切除修复中的关键酶, 许多研究证明他参与了肿瘤的发生和发展[1]. 文献提示[2-3], polβ在细胞中的过量表达会影响染色体的稳定性,诱导低水平的微卫星不稳定现象, 从而参与肿瘤的发生发展. 有研究显示[4-7], 在食管癌组织中存在着polβ基因mRNA的高表达, 且存在明显的polβ基因突变, 提示polβ基因的高表达和突变可能与食管癌的发生发展有关. polβ启动子序列与其基因转录后调控及其表达有密切关系, 当polβ启动子出现碱基序列的改变将通过调节影响到基因表达产物的活性和含量[8]. 为探讨polβ启动子是否也有突变的发生, 本实验将突变的筛查扩展到基因5'端的启动子区, 对食管癌患者癌组织中polβ基因启动子的突变情况进行了初步的检测和分析. 以了解食管癌、癌旁及其正常组织中polβ基因启动子有无突变及三者的关系, 为进一步研究polβ启动子序列对polβ表达的调节作用及是否该基因的过量表达与启动子突变有关提供实验基础, 也为阐明食管癌新的发生机制及基因靶向治疗奠定基础.
收集河南省林州市肿瘤医院和林州市人民医院手术切除的食管癌标本25例(编号为N1-N25), 均经病理检查证实为鳞状上皮细胞浸润癌, 术前患者未接受任何化疗或放疗. 每份标本取癌组织, 癌旁组织及正常黏膜组织各一块(0.5 cm×0.5 cm), 标本离体后迅速置于-196℃液氮保存待用. 质粒pGEM-T、IPTG、X-gal、Taq酶、T4DNA连接酶均购自Promega公司, 胶回收试剂盒购自AXYGEN; PCR仪为德国Biometra公司产品, 紫外凝胶成像仪为美国Pharmacia公司产品.
1.2.1 DNA提取及polβ启动子DNA序列的PCR扩增: 从液氮中取出食管癌、癌旁及正常组织, 加液氮在研钵中研碎, 用BIOSCIENCES公司AxyPrep基因组DNA小量提取试剂盒提取标本组织的总DNA. 参照polβ基因启动子序列[9], 设计扩增polβ启动子引物, Pl: 5'-AAAGGATTCCAGATAAACAC-3', P2: 5'-GCTGGAAGGAAAGAAGAAAG-3', 产物大小499 bp, 由上海生工公司合成. PCR 反应体积30 μL: 10×缓冲液3 μL, 5 mmol/L 4×dNTP 2 μL, 引物P1、P2各0.5 μL, Promega公司高保真Taq酶2 U, 组织标本DNA模板5 μL, 去离子水补足30 μL. 反应条件: 94℃预变性180 s, 94℃变性45 s, 55℃复性45 s, 72℃延伸60 s, 扩增25个循环. 取扩增产物5 μL, 用琼脂糖凝胶电泳, EB染色, 256 nm紫外灯下观察结果.
1.2.2 转化克隆及测序: 用DNA胶回收试剂盒对PCR产物进行纯化, 纯化后再次用琼脂糖凝胶电泳进行鉴定. 鉴定正确, 将纯化所得目的片段与pGEM-T 4℃连接过夜后, 转化感受态细菌DH5α, 接种含IPTG和X-gal的Amp+LB平板培养. 取半个白色菌落留种, 余半个溶到20 μL水中, 100℃水浴裂解细菌后, 用通用引物T7/SP6行PCR, 以鉴定目的片段是否转入. 鉴定正确后用接种环取留种的阳性克隆细菌接种到LB液体培养基中, 37℃摇床培养过夜, 次日将菌液装入EP管中封好待测.
1.2.3 序列比较分析: 测得序列利用DNASIS、OMIGA软件与GenBank中查到DNA polβ启动子序列进行同源性比较和分析.
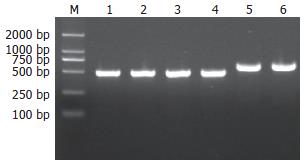
用引物P1/P2 PCR扩增polβ启动子DNA序列, 扩增出499 bp目的片段, 结果与预期一致. 用通用引物T7/SP6鉴定阳性克隆菌落后电泳, 目的片段675 bp, 比499 bp多176 bp, 结果正确(图1).
测序结果显示, 25例人食管癌组织中polβ基因启动子, 共有8例存在18个位点, 总突变率为32%(8/25); 而25例癌旁组织中polβ基因启动子有6例存在9个突变位点,突变率为24%(6/25); 正常黏膜组织有5例突变存在8个突变点, 突变率为20%(5/25). 三组比较差异无统计学意义(P = 0.611) . 其中, -37位C→A突变出现8次; -65 位G→T突变出现7次; 29位T→C突变出现2次; -19位出现C的缺失和插入突变各出现1次(表1)
| 标本 | 变异位点 | ||
| 癌组织 | 癌旁组织 | 正常黏膜组织 | |
| 1 | -65位G→T; 88位T→C | -177位T→C; -65位G→T; 126位A→G | - |
| 2 | - | - | - |
| 3 | - | - | - |
| 4 | -131位G→A; -65位G→T; 29位T→C | - | -37位C→A; -19位插入C突变 |
| 5 | - | - | - |
| 6 | -124位C→T;-100位C→A; | - | -37位C→A; 29位T→C |
| -37位C→A;20位G→A | |||
| 7 | - | - | - |
| 8 | -37位C→A | -144位T→C; 17位G→A | - |
| 9 | - | - | - |
| 10 | - | - | - |
| 11 | -65位G→T | - | -109位T→C; -65位G→T |
| 12 | - | - | - |
| 13 | - | - | - |
| 14 | -114位G→A; -37位C→A | -37位C→A | -19位缺失C突变 |
| 15 | - | - | - |
| 16 | - | - | - |
| 17 | - | -194位T→C | - |
| 18 | - | - | - |
| 19 | - | - | - |
| 20 | - | 115位T→C | - |
| 21 | - | - | - |
| 22 | - | - | - |
| 23 | -37位C→A; 12位G→A | - | -37位C→A |
| 24 | -167位A→G; -111位T→C; | - | -65位G→T |
| -65位G→T | - | - | |
| 25 | - | - | - |
食管癌为是我国常见高发的恶性肿瘤,在我国居恶性肿瘤的第四位[10]. 文献显示[11-12], 在食管癌发生发展中有癌基因和抗癌基因等多种基因发生突变或缺失和抑癌基因甲基化的现象. polβ是人体修复酶之一, 主要参与碱基切除修复(base excision repair, BER)以及跨损伤修复, 对受损或突变基因起修复作用[13-16]. 哺乳动物DNA修复酶DNA polβ的基因在大多数细胞中都是基本表达, 但他以一种组织特异性的方式调节. polβ在细胞内的表达水平必须受到严格的调控, polβ表达过低、突变或缺失, 均可造成DNA修复功能的缺陷, 细胞中DNA的损伤不能被及时修复则导致突变或细胞毒性[17]. 启动子区是调控polβ基因表达的主要调控区域, polβ启动子出现碱基序列的改变可能影响基因的表达及转录的稳定性, 从而影响染色体的稳定性.
根据DNA polβ基因序列分析文献报道[9], polβ基因5'区约-100 bp左右(-113~+62)核心启动子序列是调节基因表达的重要序列, 该区域可维持启动子的绝大部份活性. 因此, 本研究将polβ基因启动子测序范围界定在-261~+238(499 bp)序列之间, 此序列不仅包含了polβ基因启动子核心区域, 而且延伸跨过第一个外显子. 实验结果显示, 三组标本总突变位点达35个, 其中25个位于该基因的核心启动子区域, 表明该启动子核心区域是一个高度突变性或多态性的区域, 在食管癌中突变率较高. 从polβ基因启动子变异位点分析, 在所有发生突变的标本中, 变异并非独立的突变位点, 常是多位点变异的组合, 并且有一些变异热点, 如, -37位C→A突变出现8次, 其出现频率达22.9%(8/35); -65位G→T突变出现7次, 其出现频率达20%(7/35), 因此, 这一突变形式有可能是polβ基因启动子在食管癌中的热点突变形式. 这2个改变不仅在食管癌组织, 而且在癌旁及正常黏膜组织中均有, 因此推测他也可能应属于SNP(单核苷酸多态性). 这些变异位点的存在有何意义, 是否可导致polβ基因表达的上调或下调及是否与polβ的活性改变即与发病有关, 值得进一步的深入研究.
本研究结果显示polβ在食管癌癌组织,癌旁及正常黏膜组织中的突变率差异无统计学意义. 其原因可能是, 虽然旁癌组织及正常黏膜组织中表观病理正常, 而polβ基因变异已存在. 光镜下病理学改变很可能正常的移行黏膜已存在着组织化学、细胞增殖动力学及分子基因水平的异常改变, 他们早于临床病理学异常之前出现, 因此也不能视为正常组织. 提示polβ基因启动子变异不仅发生在癌变之后, 而且极有可能发生在食管癌癌变之前. 说明这些细胞已经发生了polβ调控或蛋白结构的异常, 其分子水平的变化先于形态学的改变, 这一区域是临床关注的焦点,可能为潜在癌变区. 提示在肿瘤切除边缘的周围存在一定区域, 虽然无光镜下可辨认的癌细胞, 组织学形态和结构仍表现正常, 但存在基因学已发生"癌变"的食管黏膜组织, 这些组织可能是造成癌症局部复发的重要原因之一. 总之, 本研究结果证实在食管癌中也存在polβ基因启动子突变现象, 他可能与食管癌的发生、发展存在一定的内在关系.
食管癌为是我国常见高发的恶性肿瘤. 有研究显示, 在食管癌组织中存在着polβ基因mRNA的高表达和明显的polβ基因突变, 提示polβ基因的高表达和突变可能与食管癌的发生发展有关. 为探讨polβ启动子是否也有突变的发生, 本实验将突变的筛查扩展到基因5'端的启动子区, 对食管癌患者癌组织中polβ基因启动子的突变情况进行了初步的检测和分析.
崔立红, 副教授, 中国人民解放军海军总医院消化内科
DNA po1β在脊椎动物的细胞内是一个基本表达的碱基切除修复中的关键酶, 许多研究证明他参与了肿瘤的发生和发展. 哺乳动物DNA修复酶DNA polβ的基因在大多数细胞中都是基本表达, 但他以一种组织特异性的方式调节. polβ在细胞内的表达水平必须受到严格的调控, polβ表达过低、突变或缺失, 均可造成DNA修复功能的缺陷, 细胞中DNA的损伤不能被及时修复则导致突变或细胞毒性. 启动子区是调控polβ基因表达的主要调控区域, 当polβ启动子出现碱基序列的改变可能影响基因的表达及转录的稳定性, 从而影响染色体的稳定性. 因此, 研究polβ基因启动子与食管癌发生发展的关系, 可能成为进一步食管癌研究的热点.
本实验将人食管癌组织、癌旁组织及其远端正常黏膜组织中DNA聚合酶β基因5'端的启动子区的突变情况进行了初步的检测和比对分析. 为进一步研究polβ启动子调控作用及该基因的过量表达与启动子突变相关性提供实验基础, 也为阐明食管癌新的发生机制及基因靶向治疗奠定基础.
本文在众多食管癌基础研究方面有一定新意, 但这些表达说服力有限, 研究应继续深入.
编辑: 李军亮 电编:吴鹏朕
| 1. | Chan K, Houlbrook S, Zhang QM, Harrison M, Hickson ID, Dianov GL. Overexpression of DNA polymerase beta results in an increased rate of frameshift mutations during base excision repair. Mutagenesis. 2007;22:183-188. [PubMed] [DOI] |
| 2. | Bergoglio V, Pillaire MJ, Lacroix-Triki M, Raynaud-Messina B, Canitrot Y, Bieth A, Gars M, Wright M, Delsol G, Loeb LA. Deregulated DNA polymerase beta induces chromosome instability and tumorigenesis. Cancer Res. 2002;62:3511-3514. [PubMed] |
| 3. | Yamada NA, Farber RA. Induction of a low level of microsatellite instability by overexpression of DNA polymerase Beta. Cancer Res. 2002;62:6061-6064. [PubMed] |
| 4. | 赵 国强, 王 涛, 赵 明耀, 何 炜, 杨 红艳, 王 明臣, 汤 黎明, 赵 继敏, 赵 勤, 董 子明. 食管正常、癌前及癌变组织中DNA聚合酶βmRNA检测. 郑州大学学报(医学版). 2005;40:603-605. |
| 6. | Zhao GQ, Wang T, Zhao Q, Yang HY, Tan XH, Dong ZM. Mutation of DNA polymerase beta in esophageal carcinoma of different regions. World J Gastroenterol. 2005;11:4618-4622. [PubMed] |
| 7. | 赵 国强, 赵 勤, 刘 栋, 杨 洪艳, 郑 乃刚, 章 茜, 董 子明. 高发区人食管癌组织中DNA聚合酶β基因突变检测. 郑州大学学报(医学版). 2003;38:493-495. |
| 8. | Bhattacharyya N, Chen HC, Wang L, Banerjee S. Heterogeneity in expression of DNA polymerase beta and DNA repair activity in human tumor cell lines. Gene Expr. 2002;10:115-123. [PubMed] |
| 9. | Widen SG, Kedar P, Wilson SH. Human beta-polymerase gene. Structure of the 5'-flanking region and active promoter. J Biol Chem. 1988;263:16992-16998. [PubMed] |
| 10. | Liu JF, Wang QZ, Hou J. Surgical treatment for cancer of the oesophagus and gastric cardia in Hebei, China. Br J Surg. 2004;91:90-98. [PubMed] [DOI] |
| 11. | Kuwano H, Kato H, Miyazaki T, Fukuchi M, Masuda N, Nakajima M, Fukai Y, Sohda M, Kimura H, Faried A. Genetic alterations in esophageal cancer. Surg Today. 2005;35:7-18. [PubMed] [DOI] |
| 13. | Imoto S, Bransfield LA, Croteau DL, Van Houten B, Greenberg MM. DNA tandem lesion repair by strand displacement synthesis and nucleotide excision repair. Biochemistry. 2008;47:4306-4316. [PubMed] [DOI] |
| 14. | Liu Y, Beard WA, Shock DD, Prasad R, Hou EW, Wilson SH. DNA polymerase beta and flap endonuclease 1 enzymatic specificities sustain DNA synthesis for long patch base excision repair. J Biol Chem. 2005;280:3665-3674. [PubMed] [DOI] |
| 15. | Gembka A, Toueille M, Smirnova E, Poltz R, Ferrari E, Villani G, Hübscher U. The checkpoint clamp, Rad9-Rad1-Hus1 complex, preferentially stimulates the activity of apurinic/apyrimidinic endonuclease 1 and DNA polymerase beta in long patch base excision repair. Nucleic Acids Res. 2007;35:2596-2608. [PubMed] [DOI] |
| 16. | Sykora P, Snow ET. Modulation of DNA polymerase beta-dependent base excision repair in cultured human cells after low dose exposure to arsenite. Toxicol Appl Pharmacol. 2008;228:385-394. [PubMed] [DOI] |
| 17. | Idriss HT, Al-Assar O, Wilson SH. DNA polymerase beta. Int J Biochem Cell Biol. 2002;34:321-324. [PubMed] [DOI] |