修回日期: 2008-07-17
接受日期: 2008-07-21
在线出版日期: 2008-08-18
乳酸菌作为胃肠道的优势菌群, 对于维护胃肠道微生态环境稳定有重要意义, 而与宿主胃肠道上皮表面的黏附和定植是发挥这些作用的前提和基础. 本文就乳酸杆菌黏附活性成分及其生物学特性, 与肠上皮细胞的黏附机制及其影响因素的研究现状作一综述.
引文著录: 沈通一, 秦环龙. 乳酸杆菌对肠上皮黏附机制研究进展. 世界华人消化杂志 2008; 16(23): 2631-2636
Revised: July 17, 2008
Accepted: July 21, 2008
Published online: August 18, 2008
Lactobacillus, as the predominant microorganism in gut, is of vital importance in maintaining the stability of microbiological environment in intestine. The adhering of lactobacillus to intestinal epithelia is the primise and basis of these actions. In this article, we review the progress in the study of the active ingredients, the biological features, the adhering mechanisms of lactobacillus and their influencing factor.
- Citation: Shen TY, Qin HL. Research progress in mechanisms of lactobacillus adhering to intestinal epithelia. Shijie Huaren Xiaohua Zazhi 2008; 16(23): 2631-2636
- URL: https://www.wjgnet.com/1009-3079/full/v16/i23/2631.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i23.2631
人类的胃肠道含有1000多种约1013-1014个微生物, 其基因组总含量至少是人类基因组的一千倍[1]. 乳酸菌作为这其中优势菌群, 同宿主胃肠道上皮表面的黏附和定植可以起到竞争性地排除病原体和调节宿主细胞反应的效果, 对于维护胃肠道正常的生态环境稳定起到了重要作用. 与目前已知的病原菌黏附机制相比, 乳酸菌黏附因子作用机制的研究还在起步阶段. 目前这方面的研究正日益受到重视. 本综述着重分析乳酸菌黏附因子对人类胃肠道的黏附作用机制.
乳酸杆菌和宿主肠上皮细胞的黏附与乳酸菌体表面成分作用有关, 如脂磷壁酸(lipoteichoic acid, LTA)、细胞外多糖(exopolysaccharides, EPS)和细胞表面蛋白等, 其中细胞表面蛋白起着关键性的作用[2]. 目前研究证实乳酸菌包括Lactobacillus brevis, L. acidophilus, L crispatus, L amylovorus, L gallinarum和L. helveticus等其细胞表面蛋白均有黏附能力, 因其大多分布于细菌表层, 故又被统称为表层蛋白(surface layer protein, SLP).
S-layer是大多数微生物细胞壁的最外层结构, 由分子质量40-200 kDa的蛋白或糖蛋白亚单位晶体状排列而成. S-layer厚约5-15 nm, 其疏水外表面由一定大小和不同形态的孔隙组成多孔状结构, 这些孔隙构成70%的晶格状表面[3]. 目前对S-layer的生物功能认识有限, 主要包括组成保护性包膜、细胞形态决定簇、分子和离子通道、细胞外酶的黏附部位、以及参与细胞黏附和表面识别的结构[4].
SLP的分子质量从25-71 kDa, 最大可达200 kDa, 占细菌总蛋白的10%-15%, 含有大量的疏水氨基酸, 占31.9%-38.7%. SLP阳性氨基酸数量较阴性高12.5%, 导致了高等电点(PI), 其PI值为9.35-10.4, 并成为乳酸杆菌SLP特征性的标志[5-6].
乳酸菌可识别宿主表面特异受体, 而宿主表面的蛋白、糖蛋白和糖脂可能就是受体, 也可选择性地吸附特定种类的细菌. 其黏附过程包括二步: 第一步是非特异性的, 由菌体结构的特异性所决定; 第二步是在非特异性结合的基础上, 菌体的特异性配体进一步与宿主细胞相应的受体之间特异性的结合, 这主要通过表层蛋白来发挥作用[7]. Bernet et al用L. acidophilus LA1株和肠致病性大肠杆菌一起与Caco-2共同培养, 发现肠致病菌的黏附能力受抑制, 这可能是乳杆菌与致病菌之间存在的非特异性的对肠上皮细胞顶端受体竞争黏附所引起的[8-9]. 并认为其黏附成分可能是细菌表面的不稳定蛋白质, 据此研制了含冻干培养上清成分的活菌制剂, 临床效果较单纯活菌为优, 但这种分泌型黏附分子的本质尚未阐明. 而包括L. crispatus和L. acidophilus在内的一些乳酸菌在祛除或破坏SLP后其和宿主上皮的黏附能力也降低了[10]. 近来发现单用L. helveticus的SLP提取物也可以达到抑制肠致病性大肠杆菌对宿主上皮细胞的黏附的效果[11]. 许多研究发现在创伤、病毒或细菌感染引起肠上皮破坏的情况下, 黏膜的破坏使细胞外基质(ECM)暴露在外允许有害微生物定植和感染. 乳酸菌通过黏附于这些基质, 就能与病原体竞争相同的受体占据肠道内潜在的连接位点. 在使用家禽的体外CbsA黏附实验中, 鸡粪来源的L. Crispatus可以黏附于鸡肠道组织的胶原或层连纤维[12]. 有研究通过使用异源性的Escherichia coli的CbsB蛋白, 来替代L. Crispatus的CbsB基因编码S-layer蛋白作胶原黏附功能实验, 结果该异源性CbsB蛋白不能和胶原黏附, 故研究者认为L. brevis和L. Crispatus的S-layer表层结构在与肠上皮的黏附过程的作用也很关键[13]. 近来已有多项研究显示L. brevis ATCC 8287 SLP的SLPA拥有与人肠上皮细胞、膀胱内皮细胞和纤连蛋白黏附的能力, 认为乳酸菌SLP可调节不同的宿主表面的黏附[4].
除了表层蛋白外, 其他相关表面成分也起到一定的作用. 多种革兰氏阳性菌包括葡萄球菌、链球菌及乳杆菌等, 不仅细胞壁中含有充足的LTA, 而且在其生长发育过程中, 不断地向周围环境中释放LTA[14]. 有报道认为后者可调节L. johnsonii NCC 533黏附于Caco-2细胞[15]. 研究显示dlt操纵子编码蛋白可以将d-丙氨酸酯嵌入乳酸菌细胞壁相关LTA, 而d-丙氨酸酯在耐酸、抵抗微生物肽、生物膜形成、抗病原菌的毒性方面起着重要的作用, 通过对dlt操纵子的插入灭活导致LTA的d-丙氨酸酯不足, 这可以使L. reuteri 100-23在小鼠肠道的定植明显减少, 并在和肠道菌株的竞争实验中几乎从栖息地消失[16].
此外, 乳酸菌分泌的EPS可以提高菌株对肠道表面的非特异性黏附能力. 研究显示乳酸菌合成的细胞外多糖与细菌聚集也有密切相关, 细菌聚集是生物膜形成的一个整合的过程, 后者对形成黏附起到了推动作用[17]. 研究发现EPS可以调节L. plantarum LP6的黏附作用, 因EPS的表面分布决定LP6的疏水特性, 细菌和黏液的疏水性接触可以影响乳酸菌的初步黏附[18].
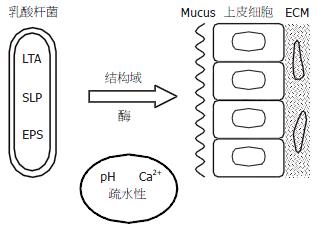
乳酸菌黏附于肠上皮细胞, 主要通过SLP上的结构域和相关调节酶的作用, 而在实施上并受环境的影响(图1).
蛋白质的结构域是蛋白质中具有特异结构和独立功能的区域, 与蛋白质本身的数量相比结构域的数量是有限的, 每个结构域所包含的成员数也是有限的. 结构域作为一个重要的进化单元, 可以在基因组中重复出现, 表明某个结构域在基因组中的重复和重排可能是影响该基因编码的蛋白质功能的一个重要因素. 结构域的核苷酸序列比较保守, 可以经若干代的进化比较完整地保留下来, 也证明了结构域对于蛋白质的功能无可替代的重要性[19-20].
黏附蛋白通常具有革兰氏阳性菌跨膜蛋白的一些典型特征[21], 其中间肽段往往含有2个或2个以上拷贝的重复氨基酸序列, 黏附结构域常位于这些重复序列中, 通过某些特殊的序列连接于细胞壁. 目前有研究将L. brevis ATCC 8287[22]的SLP黏附结构域做了鉴定, 在E.coli的体外鞭毛显示实验中发现L. brevis的受体连接区域位于SLP的N端区域, 包括96-176个氨基酸组成, 主要调节与人肠上皮细胞黏附, 而且在该蛋白的N端还发现同纤连蛋白(fibronectin)连接区域, 由96-245个氨基酸组成. Avall-Jääskeläinen et al[21]将L. brevis ATCC 8287 SLPA中的受体-连接区域(SLPA receptor-binding region)编码基因引入表达质粒, 然后导入乳酸球菌(Lactococcus lactis), 并且表达于乳球菌表面, 结果使得原本无黏附能力的乳酸球菌获得了黏附肠道407上皮细胞系(intestine 407 cells line)及黏附纤连蛋白的能力. 进一步研究表明, 该黏附能力是由slpA基因编码的N末端的247个氨基酸(包含30个氨基酸残基的信号肽)所介导的. 但尽管SLPA的黏附-连接区域能够使L. lactis获得黏附407细胞的能力, 其黏附能力仍较野生型L. brevis低. 可能的解释为野生型L. brevis的S-layer含有50万个SLPA亚基, 而Lactococcus lactis所表达的LPA受体-连接区域只相当于野生型L. brevis S-layer中很少的一部分SLPA蛋白亚基, 所以质粒转染后的乳酸球菌黏附能力较野生型L. brevis低.
近来研究发现包括L. reuteri 1063[22]、L. acidophilus NCFM[23]的细胞外黏附蛋白、L. plantarum WCFS1[24]的凝集素样甘露醇特异黏附素(Msa)等拥有类似的黏液连接结构域(Mub结构域), 该结构域在Pfam资料库描述为Muc连接蛋白(Mucbp), 由50个氨基酸残基组成, 常存在于与肽聚糖连接的蛋白, 可以和真核生物细胞膜表面富含亮氨酸的短链模体相结合起黏附作用. 研究发现部分Mub结构域内或侧方常含有一些富含脯氨酸(P)的区域, 并通过这个区域同蛋白其他部分区分开来, 这些区域中脯氨酸往往被两个非脯氨酸残基隔开, 所以命名为PxxP区域. 而富含脯氨酸的肽段能形成带状或绞链状的二级结构, 可以使蛋白黏附时具有更大的活动性. 在真核生物可以形成富含脯氨酸的模体, 插入上皮细胞SH3结构域的疏水区域, 这可能是黏附机制之一[25]. 另有研究显示, Msa含有的Mub结构域能与肠道上皮细胞表面覆盖的粘液素(Mucin)中的甘露糖成分发生黏附, 如果加入某些糖蛋白(glycoproteins fetuin)可以竞争抑制Mub的黏附作用, 说明黏液中的糖链可能是Mub结构域的配体[22].
不同种类乳酸杆菌黏附结构域具有同源性, 可通过相关数据库归类分析. 而同一黏附素可以有不同黏附结构域的存在, 也可以出现一系列相同的连接域. Boekhorst et al[25]根据存在于L. reuteri 1063和L. plantarum WCFS1的Mub和Msa的结构域序列, 用隐马尔科夫模型(hidden markov models, 简称HMM)从Pfam、SMART和Superfam等数据库中检测搜索潜在的黏液连接蛋白, 通过序列比对的结果在10个乳酸菌种类中共鉴定出有30种蛋白含有3个或更多的Mub结构域. 通过Pfam数据库比较Mucbp结构域, 发现确认的结构域大小不一, 其变化范围从100个到200多个氨基酸不等, 出现在胃肠道大多数的乳酸菌内.
细菌表面粘附蛋白中部分是引物酶依赖的, 在革兰氏阳性菌, 这些表面蛋白c端LPxTG模体可以被引物酶(sortase, SrtA)所识别, 后者可以切断T和G残基, 使苏氨酸羧基群共价连接到细胞壁肽聚糖骨架的五甘氨酸, 和包膜合为一体并在微生物表面显示出来. 除SrtA, 引物酶家族还包括识别NPQTN模体的SrtB和识别QVPTGV模体的SrtC等, 因此又将这些SLP称为引物酶依赖的SLP[26]. 虽然细菌基因组编码许多引物酶依赖SLP, 但绝大多数没有确定的功能. 有研究对四种该类蛋白做了功能分类, 前三种乳酸菌引物酶依赖的SLP(L. reuteri 1063 Mub、L. plantarum WCFS1 Msa和L. acidophilus NCFM Mub)属于黏液黏附蛋白, 第四种蛋白是L. salivarius UCC118的LspA, 他是一种300 kDa的大分子蛋白, 除LPXTG模体以及46个氨基酸残基组成的YSIRK型信号肽(YSIRK-type signal peptide), 其编码基因Lsp在序列上与乳酸菌Lactobacillus johnsonii NC533(简称La1)编码SLP(LJ0621)的基因有80%的同源性[27]. 为了调查引物酶对lsp黏附是否起作用, van Pijkeren et al[28]建立一个缺少引物酶基因(LSL-1606)的突变株, 发现其同肠上皮HT-29和Caco-2细胞黏附能力明显降低, 仅达到野生型菌株的61%和68%, Caco-2细胞影响较少可能同该细胞表面存在大量非引物酶依赖黏附蛋白的受体有关. 而同LspA基因突变株对比, 后者黏附能力仅高于缺乏引物酶UCC118约15%, 这也说明了LspA在黏附过程中的重要作用.
目前研究显示引物酶依赖的SLP能与黏液相连. 然而这并不意味着所有该类蛋白的作用和引物酶调节黏附有关, 有些可能和黏液成分的亲和力相关, 所以需要探明乳酸菌中各种该类蛋白的功能. 近来, 通过多种生物信息方法包括种系序列谱和结构域分析来预测L. plantarum WCFS1细胞外蛋白, 在该研究中12种蛋白被证实含有黏附因子, 其中10种含有LPxTG的引物酶, 包括前面提到的Msa蛋白, 其黏附作用已在试验中证实[29]. 目前已有学者经计算机模拟这些特殊菌株中引物酶依赖的黏附素, 并尝试推测其在生态学上的作用, 而未来的体内和体外的鉴定实验必然会验证这些假设[30].
另外, 有研究显示乳酸菌可以产生EPS合成酶参与调节聚集和粘附以及生物膜的形成. L reuteri TMW1.106表达糖基转移酶(gtfA)和菊粉蔗糖酶(inu), 合成大量高分子量的葡聚糖和寡葡萄糖及少量的果聚糖. 插入灭活破坏inu基因同时影响了L reuteri TMW1.106和野生型竞争黏附小鼠肠上皮, 而破坏gtfA则对粘附没有影响. 根据同源性分析显示, inu在L reuteri TMW1.106的功能除葡聚糖连接蛋白还是葡聚糖的受体, inu的破坏影响同生物膜葡聚糖基质相连. 相对而言, gtfA只和葡聚糖合成相关但和连接无关[31].
研究发现La1上有两类特殊的乳酸菌黏附素. 第一类是存在于胞质的鸟苷酸结合蛋白EF-Tu(elongation factor Tu), 在蛋白质翻译过程中对肽链的延长有重要作用. 然而研究者发现La1的EF-Tu定位在菌体的表面, 而且在这种蛋白上没有发现可以解释的结构域或模体, 说明EF-Tu与一般SLP的结构有所不同. Granato et al[32]将La1用LiCl分离到一种50 kDa的表面蛋白, 能够介导La1对Caco-2细胞及黏液素的黏附, 通过测序和比对结果表明, 他与L. plantarum WCFS-1的EF-Tu在氨基酸序列上有83%的同源性. 重组EF-Tu能竞争抑制La1对Caco-2细胞的黏附, 但抑制率仅40%, 不能达到100%, 说明EF-Tu可能只是La1的SLP的一种. 此外, 重组EF-Tu对两种不同的黏液素(胃腔和肠腔的)的黏附能力相似, 而上述两种黏液素在结构上存在某些相同寡糖决定簇, 他们可能为EF-Tu的黏附配体.
另一类是GroEL热休克家族蛋白(又称分子伴侣, 属于Hsp60家族), 主要功能是帮助新合成的蛋白质正确折叠和装配, 以保证蛋白质有效地发挥功能. 以往认为该类蛋白不存在分泌信号序列及其他模体结构证明其外分泌性, 没有黏附功能. 但Bergonzelli et al[33]用ELISA反应证实GroEL蛋白不仅存在于La1胞质而且位于细菌表面, 且培养8 h后, 培养基内的GroEL蛋白浓度大幅度升高, 根据重组GroEL蛋白同La1黏附实验表明GroEL可能竞争抑制La1对于HT-29细胞的黏附.
以往研究认为乳酸菌的黏附是需要Ca2+的非特异系统, Ca2+信号活化途径可促进乳酸菌与肠细胞的特异受体结合. 研究发现, 使用放射标记的多种乳酸菌, 与缺乏钙离子比较, 在加入钙离子后, L. reuteri DSM 12246, L. plantarum Q47, L. rhamnosus GG和L. johnsonii NCC 533等同IPEC-J2的黏附明显增加, 而Zn及Mg的作用不明显. 而且在钙离子存在的情况下, 黏附力差的菌株其黏附功能增加更明显[34].
Vadillo-Rodríguez et al[35]研究发现由L. acidophilus ATCC 4356的S-layer表达的疏水性与表面黏附能力相关, 后者和环境的离子强度改变相关, 不过不是所有的乳酸菌S-layer拥有这样的机制.
乳酸杆菌作为胃肠道的优势菌群, 对于维护胃肠道生态环境稳定有重要意义, 而与宿主胃肠道上皮表面的黏附和定植是发挥这些作用的前提和基础. 因肠道内的乳酸杆菌数量与种类繁多, 导致黏附机制复杂差异大. 目前, 尚未见关于此方面的确切的归纳和定论.
宁琴, 教授, 华中科技大学同济医学院附属同济医院感染科; 王振宁, 教授, 中国医科大学附属第一医院肿瘤外科
近来对乳酸杆菌与肠上皮细胞黏附的研究中, 除细菌表面活性成分对上皮细胞作用的观点外, 许多研究针对乳酸菌表层蛋白结构域的描述、相关酶的修饰作用及对其影响因素做了深入的分析, 成为研究的热点.
目前对乳酸杆菌黏附机制的研究主要局限在其中的某一方面, 而对其进行全面分析概括较少. 本文从乳酸菌的外部结构特征和活性成分分析入手由粗到细逐层深入, 并通过绘制示意图使具体机制更为明了.
本文全面综述了乳酸杆菌对肠上皮细胞的黏附机制的研究进展, 对进一步深入研究提供有用的参考资料.
本文综述了乳酸杆菌同肠上皮细胞的黏附机制及其影响因素的研究现状, 具有一定的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Gill SR, Pop M, Deboy RT, Eckburg PB, Turnbaugh PJ, Samuel BS, Gordon JI, Relman DA, Fraser-Liggett CM, Nelson KE. Metagenomic analysis of the human distal gut microbiome. Science. 2006;312:1355-1359. [PubMed] [DOI] |
| 2. | Jakava-Viljanen M, Palva A. Isolation of surface (S) layer protein carrying Lactobacillus species from porcine intestine and faeces and characterization of their adhesion properties to different host tissues. Vet Microbiol. 2007;124:264-273. [PubMed] [DOI] |
| 3. | Sára M, Sleytr UB. S-Layer proteins. J Bacteriol. 2000;182:859-868. [PubMed] [DOI] |
| 4. | Avall-Jääskeläinen S, Palva A. Lactobacillus surface layers and their applications. FEMS Microbiol Rev. 2005;29:511-529. [PubMed] [DOI] |
| 5. | Sleytr UB, Sära M. Bacterial and archaeal S-layer proteins: structure-function relationships and their biotechnological applications. Trends Biotechnol. 1997;15:20-26. [PubMed] [DOI] |
| 6. | Br汁ckl G, Behr M, Fabry S, Hensel R, Kaudewitz H, Biendl E, K汁nig H. Analysis and nucleotide sequence of the genes encoding the surface-layer glycoproteins of the hyperthermophilic methanogens Methanothermus fervidus and Methanothermus sociabilis. Eur J Biochem. 1991;199:147-152. [PubMed] [DOI] |
| 7. | Rinkinen M, Westermarck E, Salminen S, Ouwehand AC. Absence of host specificity for in vitro adhesion of probiotic lactic acid bacteria to intestinal mucus. Vet Microbiol. 2003;97:55-61. [PubMed] [DOI] |
| 8. | Bernet MF, Brassart D, Neeser JR, Servin AL. Lactobacillus acidophilus LA 1 binds to cultured human intestinal cell lines and inhibits cell attachment and cell invasion by enterovirulent bacteria. Gut. 1994;35:483-489. [PubMed] [DOI] |
| 9. | Bernet-Camard MF, Liévin V, Brassart D, Neeser JR, Servin AL, Hudault S. The human Lactobacillus acidophilus strain LA1 secretes a nonbacteriocin antibacterial substance(s) active in vitro and in vivo. Appl Environ Microbiol. 1997;63:2747-2753. [PubMed] |
| 10. | Kos B, Suskovic J, Vukovic S, Simpraga M, Frece J, Matosic S. Adhesion and aggregation ability of probiotic strain Lactobacillus acidophilus M92. J Appl Microbiol. 2003;94:981-987. [PubMed] [DOI] |
| 11. | Johnson-Henry KC, Hagen KE, Gordonpour M, Tompkins TA, Sherman PM. Surface-layer protein extracts from Lactobacillus helveticus inhibit enterohaemorrhagic Escherichia coli O157:H7 adhesion to epithelial cells. Cell Microbiol. 2007;9:356-367. [PubMed] [DOI] |
| 12. | Antikainen J, Anton L, Sillanpää J, Korhonen TK. Domains in the S-layer protein CbsA of Lactobacillus crispatus involved in adherence to collagens, laminin and lipoteichoic acids and in self-assembly. Mol Microbiol. 2002;46:381-394. [PubMed] [DOI] |
| 13. | Sillanpää J, Martínez B, Antikainen J, Toba T, Kalkkinen N, Tankka S, Lounatmaa K, Keränen J, H汁汁k M, Westerlund-Wikstr汁m B. Characterization of the collagen-binding S-layer protein CbsA of Lactobacillus crispatus. J Bacteriol. 2000;182:6440-6450. [PubMed] [DOI] |
| 14. | Neuhaus FC, Baddiley J. A continuum of anionic charge: structures and functions of D-alanyl-teichoic acids in gram-positive bacteria. Microbiol Mol Biol Rev. 2003;67:686-723. [PubMed] [DOI] |
| 15. | Granato D, Perotti F, Masserey I, Rouvet M, Golliard M, Servin A, Brassart D. Cell surface-associated lipoteichoic acid acts as an adhesion factor for attachment of Lactobacillus johnsonii La1 to human enterocyte-like Caco-2 cells. Appl Environ Microbiol. 1999;65:1071-1077. [PubMed] |
| 16. | Walter J, Loach DM, Alqumber M, Rockel C, Hermann C, Pfitzenmaier M, Tannock GW. D-alanyl ester depletion of teichoic acids in Lactobacillus reuteri 100-23 results in impaired colonization of the mouse gastrointestinal tract. Environ Microbiol. 2007;9:1750-1760. [PubMed] [DOI] |
| 17. | Ruas-Madiedo P, de los Reyes-Gavilán CG. Invited review: methods for the screening, isolation, and characterization of exopolysaccharides produced by lactic acid bacteria. J Dairy Sci. 2005;88:843-856. [PubMed] |
| 18. | Sun J, Le GW, Shi YH, Su GW. Factors involved in binding of Lactobacillus plantarum Lp6 to rat small intestinal mucus. Lett Appl Microbiol. 2007;44:79-85. [PubMed] [DOI] |
| 19. | Schatz G, Dobberstein B. Common principles of protein translocation across membranes. Science. 1996;271:1519-1526. [PubMed] [DOI] |
| 20. | Hyn汁nen U, Westerlund-Wikstr汁m B, Palva A, Korhonen TK. Identification by flagellum display of an epithelial cell- and fibronectin-binding function in the SlpA surface protein of Lactobacillus brevis. J Bacteriol. 2002;184:3360-3367. [PubMed] [DOI] |
| 21. | Avall-Jääskeläinen S, Lindholm A, Palva A. Surface display of the receptor-binding region of the Lactobacillus brevis S-layer protein in Lactococcus lactis provides nonadhesive lactococci with the ability to adhere to intestinal epithelial cells. Appl Environ Microbiol. 2003;69:2230-2236. [PubMed] [DOI] |
| 22. | Roos S, Jonsson H. A high-molecular-mass cell-surface protein from Lactobacillus reuteri 1063 adheres to mucus components. Microbiology. 2002;148:433-442. [PubMed] |
| 23. | Buck BL, Altermann E, Svingerud T, Klaenhammer TR. Functional analysis of putative adhesion factors in Lactobacillus acidophilus NCFM. Appl Environ Microbiol. 2005;71:8344-8351. [PubMed] [DOI] |
| 24. | Pretzer G, Snel J, Molenaar D, Wiersma A, Bron PA, Lambert J, de Vos WM, van der Meer R, Smits MA, Kleerebezem M. Biodiversity-based identification and functional characterization of the mannose-specific adhesin of Lactobacillus plantarum. J Bacteriol. 2005;187:6128-6136. [PubMed] [DOI] |
| 25. | Boekhorst J, Helmer Q, Kleerebezem M, Siezen RJ. Comparative analysis of proteins with a mucus-binding domain found exclusively in lactic acid bacteria. Microbiology. 2006;152:273-280. [PubMed] [DOI] |
| 26. | Marraffini LA, Dedent AC, Schneewind O. Sortases and the art of anchoring proteins to the envelopes of gram-positive bacteria. Microbiol Mol Biol Rev. 2006;70:192-221. [PubMed] [DOI] |
| 27. | Claesson MJ, Li Y, Leahy S, Canchaya C, van Pijkeren JP, Cerdeño-Tárraga AM, Parkhill J, Flynn S, O'Sullivan GC, Collins JK. Multireplicon genome architecture of Lactobacillus salivarius. Proc Natl Acad Sci U S A. 2006;103:6718-6123. [PubMed] [DOI] |
| 28. | van Pijkeren JP, Canchaya C, Ryan KA, Li Y, Claesson MJ, Sheil B, Steidler L, O'Mahony L, Fitzgerald GF, van Sinderen D. Comparative and functional analysis of sortase-dependent proteins in the predicted secretome of Lactobacillus salivarius UCC118. Appl Environ Microbiol. 2006;72:4143-4153. [PubMed] [DOI] |
| 29. | Boekhorst J, Wels M, Kleerebezem M, Siezen RJ. The predicted secretome of Lactobacillus plantarum WCFS1 sheds light on interactions with its environment. Microbiology. 2006;152:3175-3183. [PubMed] [DOI] |
| 30. | Vélez MP, De Keersmaecker SC, Vanderleyden J. Adherence factors of Lactobacillus in the human gastrointestinal tract. FEMS Microbiol Lett. 2007;276:140-148. [PubMed] [DOI] |
| 31. | Walter J, Schwab C, Loach DM, Gänzle MG, Tannock GW. Glucosyltransferase A (GtfA) and inulosucrase (Inu) of Lactobacillus reuteri TMW1.106 contribute to cell aggregation, in vitro biofilm formation, and colonization of the mouse gastrointestinal tract. Microbiology. 2008;154:72-80. [PubMed] [DOI] |
| 32. | Granato D, Bergonzelli GE, Pridmore RD, Marvin L, Rouvet M, Corthésy-Theulaz IE. Cell surface-associated elongation factor Tu mediates the attachment of Lactobacillus johnsonii NCC533 (La1) to human intestinal cells and mucins. Infect Immun. 2004;72:2160-2169. [PubMed] [DOI] |
| 33. | Bergonzelli GE, Granato D, Pridmore RD, Marvin-Guy LF, Donnicola D, Corthésy-Theulaz IE. GroEL of Lactobacillus johnsonii La1 (NCC 533) is cell surface associated: potential role in interactions with the host and the gastric pathogen Helicobacter pylori. Infect Immun. 2006;74:425-434. [PubMed] [DOI] |
| 34. | Larsen N, Nissen P, Willats WG. The effect of calcium ions on adhesion and competitive exclusion of Lactobacillus ssp. and E. coli O138. Int J Food Microbiol. 2007;114:113-119. [PubMed] [DOI] |
| 35. | Vadillo-Rodríguez V, Busscher HJ, van der Mei HC, de Vries J, Norde W. Role of lactobacillus cell surface hydrophobicity as probed by AFM in adhesion to surfaces at low and high ionic strength. Colloids Surf B Biointerfaces. 2005;41:33-41. [PubMed] [DOI] |