修回日期: 2008-08-05
接受日期: 2008-08-10
在线出版日期: 2008-08-18
目的: 构建含融合自杀基因FCU1的重组腺病毒载体, 转染293细胞构建重组腺病毒, 并感染结肠癌细胞, 同时给以前体药物5-FC, 观察其对结肠癌细胞的杀伤作用.
方法: 将FCU1基因采用EcoRⅠ、SalⅠ双酶切克隆至穿梭质粒pDC316, 构建质粒pDC316-FCU1, 并酶切和测序鉴定. pDC316-FCU1与骨架质粒pBHG经脂质体共转染HEK 293细胞, 在HEK 293细胞中同源重组并包装重组腺病毒Ad5-FCU1. 将Ad5-FCU1感染结肠癌细胞HCT116, 同时给以前体药物5-FC, MTT法检测5-FC对HCT116杀伤作用.
结果: 重组质粒pDC316-FCU1构建成功. pDC316-FCU1与骨架质粒pBHG共转染HEK 293细胞后, 出现明显的毒斑, 纯化后病毒滴度为2×1012 PFU/L. 重组病毒Ad5-FCU1感染HCT116细胞后, 给以无毒前体药物5-FC显示极强的杀伤作用, 当5-FC达100 μmol/L时, 存活的HCT116/FCU1细胞极少, 而对照组存活率接近90%.
结论: 成功构建了含融合自杀基因FCU1的Ad5-FCU1重组腺病毒, FCU1/5-FC自杀基因系统对结肠癌细胞具有显著的体外杀伤作用.
引文著录: 吴斌文, 李友佳, 张凯军, 李东风, 曾志刚, 张瑛华, 耿庆山. FCU1重组腺病毒载体构建及对结肠癌细胞的杀伤作用. 世界华人消化杂志 2008; 16(23): 2599-2603
Revised: August 5, 2008
Accepted: August 10, 2008
Published online: August 18, 2008
AIM: To construct a recombinant adenovirus vector containing fusion suicide gene FCU1, and study the cytotoxic effect of prodrug 5-FC on colon cancer cells.
METHODS: Restriction fragment of FCU1 was inserted into pDC316 vector with EcoRⅠ and SalⅠ. Recombinant plasmid pDC316-FCU1 was confirmed by restriction enzyme digestion and sequencing. Thereafter, pDC316-FCU1 was cotransfected with adenovirus backbone pBHG into 293 cells to establish the recombinant adenovirus Ad5-FCU1 by homologous recombination. The cytotoxic effect of prodrug 5-FC on the infected HCT116 cells was determined with MTT assay.
RESULTS: Recombinant plasmid pDC316-FCU1was constructed successfully. After pDC316-FCU1 together with adenovirus backbone pBHG was cotransfected into 293 cells, significant virus plaques were observed, which showed the successful homologous recombination and virus packaging in 293 cells. The titer of the purified Ad-FCU1 was 2 × 1012 PFU/L. Nontoxic prodrug 5-FC has significant cytotoxic effect on HCT116 cells infected with pAd5-FCU1. The survival of HCT116/FCU1 cells was minimal, while that of the control cells was close to 90%, when 5-FC was used at 100 μmol/L.
CONCLUSION: Recombinant adenovirus Ad5-FCU1 containing fusion suicide gene FCU1 is established successfully, which has significant killing effect on colon cancer cells in vitro.
- Citation: Wu BW, Li YJ, Zhang KJ, Li DF, Zeng ZG, Zhang YH, Geng QS. Construction of FCU1 recombinant adenovirus vector and its killing effect on colon cancer cells. Shijie Huaren Xiaohua Zazhi 2008; 16(23): 2599-2603
- URL: https://www.wjgnet.com/1009-3079/full/v16/i23/2599.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i23.2599
自杀基因疗法是肿瘤基因治疗方法之一. 所谓自杀基因疗法就是将编码某一敏感因子的基因导入肿瘤细胞, 使该细胞对某种原本无毒或低毒的药物产生特异敏感性, 由此导致肿瘤细胞死亡. 这一表达敏感基因称为自杀基因(suicide gene)或药物敏感基因(drug sensitive gene). Huber和Russel称其为病毒介导酶解药物前体疗法(virus directed enzyme prodrug treatment, VDEPT)[1]. 常用的自杀基因系统有HSV-tk/GCV系统和CD/5-FC系统等.
自杀基因CD/5-FC系统中, CD基因编码胞嘧啶脱氨酶, 可将无毒性的5-氟胞嘧啶(5-FC)转化为高毒性的5-氟尿嘧啶(5-FU). 融合自杀基因 FCU1融合了酵母胞嘧啶脱氨酶基因(FCY1)和尿嘧啶磷酸核糖转移酶基因(FUR1), 后者可进一步将5-FU转化为5-氟尿嘧啶三磷酸盐(FUTP)和5-氟脱氧尿嘧啶单磷酸盐(FdUMP), FUPT掺入RNA(F-RNA), 抑制RNA的活性. FdUMP可抑制胸苷酸合成酶(thymidylate synthase, TS), 从而抑制DNA的合成. 而且该酶具有抑制DPD活性的作用, 减少5-FU的降解[2]. FCU1/5-FC系统较CD/5-FC系统具有更强的杀瘤作用, 尤其对于具有5-FU抗药性的肿瘤细胞.
本研究构建含高效融合自杀基因FCU1的腺病毒载体, 采用质粒共转染进行同源重组构建腺病毒载体, 含FCU1重组腺病毒感染结肠癌细胞HCT116, 观察前体药物5-FC对其杀伤作用, 为进一步研究提供实验依据.
质粒载体和细胞株: 细胞株HCT116购自中国医学科学院典型培养物上海细胞库. pCIneo-FCU1由法国斯特拉斯堡国家科学研究中心基因工程研究所Erbs教授惠赠. Admax腺病毒载体系统的穿梭质粒pDC316和骨架质粒pBHG为病毒基因工程国家重点实验室段招军博士提供. 主要试剂: RPMI 1640购自Gibco公司; 胎牛血清购自HyClone公司; 胰蛋白酶购自Ser-va公司. 限制性内切酶EcoRⅠ、SalⅠ、T4 DNA连接酶、DNA marker购自TaKaRa公司; 小量质粒DNA制备试剂盒Reverse Transcription System试剂盒购自Promega公司; DNA胶回收试剂盒购自上海Sangon公司; MTT、5-FC购自Sigma公司.
1.2.1 重组腺病毒载体pDC316-FCU1的构建: 设计扩增FCU1全基因的引物如下: 上游引物: 5'-CTGCgaattcATGGTGACAGGGGGAATGG-3'(EcoRⅠ), 下游引物: 5'-GCCAgtcgacTTAAAC ACAGTAGTATCTG-3'(SalⅠ). 上游引入EcoRⅠ位点, 下游引入SalⅠ位点, 以携带FCU1基因的质粒pCI-FCU1为模板, 用高保真Taq酶进行扩增, 回收PCR产物, 用EcoRⅠ+SalⅠ双酶切, 回收. EcoRⅠ+SalⅠ双酶切重组腺病毒载体穿梭质粒pDC316, 回收线性化的片段. 将上述两片段进行连接、转化、筛选, 得到重组质粒pDC316-FCU1. 重组质粒经EcoRⅠ+SalⅠ双酶切鉴定.
1.2.2 重组腺病毒的包装及扩增: 将293细胞接种于六孔板中, 每孔5×105个细胞, 置37℃含50 mL/L CO2的培养箱中培养. 待细胞生长至底面积的80%-90%时, 取骨架质粒pBHG和穿梭质粒pDC316-FCU1, 用Lipofectamine2000脂质体共转染HEK 293细胞. 待细胞病变脱落后, 收集细胞, 经液氮反复冻融3次后, 离心去除细胞碎片, 0.2 nm滤膜过滤, -70℃保存备用.
1.2.3 重组腺病毒滴度的测定: 采用TCID50法测定重组腺病毒滴度. 方法如下: 293细胞按1×104/孔接种于96孔板中, 接种24 h后将系列稀释的病毒液加入孔中, 每个稀释度接种10孔, 设置2孔为阴性对照. 37℃、50 mL/L CO2细胞培养箱培养10 d, 观察每个稀释度细胞病变效应(CPE)出现的百分率, 按照Admax操作手册中的公式: T = 101+d(s-0.5)计算病毒的滴度(d为稀释度的对数值, s为阳性比率之和), 计算出重组腺病毒的滴度(将TCID50/mL转换成PFU/mL: T = a×10bTCID50/mL = a×10b-0.7 PFU/mL).
1.2.4 重组腺病毒感染HCT116细胞及PCR鉴定: 将HCT116以104接种于24孔板, 12 h后给予50 MOI的AD-FCU1感染, 以RPMI 1640为对照, 1-2 h后吸去病毒液, 每孔加入2 mL培养液. 收集培养48 h的感染细胞, 抽提总DNA用于PCR检测. 上游引物: 5'-CTGCgaattcATGGTGACAGGGGGAATGG-3', 下游引物: 5'-GCCAgtcgac TTAAACACAGTAGTATCTG-3'. 使用Promega公司的Reverse Transcription System试剂盒, 按说明书操作.
1.2.5 5-FC对转染HCT116/FCU1的杀伤作用: 将HCT116以2×103接种于96孔板, 24 h后给予50 MOI的AD-FCU1感染, 以RPMI 1640为对照, 1-2 h后吸去病毒液, 每孔加入新鲜培养液. 48 h后分别加入不同浓度的5-FC, 分别为0, 0.01, 0.1, 1, 10, 100 μmol/L, 每组6孔重复. 培养6 d后用MTT法测定吸光度, 即每孔加MTT(5 g/L)20 μL,于37℃孵育4 h后, 加MTT溶解液二甲基亚砜DMSO 150 μL, 再于37℃孵育4 h, 选择490 nm波长, 酶标仪检测各孔吸光值. 以不加5-FC对照组吸光值为100%, 计算细胞存活率. 以存活率为纵坐标, 药物浓度的对数值为横坐标作图.
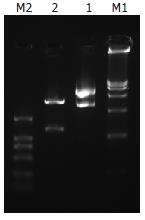
重组质粒pDC316-FCU1经EcoRⅠ+SalⅠ双酶切, 可得到一条1.3 kb左右大小的片段, 与预期相符, 酶切鉴定表明, 质粒构建正确. 测序鉴定, 与已发表的FCU1的序列完全相符(图1).
将质粒pDC316-FCU1与腺病毒骨架质粒pBHG共转染HEK 293细胞, 第8天, 细胞变大变圆, 呈葡萄状, 并开始出现明显噬斑等典型细胞病变(CPE)(图2). 第11天时, 细胞大部分病变并从底部脱落. 用TCID50法测定, 病毒滴度为2×109 PFU/mL.
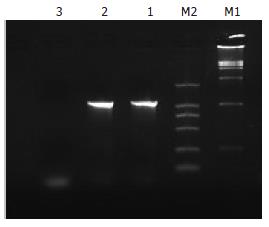
将HCT116以104接种于24孔板, 12 h后给予50 MOI的AD-FCU1感染, 以RPMI 1640为对照, 1-2 h后吸去病毒液, 每孔加入2 mL培养液. 收集培养48 h的感染细胞, 抽提总DNA用于PCR检测(图3), 感染细胞能够特异地扩增出1300 bp左右大小的条带, 与质粒扩增结果一致, 而对照组则为阴性.
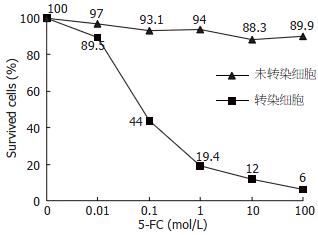
随着5-FC浓度的增加, HCT116/FCU1细胞的存活率明显下降, 当5-FC达100 μmol/L时, 存活的HCT116/FCU1细胞极少, 而对照组存活率接近90%(图4).
腺病毒载体法是基因治疗中最有前途的基因转移方法之一. 其生物学特性得到广泛研究. 腺病毒有一个中等大小的基因组(平均36 kb), 适合于容纳于大片段基因, 载体容易构建和操作. 腺病毒宿主范围广, 不仅能感染繁殖期的细胞, 而且能感染非分裂期的细胞, 故能达到很高的转染效率. 在腺病毒生活周期中, 其基因不整合到宿主细胞中, 因而遗传毒性低. AdMax包装系统通过Cre/loxP获得重组病毒, 这个过程发生在293细胞中, 从而避免在细菌中重组. 将克隆的外源基因的腺病毒穿梭质粒与携带了腺病毒大部分基因组的包装质粒共转染293细胞, 利用Cre/loxP系统的作用实现重组, 产生重组腺病毒. 这个系统有多种优势, 包括操作简便、重组效率高、获得的病毒产率高、目的基因的表达水平高等. 本研究构建了含融合自杀基因FCU1的重组质粒pDC316-FCU1, 采用AdMax系统成功包装和扩增了Ad5 FCU1重组腺病毒, 经纯化病毒滴度为2×109 PFU/mL, 并能有效感染结肠癌细胞HCT116.
结肠癌是常见的恶性肿瘤之一, 以40-50岁年龄组发病率最高. 据世界流行病学调查, 发现结肠癌在北美、西欧、澳大利亚、新西兰等地的发病率最高. 近年各地资料显示随着人民生活水平的提高, 饮食结构的改变, 我国发病率呈逐年上升趋势. 基因治疗是一种崭新的在分子水平治疗肿瘤的方法. 自杀基因疗法是将自杀基因导入肿瘤细胞内, 可将无毒的前体药物转化为杀瘤的药物, 许多自杀基因系统, 如HSV-tk/GCV[4-5]和CD/5-FC系统[6]等, 均显示了良好的杀瘤效应.
为了进一步提高自杀基因的疗效, 许多研究者采用联合基因治疗或融合基因治疗的方法, 取得了令人鼓舞的效果[7-9]. FCY1基因编码酵母的胞嘧啶脱氨酶基因, 可将5-FC转化为5-FU,研究表明, 用重组腺病毒将FCY1基因导入胃、肠、肝肿瘤细胞可以增加这些细胞对5-FU的敏感性, 并显示旁观者效应[10]. FUR1编码酵母尿嘧啶磷酸核糖转移酶, 可将5-FU进一步转化为毒性代谢产物5-氟尿嘧啶三磷酸盐和5-氟脱氧尿嘧啶单磷酸盐, 分别阻断细胞的RNA和DNA的合成, 直接发挥杀瘤效应. 有学者将FCY1和FUR1分别构建于独立的载体上联合应用于结肠癌、肺癌和脑肿瘤, 杀瘤效果和旁观者效应较单用显著增强[2,11].
Erbs et al[12]将FCY1和FUR1两种自杀基因的编码序列经过特定的酶切连接和定点缺失突变等过程融合, 构建了新型高效融合自杀基因FCU1. 研究表明, 融合自杀基因FCU1较单用FCY1, 或将FCY1和FUR1分别构建于独立的载体上联合应用均具有100倍的杀瘤作用. FCU1/5-FC系统对肝癌细胞显示较好的杀伤作用[13]. 本研究将该融合自杀基因经腺病毒载体导入结肠癌细胞, 给以无毒的前体药物5-FC, 显示了极强的杀伤作用.
自杀基因疗法是治疗肿瘤有着较为肯定疗效的方法, 采用融合基因或联合基因治疗可大大提高其疗效, 随着载体技术和靶向性的提高, 有望成为切实有效的临床治疗手段.
为了进一步提高自杀基因的疗效, 许多研究者采用联合基因治疗或融合基因治疗的方法, 取得了令人鼓舞的效果, 本研究采用重组腺病毒载体介导融合自杀基因FCU1, 对结肠癌细胞HCT116具有较强的体外杀伤效应.
黄颖秋, 教授, 本溪钢铁(集团)有限责任公司总医院消化内科
FCU1基因融合了酵母胞嘧啶脱氨酶基因(FCY1)和尿嘧啶磷酸核糖转移酶基因(FUR1), 前者可将无毒的5-FC转化为5-FU, 后者可将5-FU进一步转化, 直接抑制DNA的合成, 提高了杀伤作用, 同时避免了5-FU耐药. 重组腺病毒载体AdMax包装系统较最普及的AdEasy系统有多种优势, 他通过Cre/loxP获得重组病毒, 这个过程发生在293细胞中, 从而避免在细菌中重组, 在真核细胞内重组病毒, 保持了对腺病毒的生存压力, 有助于重组腺病毒基因组的完整性. 此外, 操作简便、重组效率高、获得的病毒产率高.
融合自杀基因FCU1较单用FCY1, 或将FCY1和FUR1分别构建于独立的载体上联合应用均具有100倍的杀瘤作用. FCU1/5-FC系统对肝癌细胞显示较好的杀伤作用.
本文首次报道应用融合自杀基因FCU1/5-FC系统杀伤结肠癌细胞的实验结果, 为进一步研究提供了实验依据.
自杀基因疗法是治疗肿瘤有着较为肯定疗效的方法, 采用融合基因或联合基因治疗可大大提高其疗效, 而且融合自杀基因FCU1克服了肿瘤细胞对5-FU耐药性, 有望成为切实有效的临床治疗手段.
本文选题较新, 研究方法科学, 对采用融合基因治疗结肠癌的临床研究提供了较充分的实验依据, 学术价值较好.
编辑: 李军亮 电编:何基才
| 1. | Huber BE, Richards CA, Krenitsky TA. Retroviral-mediated gene therapy for the treatment of hepatocellular carcinoma: an innovative approach for cancer therapy. Proc Natl Acad Sci U S A. 1991;88:8039-8043. [PubMed] [DOI] |
| 2. | Adachi Y, Tamiya T, Ichikawa T, Terada K, Ono Y, Matsumoto K, Furuta T, Hamada H, Ohmoto T. Experimental gene therapy for brain tumors using adenovirus-mediated transfer of cytosine deaminase gene and uracil phosphoribosyltransferase gene with 5-fluorocytosine. Hum Gene Ther. 2000;11:77-89. [PubMed] [DOI] |
| 3. | Ng P, Parks RJ, Cummings DT, Evelegh CM, Graham FL. An enhanced system for construction of adenoviral vectors by the two-plasmid rescue method. Hum Gene Ther. 2000;11:693-699. [PubMed] [DOI] |
| 4. | Määttä AM, Tenhunen A, Pasanen T, Meriläinen O, Pellinen R, Mäkinen K, Alhava E, Wahlfors J. Non-small cell lung cancer as a target disease for herpes simplex type 1 thymidine kinase-ganciclovir gene therapy. Int J Oncol. 2004;24:943-949. [PubMed] |
| 5. | Wang J, Lu XX, Chen DZ, Li SF, Zhang LS. Herpes simplex virus thymidine kinase and ganciclovir suicide gene therapy for human pancreatic cancer. World J Gastroenterol. 2004;10:400-403. [PubMed] |
| 6. | Rehemtulla A, Hamstra DA, Kievit E, Davis MA, Ng EY, Dornfeld K, Lawrence TS. Extracellular expression of cytosine deaminase results in increased 5-FU production for enhanced enzyme/prodrug therapy. Anticancer Res. 2004;24:1393-1399. [PubMed] |
| 7. | Ou-Yang F, Lan KL, Chen CT, Liu JC, Weng CL, Chou CK, Xie X, Hung JY, Wei Y, Hortobagyi GN. Endostatin-cytosine deaminase fusion protein suppresses tumor growth by targeting neovascular endothelial cells. Cancer Res. 2006;66:378-384. [PubMed] [DOI] |
| 8. | Chung-Faye GA, Chen MJ, Green NK, Burton A, Anderson D, Mautner V, Searle PF, Kerr DJ. In vivo gene therapy for colon cancer using adenovirus-mediated, transfer of the fusion gene cytosine deaminase and uracil phosphoribosyltransferase. Gene Ther. 2001;8:1547-1554. [PubMed] [DOI] |
| 9. | Boucher PD, Im MM, Freytag SO, Shewach DS. A novel mechanism of synergistic cytotoxicity with 5-fluorocytosine and ganciclovir in double suicide gene therapy. Cancer Res. 2006;66:3230-3237. [PubMed] [DOI] |
| 10. | Kanai F, Kawakami T, Hamada H, Sadata A, Yoshida Y, Tanaka T, Ohashi M, Tateishi K, Shiratori Y, Omata M. Adenovirus-mediated transduction of Escherichia coli uracil phosphoribosyltransferase gene sensitizes cancer cells to low concentrations of 5-fluorouracil. Cancer Res. 1998;58:1946-1951. [PubMed] |
| 11. | Koyama F, Sawada H, Hirao T, Fujii H, Hamada H, Nakano H. Combined suicide gene therapy for human colon cancer cells using adenovirus-mediated transfer of escherichia coli cytosine deaminase gene and Escherichia coli uracil phosphoribosyltransferase gene with 5-fluorocytosine. Cancer Gene Ther. 2000;7:1015-1022. [PubMed] [DOI] |
| 12. | Erbs P, Regulier E, Kintz J, Leroy P, Poitevin Y, Exinger F, Jund R, Mehtali M. In vivo cancer gene therapy by adenovirus-mediated transfer of a bifunctional yeast cytosine deaminase/uracil phosphoribosyltransferase fusion gene. Cancer Res. 2000;60:3813-3822. [PubMed] |