修回日期: 2008-07-10
接受日期: 2008-07-14
在线出版日期: 2008-08-18
目的: 探讨肝硬化肝性脑病脑水肿的发生机制, 为治疗脑水肿新方法的发现提供理论依据.
方法: 实验大鼠随机分为正常组(n = 10)、正常氨负荷组(n = 10)、肝硬化组(n = 20)和肝硬化氨负荷组(n = 20). 后2组给予400 g/L CCl4橄榄油, 按0.2 mL/kg腹腔注射, 2 次/wk, 共12 wk. 前两组给与橄榄油, 注射剂量、部位、频次、时间同后两组. 正常氨负荷组、肝硬化氨负荷组分别在最后1次给药2 d后, 给与乙酸胺盲肠注射. 4组大鼠通过尾静脉注射伊文思蓝(EB)应用干式生化法测量动脉血氨, 比色法测量EB含量, 干-湿重法测量脑含水量, 免疫组化法染色并通过图像分析系统分析脑组织中AQP4的表达.
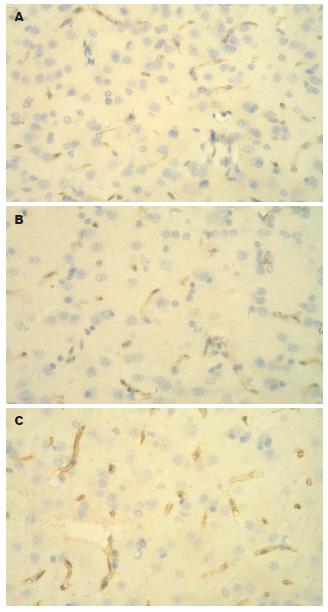
结果: 肝硬化组动脉血氨与正常组、正常氨负荷组比较有差异性(97.20±29.66 μmol/L vs 42.62±10.11, 59.33±15.06 μmol/L, 均P<0.05), 肝硬化氨负荷组的动脉血氨(420.18±75.91 μmol/L)与其他各组比较有明显的差异性(P<0.01). 肝硬化组EB和脑含水量与正常组、正常氨负荷组比较没有差异性, 而肝硬化氨负荷组与其他各组比较有差异性(1.96±0.55 μg/g vs 1.41±0.46, 1.19±0.38, 1.05±0.18 μg/g; 75.14±5.68 vs 65.58±4.14, 62.14±2.29, 66.27±4.57, 均P<0.05). 肝硬化大鼠AQP4表达部位与正常大鼠一致, 但肝硬化大鼠给与氨负荷后, 无论是平均吸光度还是显色阳性面积均较正常组增高(P<0.05).
结论: AQP4可能在肝硬化肝性脑病大鼠脑水肿形成中起一定的作用.
引文著录: 刘洪波, 王静艳. 肝硬化肝性脑病大鼠脑水通道蛋白-4的表达与脑水肿的关系. 世界华人消化杂志 2008; 16(23): 2592-2598
Revised: July 10, 2008
Accepted: July 14, 2008
Published online: August 18, 2008
AIM: To investigate the mechanism of brain edema in cirrhotic rats with hepatic encephalopathy, and to provide the theoretical basis for management of brain edema.
METHODS: Rats were divided into 4 groups randomly: normal group (n = 10), normal ammonia burden group (n = 10), cirrhosis group (n = 20), cirrhosis ammonia burden group (n = 20). After models were generated successfully, the arterial plasma ammonia was measured by dry biochemical method, and the evans blue (EB) content was examined by colorimetric method; the brain water content (BWC) was measured by means of dry-wet method and the aquaporin-4 (APQ-4) in the brain tissue was assessed by immunohistochemistry.
RESULTS: In comparison with that in the normal group and nomal ammonia burden group, the arterial plasma ammonia was significantly increased in the cirrhosis group and cirrhosis ammonia burden group (420.18 ± 75.91, 97.20 ± 29.66 μmol/L vs 42.62 ± 10.11, 59.33 ± 15.06 μmol/L; P < 0.05 or P < 0.01). The EB content (1.96 ± 0.55 μg/g) and brain water content (75.14 ± 5.68) in the cirrhosis ammonia burden group were higher than those in the nomal group, nomal ammonia burden group, and cirrhosis group (1.96 ± 0.55 μg/g vs 1.05 ± 0.18, 1.19 ± 0.38, 1.41 ± 0.46 μg/g; 75.14 ± 5.68 vs 62.14 ± 2.29, 66.27 ± 4.57 65.58 ± 4.14; all P < 0.05). The location of APQ-4 expression in cirrhotic rats was consistent with that in normal rats, but both the intensity and area of APQ-4 expression were increased as compared with those in normal controls (P < 0.05).
CONCLUSION: APQ-4 expression is up-regulated in cirrhotic rats with hepatic encephalopathy, suggesting that APQ-4 may play a role in the occurrence of hepatic encephalopathy.
- Citation: Liu HB, Wang JY. Relationship between aquaporin-4 expression and brain edema in cirrhotic rats with hepatic encephalopathy. Shijie Huaren Xiaohua Zazhi 2008; 16(23): 2592-2598
- URL: https://www.wjgnet.com/1009-3079/full/v16/i23/2592.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i23.2592
肝性脑病又称肝昏迷, 是各种严重肝病并发的、以代谢紊乱为基础、中枢神经系统功能失调为表现的常见并发症, 其主要表现是意识障碍、行为异常和昏迷. 肝性脑病的发病机制迄今未完全明了. 一般认为产生肝性脑病的病理生理基础是肝细胞功能衰竭和门腔静脉之间有手术造成的或自然形成的侧支分流, 从而导致主要来自肠道的许多毒性代谢产物-氨、芳香族氨基酸和一些假性神经递质, 未经肝脏解毒和清除, 经侧支循环直接进入体循环, 透过血脑屏障而至脑部, 引起大脑功能紊乱. 另外, 肝性脑病时常常出现脑水肿[1]. 最近有学者提出即使在肝硬化阶段也普遍存在脑水肿且发现脑水肿存在与肝性脑病密切相关[2-5]. Miese et al[6]对非酒精性肝硬化患者的研究中也观察到了类似结果.
本研究采用CCl4制备大鼠肝硬化动物模型, 探讨肝硬化大鼠在氨负荷前后脑组织含水量、BBB通透性和AQP4的变化情况, 从而探索肝硬化肝性脑病的发生机制.
健康♂SD大鼠60只, 体质量250-300 g, 由中国医科大学动物中心提供. 国药集团化学试剂有限公司生产的CCl4溶液, 甲酰胺溶液; 武汉博士德生物工程有限公司生产的AQP4试剂盒; 瑞士Fluka公司生产的伊文思蓝(EB).
1.2.1 分组及造模: SD大鼠60只随机分为4组: 正常组(n = 10)与剩余的50只大鼠一同饲养, 不加外界干预因素; 正常氨负荷对照组(n = 10)与其他50只大鼠一同饲养, 实验末给予氨负荷; 肝硬化组(n = 20)与其他40只大鼠一同饲养, 制备肝硬化模型, 不加外界干预因素; 肝硬化氨负荷组(n = 20)与其他40只大鼠一同饲养, 制备肝硬化模型, 实验末给予氨负荷.
肝硬化组和肝硬化氨负荷组大鼠共40只, 给予400 g/L CCl4橄榄油ip, 按0.2 mL/kg给药, 2 次/wk, 给药时间为12 wk; 另两组大鼠给予同等量的橄榄油ip, 2 次/wk, 时间为12 wk. 注射期间, 观察大鼠的毛色、精神状态、体质量. 肝硬化模型制备后, 应用角膜反射及翻转反射的存在与否判断是否伴有HE的发生[7].
1.2.2 氨负荷的方法及测定: CCl4 12 wk最后一次给药后2 d, 开腹后, 经盲肠给予乙酸氨(500 mg/kg, 用0.5 mL蒸馏水稀释); 正常组及肝硬化组经盲肠给予蒸馏水0.5 mL, 正常氨负荷组经盲肠给予乙酸氨, 用量同肝硬化氨负荷组. 制造模型结束后, 沿中线剪开腹腔, 暴露腹膜后的主动脉, 于肾动脉下方约1 cm处进行腹主动脉穿刺, 抽取2 mL动脉血肝素抗凝管密闭保存, 2 h内用上海强生950干化学分析仪, 干式生化法检测动脉血氨浓度.
1.2.3 血脑屏障通透性的检测: (1)建立标准曲线[8]: 取伊文思蓝(EB)10 mg溶于100 mL生理盐水中, 取出0.1 mL加入1.9 mL甲酰胺中, 混匀作为第1管, 从第1管中取0.1 mL加入1.9 mL甲酰胺中, 混匀作为第2管, 再从第2管中取1 mL加入1 mL甲酰胺中混匀作为第3管, 以此类推共做6管, 其浓度分别为5, 0.25, 0.125, 0.0625, 0.0313和0.0156 mg/L, 37℃避光水浴48 h, 于紫外分光光度仪上(波长632 nm)进行比色, 蒸馏水作空白对照, 制作出标准曲线. (2)血脑屏障(BBB)通透性的检测: 动物尾静脉注射2% EB(2 mg/kg)2 h后, 迅速断头(为清除血液中染料, 向左心室灌注生理盐水, 直至右心室流出透明液体为止). 取脑称质量, 加入3 mL甲酰胺, 37℃避光水浴48 h. 1500 r/min, 取上清于波长632 nm进行比色, 根据标准曲线计算出EB含量, 结果以EB含量/脑质量(μg/g)表示.
1.2.4 脑含水量的测定: 应用干-湿重的方法测定脑含水量[9]. 将脑组织用电子分析天平称湿质量后, 置入100℃恒温箱中, 24 h后取出称干质量. 以(湿质量-干质量)/湿质量×100%来计算脑含水量, 以此代表脑水肿程度.
1.2.5 大脑组织免疫组化及图像分析: 处死后取大脑组织, 4%甲醛溶液固定, 脑组织切片厚度5-7 μm, HE染色, 脑组织切片抗原修复后, 内源性过氧化物酶阻断, 链亲和素-酶复合物方法(SP法)免疫组织化学染色, 滴加第一抗体: APQ-4抗体(1:1500)后, 4℃孵育过夜, 24 h后, 再加入生物素标志第二抗体-链霉素抗生物素蛋白-过氧化物酶(SP)-酶底物显色剂(辣根过氧化物酶, DAB), 光镜下观察组织细胞呈棕色, 即终止反应并封片. 采用高清晰度彩色病理图文报告分析系统对免疫组化图像进行分析(光密度和显色阳性面积).
统计学处理 采用统计学分析: 血氨, EB值, 脑含水量, AQP-4表达阳性面积和平均光密度值等数据以mean±SD表示, 应用SPSS12软件进行方差分析, 方差不齐时用Tamhane's方法检测, 方差齐同时用Bonferroni方法检测. P值小于0.05认为差异有统计学意义.
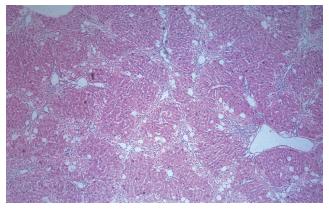
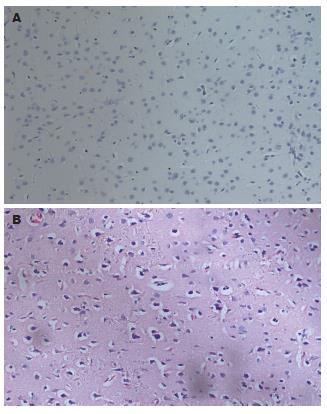
肝硬化组大鼠死亡5只(12 wk末在肝硬化组大鼠中随机处死2只, 以确定模型制备情况), 肝硬化氨负荷组大鼠死亡8只, 正常组及正常氨负荷组大鼠没有死亡. 活体观察: 肝硬化组及肝硬化氨负荷组大鼠毛色蓬乱、不光洁、进食减少; 其中仅肝硬化氨负荷组大鼠角膜反射与翻转反射消失, 证明出现肝性脑病. 正常组及正常氨负荷组大鼠没有上述改变. 病理: 肝硬化组及肝硬化氨负荷组大鼠肝叶体积缩小, 部分可见尾叶代偿性增大, 肝包膜起伏不平, 肝实质呈大小不等的结节样外观, 质地硬. HE染色: 小叶结构破坏, 中央静脉结构不清, 门汇管区扩大, 肝细胞排列紊乱, 肝窦间隙消失, 小叶内可见肝细胞变性坏死并伴有淋巴细胞浸润. 纤维组织增生有假小叶形成, 见部分胆小管扩张及淤胆改变(图1). 正常组及正常氨负荷组肝脏体积及肝叶形态比例正常, 颜色红润, 质地柔软, HE染色: 肝小叶分界清楚, 中央静脉与门汇管区结构关系正常, 辐射状排列的肝细胞索整齐, 肝窦间隙均一. 脑组织除肝硬化氨负荷组HE染色可见有细胞水肿, 部分血管外隙增大, 以大脑的皮层灰质区明显, 皮质下白质区及基底节区的改变不如上述区域, 其余组脑细胞间隙正常, 无细胞肿胀、细胞外隙和血管周围间隙改变(图2).
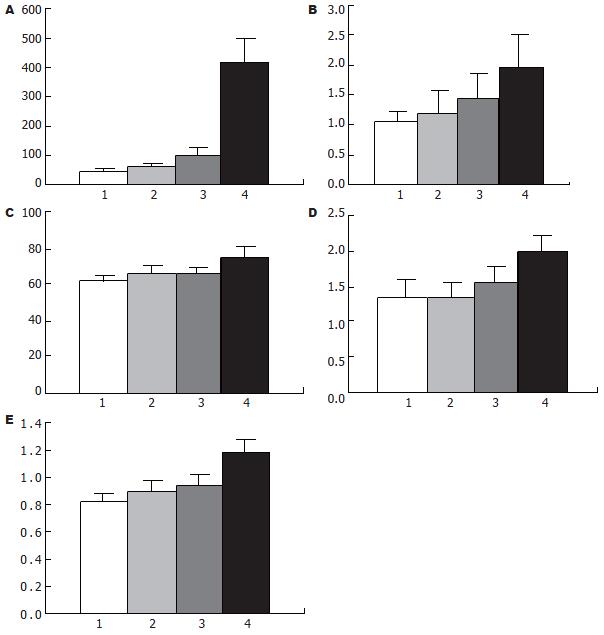
肝硬化大鼠在未给与氨负荷前就已经存在明显的血氨升高(97.20±29.66 μmol/L), 与正常组(42.62±10.11 μmol/L)大鼠及正常氨负荷组(59.33±15.06 μmol/L)大鼠比较均有显著差异(P<0.05); 给与氨负荷后(420.18±75.91 μmol/L)差异更加显著(P<0.01). 说明肝硬化大鼠体内存在氨代谢紊乱, 当给与氨负荷后, 这种紊乱表现更加显著(图3A).
肝硬化组大鼠EB含量(1.41±0.46 μg/g)、正常氨负荷组大鼠EB含量(1.19±0.38 μg/g)与正常组大鼠EB含量(1.05±0.18 μg/g)比较没有显著差异(P>0.05); 肝硬化氨负荷组大鼠EB含量(1.96±0.55 μg/g)与正常组大鼠EB含量比较有明显的差异性(P<0.05). 结果表明肝硬化肝性脑病时存在血脑屏障通透性的增高(图3B).
正常氨负荷组大鼠脑含水量(66.27±4.57)与正常组大鼠(62.14±2.29)比较没有差异性(P>0.05); 肝硬化组大鼠脑含水量(65.58±4.14)与正常组大鼠比较没有显著差异性(P>0.05); 肝硬化氨负荷组大鼠脑含水量(75.14±5.68)与肝硬化组大鼠比较有显著差异性(P<0.05). 结果表明肝硬化氨负荷组大鼠存在脑水肿, 高血氨可以引起肝硬化大鼠脑水肿的发生, 而肝硬化实验大鼠的脑水肿不明显(图3C).
肝性脑病是急性或慢性肝衰竭的主要并发症. 尽管经过几十年的临床和基础研究, 肝性脑病发病的确切机制仍然不十分明确. 尽管如此, 氨中毒学说仍被认为是肝性脑病最重要的发病机制. 本研究中分别给正常大鼠和肝硬化大鼠氨负荷观察血氨水平, 结果表明, 肝硬化组、肝硬化氨负荷组大鼠的血氨均明显高于正常组的血氨且肝硬化氨负荷组大鼠均出现肝性脑病, 提示肝硬化大鼠在未给氨之前, 就已经存在氨代谢紊乱. 氨负荷后, 这种紊乱更加加重, 引起脑功能障碍, 进一步证明了肝硬化时氨对中枢神经系统毒性作用的学说. 这种毒性作用的机制可能是: (1)氨在星形胶质细胞内, 通过谷氨酰胺合成酶合成谷氨酰胺. 谷氨酰胺是一种很强的细胞内渗透剂, 其增加导致星形细胞肿胀并最终导致脑水肿[10]. 影像学也提示谷氨酰胺增高与脑水肿一致. (2)肝衰竭时, 过高的血氨可能抑制丙酮酸脱氢酶和α-酮戊二酸脱氢酶, 干扰脑的能量代谢以致大脑不能维持正常的功能而出现神经精神症状[11]. (3)但也有学者提出是由于氨在星形胶质细胞内合成谷氨酰胺时消耗的底物没能及时补给所致[12]. 这都说明氨中毒在肝性脑病发生中的重要性.
本研究发现氨诱导的肝硬化肝性脑病大鼠均存在脑水肿. 脑水肿形成除与血氨升高有关外, 最近研究与BBB通透性增强也是相关的[8]. Mínguez et al[13]也发现, 血脑屏障通透性改变与肝性脑病时脑水肿的发生有关. BBB是由脑微血管内皮细胞及其形成的紧密连接、基膜和星形胶质细胞足板构成的复杂系统, 一方面是分隔血液与大脑的屏障, 阻止物质在两者间的通透, 另一方面又是营养成分、代谢产物以及多种化学信号分子等的进出通路, 从而构成一个扩散性屏障[14]. 肝硬化时, 正电子发射体层显像(positron emission tomography, PET)显示肝性脑病患者血氨水平增高, 血脑屏障对氨的通透表面积增大及大脑氨的代谢增高[15]. 本研究发现氨诱导的肝硬化肝性脑病大鼠存在BBB通透性增强. 这可能是由于星形胶质细胞的水肿, 引起BBB间紧密连接破坏所致.
本研究也发现肝硬化大鼠在给与氨负荷后, 脑组织内AQP4表达增加明显且脑含水量亦是增加的. 这进一步说明: 肝硬化肝性脑病时, 脑内水转运可能存在跨膜转运过程. 目前研究证实AQP4主要分布在脑组织的星形胶质细胞膜上, 尤以脑血管周围的星形胶质细胞膜、脑室脉络丛上皮细胞、室管膜细胞的膜上丰富[16-17], 还分布在渗透压感受的区域如视上核, 下丘脑也有分布[18]. Nielsen et al[19]研究了大鼠出生后发育过程中AQP4表达水平及细胞分布. 显示AQP4在出生后第1周含量低, 在第2周明显增加, 从生后7 d的2%增加到生后14 d的25%. 因此认为从生后第2周, AQP4就开始发挥生理作用. AQP4在脑组织中分布广泛、含量丰富, 提示AQP4具有功能的多样性. 他可能参与中枢渗透压的感受、脑脊液的分泌和重吸收、脑内水平衡的维持、血浆渗透压调节、垂体加压素的分泌等. Vizuete et al认为AQP4 mRNA表达水平调节与血脑屏障破坏, 胶质细胞肿胀有关. 在BBB中, 内皮细胞和胶质细胞都表达AQP4. AQP4表达水平改变使毛细血管内皮细胞及其周围的胶质细胞肿胀, 持续的肿胀将导致BBB结构破坏、通透性增加. 在脑缺血或创伤性损伤后AQP4表达增强与脑水肿的程度呈正比关系[16]. 以上结果说明AQP4在脑水肿的发生和发展中发挥了重要作用, 其表达水平的变化导致细胞膜通透性改变及水的重新分布, 从而改变脑内水平衡状态. 另外, Rama Rao et al[20]发现在用氨培养的星形细胞中, AQP4表达增加出现在培养的10 h后, 星形细胞水肿的2 h前. 说明AQP4表达的增加与星形细胞水肿有着因果关系. 这可能是由于氨通过氧化应激[21]和改变线粒体通透性[22]使APQ4表达增加而导致的星形细胞水肿. 并且, 这一过程可分别被抗氧化剂[23]和线粒体通透性改变的抑制剂[24]阻断. 本实验发现肝硬化肝性脑病脑水肿时, AQP4表达是增高的. 推测AQP4可能通过一系列作用改变BBB的通透性, 改变脑内水平衡状态, 引起脑水肿发生. Papadopoulos et al[25]发现脑内恶性肿瘤周围AQP4表达上调与细胞外容积减小密切相关, 并因此限制了来源于肿瘤血管床的细胞外液向正常脑实质渗漏. 这提示AQP4表达上调是机体对脑水肿的适应性改变. 但是Manley et al[26]对剔除AQP4基因后大鼠水中毒和脑缺血模型进行观察, 发现AQP4基因敲除的大鼠存活率明显高于野生型大鼠, 而且脑水含量和星形胶质细胞周围毛细血管水肿减轻. 最近, Papadopoulos et al[27]又在肺炎球菌脑膜炎模型中发现AQP4敲除的大鼠脑水肿及死亡率明显低于野生型大鼠. 说明不同原因所致的脑水肿, 其中AQP4所起的作用不尽相同.
肝性脑病的发病机制是复杂的. 本研究提示高血氨可使肝硬化肝性脑病大鼠脑水肿加重, 肝硬化肝性脑病时BBB通透性增强. 肝硬化肝性脑病与脑水肿密切相关且这时AQP4表达是增加的. AQP4在肝硬化肝性脑病大鼠脑组织中表达增加, 其确切的作用还有待进一步研究. 通过肝硬化肝性脑病发生机制的研究, 可为肝性脑病的治疗新方法的发现提供理论依据.
肝性脑病又称肝昏迷, 是各种严重肝病并发的、以代谢紊乱为基础、中枢神经系统功能失调为表现的常见并发症, 其主要表现是意识障碍、行为异常和昏迷. 肝性脑病的发病机制迄今未完全明了. 本研究采用CCl4制备大鼠肝硬化动物模型, 探讨肝硬化大鼠在氨负荷前后脑组织含水量、BBB通透性和AQP4的变化情况, 从而探索肝硬化肝性脑病的发生机制.
陈国凤, 主任医师, 中国人民解放军第302医院感染七科; 丁惠国, 主任医师, 首都医科大学附属北京佑安医院肝病消化科
肝性脑病是急性或慢性肝衰竭的主要并发症. 尽管经过几十年的临床和基础研究, 肝性脑病发病的确切机制仍然不十分明确.
最近, Papadopoulos et al又在肺炎球菌脑膜炎模型中发现AQP4敲除的大鼠脑水肿及死亡率明显低于野生型大鼠. 说明不同原因所致的脑水肿, 其中AQP4所起的作用不尽相同.
通过肝硬化肝性脑病发生机制的研究, 可为肝性脑病的治疗新方法的发现提供理论依据.
本文研究肝硬化大鼠脑水肿的因素及其机制, 对进一步认识肝性脑病的病理生理有一定的意义, 具有较好的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Detry O, De Roover A, Honore P, Meurisse M. Brain edema and intracranial hypertension in fulminant hepatic failure: pathophysiology and management. World J Gastroenterol. 2006;12:7405-7412. [PubMed] |
| 2. | Balata S, Olde Damink SW, Ferguson K, Marshall I, Hayes PC, Deutz NE, Williams R, Wardlaw J, Jalan R. Induced hyperammonemia alters neuropsychology, brain MR spectroscopy and magnetization transfer in cirrhosis. Hepatology. 2003;37:931-939. [PubMed] [DOI] |
| 3. | Córdoba J, Alonso J, Rovira A, Jacas C, Sanpedro F, Castells L, Vargas V, Margarit C, Kulisewsky J, Esteban R. The development of low-grade cerebral edema in cirrhosis is supported by the evolution of (1)H-magnetic resonance abnormalities after liver transplantation. J Hepatol. 2001;35:598-604. [PubMed] [DOI] |
| 4. | Rovira A, Córdoba J, Sanpedro F, Grivé E, Rovira-Gols A, Alonso J. Normalization of T2 signal abnormalities in hemispheric white matter with liver transplant. Neurology. 2002;59:335-341. [PubMed] |
| 5. | Rovira A, Grivé E, Pedraza S, Rovira A, Alonso J. Magnetization transfer ratio values and proton MR spectroscopy of normal-appearing cerebral white matter in patients with liver cirrhosis. AJNR Am J Neuroradiol. 2001;22:1137-1142. [PubMed] |
| 6. | Miese F, Kircheis G, Wittsack HJ, Wenserski F, Hemker J, M汁dder U, Häussinger D, Cohnen M. 1H-MR spectroscopy, magnetization transfer, and diffusion-weighted imaging in alcoholic and nonalcoholic patients with cirrhosis with hepatic encephalopathy. AJNR Am J Neuroradiol. 2006;27:1019-1026. [PubMed] |
| 7. | Bergqvist PB, Carpenedo R, Apelqvist G, Moroni F, Bengtsson F. Plasma and brain levels of oxindole in experimental chronic hepatic encephalopathy: effects of systemic ammonium acetate and L-tryptophan. Pharmacol Toxicol. 1999;85:138-143. [PubMed] |
| 9. | Stover JF, Beyer TF, Unterberg AW. Riluzole reduces brain swelling and contusion volume in rats following controlled cortical impact injury. J Neurotrauma. 2000;17:1171-1178. [PubMed] |
| 10. | Wright G, Jalan R. Management of hepatic encephalopathy in patients with cirrhosis. Best Pract Res Clin Gastroenterol. 2007;21:95-110. [PubMed] [DOI] |
| 11. | Ott P, Clemmesen O, Larsen FS. Cerebral metabolic disturbances in the brain during acute liver failure: from hyperammonemia to energy failure and proteolysis. Neurochem Int. 2005;47:13-18. [PubMed] [DOI] |
| 12. | Zwingmann C. The anaplerotic flux and ammonia detoxification in hepatic encephalopathy. Metab Brain Dis. 2007;22:235-249. [PubMed] [DOI] |
| 13. | Mínguez B, Rovira A, Alonso J, Córdoba J. Decrease in the volume of white matter lesions with improvement of hepatic encephalopathy. AJNR Am J Neuroradiol. 2007;28:1499-1500. [PubMed] [DOI] |
| 14. | Ballabh P, Braun A, Nedergaard M. The blood-brain barrier: an overview: structure, regulation, and clinical implications. Neurobiol Dis. 2004;16:1-13. [PubMed] [DOI] |
| 15. | Keiding S, Sørensen M, Bender D, Munk OL, Ott P, Vilstrup H. Brain metabolism of 13N-ammonia during acute hepatic encephalopathy in cirrhosis measured by positron emission tomography. Hepatology. 2006;43:42-50. [PubMed] [DOI] |
| 16. | Badaut J, Lasbennes F, Magistretti PJ, Regli L. Aquaporins in brain: distribution, physiology, and pathophysiology. J Cereb Blood Flow Metab. 2002;22:367-378. [PubMed] [DOI] |
| 17. | Rash JE, Yasumura T, Hudson CS, Agre P, Nielsen S. Direct immunogold labeling of aquaporin-4 in square arrays of astrocyte and ependymocyte plasma membranes in rat brain and spinal cord. Proc Natl Acad Sci U S A. 1998;95:11981-11986. [PubMed] [DOI] |
| 18. | Lee MD, King LS, Agre P. The aquaporin family of water channel proteins in clinical medicine. Medicine (Baltimore). 1997;76:141-156. [PubMed] [DOI] |
| 19. | Nielsen S, King LS, Christensen BM, Agre P. Aquaporins in complex tissues. II. Subcellular distribution in respiratory and glandular tissues of rat. Am J Physiol. 1997;273:C1549-C1561. [PubMed] |
| 20. | Rama Rao KV, Norenberg MD. Aquaporin-4 in hepatic encephalopathy. Metab Brain Dis. 2007;22:265-275. [PubMed] [DOI] |
| 21. | Arima H, Yamamoto N, Sobue K, Umenishi F, Tada T, Katsuya H, Asai K. Hyperosmolar mannitol simulates expression of aquaporins 4 and 9 through a p38 mitogen-activated protein kinase-dependent pathway in rat astrocytes. J Biol Chem. 2003;278:44525-44534. [PubMed] [DOI] |
| 22. | Bai G, Rama Rao KV, Murthy CR, Panickar KS, Jayakumar AR, Norenberg MD. Ammonia induces the mitochondrial permeability transition in primary cultures of rat astrocytes. J Neurosci Res. 2001;66:981-991. [PubMed] [DOI] |
| 23. | Jayakumar AR, Panickar KS, Murthy ChR, Norenberg MD. Oxidative stress and mitogen-activated protein kinase phosphorylation mediate ammonia-induced cell swelling and glutamate uptake inhibition in cultured astrocytes. J Neurosci. 2006;26:4774-4784. [PubMed] [DOI] |
| 24. | Rama Rao KV, Chen M, Simard JM, Norenberg MD. Suppression of ammonia-induced astrocyte swelling by cyclosporin A. J Neurosci Res. 2003;74:891-897. [PubMed] [DOI] |
| 25. | Papadopoulos MC, Saadoun S, Binder DK, Manley GT, Krishna S, Verkman AS. Molecular mechanisms of brain tumor edema. Neuroscience. 2004;129:1011-1020. [PubMed] [DOI] |
| 26. | Manley GT, Fujimura M, Ma T, Noshita N, Filiz F, Bollen AW, Chan P, Verkman AS. Aquaporin-4 deletion in mice reduces brain edema after acute water intoxication and ischemic stroke. Nat Med. 2000;6:159-163. [PubMed] [DOI] |
| 27. | Papadopoulos MC, Verkman AS. Aquaporin-4 gene disruption in mice reduces brain swelling and mortality in pneumococcal meningitis. J Biol Chem. 2005;280:13906-13912. [PubMed] [DOI] |