修回日期: 2008-07-16
接受日期: 2008-07-21
在线出版日期: 2008-08-18
目的: 观察光照应激状态下SD大鼠胃内促性腺素释放素(GnRH)的表达变化.
方法: 建立SD大鼠光照应激模型, 24 h持续光照, 分别取光照1 d, 2 d, 3 d, 4 d, 1 wk, 2 wk, 3 wk, 4 wk和相应对照组的胃组织, 采用免疫组化和Real-time PCR法检测GnRH在各时间段大鼠胃组织中的定位和蛋白及mRNA表达变化.
结果: GnRH阳性细胞广泛分布于大鼠胃壁上皮细胞, 免疫反应阳性细胞在实验组和对照组中定位没有差异. 实验组的GnRH平均灰度值高于其相应的对照组, 光照2-4 wk时, 实验组与对照组相比差异均显著(2 wk: 105.7±7.9 vs 77.4±7.2, P<0.05; 3 wk: 97.4±7.7 vs 77.6±6.6, P<0.05; 4 wk: 93.2±2.1 vs 77.9±4.0, P<0.05). 实验组大鼠胃的GnRH mRNA水平高于对照组, 与对照组相比, 持续光照2-4 wk时, 实验组大鼠胃的GnRH mRNA增加具有显著性差异(2 wk: 1.01±0.10 vs 0.80±0.01, P<0.05; 3 wk: 0.95±0.07 vs 0.81±0.01, P<0.05; 4 wk: 0.94±0.05 vs 0.82±0.01, P<0.05).
结论: 光照应激可以影响消化道中GnRH的表达, GnRH以自分泌和旁分泌的机制对消化系统产生调节作用. 提示GnRH除参与消化道正常生理功能外, 可能还是一种参与应激反应的激素.
引文著录: 黄祝, 恽时锋, 卢坤刚, 韩雪峰, 张艳梅, 蒋超, 姚兵. 光照应激对SD大鼠胃GnRH表达的影响. 世界华人消化杂志 2008; 16(23): 2576-2580
Revised: July 16, 2008
Accepted: July 21, 2008
Published online: August 18, 2008
AIM: To observe the expression changes of gonadotropin-releasing hormone (GnRH) in the stomach of Sprague-Dawley (SD) rats exposed to light stress.
METHODS: SD rats were exposed to continuous light to establish illumination-stressed models. Then, gastric tissues were taken from the rats exposed to continuous light for 1 d, 2 d, 3 d, 4 d, 1 wk, 2 wk, 3 wk, 4 wk and their corresponding controls, respectively. The localization and expression of GnRH protein and GnRH mRNA were detected by immunohistochemistry and real-time polymerase chain reaction (PCR), respectively.
RESULTS: Immunoreactivity was displayed mostly in the parietal cells of rat stomachs, and there were no differences in this locolization between the illumination stress groups and their corresponding control groups. Compared with that in the control group, the mean gray scale of GnRH in the rats exposed to continuous illumination was increased from 2 wk to 4 wk (2 wk: 105.7 ± 7.9 vs 77.4 ± 7.2, P < 0.05; 3 wk: 97.4 ± 7.7 vs 77.6 ± 6.6, P < 0.05; 4 wk: 93.2 ± 2.1 vs 77.9 ± 4.0, P < 0.05). The quantity of GnRH mRNA in the rats exposed to continuous illumination was also higher than that in the controls (2 wk: 1.01 ± 0.10 vs 0.80 ± 0.01, P < 0.05; 3 wk: 0.95 ± 0.07 vs 0.81 ± 0.01, P < 0.05; 4 wk: 0.94 ± 0.05 vs 0.82 ± 0.01, P < 0.05).
CONCLUSION: The expression of GnRH in digestive tract can be effected by illumination stress. GnRH may regulate digestive function by autocrine and paracrine, suggesting that GnRH may be a kind of hormone not only responded to normal physiological function of digestive tract but also responded to stress activity.
- Citation: Huang Z, Yun SF, Lu KG, Han XF, Zhang YM, Jiang C, Yao B. Effect of illumination stress on the expression of gonadotropin-releasing hormone in stomach of SD rats. Shijie Huaren Xiaohua Zazhi 2008; 16(23): 2576-2580
- URL: https://www.wjgnet.com/1009-3079/full/v16/i23/2576.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i23.2576
不同的应激条件(如光照、温度等)可以通过GnRH神经元的调节机制引起GnRH分泌的变化[1-3], 并且长时间处于这些应激状态下, 会引起消化系统功能紊乱等症状[4]. 已有研究表明, 胃黏膜壁细胞、胃平滑肌细胞, 胃壁细胞上有GnRH免疫反应阳性上皮细胞, 并表达GnRH mRNA[5]. 但在应激状态下, 消化系统中的GnRH定位和表达是否有变化尚未有报道. 为此, 本实验通过建立持续光照应激大鼠模型, 利用免疫组化和Real-time PCR方法观察持续光照应激下大鼠胃GnRH定位和蛋白及mRNA表达变化, 分析GnRH是否参与消化系统对应激的反应.
清洁级SD♂大鼠80只, 体质量190-210 g. 动物饲料和垫料(中国人民解放军南京军区南京总医院动物比较医学科购买). 兔抗大鼠GnRH抗体(武汉博士德公司), 羊抗兔IgG-HRP(北京博奥森公司), DAB显色液(福建迈新公司), TRIzol RNA提取液(invitrogen), Omniscript RT kit反转录试剂盒(Qingen), SYBR Green I(invitrogen), 胶回收试剂盒(杭州博日生物科技公司), 100 bp DNA ladder(GenScript).
1.2.1 造模: 随机选取40只SD大鼠持续光照(40 W日光灯), 可自由饮食. 光照应激时间分为1 d、2 d、3 d、4 d、1 wk、2 wk、3 wk和4 wk 8个时间段, 每个时间段有5只SD大鼠, 温度为22±2℃. 同时设立相同数量的正常昼夜节律的SD大鼠(光照时间:黑暗时间 = 12 h:12 h)为对照组. 对照组室温、光的强度与实验组相同. 实验操作严格按照南京军区南京总院实验动物伦理委员会的要求进行.
1.2.2 动物取材: 光照应激组、对照组在相应时间段按10 mg/100 g体质量盐酸氯胺酮麻醉后, 心脏取血处死. 取胃组织放入预冷的0.01 mol/L PBS(pH7.4)中冲洗干净. 取部分组织投入Bouin's液中固定24 h, 用于免疫组化分析, 部分组织放入液氮内用于Real-time PCR分析.
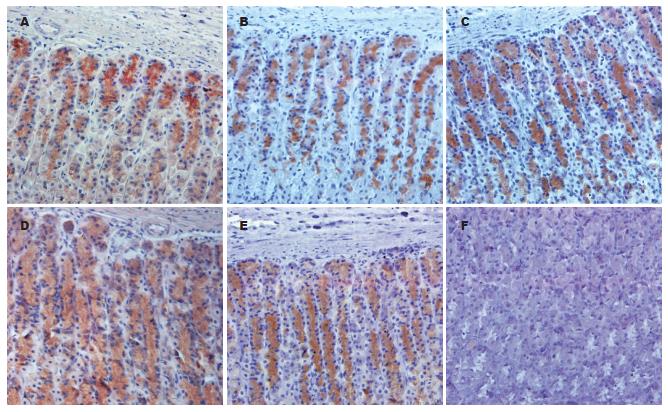
1.2.3 免疫组化: 石蜡切片经脱蜡水化之后, 高温高压进行抗原修复, 然后浸入3%过氧化氢/甲醇温育30 min, 以除去内源性过氧化物酶. 浸蒸馏水5 min后入0.01 mol/L PBS(pH7.4)漂洗5 min, 共3次. 加入兔抗大鼠GnRH抗体(1:200稀释), 4℃孵育过夜. 次日经0.01 mol/L PBS(pH7.4)漂洗5 min, 共3次. 加入羊抗兔IgG-HRP(1:200稀释), 室温温育1 h, 0.01 mol/L PBS(pH7.4)漂洗5 min, 共3次. 滴加DAB显色液显色2 min, 蒸馏水充分漂洗, 苏木素复染10 s, 常规脱水, 二甲苯透明, 中性树胶封片, 显微镜下观察拍照. 用0.01 mol/L PBS(pH7.4)取代第一抗体做阴性对照. 用Image-Pro plus 6.0图像分析系统对光照不同时间胃的GnRH的含量进行半定量分析. 测定阳性细胞的平均灰度, 每个光照时间段分别选4个标本, 计算其均值. 灰度值低, 说明透光度低, 即免疫染色阳性强度高. 计算出每个单位面积的GnRH免疫反应产物的相对含量.
1.2.4 总RNA的提取和反转录: 将胃从液氮中取出, 研磨成粉末, 按照TRIzol试剂盒抽提总mRNA, 使用Omniscript RT kit反转录试剂盒按照操作说明进行反转录反应, 总体积20 μL, 反应体系如下: 总RNA50 ng-2 μg至nuclease-free的小管中, 加DEPC-H2O至12 μL. 65℃ 5 min后, 置于冰上至少1 min. 在各小管中加入10×第一链合成缓冲液2 μL, dNTP混合物(10 mmol/L)1 μL, RNase抑制剂(10 kU/L)1 μL, Omniscript Reverse Transcriptase(200 kU/L)1.0 μL, 反转录引物(10 µmol/L)2 μL, 37℃ 1 h后, 93℃ 5 min中止反应. -20℃保存待用.
1.2.5 引物设计: 在GenBank上查找大鼠GnRH和内参GAPDH的mRNA序列, 取其保守区, 使用primier 5.0设计引物, 由上海英骏生物技术有限公司合成, GnRH: 上游引物5'-CTGGCCCCGTTCACCTCTTA-3', 下游引物5'-AGAAATGCGGAAGCCCACAC-3'; GAPDH: 上游引物5'-ATCACTGCCACTCAGAAG-3', 下游引物5'-AAGTCACAGGAGACAACC-3'. 扩增片段分别为182 bp和317 bp.
1.2.6 标准曲线的制作: 将PCR产物割胶回收, 定量, 按以下浓度稀释: 1×1010、1×109、1×108、1×107、1×106 copies/L, 进行荧光定量PCR, 制作标准曲线. 反应体系为: 10×Buffer 2.5 μL、dNTP(10 mmol/L)0.5 μL、MgCl2(25 mmol/L)2.5 μL、上游引物(10 μmol/L)1 μL、下游引物(10 μmol/L)1 μL、SYBR Green I 1 μL、Taq DNA polymerase(5 kU/L)0.15 μL、cDNA 1 μL加无核酶水至25 μL. 反应条件为: 94℃预变性5 min; 94℃ 30 s , 55℃ 30 s, 72℃ 40 s , 35个循环; 72℃ 7 min.
1.2.7 GnRH: mRNA的荧光定量PCR检测: 取样本cDNA按照以上条件混合, 同上条件进行PCR扩增, 同时作标准曲线, 将目的基因的CT值(Threshold cycle)与标准曲线的CT值相比较作为目的基因mRNA的相对含量. 每个样本重复3次, 以平均值表示最后结果.
统计学处理 全部数据用SPSS11.0统计软件计算, 所有数据用mean±SD表示, 并进行独立样本t检验, 以P<0.05为差异显著.
标本免疫组织化学染色特异性良好, 胃GnRH阳性细胞呈棕色, 背底不着色, 易于识别. GnRH阳性细胞在大鼠胃壁上皮细胞分布较广泛, 定位于胞膜和胞质中, 胞核呈阴性. 阴性对照大鼠胃细胞均呈阴性反应(图1). 用Image-Pro Plus 6.0图像分析结果发现, 实验组的GnRH平均灰度值高于其相应的对照组, 持续光照2 wk后, GnRH的平均灰度值达到最高, 与相应对照组相比, 光照2-4 wk后, 实验组的GnRH平均灰度值显著性增高(105.7±7.9 vs 77.4±7.2, 97.4±7.7 vs 77.6±6.6, 93.2±2.1 vs 77.9±4.0, P<0.05, 表1).
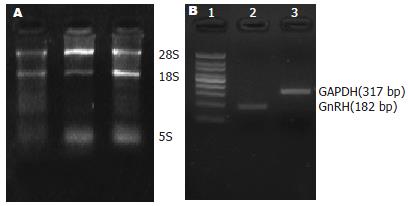
2.2.1 大鼠胃总RNA的提取: 20 g/L的琼脂糖凝胶电泳, 可见28S、18S和5S三条rRNA条带, 提示RNA完整(图2A). 经紫外分光光度计检测, A260/A280为1.8-2.0.
2.2.2 引物特异性鉴定: 以cDNA为模板扩增, 可见182 bp和317 bp(图2B), 未见非特异性条带出现, 说明引物特异性高.
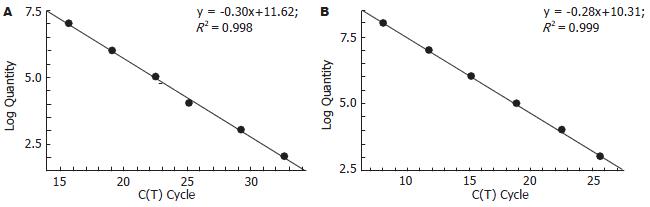
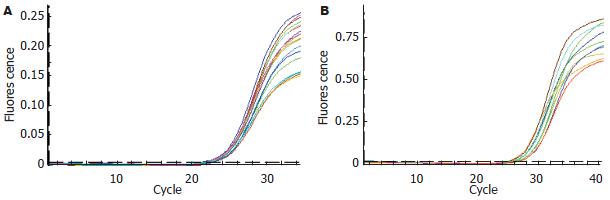
2.2.3 标准曲线和荧光定量结果: 将割胶回收的PCR产物按一定浓度稀释后作为模板, 进行荧光定量PCR扩增, 所得的标准曲线线性关系良好, 两个基因标准曲线的R2值均超过0.99(图3). 将所有样本cDNA进行荧光定量PCR扩增, CT值均在准确的定量范围以内, 因此扩增结果可靠(图4).
根据标准曲线计算GnRH mRNA的相对含量, 并进行统计学分析. 结果发现: 实验组大鼠胃的GnRH mRNA比值高于对照组, 持续光照2 wk后, GnRH mRNA比值达到最高, 与对照组相比, 持续光照2-4 wk时, 差异具有显著性(1.01±0.10 vs 0.80±0.01, 0.95±0.07 vs 0.81±0.01, 0.94±0.05 vs 0.82±0.01, P<0.05, 表2).
促性腺激素释放激素(gonadotropin releasing hormone, GnRH), 是一种由脑组织分泌以调控生殖系统功能的信号分子, 刺激垂体细胞分泌黄体生成激素(luteining hormone, LH)和卵泡刺激激素(follicle stimulating hormone, FSH). 姚兵 et al[6-7]通过原位杂交等方法, 在消化系统(如, 颌下腺、胃和肠等)可检测到较强的GnRH和GnRH受体mRNA杂交信号, 由此认为GnRH也是一种胃肠激素, 他可由消化系统产生并作用于消化道黏膜上皮、腺上皮细胞, 参与胃肠功能的调节.
光照周期对动物的内分泌系统影响较大. 光信号通过视网膜下丘脑神经束经交感神经传到松果体, 在此光信号转换成褪黑素. 褪黑素具有昼低夜高的分泌规律, 光周期是调节褪黑素昼夜节律的重要外环境因素. 褪黑素可作用于下丘脑-垂体-性腺轴, 也能直接对性腺产生抑制性作用, 改变GnRH的脉冲频率[8-9]. 光照周期越长, 褪黑素分泌越低, 对GnRH的抑制作用越弱, 从而引起GnRH分泌的变化. 连续的光照对内分泌系统特别是垂体-性腺轴产生重要改变. 褪黑素分泌减少与生殖能力增加的现象在生活于北半球的妇女中已经发现[10]. El Qandil et al[11]利用短日照研究生活在沙漠中飞鼠GnRH的表达水平时发现, 光照时间缩短, 可以抑制脑垂体正中核GnRH的释放. 并且长期处于光照时间, 导致胃肠道内一些淀粉酶的活性减弱, 影响胃肠道的动力而导致消化功能发生紊乱[12].
我们实验结果发现, 光照应激导致GnRH的蛋白和mRNA表达水平升高, 持续光照2 wk时, 胃的GnRH的表达水平达到最高, 并且mRNA水平也达到最高. 持续光照3-4 wk时, GnRH的蛋白和mRNA表达水平有所降低, 说明机体可能通过"内稳态机制的调节", 改变GnRH的脉冲频率. 推测消化道通过自分泌(或/和旁分泌)的方式产生GnRH, GnRH参与了胃肠道内淀粉酶等活性的改变影响胃肠道的动力, 从而参与了胃对光照应激的生理调节过程. 因此, 我们认为GnRH除参与消化道正常生理功能外, 可能还是一种参与应激反应的激素.
GnRH是一种由脑组织分泌以调控生殖系统功能的信号分子. 有报道发现, 在消化系统(如, 颌下腺、胃和肠等)可检测到较强的GnRH和GnRH受体mRNA杂交信号, 由此认为GnRH也是一种胃肠激素. 他可由消化系统产生并作用于消化道黏膜上皮、腺上皮细胞, 参与胃肠功能的调节. 但在应激状态下, 消化系统中的GnRH定位和表达是否有变化尚未见相关报道.
周国雄, 主任医师, 南通大学附属医院消化内科
GnRH已经在消化系统中发现, 认为他不仅是一种生殖激素还是一种消化激素. 因此寻求他在消化系统中的作用和作用机制成为目前的研究热点.
刘晓宁研究胃腔内GnRH类似物对大鼠消化道胃泌素免疫阳性细胞及血液、胃液中胃泌素含量的影响, 认为外分泌的GnRH对大鼠消化道中胃泌素的合成与分泌均起显著的促进作用. Svechkina et al发现长期处于光照状态, 不论年轻的还是老年大鼠, 他们的胰腺和淀粉酶活性都降低影响胃肠道的动力而导致消化功能发生紊乱.
利用光照应激造成消化功能的紊乱, 探讨在此状态下, 胃内的GnRH定位和表达是否改变, 以及通过什么途径发生改变, 尚未相关报道.
本研究为GnRH在消化系统中的作用及其作用机制提供研究依据.
1 促性腺激素释放激素(GnRH), 他的主要作用是刺激卵泡刺激素(FSH) 和黄体生成素(LH)的生成, 从而调控性腺内配子形成和激素功能. 在更进一步的研究中,发现GnRH 不但存在于下丘脑中,而且存在于其他脑组织或非脑组织,他不但在不同脊椎动物中结构可变,而且每一种动物体中还会有二种或二种以上形式的GnRH ,他的功能也有多种.
2 应激: 指机体在受到各种内外环境因素刺激时所出现的非特异性全身反应. 而刺激因素被称为应激原.
本研究实验设计合理, 技术路线正确, 方法先进, 图表清晰, 论文结构严谨, 层次分明, 结论明确, 具有一定的理论价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Rodríguez L, Begtashi I, Zanuy S, Carrillo M. Long-term exposure to continuous light inhibits precocity in European male sea bass (Dicentrarchus labrax, L.): hormonal aspects. Gen Comp Endocrinol. 2005;140:116-125. [PubMed] [DOI] |
| 2. | Lincoln GA. Changes in pituitary responsiveness to luteinizing hormone releasing hormone in rams exposed to artificial photoperiods. J Endocrinol. 1977;73:519-527. [PubMed] |
| 3. | Mintz EM, Lavenburg KR, Blank JL. Short photoperiod and testosterone-induced modification of GnRH release from the hypothalamus of Peromyscus maniculatus. Brain Res. 2007;1180:20-28. [PubMed] [DOI] |
| 4. | Vinogradova IA. [Effect of different light regimens on the development of metabolic syndrome of aging rats]. Adv Gerontol. 2007;20:70-75. [PubMed] |
| 5. | Chen L, He HX, Sun XD, Zhao J, Liu LH, Huang WQ, Zhang RQ. Expression of gonadotropin-releasing hormone receptor and effect of gonadotropin-releasing hormone analogue on proliferation of cultured gastric smooth muscle cells of rats. World J Gastroenterol. 2004;10:1780-1784. [PubMed] |
| 6. | Yao B, Huang W, Huang Y, Chui Y, Wang Y, Li H, Pu R, Wan L, Zhang R. A study on the localization and distribution of GnRH and its receptor in rat submaxillary glands by immunohistochemical, in situ hybridization and RT-PCR. Life Sci. 2003;72:2895-2904. [PubMed] [DOI] |
| 7. | Huang W, Yao B, Sun L, Pu R, Wang L, Zhang R. Immunohistochemical and in situ hybridization studies of gonadotropin releasing hormone (GnRH) and its receptor in rat digestive tract. Life Sci. 2001;68:1727-1734. [PubMed] [DOI] |
| 8. | Reiter RJ. Pineal gland interface between the photoperiodic environment and the endocrine system. Trends Endocrinol Metab. 1991;2:13-19. [PubMed] [DOI] |
| 9. | Bayarri MJ, Rodríguez L, Zanuy S, Madrid JA, Sánchez-Vázquez FJ, Kagawa H, Okuzawa K, Carrillo M. Effect of photoperiod manipulation on the daily rhythms of melatonin and reproductive hormones in caged European sea bass (Dicentrarchus labrax). Gen Comp Endocrinol. 2004;136:72-81. [PubMed] [DOI] |
| 10. | Boczek-Leszczyk E, Juszczak M. [The influence of melatonin on human reproduction]. Pol Merkur Lekarski. 2007;23:128-130. [PubMed] |
| 11. | El Qandil S, Chakir J, El Moussaouiti R, Oukouchoud R, Rami N, Benjelloun WA, Lakhdar-Ghazal N. Role of the pineal gland and melatonin in the photoperiodic control of hypothalamic gonadotropin-releasing hormone in the male jerboa (Jaculus orientalis), a desert rodent. Brain Res Bull. 2005;64:371-380. [PubMed] [DOI] |
| 12. | Svechkina EB, Tiutiunnik NN, Vinogradova IA. [Influence of light regimens, melatonin, and epitalon on amylase activity in the pancreas and small intestine in rats of different age]. Adv Gerontol. 2006;19:66-71. [PubMed] |