修回日期: 2008-06-24
接受日期: 2008-06-30
在线出版日期: 2008-08-08
目的: 对Wistar大鼠肝脏及脉管进行系统的解剖学观测, 并建立肝部分切除术的实验模型.
方法: 对40只大鼠原位观测、肝叶切除和离体观测, 明确大鼠肝脏位置、分叶、脉管系统以及比邻的特征; 54只大鼠按照切除体积的不同, 随机分为9组, 应用无血切肝技术, 实施大鼠原位肝部分切除术, 观察术后肝叶和大鼠生存情况.
结果: 各肝叶形态、比例较为恒定, 均有相对独立的Glisson系统和肝静脉回流系统, 易于结扎肝蒂行肝叶切除. 按照不同的肝叶组合, 成功实施了切除比例为10%-90%肝部分切除术.
结论: 以肝叶4分法为基础的肝脏应用解剖和无血切肝技术的应用是实施大鼠不同切除比例的肝部分切除术的关键.
引文著录: 史冀华, 朱盛兴, 张水军. 大鼠肝部分切除术的应用解剖及实施. 世界华人消化杂志 2008; 16(22): 2516-2520
Revised: June 24, 2008
Accepted: June 30, 2008
Published online: August 8, 2008
AIM: To observe the anatomy of liver and its accessory ducts in Wistar rats, and to establish an experimental model of partial hepatectomy.
METHODS: Through in vivo and in vitro specimens and observation after hepatic lobectomy, we clarified the hepatic location, lobes, accessory ducts and their neighborhood characters of 40 rats. Another 54 rats were classified into 9 groups depending on the amount to be resected. Then partial hepatectomy was conducted using bloodless liver resection and the remnant lobes and the survival of rats were observed.
RESULTS: The shape and weight ratio of each lobe kept relatively constant. Each lobe had independent Glisson system and hepatic vein system, so hepatic lobectomy could be performed easily after ligation of pedicles. The partial hepatectomy with different sizes from 10% to 90% were performed successfully according to different combinations of hepatic lobes.
CONCLUSION: Applied anatomy based on the four divisions of liver and employment of bloodless hepatectomy are the keys to perform partial hepatectomy.
- Citation: Shi JH, Zhu SX, Zhang SJ. Applied anatomy of liver and partial hepatectomy in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(22): 2516-2520
- URL: https://www.wjgnet.com/1009-3079/full/v16/i22/2516.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i22.2516
大鼠肝部分切除术模型是Higgins和Anderson et al[1]首先创建, 主要应用于肝脏肿瘤、急慢性肝衰、肝脏再生和肝脏移植等模型的研究. 随着临床减体积肝移植等新技术的实施和发展, 对大鼠肝部分切除术模型的制作也提出了新的要求. 然而关于大鼠肝脏解剖系统研究报道很少, 现有的文献中关于大鼠肝脏的解剖学描述简短、混乱[2-5]. 本实验在Gershbein et al[4]和吕毅 et al[5]研究基础上, 对94只成年Wistar大鼠肝脏进行系统的解剖学观测并实施肝部分切除术, 为大鼠肝部分切除术为基础的研究提供解剖基础和实验依据.
健康成年Wistar大鼠94只, 雌雄不拘, 10-12 wk龄, 体质量180-230 g, 由河南省实验动物中心提供, 排除器官左右易位者. 器械主要有SXP-1手术显微镜, 显微外科手术器械, 托盘式扭力天平(TN-100B), 自制电热烧灼器和自制鼠台. 所有操作均在清洁的环境下实施.
所有大鼠术前禁食12 h、禁水4 h. 40 g/L水合氯醛麻醉后固定于鼠板. 腹部正中切口脱毛, 30 g/L碘伏消毒. 参照Kamada et al[6]方法, 游离肝脏周围的韧带, 显露大鼠肝脏, 游离第一肝门中肝动脉、门静脉和胆道.
1.2.1 原位观测和肝叶切除: 对30只大鼠肝脏行解剖学观察, 测量肝脏附属管道的长度和内径进行测量. 参照Higgins和Anderson et al[1]大鼠肝部分切除术, 在本研究观测的肝脏解剖的基础上, 实施规则的原位肝叶切除. 用棉签拨起肝脏, 显露各叶肝蒂. 按照Kubota et al方法改进, 采用无血切肝术即先使用7-0丝线集束结扎各肝叶Glisson系统, 3-0丝线结扎含肝叶静脉的肝蒂后切断肝叶[7-9]. 沿逆时针方向依次切除乳头叶、左外叶、左内叶、中叶、三角叶和右外叶, 测量各叶肝脏湿重和比重. 注意结扎、切除时左外叶和左内叶应远离第二肝门, 以免影响其他肝叶静脉回流; 结扎、切除肝中叶、右外叶和三角叶时应距离下腔静脉(PVC)3 mm, 3-0丝线缝扎肝组织断面.
1.2.2 离体观测: 10只大鼠, 使用Kamada et al[6]方法沿经肠系膜总静脉(CMV)使用0-4℃肝素生理盐水10 mL(含肝素500 IU)原位灌注肝脏后, 取下肝脏, 保持其完整性. 沿腹侧切开PVC, 观察第二肝门; 切断各叶肝蒂, 分别称质量.
1.2.3 大鼠原位肝部分切除术: 54只大鼠按照切除肝脏部位和剩余肝脏体积的不同, 随机分为9组: 乳头叶切除组(C组), 肝左叶(含左外叶和左内叶)切除组(L组), 肝中叶切除组(M组), 肝右叶(右外叶和三角叶)切除组(R组), 乳头叶和肝左叶切除组(50%组), 左外叶和肝中叶切除组(40%组), 肝左叶和肝中叶切除组(30%组), 乳头叶、肝左叶和肝中叶切除组(20%组), 肝左叶、肝中叶和肝右叶切除组(10%组). 每组6只, 均采用上述无血切肝术依次切除上述各肝叶, 保留第一肝门Glisson系统和肝上、下下腔静脉. 3-0丝线连续缝合腹部切口, 术后观察大鼠生存情况, 予保暖、50 g/L葡萄糖饮饲. 术后1 d后再次手术, CMV插管、使用0-4℃肝素生理盐水10 mL(含肝素500 IU)原位灌注剩余肝叶, 观察肝叶灌注情况.
统计学处理 记录各组大鼠的体质量、肝质量和各肝叶的质量以及各组肝部分切除术的手术成功率和1 d生存率, 结果用mean±SD表示.
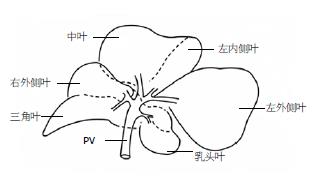
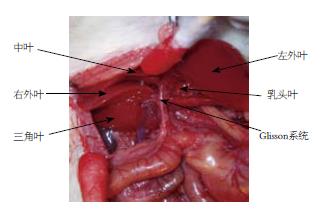
2.1.1 肝脏分叶及形态: 大鼠肝脏分为6叶, 以肝门为中心逆时针依次为乳头叶(2叶)、左外叶、左内叶、中叶、右外叶和三角叶. 各叶均具一肝蒂, 为Glisson系统和肝静脉系统出入. 乳头叶离开肝门分为腹、背两个叶片, 相互交错、重叠; 中叶与左内叶在镰状韧带附着处通过间质组织(interstitial tissue)和血管相连; 右外叶与三角叶环形包裹PVC并沿PVC相互移行, 在PVC左侧与乳头叶相连; 三角叶呈狭长三棱锥形, "锥尖"指向外侧, 锥底紧贴PVC. 除三角叶外, 其余各肝叶为薄片样结构, 其中央钝厚, 外缘薄锐, 分隔脏两面, 隔面稍凸, 脏面微凹, 缘呈圆弧状. 原位观测和离体观测的40份肝脏及各肝叶质量资料见表1.
| 全肝 | 肝乳头叶 | 肝左叶 | 肝中叶 | 肝右叶 | |||
| 乳头叶 | 左外叶 | 左内叶 | 中叶 | 右外叶 | 三角叶 | ||
| 质量(g) | 7.45±0.69 | 0.59±0.13 | 2.24±0.49 | 0.77±0.13 | 2.07±0.22 | 1.14±0.21 | 0.58±0.16 |
| 百分比(%) | 100 | 7.9 | 30.1 | 10.3 | 27.8 | 15.3 | 7.8 |
2.1.2 位置及毗邻: 大鼠肝脏位于横膈以后、腹腔头侧. 两片乳头叶嵌于胃小弯, 其周缘从背腹两面夹胃小弯. 左外叶左缘和食道相邻, 中叶和左内叶又将几乎全部右外叶和左外叶的1/2遮盖, 肝下缘和十二指肠、空肠、横结肠、胰腺组织相邻. 三角叶与右肾、右肾上腺相毗邻.
2.1.3 肝脏的韧带: 镰状韧带: 起于中叶与左内叶交界处头侧1/2, 矢向止于隔肌; 冠状韧带: 起于左外叶、左内叶、中叶、右外叶的脏隔面交界线, 冠状位止于膈弯; 肝食管韧带: 起于左外叶, 止于食道, 内有血管交通支; 肝胃韧带: 起于第一肝门, 包裹乳头叶, 止于胃小弯; 肝十二指肠韧带: 起于第一肝门, 止于十二指肠, 内有肝动脉、门静脉和胆道, 门静脉位于背侧, 其腹侧偏左为肝动脉、紧贴门静脉, 偏右为胆道; 肝肾韧带: 起于三角叶, 止于右肾前极, 右肾上腺静脉包埋于此韧带中; 肝后腔韧带: 起于三角叶、右外叶, 背侧止于肝后膈肌、肾上腺.
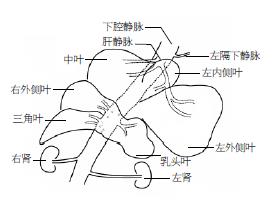
2.1.4 肝脏脉管系统: 大鼠肝脏脉管系统主要包括Glisson系统和肝静脉. 肝动脉: 肝总动脉起自腹腔干动脉, 向右头侧走行, 继之转向腹侧, 位于肝十二指肠韧带内门静脉及胆管左侧, 发出胰十二指肠动脉和胃右动脉后, 即延续为肝固有动脉, 直达肝门, 分左、右、头三支入肝实质. 门静脉: 由肠系膜总静脉和脾静脉汇合而成, 位于肝十二指肠韧带右侧缘背方, 沿途收纳幽门静脉回流. 胆道: 大鼠无胆囊, 各肝胆管直接汇合成胆总管, 在肝十二指肠韧带内, 位于PV腹侧及肝动脉右侧, 尾段被弥散的胰腺组织包绕, 在十二指肠左背侧进入肠腔. PVC: 肝上PVC较粗短. 肝背PVC被肝中叶、左内叶及右外叶、三角叶的肝组织包绕, 出三角叶后即延续为肝下PVC.
第一肝门为Glisson系统入肝处, 在肝外易游离各管道. 肝动脉、门静脉和胆道及其分支全程相伴, 在肝内三者走行基本一致. Glisson系统在肝门分为三支, 分别走向左、右、头方. 左支进入两片乳头叶, 右支入右外叶前分支至三角叶. 头支较粗, 分二支, 分别入中叶和左外叶、左内叶.
肝静脉系统与Glisson系统在肝内空间上交叉分布, 出各叶肝实质时, 与各叶Glisson系统距离甚近, 近向背侧分别开口于PVC. 乳头二叶静脉汇合后形成共干、肝组织包裹形成肝蒂, 开口于PVC左侧壁; 右外叶、三角叶除各有2-3支较大的静脉开口于PVC右侧壁外, 另有数支微小肝静脉直接沿PVC背侧弥散汇入. 左外叶二支静脉与左内叶静脉汇合后形成肝左静脉, 中叶内含肝中静脉(镰状韧带附着处右侧约3 mm肝实质内)和肝右静脉. 大鼠第二肝门为肝背段PVC腹侧壁前部分, 是肝左静脉、肝中静脉和肝右静脉开口进入PVC处(图1-3).
在肝脏观测和肝叶切除的基础上实施原位肝部分切除术, 切除肝脏比例为10%-90%, 手术成功率100%, 术中无因结扎线脱落致门静脉、肝动脉或下腔静脉大出血、胆瘘等. 50%组、40%组、30%组、20%组和10%组大鼠术后均出现精神萎靡不振、嗜睡状态, 6-12 h后恢复自由饮水、活动; 10%组大鼠1 d生存率均为83%(5/6), 其余8组大鼠1 d生存率均为100%. 肝素生理盐水原位灌注后剩余肝叶皆变淡白色, 无血管扭曲或局段血栓栓塞形成, 切除各叶断面无渗漏(表2).
| 分组 | 切除肝叶 | 剩余肝叶 | 保留肝脏(%) |
| C组 | C | L, M, R | 90 |
| L组 | L | C, M, R | 60 |
| M组 | M | C, L, R | 70 |
| R组 | R | C, L, M | 80 |
| 50%组 | C, R | M, R | 50 |
| 40%组 | LL, M | C, LC, R | 40 |
| 30%组 | L, M | C, R | 30 |
| 20%组 | C, L, M | R | 20 |
| 10%组 | L, M, R | C | 10 |
根据原位、离体标本的观察研究以及原位肝叶切除术的实施情况, 本研究对大鼠肝叶和Glisson系统, 特别对下腔静脉和肝静脉进行了系统解剖; 较Madrahimov et al[3]更系统的揭示了大鼠下腔静脉和肝静脉与肝脏的解剖比邻情况. 该结果为按照不同比例切肝、研究部分肝切除后再生规律和减体积肝移植移植物的选取等提供了理想的实验模型. 在吕毅 et al[5]肝脏分为6叶的基础上, 按照大鼠肝脏Glisson系统和肝静脉系统的特征, 将肝脏分为4个解剖功能单位: 乳头叶、肝左叶(包括左外叶和左内叶)、肝中叶和肝右叶(包括右外叶和三角叶). 并按照以上分叶方法, 使用不同的组合构成不同的肝切除比例, 规范了肝叶切除程序.
在熟悉肝脏解剖的基础上, 成功实施了大鼠肝脏各叶切除术以及切除比例为10%-90%肝部分切除术, 术后短期生存率优于同类研究报道[10-13]. 总结其操作要点有: (1)熟悉大鼠肝叶解剖特征. 本研究表明肝脏按各肝叶重量百分比计, 从大到小依次为左外叶、中叶、右外叶、左内叶、三角叶和乳头叶, 各肝叶形态、比例较为恒定, 这与吕毅 et al[5]、Palmes et al[10]研究结果基本一致. 肝脏各叶有相对独立的Glisson系统和肝静脉回流系统[14], 易于绕线以阻断血流, 或结扎肝蒂行肝叶切除. 肝乳头叶、左外叶单独切除较容易. 左内叶与中叶头侧部分相连不易独立切除某一叶, 但使用无血切肝术、3-0丝线连续缝合断面, 左内叶与中叶也可分离. 肝右外叶和三角叶包绕下腔静脉, 且有较多微小静脉直接开口下腔静脉, 不易彻底切除. (2)注意肝叶周围组织及其游离. 肝镰状韧带是分隔肝中叶和左内叶的表面标志, 他将中叶和左内叶矢状位固定于横隔, 只有切断此韧带, 向尾端轻拨中叶和左内叶, 方能暴露和游离肝上PVC. 冠状韧带将除三角叶和乳头叶外的其他肝叶冠状位固定于横隔, 切断此韧带, 可游离左内叶、左外叶、中叶和右外叶. 肝胃韧带背腹两层内夹两片乳头叶, 游离乳头叶必须切开肝胃韧带. 肝十二指肠韧带内含构成Glisson系统的三条管道, 将胃及肠管拨向左、尾方才直接暴露此韧带, 游离门静脉. 肝肾韧带内有右肾前腺静脉, 切断时需结扎此静脉或烧灼确切. 固定三角叶除肝肾韧带外, 还有肝后腔韧带. 肝食道韧带中有细血管交通支, 切断前应先予结扎或烧灼. 肝叶间韧带将左外叶和乳头叶维系在一起, 游离左外叶和乳头叶前应先剪开此韧带. (3)以显微外科技术为基础的无血切肝技术, 已使大鼠的各个肝叶切除术以及各种体积的切除术成为可能[10]. 但应避免肝脏出血、胆漏或血管扭曲. 在确认切除的肝组织后, 沿门静脉分支确认切除肝叶的Glisson系统. 先使用7-0丝线紧贴肝组织集束结扎各肝叶Glisson系统, 3-0丝线结扎含肝叶静脉的肝蒂后切断肝叶. 各肝叶均有独立的管道系统出入肝蒂, 行肝蒂阻断或切除的操作并不复杂. 需要指出, 左外叶、左内叶脉管紧邻、空间位置关系密切, 行一叶肝蒂结扎时, 极易影响另一肝叶蒂的血供. 在国内外的研究报道[5-6,15]倾向于将左内叶与肝中叶视为同一解剖单位观点的基础上, 本研究从二叶脉管关系和肝叶切除的实际考虑出发, 将左外叶和左内叶合并为同一解剖单位-肝左叶. 同样, 肝右外叶和三角叶位置紧邻、与下腔静脉的解剖紧密, 将肝右外叶和三角叶归为肝右叶.
总之, 本研究在对大鼠肝脏系统解剖的基础上, 按照大鼠肝脏Glisson系统和肝静脉系统的特征, 将肝脏分为乳头叶、肝左叶、肝中叶和肝右叶4个解剖功能单位; 应用无血切肝技术, 成功实施了大鼠10%-90%的肝部分切除术. 大鼠术后短期存活好, 剩余肝脏保留了胆总管、肝动脉、门静脉主干和下腔静脉的结构, 为袖套法减体积肝移植的实施奠定了基础. 以此为基础, 肝脏再生, 急性肝脏衰竭以及减体积肝移植模型的建立及其机制有待于进一步探讨.
大鼠肝部分切除术模型主要应用于肝脏肿瘤、急慢性肝衰、肝脏再生和肝脏移植等模型的研究. 随着临床减体积肝移植等新技术的实施和发展, 对大鼠肝部分切除术模型的制作也提出了新的要求.
邱伟华, 副主任医师, 上海交通大学医学院附属瑞金医院普外科
近年来肝移植近期效果的提高以及减体积肝移植、背驮式肝移植等新的外科技术的发展, 极大推动了肝脏基础研究, 也对新的实验模型的建立以及相关的大鼠肝脏解剖的研究提出了新的要求.
本研究对大鼠肝脏及脉管进行系统的解剖学观测, 并建立肝部分切除术的实验模型, 发现各肝叶形态、比例较为恒定, 均有相对独立的Glisson系统和肝静脉回流系统, 易于结扎肝蒂行肝叶切除; 并按照不同的肝叶组合, 成功实施了切除比例为10%-90%肝部分切除术.
本文证实以肝叶4分法为基础的肝脏应用解剖和无血切肝技术的应用是实施大鼠不同切除比例的肝部分切除术的关键.
本研究内容详细具体, 研究方法先进, 紧密结合目前动物实验中的核心问题, 具有重要的现实意义.
编辑: 李军亮 电编:何基才
| 1. | Higgins GM, Anderson RM. Experimental pathology of the liver. 1. Restoration of liver of white rat following surgical removal. Arch Pathol Lab Med. 1931;12:186-202. |
| 2. | Martins PN, Neuhaus P. Surgical anatomy of the liver, hepatic vasculature and bile ducts in the rat. Liver Int. 2007;27:384-392. [PubMed] [DOI] |
| 3. | Madrahimov N, Dirsch O, Broelsch C, Dahmen U. Marginal hepatectomy in the rat: from anatomy to surgery. Ann Surg. 2006;244:89-98. [PubMed] [DOI] |
| 4. | Gershbein LL, Elias H. Observations on the anatomy of the rat liver. Anat Rec. 1954;120:85-98. [PubMed] [DOI] |
| 5. | 吕 毅, 潘 承恩, 孟 令忠, 刘 学民. SD大鼠肝脏及附属管道的应用解剖. 西安医科大学学报(中文版). 1998;19:70-73. |
| 6. | Kamada N, Calne RY. A surgical experience with five hundred thirty liver transplants in the rat. Surgery. 1983;93:64-69. [PubMed] |
| 7. | Kubota T, Tanabe K, Yang M, Sekido H, Endo I, Ichikawa Y, Togo S, Shimada H. Minimum sizes for remnant and transplanted livers in rats. J Hep Bil Pancr Surg. 1997;4:398-404. [DOI] |
| 8. | Tanaka H, Hashizume K, Enosawa S, Suzuki S. Successful transplantation of a 20% partial liver graft in rats: a technical innovation. J Surg Res. 2003;110:409-412. [PubMed] [DOI] |
| 9. | Rodríguez G, Lorente L, Durán HJ, Aller MA, Arias J. A 70% hepatectomy in the rat using a microsurgical technique. Int Surg. 1999;84:135-138. [PubMed] |
| 10. | Palmes D, Spiegel HU. Animal models of liver regeneration. Biomaterials. 2004;25:1601-1611. [PubMed] [DOI] |
| 11. | Panis Y, McMullan DM, Emond JC. Progressive necrosis after hepatectomy and the pathophysiology of liver failure after massive resection. Surgery. 1997;121:142-149. [PubMed] [DOI] |
| 12. | Gaub J, Iversen J. Rat liver regeneration after 90% partial hepatectomy. Hepatology. 1984;4:902-904. [PubMed] |
| 13. | Kim WH, Lee JH, Han SU, Jin YM, Kwak YS, Wang HJ, Kim MW. Systematic analysis of the effects of hepatocyte transplantation on rats with acute liver failure. Hepatogastroenterology. 2000;47:371-374. [PubMed] |
| 14. | Kogure K, Ishizaki M, Nemoto M, Kuwano H, Makuuchi M. A comparative study of the anatomy of rat and human livers. J Hep Bil Pancr Surg. 1999;6:171-175. [PubMed] [DOI] |