修回日期: 2008-06-27
接受日期: 2008-07-07
在线出版日期: 2008-08-08
目的: 观察不同条件下骨髓间充质干细胞(MSCs)体外诱导分化为类肝细胞的差异.
方法: Wistar大鼠24只随机均分为3组, 分别为正常对照组、肝纤维化模型组、自拟中药干预组. 采用CCl4乳剂皮下注射建立肝纤维化模型. 造模成功后中药干预组采用丹金舒肝胶囊药液灌胃治疗. 治疗结束后剖杀大鼠, 留取大鼠肝脏标本, HE染色观察各组病理改变. 采用密度梯度离心法和贴壁法分离各组大鼠的MSCs, 经培养传代获得纯化的MSCs. 各组纯化的MSCs采用HGF、FGF-4进行诱导培养. 留取15、21、27 d细胞培养液进行白蛋白(Alb)、甲胎蛋白(AFP)检测; 于27 d收集细胞爬片, 进行糖原染色和CK-18免疫细胞化学染色.
结果: 3组15、21和27 d各MSCs诱导组AFP水平均高于MSCs非诱导组(P<0.01), 其中21 d AFP水平最高(肝纤维化模型组: 48.94±0.08 vs 9.90±0.09; 中药干预组: 49.86±0.29 vs 8.69±0.62; 正常对照组: 38.65±0.33 vs 9.04±0.11, 均P<0.01); 3组15 d各MSCs诱导组与MSCs非诱导组白蛋白水平无统计学意义; 21 d、27 d各MSCs诱导组白蛋白水平均高于MSCs非诱导组(1.11±0.08 vs 0.32±0.00, 1.25±0.04 vs 0.32±0.00, 1.06±0.03 vs 0.33±0.00; 1.52±0.02 vs 0.33±0.00, 1.79±0.01 vs 0.31±0.03, 1.63±0.04 vs 0.32±0.01, 均P<0.01), 27 d最高. 27 d各MSCs诱导组糖原染色阳性, 免疫细胞化学染色CK-18均阳性, 而MSCs非诱导组糖原染色、CK-18均阴性.从AFP、Alb水平综合比较, 3组诱导效果发现自拟中药干预组优于其他2组.
结论: HGF、FGF-4可在体外诱导实验性大鼠的MSCs分化为具有肝细胞样细胞表型和功能的类肝细胞; 自体MSCs可以作为治疗临床重症肝病的一种细胞来源, 而临床联合中药复方治疗可能会使MSCs体外诱导的效果更为理想.
引文著录: 何文艳, 刘树贤, 姜慧卿. 大鼠骨髓间充质干细胞向类肝细胞体外诱导分化. 世界华人消化杂志 2008; 16(22): 2464-2469
Revised: June 27, 2008
Accepted: July 7, 2008
Published online: August 8, 2008
AIM: To investigate differentiation of rat bone marrow mesenchymal stem cells (MSCs) into hepatocyte-like cells.
METHODS: A total of 24 Wistar rats were randomly divided into 3 groups: normal group, hepatic fibrosis model group and Chinese medicine treatment group. The model of liver fibrosis was induced by subcutaneous injection of CCl4. After the model was successfully developed, and the rats in Chinese medicine treatment group were fed with Danjin Shugan capsule. At the end of treatment, the rats were killed and the livers were obtained. Histopathological changes were evaluated by hematoxylin and eosin staining. MSCs were isolated by gradient density centrifugation and plastic adherence and then purified. The purified MSCs in each group were cultured with hepatocyte growth factor (HGF) and fibroblast growth factor-4 (FGF-4). The levels of alpha-fetoprotein (AFP) and albumin (Alb) in the supernatant were determined by radioimmunoassay on days 15, 21 and 27. On day 27, the cells were collected for glycogen staining and CK-18 immunocytochemical analysis.
RESULTS: Compared with those in the non-induced MSCs among the three groups, the levels of AFP in the induced-MSCs were higher on days 15, 21, and 27, and reached to the peak value on day 21 (hepatic fibrosis model group: 48.94 ± 0.08 vs 9.90 ± 0.09; Chinese medicine treatment group: 49.86 ± 0.29 vs 8.69 ± 0.62; normal group: 38.65 ± 0.33 vs 9.04 ± 0.11; all P< 0.01). There were significant differences in Alb levels on days 21 and 27 between the induced and non-induced MSCs (1.11 ± 0.08 vs 0.32 ± 0.00, 1.25 ± 0.04 vs 0.32 ± 0.00, 1.06 ± 0.03 vs 0.33 ± 0.00; 1.52 ± 0.02 vs 0.33 ± 0.00, 1.79 ± 0.01 vs 0.31 ± 0.03, 1.63 ± 0.04 vs 0.32 ± 0.01; all P < 0.01), but not on day 15; the peak level of Alb was on day 27. Both glycogen and CK-18 were positive on day 27 in the induced MSCs. According to AFP and Alb levels, the induced effects of Chinese medicine group were superior to those of the other two groups.
CONCLUSION: MSCs can differentiate into hepatocyte-like cells with hepatic phenotype and function in the presence of HGF and FGF-4, which may be used as a kind of cell resources to treat severe hepatic disease. Chinese medicine may optimize the induction of MSCs differentiation in vitro.
- Citation: He WY, Liu SX, Jiang HQ. Rat bone marrow mesenchymal stem cells differentiate into hepatocyte-like cells in vitro. Shijie Huaren Xiaohua Zazhi 2008; 16(22): 2464-2469
- URL: https://www.wjgnet.com/1009-3079/full/v16/i22/2464.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i22.2464
当前重症肝病患者的肝移植已取得重大成就, 但由于肝源紧张、费用昂贵等因素限制了肝移植的开展. 因此, 人体干细胞的研究越来越受到人们的重视. 骨髓间充质干细胞(MSCs)是骨髓干细胞的重要组成部分. 该细胞能在不同理化环境和细胞因子的诱导下分化为成骨细胞[1-2]、脂肪细胞[3-4]、神经元样细胞[5-6]、心肌细胞[7-8]和肝实质细胞[9-12]等组织细胞. 因此, MSCs有希望成为治疗重症肝病的理想选择. 本实验研究旨在观察实验性大鼠正常组、肝纤维化模型组和自拟中药干预组MSCs体外诱导分化为类肝细胞的差异, 为MSCs治疗临床重症肝病提供参考依据.
清洁级Wistar大鼠24只(来自河北医科大学动物中心, 合格证编号; DK0512051), 体质量180-200 g, 雌雄各半. 丹金舒肝胶囊由河北医科大学第一医院制剂室提供(制剂号; 冀药试制字Z05000019), 主要由丹参、当归、莪术、三棱、鳖甲粉、郁金、水红花子、土鳖虫组成. 剂型; 胶囊, 0.5 g/粒. DMEM低糖培养基购于美国HyClone; 胎牛血清购于中美合资兰州民海生物工程有限公司; 细胞因子购于美国Pepro Tech; 淋巴细胞分离液购于上海恒信化学试剂有限公司; AFP放射免疫分析药盒购于北京北方生物技术研究所; 大鼠Alb放射免疫分析药盒购于北京市福瑞生物工程公司; CK-18 mAb购于北京中杉金桥生物公司.
取丹金舒肝胶囊制成成人每日每公斤体质量用药剂量的20倍, 浓度为0.5 g/mL药液. Wistar大鼠24只, 普通饲养观察1 wk后, 随机分为3组, 每组8只, 雌雄各半. 分别为正常对照组、肝纤维化模型组、自拟中药干预组. 肝纤维化模型组、自拟中药干预组第1天sc 400 mL/L CCl4乳剂 4 mL/kg, 以后每4 d sc 400 mL/L CCl4乳剂2 mL/kg, 正常对照组每次应用等量生理盐水sc. 共注射13次, 每组随机抽取1只剖杀, 确定造模成功. 自拟中药干预组开始应用丹金舒肝胶囊药液ig治疗, 6 mL/(kg·d); 肝纤维化模型组、正常对照组每天给予等量蒸馏水ig. 共治疗42 d. 末次给药后, 将各组大鼠禁食不禁水24 h. 每组随机选取6只, 雌雄各半, 100 mL/L水合氯醛3 mL/kg麻醉, 切取部分肝脏左叶约1.0 cm×1.0 cm×0.5 cm, 以40 g/L中性甲醛固定常规石蜡切片, 用于HE染色. 无菌条件下取大鼠胫骨、股骨, 除去骨表面附着的组织. 用肝素(200 U/mL)-PBS混合液冲出骨髓腔中的骨髓, 制成单细胞悬液至无菌离心管中, 将每组大鼠的细胞悬液混合; 室温1500 r/min离心10 min, 收集沉淀物用含200 mg/L胎牛血清DMEM重悬后加在等体积的淋巴细胞分离液(比重1.077 mg/L)上, 室温1500 r/min离心10 min; 取白膜层到无菌离心管中, 用含200 mg/L胎牛血清低糖DMEM重悬细胞, 1500 r/min离心10 min, 洗涤细胞1次, 最后弃上清. 取10 μL上述细胞悬液与100 μL 2%醋酸混匀, 进行细胞计数. 调整单个核细胞数为1×105/cm2, 接种到25 cm2细胞培养瓶内. 加入5 mL低糖DMEM完全培养基(含200 mg/L胎牛血清、青霉素100 mg/L、链霉素100 mg/L), 置37℃、50 mL/L CO2、饱和湿度的CO2细胞培养箱中培养. 原代骨髓细胞培养48 h后进行首次换液弃掉悬浮细胞, 以后每3 d更换新鲜的低糖DMEM完全培养基. 在细胞接近90%汇合时, 进行消化传代, 在传至第3代时, 已完全去除非贴壁的球形骨髓造血细胞, 得到纯化的MSCs. 将每组纯化的MSCs按104/孔接种于24孔培养板, 加用含200 mg/L FBS的低糖DMEM+20 μg/L HGF+20 μg/L FGF-4, 进行培养和诱导, 以不加用HGF、FGF-4进行诱导培养组作为对照, 每3 d换液1次. 肝组织做5 μm连续切片, 按常规程序染色, 确认造模成功. 分别于细胞诱导分化的15、21、27 d收集细胞培养液, 采用放射免疫分析法进行AFP、白蛋白检测. 以未诱导的MSCs细胞培养液为阴性对照. 于诱导27 d收集诱导细胞爬片, 采用过碘酸希夫(PAS)实验进行糖原染色, 红紫色染色的积聚物看作糖原储存; 同时进行免疫细胞化学染色检测MSCs中CK-18, 按说明操作, 胞质内呈现棕黄色颗粒为阳性染色. 均以未诱导培养27 d的MSCs作阴性对照.
统计学处理 计量资料组间比较采用t检验、方差分析; 所有统计数据均采用SPSS13.0软件处理; P<0.05有统计学意义.
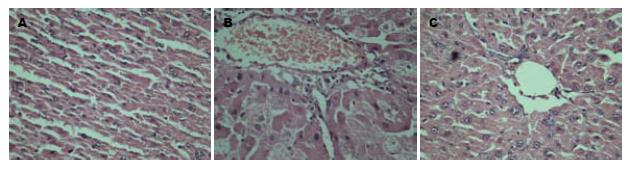
肝纤维化模型组肝脏广泛纤维组织增生, 肝小叶失去正常结构; 自拟中药干预组肝细胞索排列规则, 无假小叶形成; 正常组肝组织表现正常, 无肝纤维化(图1).
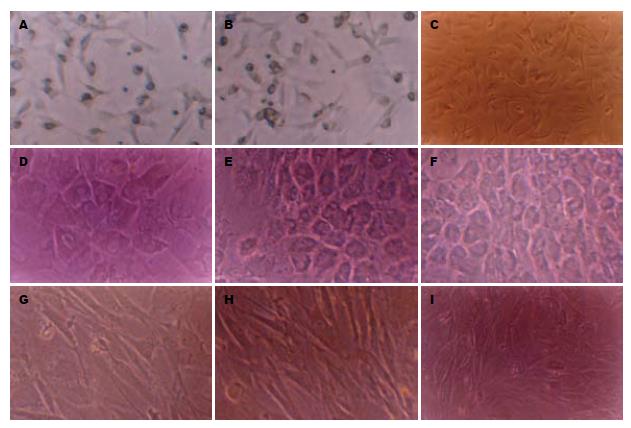
倒置显微镜下观察新鲜分离的骨髓干细胞大小均匀, 透光度好. 接种24-48 h后, 几乎所有的细胞都沉积于瓶底, 少部分细胞贴壁, 呈圆形. 72 h后, 贴壁细胞数增加, 呈小梭形, 并开始分裂增殖. 7 d后, 贴壁分裂细胞形成不同大小、分散的细胞集落, 细胞多呈梭形(图2A-C). 14 d后, 集落中细胞数量增多, 呈放射状向周围扩张, 集落间渐汇合成单层. 21 d左右细胞达90%汇合, 可以传代. 传代后细胞3-4 h开始贴壁, 24 h内完全贴壁, 展成梭形, 开始迅速增殖, 7 d左右可达90%汇合, 可继续传代; 经细胞因子诱导处理的细胞与非诱导细胞在最初1 wk细胞形态变化不大, 随诱导时间延长, 诱导细胞自梭形逐渐变成多角形, 且细胞数量逐渐增多(图2D-F). 而非诱导细胞仍为成纤维细胞样, 细胞密度增加, 局部有重叠交错(图2G-I).
2.3.1 各组细胞培养上清液AFP检测结果: 各组15、21、27 d的诱导细胞的培养上清液AFP水平均高于非诱导细胞(P<0.01), 且21 d各诱导细胞培养上清液AFP水平最高15 d中药干预组AFP水平优于模型组和正常对照组(P<0.05), 而模型组和正常对照组之间比较无统计学意义(P>0.05); 21 d中药干预组和模型组的AFP水平均优于正常对照组(P<0.01), 而中药干预组和模型组之间比较无统计学意义(P>0.05); 27 d三组AFP水平比较无统计学意义(表1, P>0.05).
2.3.2 各组细胞培养上清液白蛋白检测结果: 15 d各组诱导细胞与非诱导细胞培养上清液白蛋白水平比较无统计学意义(P>0.05), 而21、27 d诱导细胞培养上清液白蛋白水平均高于非诱导细胞, 27 d诱导细胞培养上清液白蛋白水平最高15、21 d时白蛋白水平三组间比较无统计学意义(P>0.05); 27 d时中药干预组白蛋白水平优于模型组(P<0.01)和正常对照组(P<0.05), 而模型组和正常对照组之间比较无统计学意义(表2, P>0.05).
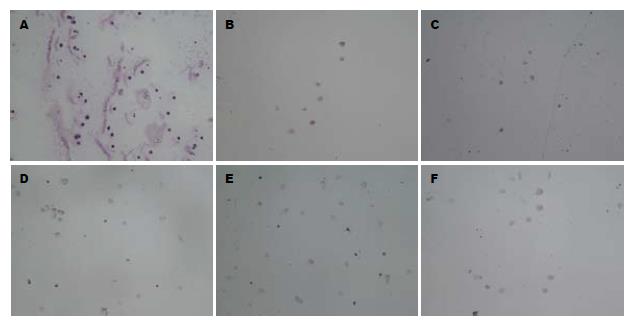
27 d各组诱导MSCs糖原染色强阳性(图3).
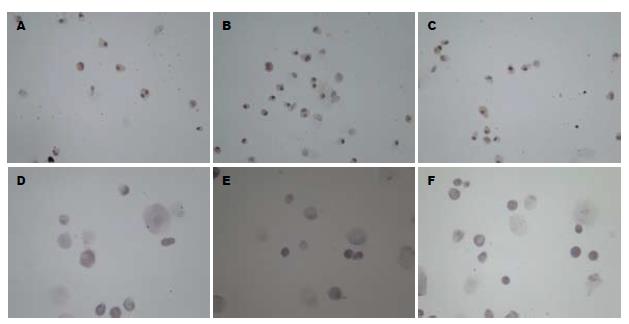
27 d各组诱导MSCs CK-18均阳性. 非诱导MSCs CK-18均阴性(图4).
MSCs具有多向分化潜能, 是组织工程领域中重要的种子细胞. MSCs来源充足, 可以自体取材, 植入体内无免疫排斥反应, 遗传背景稳定, 增殖能力强, 体内外均有极强分化潜能, 易于临床应用.
本研究采用梯度密度离心法, 得到含MSCs的骨髓单个核细胞, 再利用MSCs贴壁生长的特性加以纯化, 与此同时, 大量不贴壁的造血系细胞随着更换培养液得以除去. 再通过传代使其更加纯化. 此种方法操作简单, 很易得到纯化的MSCs. 这也是近年研究[13-15]多采用的MSCs分离方法.
本实验根据此前进行的诱导条件对大鼠骨髓间充质干细胞体外诱导类肝细胞的研究[16], 确定采用200 mg/L胎牛血清和20 μg/L HGF、FGF-4在体外诱导MSCs的分化. HGF是肝细胞生长因子, 在肝脏的发育成熟和再生过程中发挥重要作用[17-19]. FGF-4在体内是一种重要的来源于中胚层和内胚层的信号分子, 可促进胚胎肝脏的形成和发育[20]. HGF、FGF-4在肝细胞的发育和再生中起着不可替代的作用[21]. 胎牛血清中也含有多种生长因子和促分化因子.
AFP、白蛋白、CK-18和糖原均为肝系细胞较为特异的标志. 本实验诱导分化后的3组MSCs均能够分泌AFP、白蛋白, 储存糖原, 表达CK-18肝细胞标记, 证明HGF、FGF-4成功诱导了肝纤维化模型组、自拟中药干预组和正常对照组大鼠MSCs向具有肝细胞表型和功能的类肝细胞的分化. 说明HGF、FGF-4和胎牛血清为MSCs体外分化提供了微环境, 是MSCs分化的关键因素.
3组大鼠诱导情况的差异主要表现在不同诱导时间AFP、白蛋白水平不完全相同. AFP水平在诱导早期(15 d)即表现出中药干预组水平明显高于其他两组, 随诱导时间延长至21 d时(即AFP水平最高时), 中药组、肝纤维化模型组均优于正常对照组, 推测可能由于中药干预组和肝纤维化模型组大鼠肝脏处于病理状态, 加速激发MSCs作为肝细胞的祖细胞向肝细胞分化[22], 从而补充坏死的肝细胞; 中药干预组由于中药的复方具有多途径、多层次、多靶点的综合药理作用加速了MSCs向肝细胞的分化, 所以在诱导早期中药干预组首先在AFP水平上高于其他两组. 白蛋白水平的比较结果正好相反, 在诱导早(15 d)、中期(21 d)各组比较无统计学意义, 而在诱导末期(27 d白蛋白水平最高时)表现为中药干预组明显高于其他两组. 中药干预组由于药物的干预可能更进一步促进了MSCs向肝细胞分化、成熟. 通过上述分析, 提示了中药干预组由于药物的作用而在体外MSCs向肝细胞分化过程中占有一定优势.
总之, 肝纤维化状态、中药治疗状态及正常状态下的大鼠MSCs均可以在体外通过HGF、FGF-4诱导分化为具有肝细胞功能和表型的类肝细胞; MSCs可以作为人工肝和肝细胞移植的一种细胞来源, 为临床治疗重症肝病提供新的途径; 同时也提示了临床应用MSCs治疗重症肝病时, 联合药物治疗, 特别是中药复方治疗更应引起临床医学的重视.
肝细胞移植越来越受到重视, 寻找合适的肝细胞来源成为重要的研究课题. MSCs可以分化为肝细胞, 可以自体取材, 植入体内无免疫排斥反应, 体内外均有极强分化潜能. MSCs有希望成为治疗重症肝病的种子细胞.
朱传武, 副主任医师, 江苏省苏州市第五人民医院传染科
MSCs在不同理化环境和细胞因子的诱导下可以分化为多种组织细胞, 研究MSCs定向分化为类肝细胞的诱导条件及所获细胞的功能和表型是目前的一个热点问题.
近年的研究报道表明HGF、FGF-4在MSCs诱导分化为类肝细胞中起重要作用, 所获类肝细胞具备肝细胞的功能和表型.
正常动物及人的MSCs在体外可诱导分化为类肝细胞, 但肝纤维化动物, 尤其是中药治疗肝纤维化动物MSCs在体外诱导分化为类肝细胞的情况报道很少.
HGF、FGF-4可在体外诱导肝纤维化状态、中药治疗状态下的大鼠MSCs分化为类肝细胞. 中药治疗状态下, MSCs 的分化更有优势. MSCs联合中药复方治疗在临床应用更具前景.
本研究内容较新颖, 设计合理, 统计方法得当, 是一篇较好的文章.
编辑: 李军亮 电编:郭海丽
| 1. | Chen TL, Shen WJ, Kraemer FB. Human BMP-7/OP-1 induces the growth and differentiation of adipocytes and osteoblasts in bone marrow stromal cell cultures. J Cell Biochem. 2001;82:187-199. [PubMed] [DOI] |
| 2. | Atmani H, Chappard D, Basle MF. Proliferation and differentiation of osteoblasts and adipocytes in rat bone marrow stromal cell cultures: effects of dexamethasone and calcitriol. J Cell Biochem. 2003;89:364-372. [PubMed] [DOI] |
| 3. | Porter RM, Huckle WR, Goldstein AS. Effect of dexamethasone withdrawal on osteoblastic differentiation of bone marrow stromal cells. J Cell Biochem. 2003;90:13-22. [PubMed] [DOI] |
| 4. | Allan EH, Ho PW, Umezawa A, Hata J, Makishima F, Gillespie MT, Martin TJ. Differentiation potential of a mouse bone marrow stromal cell line. J Cell Biochem. 2003;90:158-169. [PubMed] [DOI] |
| 5. | Wislet-Gendebien S, Hans G, Leprince P, Rigo JM, Moonen G, Rogister B. Plasticity of cultured mesenchymal stem cells: switch from nestin-positive to excitable neuron-like phenotype. Stem Cells. 2005;23:392-402. [PubMed] [DOI] |
| 6. | Song S, Kamath S, Mosquera D, Zigova T, Sanberg P, Vesely DL, Sanchez-Ramos J. Expression of brain natriuretic peptide by human bone marrow stromal cells. Exp Neurol. 2004;185:191-197. [PubMed] [DOI] |
| 7. | Orlic D. Adult bone marrow stem cells regenerate myocardium in ischemic heart disease. Ann N Y Acad Sci. 2003;996:152-157. [PubMed] |
| 8. | Heng BC, Haider HKh, Sim EK, Cao T, Ng SC. Strategies for directing the differentiation of stem cells into the cardiomyogenic lineage in vitro. Cardiovasc Res. 2004;62:34-42. [PubMed] [DOI] |
| 9. | Mallet VO, Mitchell C, Mezey E, Fabre M, Guidotti JE, Renia L, Coulombel L, Kahn A, Gilgenkrantz H. Bone marrow transplantation in mice leads to a minor population of hepatocytes that can be selectively amplified in vivo. Hepatology. 2002;35:799-804. [PubMed] [DOI] |
| 10. | Chen Y, Dong XJ, Zhang GR, Shao JZ, Xiang LX. Transdifferentiation of mouse BM cells into hepatocyte-like cells. Cytotherapy. 2006;8:381-389. [PubMed] [DOI] |
| 11. | Ong SY, Dai H, Leong KW. Hepatic differentiation potential of commercially available human mesenchymal stem cells. Tissue Eng. 2006;12:3477-3485. [PubMed] [DOI] |
| 12. | Wang PP, Wang JH, Yan ZP, Hu MY, Lau GK, Fan ST, Luk JM. Expression of hepatocyte-like phenotypes in bone marrow stromal cells after HGF induction. Biochem Biophys Res Commun. 2004;320:712-716. [PubMed] [DOI] |
| 14. | Kang XQ, Zang WJ, Song TS, Xu XL, Yu XJ, Li DL, Meng KW, Wu SL, Zhao ZY. Rat bone marrow mesenchymal stem cells differentiate into hepatocytes in vitro. World J Gastroenterol. 2005;11:3479-3484. [PubMed] |
| 17. | Oh SH, Miyazaki M, Kouchi H, Inoue Y, Sakaguchi M, Tsuji T, Shima N, Higashio K, Namba M. Hepatocyte growth factor induces differentiation of adult rat bone marrow cells into a hepatocyte lineage in vitro. Biochem Biophys Res Commun. 2000;279:500-504. [PubMed] [DOI] |
| 18. | Schwartz RE, Reyes M, Koodie L, Jiang Y, Blackstad M, Lund T, Lenvik T, Johnson S, Hu WS, Verfaillie CM. Multipotent adult progenitor cells from bone marrow differentiate into functional hepatocyte-like cells. J Clin Invest. 2002;109:1291-1302. [PubMed] |
| 19. | Fiegel HC, Lioznov MV, Cortes-Dericks L, Lange C, Kluth D, Fehse B, Zander AR. Liver-specific gene expression in cultured human hematopoietic stem cells. Stem Cells. 2003;21:98-104. [PubMed] [DOI] |
| 20. | Jung J, Zheng M, Goldfarb M, Zaret KS. Initiation of mammalian liver development from endoderm by fibroblast growth factors. Science. 1999;284:1998-2003. [PubMed] [DOI] |
| 21. | Seo MJ, Suh SY, Bae YC, Jung JS. Differentiation of human adipose stromal cells into hepatic lineage in vitro and in vivo. Biochem Biophys Res Commun. 2005;328:258-264. [PubMed] [DOI] |