修回日期: 2008-05-01
接受日期: 2008-05-08
在线出版日期: 2008-08-08
目的: 利用流体动力学法构建小鼠HBV感染模型, 观察pSiHBV/P在体内对HBV的抑制作用.
方法: 以流体动力学法构建小鼠HBV感染模型, 将pSiHBV/P与pHBV1.3尾静脉共注射Balb/c小鼠. 转染后第6天, 用酶联免疫分析法检测小鼠血清乙肝表面抗原(HBsAg), 用荧光定量PCR检测血清HBV DNA的水平, 用免疫组织化学方法检测肝内HBsAg、乙肝病毒核心抗原(HBcAg)的表达, RT-PCR法半定量检测肝内HBV 3.5 kb mRNA、S-mRNA及0.7 kb mRNA的水平.
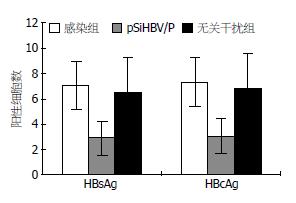
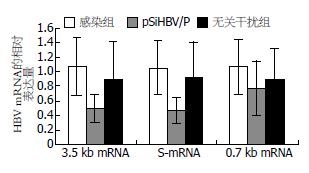
结果: 感染组和无关干扰组血清HBsAg表达量平均值分别为9.11±3.34和8.19±5.41, pSiHBV/P干扰组平均值1.94±1.78; pSiHBV/P干扰组血清中HBV DNA的含量较感染组明显下降(2.91±0.55 vs 4.32±0.57, P<0.05), 抑制率为33%; 干扰组肝细胞中HBsAg和HBcAg阳性细胞数较对照组明显减少; 干扰组3.5 kb mRNA、S-mRNA的水平较感染组和无关干扰组均有明显下降(0.48±0.19 vs 1.06±0.40, 0.88±0.54; 0.46±0.18 vs 1.05±0.38, 0.90±0.51, P<0.05).
结论: RNAi技术在体内能高效、特异地抑制小鼠体内HBV.
引文著录: 高海燕, 张建军, 杨向东, 王道理, 卞铁荣, 阳艾玲, 夏纪毅, 耿颖, 黄飞. 聚合酶RNA干扰对小鼠体内乙型肝炎病毒的抑制作用. 世界华人消化杂志 2008; 16(22): 2448-2452
Revised: May 1, 2008
Accepted: May 8, 2008
Published online: August 8, 2008
AIM: To develop a mouse model of hepatitis B virus (HBV) infection by hydrodynamic method and to observe the inhibition and replication of HBV induced by pSiHBV/P in the model.
METHODS: Hydrodynamic method was used to establish the model of HBV infection in Balb/c mice. pHBV1.3 was injected into the mice via tail veins together with pSiHBV/P, which could specifically target the P gene sequence of HBV by synthesizing small interfering RNA (siRNA) in vivo. On the 6th day of transfection, blood samples liver specimens were collected. Serum HBsAg were analyzed by enzyme-linked immunosorbent assay (ELISA), and the contents of HBsAg and HBcAg in liver specimens were measured by immunohistochemical staining. HBV DNA and mRNA levels were detected by fluorescence quantitative polymerase chain reaction (FQ-PCR) and semi-quantitative RT-PCR.
RESULTS: The mean levels of serum HBsAg expression in the infected group, the irrelative interference group and the pSiHBV/P interfering group were 9.11 ± 3.34, 8.19 ± 5.41 and 1.94 ± 1.78, respectively. The HBV DNA loads were reduced by 33% in the pSiHBV/P interfering group, significantly lower than that in the infected group (2.91 ± 0.55 vs 4.32 ± 0.57, P < 0.05). The count of HbsAg- or HbcAg-positive cells in the pSiHBV/P interfering group was lower than that in the control groups. The levels of 3.5 kb mRNA and S-mRNA in the pSiHBV/P interfering group were reduced remarkably in comparison with those in the infected group and the irrelative interference group (0.48 ± 0.19 vs 1.06 ± 0.40, 0.88 ± 0.54; 0.46 ± 0.18 vs 1.05 ± 0.38, 0.90 ± 0.51; all P < 0.05).
CONCLUSION: RNAi can inhibit HBV expression and replication effectively and specifically in vivo.
- Citation: Gao HY, Zhang JJ, Yang XD, Wang DL, Bian TR, Yang AL, Xia JY, Geng Y, Huang F. RNA interference targeting polymerase inhibits the expression and replication of hepatitis B virus in mice. Shijie Huaren Xiaohua Zazhi 2008; 16(22): 2448-2452
- URL: https://www.wjgnet.com/1009-3079/full/v16/i22/2448.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i22.2448
乙型肝炎病毒(hepatitis B virus, HBV)感染是一个严重的公共卫生问题, HBV感染后不仅可以引起急、慢性肝炎, 而且与肝硬化、肝癌的发生、发展有密切的关系. HBV基因紧密而高效, 且易发生变异. 目前抗病毒治疗所使用的药物主要是干扰素和核苷类似物, 疗效尚不满意, 研究新的治疗方法仍是当前的难点和热点. RNA干扰技术的出现为抗HBV治疗的研究提供了新的选择. 在本实验室成功应用HBV P基因区特异的小干扰RNA质粒(pSiHBV/P)在体外抑制HBV的基础上, 本研究应用流体动力学法[1]建立小鼠HBV感染模型, 观察pSiHBV/P在体内对HBV复制和表达的影响.
3-4 wk龄Balb/c小鼠36只, ♂, 体质量18-22 g, 清洁级, 购于成都达硕生物科技有限公司. pHBV1.3为含1.3倍HBV ayw型全基因组真核表达载体, pSiGFP为针对绿色荧光蛋白GFP的siRNA转录载体, 由重庆医科大学病毒性肝炎研究所惠赠. pSiHBV/P为针对HBV P基因的发夹状siRNA转录载体, 由本实验室构建, 作用靶位为P读码框起始密码子下游含19个碱基序列的寡核苷酸链CGCAGGATAACCACATTGT(1012-1030). 两条寡核苷酸链: 正义5'-TCGAGCGCAGGATAACCACATTGTTTCGACAATGTGGTTATCCTGCGTTTTT-3'; 反义链5'-CTAGAAAAACGCAGGATAACCACATTGTCGAAACAATGTGGTTATCCTGCGC-3'. HBsAg诊断试剂盒为上海实业科华生物技术有限公司产品. HBV DNA荧光定量PCR试剂盒为上海申友生物技术有限责任公司产品. 鼠抗-HBs mAb(其二抗为羊抗鼠IgG-HRP多聚体)、兔抗-HBc多克隆抗体(其二抗为羊抗兔IgG-HRP多聚体)、PV-6001/6002二步法免疫组化检测试剂盒为北京中杉金桥生物技术有限公司产品. 小量不含DNA的总RNA抽提试剂盒为上海华舜生物工程有限公司产品. 逆转录试剂盒为Fermentas公司产品. iQTM SYBR Green Supermix为Bio-Rad公司产品.
1.2.1 模型建立及取材: 将Balb/c小鼠随机分为6组, 每组6只. A组为感染组, 注射pHBV1.3(20 µg); B组为pSiHBV/P干扰组, 共注射pSiHBV/P(7.5 µg)和pHBV1.3(20 µg); C组为无关干扰组, 共注射pSiGFP(7.5 µg)和pHBV1.3(20 µg); D组为空白对照组, 仅注射0.9%生理盐水(NS)2 mL; A-C各组质粒均用0.9% NS稀释, 总量为2 mL. 采用流体动力学法建立HBV小鼠感染模型, 其原理是: 快速注射的大剂量溶液, 其总量超过了心输出量, 溶液储积于上腔静脉, 产生高流体静脉压, 使质粒DNA较快到达全身各组织, 质粒DNA与血液的短时间接触避免了血液中核酸酶的降解, 而肝脏是机体最大的脏器, 组织结构疏松易于扩张, 基因表达产物最丰富. 流体动力学法是一种简便有效、安全的外源基因转移方法, 不需准备载体, 基因表达量较局部注射质粒DNA法高, 可广泛用于研究基因功能、基因调节、蛋白结构及功能等许多领域, 尤其对于嗜肝表达基因更显示出优越性. 本实验中操作要点: 将计算的溶液总量, 用45 mm头皮注射针经小鼠尾静脉6 s内注射完毕. 注射后第6天, 摘除小鼠眼球取血, 分离血清. 处死小鼠, 取出肝脏, 切取数个约30 mg的组织块立即冻存于液氮中; 切取5 mm×6 mm大小的组织块, 40 g/L多聚甲醛固定.
1.2.2 血清HBsAg和HBV DNA的检测: 用酶联免疫吸附测定(ELISA)法检测, 用HBV DNA荧光定量PCR试剂盒检测, 具体方法见试剂盒说明书.
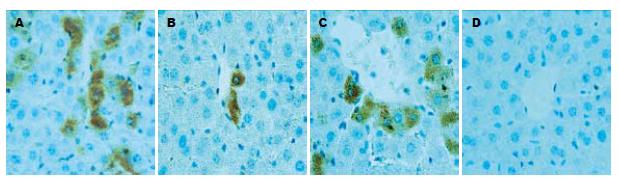
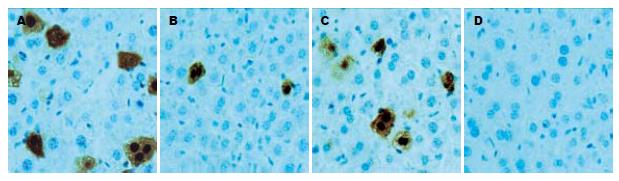
1.2.3 肝内HBsAg、HBcAg的检测: 肝组织常规石蜡包埋、切片, 采用北京中杉金桥生物技术有限公司PV-6001/6002二步法免疫组化检测试剂盒, 按照说明书操作, 二步法免疫组织化学法检测并进行二氨基联苯胺(DAB)染色, 苏木素复染. 用光学显微镜观察肝组织中HBsAg和HBcAg的着色情况: 每只小鼠取4张肝组织切片, 每张切片观察5个400倍视野, 每个视野计数100个细胞中的HBsAg和HBcAg阳性细胞数, 取其平均值.
1.2.4 肝内HBV mRNA的检测: 针对HBV 3.5 kb mRNA基因区(C区)的引物(预期产物186 bp): 上游引物为5'-CTGGGTGGGTGTTAATTTGG-3', 下游引物为5'-TAAGCTGGAGGAGTGCGAAT-3'; 针对HBV S基因区的引物(预期产物245 bp): 上游引物为5'-TTCCTAGGACCCCTTCTCGT-3', 下游引物为5'-AGCAGCAGGATGAAGAGGAA-3'; 针对HBV 0.7 kb mRNA基因区(X区)的引物(预期产物466 bp): 上游引物为5'-CATGGCTGCTAGGCTGT-3', 下游引物为5'-TTAGGCAGAGGTGAAAAAG-3'; 针对内部参照β-肌动蛋白基因的引物(预期产物294 bp): 上游引物为5'-CCTAGAAGCATTTGCGGTGC-3', 下游引物为5'-TCATGAAGTGTGAGGTTGAC-3'. 提取肝组织总RNA, 用RT-PCR法, 插入SYBR Green荧光染料, 半定量检测肝内HBV 3.5 kb mRNA、S-mRNA及0.7 kb mRNA的水平. 逆转录以试剂盒中OligoT为引物, 40 μL体系, 在RevertAidTM M-MuLV Reverse Transcriptase作用下, 反应60 min. 各反应管放入iCycler荧光定量PCR仪(Bio-Rad), 按下列条件扩增: 95℃ 3 min→(95℃ 30 s→58℃ 30 s→72℃ 1 min)×40 cycles. 并在PCR循环第二步58℃时收集荧光信号, 由计算机软件自动分析计算出Ct值. 用比较阈值法计算出每个标本目的基因的相对表达量(2-△△Ct). 取5 μL PCR扩增产物经20 g/L琼脂糖凝胶电泳分析.
统计学处理 数据以mean±SD表示, 由SPSS13.0统计软件处理, 采用完全随机设计的多组间方差分析得出P值. P<0.05为差异有显著性.
HBsAg S/N值≥2.1为阳性. 感染组和无关干扰组血清HBsAg均为阳性, 表达量接近, 平均值分别为9.11±3.34、8.19±5.41; pSiHBV/P干扰组较以上两组明显降低(P<0.05), 平均值1.94±1.78; 空白对照组均为阴性. 以上结果说明pSiHBV/P能抑制血清HBsAg的表达.
通过荧光定量PCR分析, 用HBV DNA拷贝数的log值进行统计. 抑制率 = [1-log(治疗组拷贝数)/log(感染组拷贝数)]×100%. 结果显示, pSiHBV/P干扰组血清中HBV DNA的含量较感染组明显下降(P<0.05), 抑制率为33%, 而无关干扰组则无明显抑制作用. 空白对照组未检测到HBV DNA(表1).
免疫组织化学检测结果显示, HBsAg在感染细胞胞质中呈弥漫性着色, 而HBcAg主要位于感染细胞的细胞核内, 核周胞质也有阳性着色. 感染组和无关干扰组肝内HBsAg、HBcAg的表达无明显差异, pSiHBV/P干扰组较感染组和无关干扰组均有明显下降(P<0.05), 空白对照组肝细胞内无HBsAg、HBcAg的表达(表2, 图1-3).
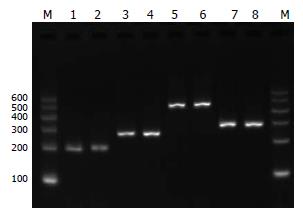
RT-PCR结果示, 感染组和无关干扰组HBV 3.5 kb mRNA、S-mRNA、0.7 kb mRNA的水平无明显差异, pSiHBV/P干扰组3.5 kb mRNA、S-mRNA的水平较感染组和无关干扰组均有明显下降(P<0.05), 0.7 kb mRNA的水平与感染组和无关干扰组无明显差异, 表明pSiHBV/P能明显抑制3.5 kb mRNA、S-mRNA, 对0.7 kb mRNA则无明显抑制作用. 空白对照组未检测到HBV mRNA(表3, 图4). RCR扩增产物经20 g/L琼脂糖凝胶电泳分析结果(图5).
HBV基因组全长3.2 kb, 有S、C、P和X 4个重叠的开放读码框, P基因区是最大的一个读码框, 与前S、S、C和X区段均有重叠, 占HBV DNA基因序列的绝大部分. 其编码的DNA聚合酶与HBV DNA的复制、逆转录, 以及3.5 kb的前基因组RNA的消化分解功能有关. 此外, 病毒的DNA多聚酶为内源性的, 可以修补病毒基因组中的短链和缺口, 使之成为完整的双链DNA. P基因区的某些核苷酸的突变或断裂, 可以造成HBV DNA多聚酶的表达水平减少或完全终止, 导致复制缺陷或复制水平的降低. 因此, 我们选择P基因区作为RNAi抗HBV治疗的靶位.
本实验通过流体动力学法成功构建了小鼠HBV感染的动物模型, 为了排除宿主自身免疫系统的影响, 我们选择病毒复制和表达均稳定的时间点[2](注射后第6天)来观察siRNA对HBV的抑制作用. 实验结果表明, pSiHBV/P能有效抑制血清HBsAg和肝内HBsAg、HBcAg的表达; 显著抑制HBV DNA复制, 抑制率为33%; 明显抑制HBV 3.5 kb mRNA、S-mRNA, 而无关干扰无论在DNA水平、RNA水平, 还是在蛋白质水平都没产生抑制作用, 说明siRNA的作用具有序列特异性. 另外, 实验结果提示pSiHBV/P能明显抑制3.5 kb mRNA、S-mRNA, 对0.7 kb mRNA则无明显抑制作用, 这与pSiHBV/P的靶位有关. HBV的生活史中可转录出4种mRNA, 即3.5、2.4、2.1和0.7 kb的mRNA. pSiHBV/P的靶序列位于HBV核苷酸(nt)1012-1030之间, 故对HBV 3.5、2.4、2.1 kb的mRNA均有抑制作用, 而对0.7 kb mRNA无直接抑制作用. 目前尚未见国内外以HBV P区基因为靶点的RNA干扰, 在活体动物的研究报道.
近年来RNAi抗HBV的治疗研究已取得了一定进展. McCaffrey et al的研究已证实RNAi技术在体内外均有抗HBV作用[3-7]. RNAi抗HBV具有很多优势: 第一, RNAi具有高度特异性, 即使仅有一个碱基错配亦可使干扰效应明显下降; 第二, RNAi具有高效性, 少量的siRNA就可起到抑制HBV的作用; 第三, 无明显副作用, siRNA本身片段短, 不会引起非特异性细胞免疫反应; 第四, HBV全长3.2 kb, 有3.5 kb、2.4 kb、2.1 kb和0.7 kb 4种转录本, 可提供数百个RNAi的作用位点, 在选择RNAi靶位时应考虑保守区域, 并可同时使用多个位点, 则可有效防止病毒变异株的出现; 第五, RNAi的作用不依赖病毒的复制, 可以弥补核苷类似物的不足, Li et al[8]用siRNA和拉米夫定联合抑制HepG2.2.15细胞中HBV的复制, 取得了比单独应用siRNA或拉米夫定更好的抑制效果.
RNAi作为一种新型的抗HBV治疗技术, 展示了良好的应用前景, 但RNAi要应用于临床, 其组织靶向性和表达效率、药代动力学及如何选择最有效的靶序列等问题仍有待解决, 比如本研究中所采用的质粒载体, 若具有肝器官靶向性, 则可能提高其效果.
虽然普及乙肝疫苗以来, 病毒携带者及急慢性肝炎患者数量已有明显下降, 但目前对于已携带有HBV的患者并无治疗良策. 自1990年发现RNA干扰(RNAi)这一现象以来, RNAi已被广泛应用于基因功能、抗病毒治疗和信号转导系统上下游分子相互关系的研究.
曹洁, 副教授, 中国人民解放军第二军医大学微生物学教研室
RNAi抗HBV有显著的应用前景. HBV复制过程中有4种mRNA产生, 且4种之间具有重叠读码框. 因此, 应用RNAi技术抗HBV已成为RNAi抗病毒作用的研究热点, 多个研究小组已经在细胞水平或动物体内取得了一定成果.
2006年, 潘金水 et al在《世界华人消化杂志》发表了 "RNA干扰抑制HepG2-N10细胞系中HBV基因表达及复制". 该研究中涉及针对HBV S基因的siRNA, 该位点同时也在P区. 在细胞实验中, 观察到培养上清中HBsAg、HBeAg显著减少; 也发现了RNA干扰对HBV转录产物mRNA的抑制.
本研究为国内较早应用流体动力学法进行外源基因转移的研究, 尾静脉注射含1.3倍HBV ayw亚型的pHBV1.3质粒, 成功构建了小鼠HBV感染模型, 一定程度上解决了长期以来缺乏合适HBV感染动物模型的问题.
本文内容全面, 实用性较强, 实验设计合理, 学术价值尚可.
编辑: 李军亮 电编:何基才
| 1. | Liu F, Song Y, Liu D. Hydrodynamics-based transfection in animals by systemic administration of plasmid DNA. Gene Ther. 1999;6:1258-1266. [PubMed] [DOI] |
| 2. | Yang PL, Althage A, Chung J, Chisari FV. Hydrodynamic injection of viral DNA: a mouse model of acute hepatitis B virus infection. Proc Natl Acad Sci U S A. 2002;99:13825-13830. [PubMed] [DOI] |
| 3. | McCaffrey AP, Nakai H, Pandey K, Huang Z, Salazar FH, Xu H, Wieland SF, Marion PL, Kay MA. Inhibition of hepatitis B virus in mice by RNA interference. Nat Biotechnol. 2003;21:639-644. [PubMed] [DOI] |
| 4. | Zhao ZF, Yang H, Han DW, Zhao LF, Zhang GY, Zhang Y, Liu MS. Inhibition of hepatitis B virus expression and replication by RNA interference in HepG2.2.15. World J Gastroenterol. 2006;12:6046-6049. [PubMed] |
| 5. | Chen CC, Ko TM, Ma HI, Wu HL, Xiao X, Li J, Chang CM, Wu PY, Chen CH, Han JM. Long-term inhibition of hepatitis B virus in transgenic mice by double-stranded adeno-associated virus 8-delivered short hairpin RNA. Gene Ther. 2007;14:11-19. [PubMed] [DOI] |
| 6. | Ying RS, Zhu C, Fan XG, Li N, Tian XF, Liu HB, Zhang BX. Hepatitis B virus is inhibited by RNA interference in cell culture and in mice. Antiviral Res. 2007;73:24-30. [PubMed] [DOI] |
| 7. | Weinberg MS, Ely A, Barichievy S, Crowther C, Mufamadi S, Carmona S, Arbuthnot P. Specific inhibition of HBV replication in vitro and in vivo with expressed long hairpin RNA. Mol Ther. 2007;15:534-541. [PubMed] [DOI] |
| 8. | Li GQ, Xu WZ, Wang JX, Deng WW, Li D, Gu HX. Combination of small interfering RNA and lamivudine on inhibition of human B virus replication in HepG2.2.15 cells. World J Gastroenterol. 2007;13:2324-2327. [PubMed] |