修回日期: 2008-04-09
接受日期: 2008-04-28
在线出版日期: 2008-07-28
目的: 探讨生长抑制DNA损伤诱导因子β(GADD45β)与肝细胞癌(hepatocellular carcinoma, HCC)发生、发展的关系.
方法: 应用寡核苷酸基因芯片、反转录PCR(RT-PCR)、免疫组织化学技术检测GADD45β在人正常肝组织、肝硬化组织和肝癌组织中的异常表达, 分析GADD45β与临床病理学特征的关系及其异常表达的可能分子生物学机制.
结果: 正常肝组织、肝硬化组织和肝癌组织中GADD45β mRNA的阳性表达率分别为80%、60%和26%, 肝癌组织与正常肝组织间有非常统计学差异(χ2 = 15.128, P<0.01); GADD45β蛋白的阳性表达率在正常肝组织、肝硬化组织和肝癌组织中分别为85%、70%和31%, 有显著统计学差异(χ2 = 24.619, P<0.01). GADD45β在肝癌组织中的表达缺失与病理学分级显著相关(P<0.01).
结论: GADD45β作为抑癌基因在肝癌的发生发展中起到相当重要的作用, 且与肿瘤分化程度密切相关.
引文著录: 杨娟, 杨玉秀, 韩双印, 白阳秋, 张立达. GADD45β在肝癌中的异常表达. 世界华人消化杂志 2008; 16(21): 2417-2422
Revised: April 9, 2008
Accepted: April 28, 2008
Published online: July 28, 2008
AIM: To explore the relationship between the expression of growth arrest and DNA-damage inducible gene β (GADD45β) and carcinogenesis of hepatocellular carcinoma (HCC).
METHODS: Using oligonucleotide chip, reverse transcription-polymerase chain reaction (RT-PCR) and immunohistochemistry, the expression of GADD45β was detected in tissues of normal human liver, liver cirrhosis and HCC. We also analyzed the relationship between GADD45β expression and the clinicopathological characteristics of HCC. Furthermore, the possible molecular mechanism of its abnormal expression was investigated.
RESULTS: The positive rates of GADD45β mRNA expression were 80%, 60% and 26% in normal liver, liver cirrhosis and HCC, respectively, and there was a significant difference between normal liver and HCC (χ2 = 15.128, P < 0.01). The positive rates of GADD45β protein were 85%, 70% and 31% in normal liver, liver cirrhosis and HCC, respectively, and there was also a significant difference between normal liver and HCC (χ2 = 24.619, P < 0.01). Meanwhile, the deletion of GADD45β was significantly correlated with the pathological grading of HCC.
CONCLUSION: GADD45β, as tumor suppressor gene, plays an important role in the carcinogenesis of HCC, and its expression is intimately correlated with tumor differentiation.
- Citation: Yang J, Yang YX, Han SY, Bai YQ, Zhang LD. Abnormal expression of growth arrest and DNA-damage inducible gene β in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(21): 2417-2422
- URL: https://www.wjgnet.com/1009-3079/full/v16/i21/2417.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i21.2417
肝细胞癌(hepatocellular carcinoma, HCC)简称肝癌, 是临床上最常见的恶性肿瘤之一, 是由病毒、化学致癌物等多病因作用的多环节、多步骤的复杂过程, 常伴随着癌基因突变、抑癌基因缺失以及DNA修复基因的异常表达等. 其中乙型肝炎病毒(hepatitis B virus, HBV)感染是导致慢性肝炎、肝硬化和肝癌发生的主要原因[1], 在这一过程中涉及多种基因的异常表达. 生长抑制DNA损伤诱导因子β(growth arrest and DNA-damage inducible gene β, GADD45β)是细胞和DNA损伤的应激基因, 主要调节控制细胞的增生、监测细胞周期、诱导细胞凋亡、调控细胞的负性生长等[2]. 目前, 有关GADD45β在肝癌中的生物学作用和临床价值尚不甚明了. 本研究通过应用寡核苷酸基因芯片、反转录PCR(RT-PCR)及免疫组织化学技术检测GADD45β在人正常肝、肝硬化、肝癌组织中的异常表达, 探讨GADD45β在肝癌演进过程中的作用, 及其与临床病理特征之间的关系.
2005-03/2006-04收取正常肝组织9例, 肝硬化组织6例, 肝癌组织15例, 用于寡核苷酸基因芯片研究; 2007-03/2007-05收取正常肝组织20例, 肝硬化组织10例, 肝癌组织35例, 用于反转录PCR及免疫组织化学研究. 肝硬化、肝癌组织标本HBsAg均阳性, 正常肝组织HBsAg阴性. 疾病诊断均经病理证实. 标本取出后迅速置于液氮冷冻, 后转移至-80℃冰箱冻存待用. 标本选取随机, 均取自河南省人民医院肝脏手术切除组织. 其中正常肝组织取自肝血管瘤手术切除病变部位的周围组织, 肝硬化组织取自门脉高压行贲门周围血管离断术要求行病理检查的肝脏组织, 肝癌组织取自肝癌手术切除组织, 所取组织新鲜, 并经过患者知情同意. 兔抗人GADD45β多克隆抗体(sc-33172)购自美国Santa Cruz公司, PV-6001羊抗兔免疫组织化学试剂盒及DAB显色剂均购自北京中杉金桥生物科技有限公司.
1.2.1 寡核苷酸基因芯片: 总RNA提取, cDNA合成、芯片杂交和检测, 数据分析, 方法见文献[3].
1.2.2 反转录PCR: (1)抽提总RNA: 用TRIzol试剂(Qiagen公司)分别抽提正常肝组织、肝硬化和肝癌组织总RNA. (2)内参基因GAPDH上游引物: 5'-GTGAAGGTCGGAGTCAAC-3', 下游引物: 5'-CTCCATGGTGGTGAAGAC-3'; 扩增片段长度309 bp. 目的基因GADD45β上游引物: 5'-CAGAAGATGCAGACGGTGAC-3', 下游引物: 5'-AGGACTGGATGAGCGTGAAG-3'; 扩增片段长度202 bp. (3)GADD45β-cDNA合成及PCR扩增: 按RT-PCR试剂盒(Promega公司提供)要求步骤进行反转录聚合酶链反应. 先合成cDNA, 再进行PCR. 扩增产物用20 g/L琼脂糖凝胶电泳鉴定. (4)扩增产物图像分析: 通过对GADD45β扩增产物进行扫描和半定量分析, 结果用Syngene GeneGenius全自动凝胶成像系统(美国Syngene公司)检测图像灰度值.
1.2.3 免疫组织化学: (1)肝癌组织病理分型: 标本经过HE染色明确诊断并确定病理分型. 肝癌病理分型参照Edmondson分级, 将肝癌分为4级: Ⅰ级: 肿瘤细胞大小一致. 核浆比类似正常肝细胞, 瘤细胞呈细索状排列; Ⅱ级: 核浆比较Ⅰ级增大, 瘤细胞呈粗索状或腺管状排列; Ⅲ级: 核浆比明显失调. 多形性明显, 索状排列紊乱, 无假腺管或胆栓形成; Ⅳ级: 核浆比严重失调细胞核大小不一. 胞质量少, 多呈实团状, 索状结构不明显. 肿瘤分化介于Ⅱ-Ⅲ级或Ⅲ-Ⅳ级之间者, 分别归入Ⅲ或Ⅳ级. 35例肝癌中, Ⅰ级8例, Ⅱ级9例, Ⅲ级12例, Ⅳ级6例. (2)免疫组织化学检测GADD45β: 肝组织经梯度解冻, 100 g/L的多聚甲醛固定, 石蜡包埋, 制成4 μm厚的石蜡切片, HE染色组织学观察. 切片经高压热修复, 采用免疫组织化学PV法, DAB显色, 苏木素复染, 无水乙醇脱水, 中性树胶封片. 以0.01 mol/L的PBS(pH值为7.5)代替第一抗体作为阴性对照, 以组织中显示棕黄色颗粒为GADD45β表达阳性. (3)GADD45β阳性判断标准: 以阳性细胞数≥10%作为阳性判断标准, 根据阳性细胞百分率分为阴性(-): 阳性细胞不可见或阳性细胞不足5%; 弱阳性(+): 阳性细胞散在或为组织细胞的1/3以下; 中度阳性(++): 阳性细胞呈局灶分布, 占全组织细胞1/3-2/3; 强阳性(+++): 阳性细胞呈弥漫分布, 占全组织细胞2/3以上.
统计学处理 应用SPSS10.0进行成组设计资料的t检验、χ2检验、fisher's精确检验和Kruskal-wallis非参数检验的统计学处理, 以α = 0.05为检验水准.
Affymetrix U133 Plus 2.0基因芯片含19378个已知基因信息, 完全符合质控标准, 通过对其进行生物信息学对比分析, 以正常肝组织为对照比较, 筛选出肝硬化、肝癌差异基因表达谱, 包括原癌基因、抑癌基因、DNA修复基因、细胞信号传导及细胞周期相关基因、代谢酶类相关基因、免疫相关基因、肿瘤相关抗原等. 其中, GADD45β在肝癌差异基因表达谱中呈现明显下调表达(Ratio值 = 0.397<0.5), 而在肝硬化中下调表达则不明显(Ratio值 = 0.955>0.5). 部分肝癌下调表达基因见表1.
| UniGene ID | Gene description | CL | Ratio |
| Hs.75678 | FBJ murine osteosarcoma viral oncogene homolog B, FOSB | 19q13.32 | 0.067 |
| Hs.110 | solute carrier family 3 member 1, SLC3A1 | 2p16.3 | 0.102 |
| Hs.82120 | nuclear receptor subfamily 4, group A, member 2, NR4A2 | 2q22-q23 | 0.198 |
| Hs.25647 | v-fos FBJ murine osteosarcoma viral oncogene homolog, FOS | 14q24.3 | 0.203 |
| Hs.534337 | major histocompatibility complex, class II, DR beta 4, HLA-DRB4 | 6p21.3 | 0.250 |
| Hs.332053 | serum amyloid A1, SAA1 | 11p15.1 | 0.287 |
| Hs.1395 | early growth response 2, EGR2 | 10q21.1 | 0.330 |
| Hs.388674 | heart alpha-kinase, HAK | 18q21.31 | 0.354 |
| Hs.171695 | dual specificity phosphatase 1, DUSP1 | 5q34 | 0.366 |
| Hs.414795 | serine (or cysteine) proteinase inhibitor clade E member 1, SERPINE1 | 7q21.3-q22 | 0.379 |
| Hs.110571 | growth arrest and DNA-damage-inducible, beta GADD45β | chr19p13.3 | 0.397 |
| Hs.8364 | pyruvate dehydrogenase kinase, isoenzyme 4, PDK4 | 7q21.3-q22.1 | 0.420 |
| Hs.156637 | Cas-Br-M ecotropic retroviral transforming sequence c, CBLC | 19q13.2 | 0.435 |
| Hs.177534 | dual specificity phosphatase 10, DUSP10 | 1q41 | 0.451 |
| Hs.9914 | follistatin, FST | 5q11.2 | 0.456 |
| Hs.351344 | transmembrane protein 25, TMEM25 | 11q23.3 | 0.467 |
| Hs.249441 | WEE1 homolog (S. pombe), WEE1 | 11p15.3-p15.1 | 0.483 |
| Hs.376206 | Kruppel-like factor 4 (gut), KLF4 | 9q31 | 0.483 |
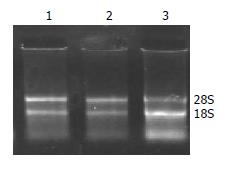
2.2.1 总RNA提取结果: 正常肝组织、肝硬化组织、肝癌组织总RNA提取结果亦良好, 总RNA的吸光度A260/A280值均在1.9-2.0, 电泳结果证实已抽提高纯度的RNA(图1).
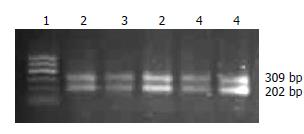
2.2.2 PCR扩增结果: GADD45β RT-PCR扩增产物电泳图谱显示在相当于202 bp处有DNA片段区带(图2). 内参基因扩增产物显示在309 bp处有DNA片段区带.
三种组织标本中GADD45β mRNA定性及统计分析结果见表2. 目的基因和内参基因同管扩增, 以GAPDH mRNA和GADD45β mRNA的灰度比值作为统计对象, 进一步行GADD45β mRNA半定量测定. 与正常肝组织相比, 肝硬化组织灰度比值没有明显差异(1.047±0.221 vs 0.940±0.230, t = 1.032, P>0.05), 肝癌组织中则明显下降(1.047±0.221 vs 0.607±0.223, t = 4.774,P<0.01), 肝硬化与肝癌组织相比, 差异亦有显著意义(0.940±0.230 vs 0.607±0.223, t = 2.898, P<0.05).
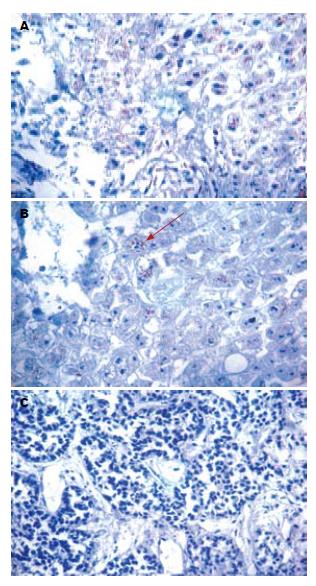
2.3.1 GADD45β的阳性表达: GADD45β阳性表达物呈棕黄色颗粒, 弥散分布于胞质, 少数细胞出现胞核着色胞膜未见着色, 不同病例的阳性胞质着色颗粒的大小、分布密度及着色深浅亦有不同(图3). 统计分析显示, GADD45β在正常肝组织与肝硬化组织中表达无明显差异, 在肝癌组织中呈现明显低表达(P<0.05), 且在3种组织中GADD45β蛋白阳性表达程度有显著差异(P<0.01,表3).
2.3.2 GADD45β表达强度与肝癌临床病理特征的关系: 35例肝癌组织中24例缺乏GADD45β表达, 其中22例为中、低分化肝癌, GADD45β在高分化肝癌组中的表达明显高于中、低分化组(P<0.01); 在核分级较高组亦缺乏GADD45β表达, EdmendsenⅡ、Ⅲ分级中GADD45β表达明显低于EdmendsenⅠ级(P<0.05). 应用Kruskal-Wallis非参数检验方法显示, 不同分化程度以及不同核分级的肝癌组织GADD45β表达强度均有显著差异(P<0.01, 表4).
肝癌是世界范围内最常见的恶性肿瘤之一, 位居全球恶性肿瘤发病率第5位[4], 死因第3位; 其发病率和死亡率有逐年上升趋势. 肝脏是机体重要的解毒器官, 肝细胞承受着来自化学物质、病毒感染及代谢废物的负荷, 很容易出现细胞增殖恶变, 虽然有关肝癌的发病机制研究取得了一些进展, 但有关DNA损伤及修复问题仍然有待进一步阐明.
GADD45是细胞和DNA损伤的应激基因, 与DNA损伤修复有重要相关, GADD45基因家族是P53、BRCA1调控的下游基因, 现已发现GADD45α, GADD45β/MYD118, GADD45γ/OIG37/CR6/GRP17三个成员, 能够在多种DNA损伤因素包括电离辐射、紫外线、甲基甲磺酸(MMS)、羟基脲等作用下, 随着DNA修复途径的启动而诱导产生. GADD45β基因最初是通过IL-6对小鼠髓样细胞性白血病的细胞株M1终末分化诱导后所产生的髓样分化反应基因[5], GADD45β具有GADD45基因家族的共有功能, 即主要调节控制细胞的增生、监测细胞周期、诱导细胞凋亡、调控细胞的负性生长[2]. 研究发现GADD45β编码的核蛋白能与其他蛋白如PCNA, p21、核组蛋白、MTK1/MEKK4激酶以及Cdk1等相互作用[6-7], 并参与多种信号通路的调节, 在NF-κB[8-9]、p38/JNK[10-11]、Foxo[12]等的通路中发挥作用, 通过信号通路间的交叉对话(cross talk)行使生物学功能, 参与DNA的损伤修复, 实现其负性生长调节.
我们应用含有19 378个已知基因的寡核苷酸芯片筛选出肝硬化及肝癌差异基因表达谱, 从中发现GADD45β在肝癌组织中是一个明显低表达基因. 通过GADD45β mRNA定性、半定量以及蛋白测定证明正常肝与肝硬化组织中GADD45β表达阳性率无明显差异, 肝癌组织GADD45β表达明显降低(P<0.05); 且其表达与肝癌的多种临床病理学特征相关(P<0.05): 高分化组GADD45β蛋白表达明显强于中、低分化组; EdmendsenⅠ级肝癌组织GADD45β蛋白表达较强; 核分级程度越高, GADD45β蛋白表达越弱. GADD45β的表达有随肿瘤分化程度降低和核分级增高而降低的趋势. RT-PCR和免疫组织化学二者相互印证, 并与基因芯片结果一致. 因此, GADD45β是与肝癌基因DNA损伤修复有着密切联系的特异分子标志, 与肝癌的发生发展密切相关.
本研究从mRNA及蛋白水平上, 对正常肝组织、肝硬化组织、肝癌组织中GADD45β进行了全面系统的分析, 证明GADD45β在肝癌的发展进程中呈下调表达趋势, 并与肝癌的分化程度有密切的关系. Qiu et al[13]利用基因芯片、定量PCR等多种实验方法研究发现, 在人类肝癌细胞株HepG2和Hep3B中GADD45β中低表达, 而在正常人肝细胞株CL-48中表达水平没有明显变化, 在结肠癌、乳腺癌、前列腺癌、鳞状细胞癌、淋巴瘤和平滑肌肉瘤等其他肿瘤中, GADD45β也无明显变化. 这与本研究结果基本相符, 说明GADD45β在肝癌中呈特异性缺失. GADD45β是一个损伤修复因子, 参与监测细胞周期和诱导凋亡, 其低表达意味着损伤修复功能的缺陷, 以及随之而来的对细胞生长不利的反常转录调节, 随着损伤修复缺陷的累积, 癌基因的高表达, 将会导致细胞增殖恶变.
Qiu et al[14]通过MSP(methylation-specific PCR)方法, 检测到在肝细胞癌组织中存在GADD45β高水平的甲基化, 而在CL-48正常细胞株中甲基化则不甚明显. 在GADD45β启动子区富含CpG岛, 存在高水平的甲基化, 而基因表达与甲基化呈负相关, 此高甲基化状态可能与GADD45β的低表达有关. DNA甲基化是一种酶相关性化学修饰, 多发生在CpG二核苷酸中, GADD45β基因启动子区的甲基化会影响转录因子的结合, 从而影响基因的正常转录, 导致正常基因表达抑制. 富含CpG岛的区域高甲基化可能会导致肿瘤发生过程中特异基因的失活[15], 甲基化状态异常在肿瘤发展中的作用已受到日益广泛的重视, 这种异常主要包括抑癌基因高甲基化和癌基因的低甲基化, 前者使抑癌基因表达受到抑制, 而后者则使癌基因表达上调. 作为抑癌基因, GADD45β的高甲基化显然也于肝癌的发生发展相关, 这也是我们下一步要研究的问题之一. 此外, 许多研究表明, 细胞内信息传递中的某些障碍与肿瘤发生有关, 这些控制细胞增殖、分化的信息传递通路中某一环节的异常都可以引起细胞生长失控, 最终导致肿瘤形成[10]. GADD45β参与多种信号通路的调节, 其表达缺失, 很可能会造成信号通路异常, 扰乱正常的细胞周期和细胞凋亡, 从而导致肿瘤发生.
本研究提示GADD45β在肝癌的发生发展中起到相当重要的作用, GADD45β可以作为肝癌早期诊断的一个候选基因, 研究GADD45β下调表达的分子机制, 有望为肝癌提供一种潜在的靶向分子治疗途径.
GADD45β是DNA损伤修复基因, 具有调节控制细胞的增生、监测细胞周期、诱导细胞凋亡、调控细胞的负性生长等功能. 目前, 有关GADD45β在肝癌中的生物学作用和临床价值尚不甚明了, 研究其异常表达机制及与临床病理特征之间的关系, 有望为肝癌的早期诊断和靶向治疗提供潜在的途径.
季国忠, 副教授, 南京医科大学第二附属医院消化科.
GADD45β与其他蛋白如PCNA, p21、核组蛋白、MTK1/MEKK4激酶以及Cdk1等的相互作用是多年来研究的热点, 而近年研究热点主要集中于GADD45β参与多种信号通路如NF-κB、p38/JNK、Foxo等的调节, 以调控细胞负性生长.
Qiu et al研究发现, 在肝癌细胞株中GADD45β呈低表达, 而在正常肝细胞株中则无明显变化. 并通过MSP方法检测到在肝癌组织中存在GADD45β高水平的甲基化, 而高甲基化状态可能与GADD45β的低表达有关.
本研究从DNA、mRNA及蛋白水平上, 对正常肝组织、肝硬化组织、肝癌组织中GADD45β进行了全面系统的分析, 证明GADD45β在肝癌的发展进程中呈下调表达趋势, 并与肝癌的分化程度密切相关.
GADD45β在肝癌的发生发展中起到相当重要的作用, GADD45β可以作为肝癌早期诊断的一个候选基因, 研究GADD45β下调表达的分子机制, 有望为肝癌提供一种潜在的靶向分子治疗途径.
DNA甲基化(methylation): 哺乳动物基因组中5%的C为甲基化(m C), mC主要存在于CpG二核苷酸中; CpG二核苷酸序列常成簇聚集并零散地分布于人基因组中, 形成CpG岛(CpG islands), 人基因组中约每10 kb就有一个CpG岛, CpG岛常与基因相连(可作为寻找基因的标记). DNA甲基化有转录抑制作用, 基因表达与甲基化呈负相关.
本文提出GADD 45b可以作为肝癌早期诊断的一个候选基因, 并为肝癌提供一种潜在的靶向治疗途径, 对于研究肝癌的发病机制有一定的理论价值.
编辑: 李军亮 电编:何基才
| 1. | Kao JH, Chen DS. Changing disease burden of hepatocellular carcinoma in the Far East and Southeast Asia. Liver Int. 2005;25:696-703. [PubMed] [DOI] |
| 2. | Papa S, Zazzeroni F, Bubici C, Jayawardena S, Alvarez K, Matsuda S, Nguyen DU, Pham CG, Nelsbach AH, Melis T. Gadd45 beta mediates the NF-kappa B suppression of JNK signalling by targeting MKK7/JNKK2. Nat Cell Biol. 2004;6:146-153. [PubMed] [DOI] |
| 3. | Su LJ, Ding GW, Yang ZL, Zhang SB, Yang YX, Xu CS. Expression patterns and action analysis of genes associated with hepatitis virus infection during rat liver regeneration. World J Gastroenterol. 2006;12:7626-7634. [PubMed] |
| 5. | Abdollahi A, Lord KA, Hoffman-Liebermann B, Liebermann DA. Sequence and expression of a cDNA encoding MyD118: a novel myeloid differentiation primary response gene induced by multiple cytokines. Oncogene. 1991;6:165-167. [PubMed] |
| 6. | Takekawa M, Saito H. A family of stress-inducible GADD45-like proteins mediate activation of the stress-responsive MTK1/MEKK4 MAPKKK. Cell. 1998;95:521-530. [PubMed] [DOI] |
| 7. | Smith ML, Ford JM, Hollander MC, Bortnick RA, Amundson SA, Seo YR, Deng CX, Hanawalt PC, Fornace AJ Jr. p53- mediated DNA repair responses to UV radiation: studies of mouse cells lacking p53, p21, and/or gadd45 genes. Mol Cell Biol. 2000;20:3705-3714. [PubMed] [DOI] |
| 8. | Jin R, De Smaele E, Zazzeroni F, Nguyen DU, Papa S, Jones J, Cox C, Gelinas C, Franzoso G. Regulation of the gadd45beta promoter by NF-kappaB. DNA Cell Biol. 2002;21:491-503. [PubMed] [DOI] |
| 9. | Qiu W, Zhou B, Chu PG, Luh F, Yen Y. The induction of growth arrest DNA damage-inducible gene 45 beta in human hepatoma cell lines by S-adenosylmethionine. Am J Pathol. 2007;171:287-296. [PubMed] [DOI] |
| 10. | Gupta M, Gupta SK, Hoffman B, Liebermann DA. Gadd45a and Gadd45b protect hematopoietic cells from UV-induced apoptosis via distinct signaling pathways, including p38 activation and JNK inhibition. J Biol Chem. 2006;281:17552-17558. [PubMed] [DOI] |
| 11. | Papa S, Zazzeroni F, Fu YX, Bubici C, Alvarez K, Dean K, Christiansen PA, Anders RA, Franzoso G. Gadd45beta promotes hepatocyte survival during liver regeneration in mice by modulating JNK signaling. J Clin Invest. 2008;118:1911-1923. [PubMed] [DOI] |
| 12. | Kobayashi Y, Furukawa-Hibi Y, Chen C, Horio Y, Isobe K, Ikeda K, Motoyama N. SIRT1 is critical regulator of FOXO- mediated transcription in response to oxidative stress. Int J Mol Med. 2005;16:237-243. [PubMed] |
| 13. | Qiu W, David D, Zhou B, Chu PG, Zhang B, Wu M, Xiao J, Han T, Zhu Z, Wang T. Down-regulation of growth arrest DNA damage-inducible gene 45beta expression is associated with human hepatocellular carcinoma. Am J Pathol. 2003;162:1961-1974. [PubMed] |
| 14. | Qiu W, Zhou B, Zou H, Liu X, Chu PG, Lopez R, Shih J, Chung C, Yen Y. Hypermethylation of growth arrest DNA damage-inducible gene 45 beta promoter in human hepatocellular carcinoma. Am J Pathol. 2004;165:1689-1699. [PubMed] |